ALLERGOL. ET IMMUNOPATHOL., 1998;26(1):9-16
ORIGINAL ARTICLES
Investigación de la eficacia y tolerabilidad de azelastina spray nasal versus ebastina comprimidos en pacientes con rinitis alérgica estacional
I. Antépara1*, I. Jaúregui1*, A. Basomba2*, A. Cadahia3*, F. Feo4*, J. J. García5*, M. A. Gonzalo6*, I. Luna7*, M. Rubio8* and M. Vázquez9**
1 H. de Basurto (Bilbao). 2 H. La Fé (Valencia). 3 H. Vall d''Hebrón (Barcelona). 4 H. Nª Sª del Carmen (Ciudad Real). 5 H. Regional Carlos Haya (Málaga). 6 H. Infanta Cristina (Badajoz). 7 H. Xeral Cíes (Vigo). 8 H. Gregorio Marañón (Madrid). 9 H. Universitario de Puerto Real (Cádiz).
* Servicio de Alergia. ** Servicio de Otorrinolaringología.
RESUMEN
Mediante un ensayo clínico abierto, comparativo y multicéntrico efectuado sobre un total de 110 pacientes en dos grupos paralelos, se evaluaron la eficacia, seguridad terapéutica y tolerabilidad local del antagonista de receptores H1 de histamina azelastina administrado en spray nasal, comparadas con el antihistamínico ebastina en comprimidos para el tratamiento de la rinitis alérgica estacional. Los pacientes fueron tratados aleatoriamente durante un período de dos semanas. Mediante el método estadístico apropiado en cada caso, se evaluaron la eficacia, tolerabilidad y cumplimiento del tratamiento. La eficacia fue valorada por el médico responsable con arreglo a la puntuación de 10 síntomas oculonasales de rinitis estacional mediante una escala categórica de cada síntoma (0 = ausente, 1 = leve, 2 = moderado, 3 = intenso). La tolerabilidad se valoró en base a la ocurrencia y naturaleza de los acontecimientos adversos durante el tratamiento. Ambos grupos mostraron una reducción significativa en la puntuación total de síntomas después del tratamiento (p < 0,0005). Al final del tratamiento, la eficacia de azelastina se valoró equivalente a la de ebastina, sin diferencia significativa entre ambos grupos. Durante el tratamiento, 19 pacientes mostraron al menos un acontecimiento adverso, 13 en el grupo de azelastina y 6 en el grupo de ebastina, leve en todos los casos. La valoración global de la tolerabilidad por el investigador fue comparable entre los dos grupos. Los acontecimientos adversos más frecuentes fueron somnolencia (cuatro casos en el grupo de ebastina) y sabor amargo (cuatro casos en el grupo de azelastina). En conclusión, los resultados del ensayo sobre 110 pacientes diagnosticados de rinitis alérgica estacional, permiten demostrar globalmente que ambos tratamientos son igualmente eficaces y bien tolerados.
Palabras clave: Azelastina. Ebastina. Estudio Clínico. Rinitis alérgica estacional. Spray nasal.
Allergol et Immunopathol 1998;26:9-16.
INTRODUCCIÓN
La rinitis alérgica estacional, fiebre del heno o polinosis es una alteración inflamatoria de la mucosa nasal causada por una reacción inmunológica mediada por IgE frente a los alergenos del polen. Clínicamente, se caracteriza por episodios cíclicos de síntomas oculonasales de coriza, y en ocasiones, puede acompañarse de tos y síntomas asmáticos.
La aproximación inicial a la prevención y tratamiento de toda rinitis alérgica es identificar el alergeno y, si es posible, eliminar la exposición al mismo. En los pacientes afectos de polinosis esto no es posible, y a menudo es necesario proporcionar un alivio sintomático, tratando al paciente mediante fármacos con propiedades antialérgicas.
Azelastina, un derivado de la ftalazinona, está clasificado como un potente compuesto antialérgico de larga duración de acción, con propiedades antagonistas selectivas especialmente intensas para histamina a nivel de receptores H1 (1, 2). Azelastina también inhíbe la síntesis y liberación de otros mediadores químicos relacionados con las reacciones alégicas, tales como leucotrienos, PAF (platelet activating factor, factor activador de plaquetas) bradicinina y calcio (2, 3) y carece de acciones anticolinérgicas o ß-adrenérgicas debido a su alta afinidad por los receptores (2, 4, 5). Azelastina se administra en forma de spray nasal directamente sobre la mucosa nasal, donde ejerce su efecto tópico, lo que incide en un comienzo de acción más rápido y una absorción sistémica significativamente menor (2).
Múltiples estudios clínicos previos muestran que azelastina spray nasal es más eficaz que el placebo (2), y al menos tan eficaz como los esteroides tópicos intranasales (6, 7), y los antihistamínicos orales, terfenadina (8), cetirizina (9), loratadina (10), astemizol (11), ebastina (12) y la propia azelastina en comprimidos (2) en el tratamiento de la rinitis alérgica.
Ebastina es un potente antagonista de receptores H1 administrado por vía oral, que se ha mostrado muy eficaz en el tratamiento de la rinitis alérgica y con escaso o nulo efecto sedante a las dosis terapéuticas de 10 mg en una toma diaria (13).
Los objetivos de este estudio fueron, por un lado, evaluar la eficacia, seguridad terapéutica y tolerabilidad local de azelastina spray nasal en la rinitis alérgica estacional; y por otro lado, comparar la eficacia y tolerabilidad de azelastina administrada en spray nasal dos veces al día (0.56 mg/día) frente a ebastina en comprimidos de 10 mg en una toma diaria.
MATERIAL Y MÉTODOS
Diseño del estudio
Se llevó a cabo un ensayo clínico abierto, comparativo y multicéntrico, efectuado durante 14 días sobre un total de 110 pacientes, diagnosticados de rinitis alérgica estacional, en base a las siguientes variables: historia clínica compatible, pruebas cutáneas, y cuando fue posible, test de provocación nasal alergeno-específico.
En una visita preliminar (día 0) se llevó a cabo la historia clínica, exploración física, y una batería de pruebas cutáneas incluyendo todos los aeroalergenos importantes en nuestro entorno --ácaros, hongos, epitelios y pólenes de gramíneas, árboles, parietaria, compuestas y quenopodiáceas--. En los casos que fue clínica y/o técnicamente posible, se llevó a cabo igualmente un estudio rinomanométrico basal y una provocación nasal antígeno-específica.
El estudio se llevó a cabo durante la estación polínica y con los pacientes sintomáticos. El primer día del estudio (visita 1) se registraron los síntomas del momento y se repitió la exploración física, comenzando el tratamiento aleatoriamente bien con Azelastina spray nasal en solución acuosa al 0,1% dos veces al día (0,56 mg/día), o con Ebastina en comprimidos de 10 mg en una toma diaria. Los pacientes fueron incluidos en uno u otro grupo en base al esquema de randomización establecido previamente. El último día del estudio (visita 2) se registraron de nuevo los síntomas y se repitió la exploración física y en su caso, la evaluación rinomanométrica (tabla I).
| Tabla I | ||
Procedimientos en cada visita: 1 y 2 | ||
Valoración | Visita basal | Fin de estudio |
| Visita | 1 | 2 |
| Semana de estudio | 0 | 2 |
| Consentimiento por escrito | X | |
| Datos demográficos | X | |
| Anamnesis | X | |
| Verificación de criterios de inclusión | X | |
| Enfermedades concomitantes | X | |
| Exploración física | X | X |
| Control de medicación | X | X |
| Valoración rinomanométrica (si es posible) | X | X |
| Eficacia: | ||
| Evaluación clínica de la rinitis | X | X |
| Seguridad: | ||
| Acontecimientos adversos | X | X |
Los síntomas que valoraron los pacientes fueron: estornudos, rinorrea, obstrucción nasal, prurito nasal, prurito conjuntival, lagrimeo, eritema conjuntival, fotofobia, tos y picor de garganta. Estos síntomas se valoraron por los pacientes de acuerdo con la siguiente escala categórica: 0 = ausente; 1 = leve (no interfiere con la actividad diaria y cede con el tratamiento), 2 = moderado (no interfiere con la actividad diaria, pero no cede del todo con el tratamiento), 3 = intenso (interfiere con la actividad diaria y no cede con el tratamiento). Para ser incluidos en el estudio, los pacientes debían tener un tanteo de síntomas de rinitis igual o superior a 8 antes del tratamiento. No se permitió el uso de antihistamínicos, ketotifeno, cromoglicato disódico y esteroides inhalados durante al menos dos semanas antes del estudio.
Los criterios para valorar la eficacia fueron: la diferencia en la suma del tanteo de síntomas de la visita 1 a la visita 2 (parámetro principal), la evaluación rinomanométrica --en su caso-- y la valoración global del investigador al terminar el ensayo (parámetros secundarios). La tolerabilidad se valoró en base a la ocurrencia y naturaleza de los acontecimientos adversos durante el tratamiento. Finalmente, se hizo una valoración por el paciente y el investigador responsable de la eficacia y tolerabilidad globales del tratamiento en la visita 2, de acuerdo a la escala "muy buena", "buena", "regular" o "insuficiente".
El protocolo de este ensayo multicéntrico se realizó de acuerdo con el coordinador, fue aprobado por el comité ético de investigación clínica de cada Hospital, y se realizó de acuerdo con la Declaración de Helsinki y la legislación actual en España. Los pacientes fueron adecuadamente informados y se obtuvo su consentimiento por escrito para ser incluidos en el estudio.
Pacientes
Se incluyeron un total de 110 pacientes de ambos sexos con un promedio de edad de 31 años (DE = 10,7, rango 17/62). La muestra estaba compuesta por 36,4% de mujeres y 63,6% de hombres. El peso promedio fue de 66,3 kg (DE = 11,9). La altura media fue de 165,4 cm (DE = 8,6). Un paciente era de raza negra y los 109 restantes caucasianos (tabla II). El historial médico de rinitis en los pacientes era de 88,4 meses en promedio (DE = 83,7). En el 82,7% no existía ninguna enfermedad concomitante, y en el resto la más frecuente fue el asma (6,4%). Para formar parte de la muestra estudiada, los pacientes voluntarios tenían que cumplir todos los criterios de inclusión y no presentar ninguno de los criterios de exclusión (tabla III).
| Tabla II | ||||||
Descripción de las características de la muestra | ||||||
| Variable | Azelastina (N = 56) | Ebastina (N = 54) | p | |||
| Edad | m (d.e.) | 29.5 (10.4) | 32.5 (11.0) | 0.141 (t-test) | ||
| Sexo | M | 24 | (43) | 16 | (30) | 0.2137 (Chi2) |
| n (%) | H | 32 | (57) | 38 | (70) | |
N = número de pacientes, m = media, d.e. = desviación estándar, | ||||||
| Tabla III |
Criterios de exclusión |
| 1. Pacientes con posibilidad de estar embarazadas. |
| 2. Pacientes con enfermedad aguda o seria. |
| 3. Pacientes con foco infeccioso-rinofaríngeo o broncopulmonar, o con pólipos nasales. |
| 4. Pacientes que padezcan: |
| 4. -- rinitis atrófica. |
| 4. -- asma severa (incluyendo asma alérgica). |
| 5. Pacientes con alteraciones severas de la función renal o hepática, o padeciendo malabsorción. |
| 6. Pacientes que sigan un tratamiento de hiposensibilización o desensibilización durante el período que dure el ensayo (pacientes en el tercer año de tratamiento pueden ser incluidos). |
| 7. Pacientes con intolernacia a antihistamínicos/antialérgicos. |
| 8. Pacientes que toman antihistamínicos/antialérgicos, cromoglicato disódico, nedocromil sódico, ketotifeno, simpatomimético, anticolinérgicos y teofilina, tres días antes del inicio del estudio o durante el estudio. Corticosteroides tópicos o sistémicos. Éstos tienen que ser establecidos lo menos durante 15 días antes del inicio del ensayo clínico. |
| 9. Pacientes que participan en un ensayo clínico o lo hicieron el mes anterior. |
| 10. Pacientes no aptos para cooperar. |
Desarrollo del estudio
El ensayo se llevó a cabo durante un único período de dos semanas de tratamiento, entre los meses de abril y agosto de 1994. El tipo de tratamiento administrado a cada paciente era dictado por el número aleatorio situado en cada unidad de tratamiento. No se realizó ninguna modificación del protocolo durante el ensayo. Fueron retirados del estudio los pacientes que no completaron el ensayo debido a acontecimientos adversos durante el tratamiento y/o ineficacia de la medicación. Se consideraron abandonos a aquellos pacientes que no completaron el estudio debido a razones no relacionadas con el ensayo (tabla IV). El cumplimiento se valoró comparando en los dos grupos la medicación devuelta por cada paciente, los días entre las visitas 1 y 2, y el cumplimiento del protocolo valorado por el investigador.
| Tabla IV | |||
| Distribución de los pacientes según grupo | |||
| terapéutico y abandonos | |||
| Grupo evaluados | Finalizado | Abandonos | No |
| Azelastina | |||
| (N = 56) | 51 | 4 | 1 |
| Ebastina | 51 | 3 | 0 |
| (N = 54) | |||
El estudio se realizó de acuerdo con los principios de la buena práctica clínica. El control de calidad de los datos se llevó a cabo mediante: a) monitorización con visitas mensuales del coordinador regional, quien analizó si se habían respetado la aleatorización, los criterios de inclusión y exclusión, el programa de visitas, y las directrices del protocolo en general; b) inventario del material devuelto al cierre del estudio; y c) explotación de los datos mediante su análisis con ordenador para detectar errores de ausencia, rango de referencia y consistencia en el caso de ser necesario.
Métodos estadísticos
La comparación de los dos grupos en la visita 1 (homogeneidad) se llevó a cabo utilizando el total de sujetos de la muestra. Las variables continuas se compararon entre los dos grupos, utilizando el t-test (Student), o bien test no paraméricos (U de Mann-Whitney) cuando no se cumplieron las condiciones de aplicación del t-test. Las variables cualitativas se compararon utilizando Chi-cuadrado, y cuando no se cumplieron las condiciones de aplicación del Chi-cuadrado, se utilizó el test de Fisher.
El análisis de la eficacia se llevó a cabo de acuerdo al siguiente método: la evolución de las puntuaciones de los síntomas entre las visitas 1 y 2 (variables ordinales) se analizó mediante el llamado Matched-pairs Signed-ranks test de Wilcoxon. A su vez, estas variables fueron comparadas entre los dos grupos utilizando el test U de Mann-Whitney.
Para el análisis de la tolerabilidad, se describió la frecuencia de pacientes que presentaron como mínimo un acontecimiento adverso, y se comparó la tolerabilidad entre los dos grupos utilizando igualmente el test U de Mann-Whitney.
RESULTADOS
Descripción
Según se observa en la tabla IV, recibieron la medicación un total de 110 pacientes, 56 en el grupo de azelastina y 54 en el de ebastina; 51 pacientes finalizaron el estudio en cada uno de los dos grupos, cuatro pacientes fueron retirados en el grupo de azelastina (ineficacia o poca tolerabilidad) y tres en el de ebastina (ineficacia, poca tolerabilidad, abandono). Un paciente no pudo ser evaluado por no acudir a la segunda visita (final).
Las pruebas cutáneas (prick test) fueron positivas en todos los casos frente a distintos pólenes del entorno geográfico. En ocho casos se llevó a cabo un estudio rinomanométrico basal, con resultados dentro de la normalidad, y una provocación nasal antígeno-específica, de resultado positivo. El 96,3% de los pacientes tuvieron una exploración física normal al comenzar el estudio (visita 1), sin diferencias significativas en la visita 2. El 18,2% de los pacientes habían recibido medicación previa para la rinitis y el 10% algún otro tratamiento concomitante. Sobre el total de 110 pacientes, 24 (21,8%) manifestaron tomar al menos un tratamiento concomitante durante el estudio, 13 del grupo de azelastina (23,2%) y 11 del grupo de ebastina (20,4%).
Evaluación de la eficacia
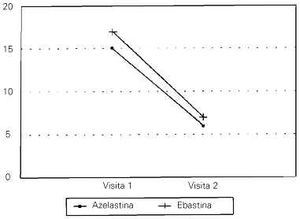
Se observaron diferencias estadísticamente significativas a favor de la visita 2 en la suma total de síntomas en los dos grupos de pacientes (p < 0,001) --excepto en lo que se refiere al síntoma Tos-- (tablas V y VI), lo que demuestra que los dos fármacos comparados resultaron altamente eficaces en el control de los síntomas de rinitis (Fig. 1).
| Tabla V | ||||||||
| Evolución de la puntuación de los síntomas entre la visita 1 y 2, por centros | ||||||||
| Visita 1 | Visita 2 | |||||||
| Suma de síntomas en función de los Centros | ||||||||
| Azelastina | Ebastina | Azelastina | Ebastina | |||||
| m | de | m | de | m | de | m | de | |
| Basurto-Bilbao | 12 | 3,4 | 14 | 3,5 | 3 | 4,6 | 7 | 6,7 |
| La Fe-Valencia | 16,5 | 5,0 | 18,5 | 5,5 | 12 | 7,9 | 10,5 | 4 |
| Vall d''Hebron-Barcelona | 18 | 3,3 | 15,5 | 4,8 | 5,5 | 2,6 | 10 | 6,1 |
| N. S. Carmen-C. Real | 14 | 4,1 | 12 | 4,8 | 7 | 4,4 | 4 | 3,5 |
| Civil-Málaga | 12 | 6,2 | 19 | 2,1 | 6,5 | 9,1 | 5 | 4 |
| I. Cristina-Badajoz | 18 | 3,6 | 18 | 4,6 | 5 | 6,7 | 7 | 7,4 |
| Xeral-Cíes-Vigo | 12 | 1,3 | 10 | 4,9 | 6 | 2,9 | 10 | 5,2 |
| G. Marañón-Madrid | 13 | 3,4 | 19 | 2,5 | 9,5 | 6,6 | 15 | 7,1 |
| Puerto Real-Cádiz | 20 | 4,6 | 16 | 6,4 | 9,5 | 8 | 6 | 2,3 |
| Tabla VI | |||||||||||
Evolución de cada síntoma después de dos semanas de tratamiento | |||||||||||
| Visita 1 | Visita 2 | Resultados de los análisis estadísticos | |||||||||
| Aze- lastina | Ebastina | Aze- lastina | Ebastina | Aze- lastina | Aze- lastina | Visita 1 | |||||
| Síntoma | m | de | m | de | m | de | m | de | vs ebastina V1, U M-W | vs ebastina V2, U M-W | vs visita 2 Wilcoxon |
| Suma de síntomas | 15 | 4,6 | 17 | 5,0 | 8,1 | 6,2 | 8,5 | 5,6 | N.S. | N.S. | < 0,0005 |
| Estornudos | 2,2 | 0,8 | 2,4 | 0,6 | 1,1 | 0,9 | 1,3 | 0,9 | N.S. | N.S. | < 0,0005 |
| Rinorrea | 2,2 | 0,9 | 2,1 | 0,8 | 1,2 | 1,0 | 1,2 | 1,0 | N.S. | N.S. | < 0,0005 |
| Prurito nasal | 2,0 | 0,9 | 2,3 | 0,7 | 1,0 | 0,9 | 1,1 | 0,9 | 0,0183 | N.S. | < 0,0005 |
| Prurito conjuntival | 1,8 | 1,0 | 1,8 | 1,0 | 0,8 | 1,0 | 0,8 | 0,8 | N.S. | N.S. | < 0,0005 |
| Eritema conjuntival | 1,6 | 1,0 | 1,5 | 0,9 | 0,8 | 1,0 | 0,6 | 0,8 | N.S. | N.S. | < 0,0005 |
| Lagrimeo | 1,1 | 1,0 | 1,4 | 1,0 | 0,5 | 0,7 | 0,5 | 0,7 | N.S. | N.S. | < 0,0005 |
| Fotofobia | 0,9 | 1,1 | 1,0 | 1,0 | 0,4 | 0,8 | 0,5 | 0,7 | N.S. | N.S. | < 0,0005 |
| Picor de garganta | 1,0 | 1,1 | 1,3 | 1,2 | 0,6 | 0,9 | 0,7 | 0,9 | N.S. | N.S. | < 0,0005 |
| Tos | 0,5 | 0,8 | 0,6 | 0,9 | 0,5 | 0,7 | 0,4 | 0,7 | N.S. | N.S. | N.S.-0,058 |
| Obstrucción nasal | 2,0 | 0,9 | 2,0 | 0,9 | 1,3 | 1,2 | 1,3 | 1,1 | N.S. | N.S. | < 0,0005 |
Fig. 1--Evolución de la suma de síntomas entre la visita 1 y 2.
En cuanto a los síntomas por separado, no se observaron diferencias significativas entre las visitas 1 y 2 para ninguno de los síntomas ni en uno ni en otro grupo. En el caso del prurito nasal, su valoración categórica en la visita 1 había sido mayor en el grupo de Azelastina (p = 0,0183), por lo que, en el caso de haber encontrado diferencias significativas entre las visitas 1 y 2, el resultado no hubiese sido válido, pero no fue así.
En conclusión, al finalizar el estudio, la eficacia de azelastina en spray nasal y ebastina en comprimidos se mostró equivalente en todos los parámetros evaluados (tabla VII).
| Tabla VII | |||||||
| Descripción de la eficacia | |||||||
| Grupo de tratamiento | Total | ||||||
Azelastina | Ebastina | Casos | % | ||||
| Eficacia | Casos | % | Casos | % | |||
| Muy bien / bien | 23 | 141,1% | 19 | 135,8% | 142 | 138,5% | |
| Satisfactoria | 20 | 135,7% | 14 | 126,4% | 134 | 131,2% | |
| Insuficiente | 29 | 116,1% | 17 | 132,1% | 126 | 123,9% | |
| No valorable | 24 | 127,1% | 23 | 125,7% | 127 | 126,4% | |
| Total | 56 | 100,0% | 53 | 100,0% | 109 | 100,0% | |
Evaluación de la seguridad
El análisis de la tolerabilidad se llevó a cabo en un total de 109 pacientes. No hubo diferencias significativas ni en la duración del tratamiento ni en el cumplimiento del protocolo en los dos grupos. Se recuperó el 80% de las medicaciones entregadas, de forma comparable en ambos grupos.
No se notificó ningún acontecimiento adverso serio durante el estudio.
Durante el tratamiento, 19 pacientes mostraron al menos un acontecimiento adverso, 13 en el grupo de azelastina y seis en el grupo de ebastina, leve en todos los casos, salvo en dos, en que fueron calificados como intensos por los pacientes --síntomas oculonasales, prurito nasal--, ambos en el grupo de azelastina (tabla VIII). Los acontecimientos adversos más frecuentes fueron somnolencia (cuatro casos en el grupo de ebastina) y sabor amargo (cuatro casos en el grupo de azelastina).
| Tabla VIII | |||||||
Acontecimientos adversos | |||||||
| Grupo de tratamiento | Total | ||||||
| Azelastina | Ebastina | Casos | % | ||||
| Acontecimientos adversos | ICD-9 | Casos | % | Casos | % | ||
| Ninguno | 42 | 75,0% | 47 | 88,7% | 89 | 81,7% | |
| Faringitis | 523001 | 2 | 3,6% | 0 | 0% | 2 | 1,8% |
| Malestar faringe | 523004 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Cefalea | 109001 | 0 | 0% | 3 | 5,7% | 3 | 2,8% |
| Estornudos | 539007 | 3 | 5,4% | 0 | 0% | 3 | 2,8% |
| Náuseas | 308001 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Somnolencia | 197006 | 0 | 0% | 4 | 7,5% | 4 | 3,7% |
| Sensación hinchazón | 711003 | 0 | 0% | 2 | 3,8% | 2 | 1,8% |
| Sabor amargo | 267003 | 4 | 7,1% | 0 | 0% | 4 | 3,7% |
| Prurito | 24001 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Síntomas oculonasales | 1 | 1,8% | 0 | 0% | 1 | 0,9% | |
| Irritación nasal | 24003 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Epistaxis | 515001 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Escozor a aplicación | 24003 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Rinorrea | 539006 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Sequedad | 218001 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Pos.aplicación | 539005 | 1 | 1,8% | 0 | 0% | 1 | 0,9% |
| Grietas mucosa nasal | |||||||
| Total | 56 | 100,0% | 53 | 100,0% | 109 | 100,0% | |
La valoración global de la tolerabilidad por el investigador fue comparable entre los dos grupos. En conclusión, tanto azelastina en spray nasal como ebastina en comprimidos son fármacos seguros y bien tolerados (tabla IX).
Tabla IX | ||||||
Descripción de la tolerancia | ||||||
| Grupo de tratamiento | Total | |||||
| Azelastina | Ebastina | Casos | % | |||
Tolerancia | Casos | % | Casos | % | ||
| Muy bien / bien | 35 | 162,5% | 41 | 177,4% | 176 | 169,7% |
| Satisfactoria | 15 | 126,8% | 9 | 117,0% | 124 | 122,0% |
| Insuficiente | 26 | 110,7% | 2 | 113,8% | 18 | 117,3% |
| No valorable | 20 | 1120% | 1 | 121,9% | 121 | 120,9% |
| Total | 56 | 100,0% | 53 | 100,0% | 109 | 100,0% |
DISCUSIÓN Y CONCLUSIONES
Los resultados de este ensayo clínico abierto, comparativo y multicéntrico, efectuado durante 14 días sobre un total de 110 pacientes diagnosticados de rinitis alérgica estacional, demuestran claramente que azelastina en spray nasal a dosis de 0,56 mg/día es eficaz y segura en el tratamiento de los síntomas de rinitis, y que dicha eficacia y seguridad son comparables a los de ebastina a dosis de 10 mg/día por vía oral.
Azelastina es el primer fármaco antihistamínico en spray nasal disponible en el mercado farmacéutico en nuestro país. Estructuralmente es un derivado de ftalazinona con efecto antihistamínico rápido y prolongado, y también inhíbe la síntesis y liberación de otros mediadores inflamatorios (2). Azelastina ha sido evaluada en múltiples estudios clínicos previos en la rinitis alérgica estacional y perenne, que muestran que azelastina spray nasal es más eficaz que el placebo, y al menos tan eficaz como los esteroides tópicos intranasales y los antihistamínicos orales: terfenadina, cetirizina, loratadina, astemizol, ebastina, y la propia azelastina en comprimidos (2, 6-12).
Como ya había sido observado en otros estudios previos comparativos con antihistamínicos por vía oral (9, 12), una ventaja terapéutica de azelastina sobre ebastina fue la menor incidencia de somnolencia, indicando menores niveles plasmáticos con concentraciones locales terapéuticas. Estos hallazgos confirman a azelastina en spray nasal como un remedio sintomático útil y seguro en el tratamiento de la rinitis alérgica estacional.
AGRADECIMIENTOS
A todo el personal que ha participado en este ensayo clínico, especialmente a los investigadores colaboradores: P. Gamboa1, G. González1, I. Urrutia1, A. Campos2, I. García2, D. Hernández2, C. Nogueiras3, P. A. Galindo4, R. García4, A. Miranda5, R. González6, C. Marcos6, M. de Barrio7, T. Herrero7, G. Dañino8.
1 H. de Basurto (Bilbao), 2 H. La Fé (Valencia), 3 H. Vall d''Hebron (Barcelona), 4 H. Nª Sª del Carmen (Ciudad Real), 5 H. Regional Carlos Haya (Málaga), 6 H. Xeral Cíes (Vigo), 7 H. Gregorio Marañón (Madrid), 8 H. Universitario de Puerto Real (Cádiz).
SUMMARY
The efficacy and safety of the nasally administred histamine H1 receptor blocking drug Azelastine was investigated in an open, multicenter, randomized comparative trial with Ebastine in seasonal allergic rhinitis. 110 patients in two parallel groups were treated for 14 days and efficacy was assessed by the physician using a rating scale measuring 10 nasal and ocular symptoms of seasonal rhinitis (0 = absent, 1 = mild, 2 = moderate, 3 = severe). Tolerability was measured on the basis of reported adverse events. Both treatment groups had dramatic reductions in the physician''s total symptom score following treatment (p < 0.0005). There was no significant difference between the two groups. Changes in individual rhinitis symptoms showed no differences between the two groups. During treatment, 19 patients had at least one adverse event, 13 in Azelastine group and 6 in Ebastine group; all were mild. The most frequent adverse events reported were somnolence (4 cases in Ebastine group) and a bitter taste (4 patients in the Azelastine group). In conclusion, the results of the study on 110 patients suggest that both Azelastine and Ebastine are effective treatments of the symptoms of seasonal allergic rhinitis. Both drugs were well tolerated.
Key words: Azelastine. Clinical study. Ebastine. Nasal spray. Seasonal allergic rhinitis.
REFERENCES
1. Diamantis W, Harrison JE, Melton J, Perhach JL, Sofia RD. In Vivo and in Vitro H1 Antagonist Properties of Azelastine. The Pharmacologist 1981;23(3):149.
2. McTavish D, Sorkin EM. Azelastine. A Review of the Pharmacodynamic and Pharmacokinetic Properties, and Therapeutic Potential. Drugs 1989;38(5):778-800.
3. Chand N, Diamantis W, Sofia RD. Antagonism of histamine and leukotrienes by azelastine in isolated guinea pig ileum. Agent Actions 1986;19:164.
4. Garrido B. Azelastina, primer antihistamínico en spray nasal. Farmacoterapia 1993;3:4-6.
5. Gastpar H, Aurich R, Petzold U, Virnkaes C. Azelastine nasal spray for topical treatment of allergic rhinopathy. Atemwegs Lungenkr 1993;19:148-54.
6. Dorow P, Aurich R, Petzold U. Efficacy and tolerability of Azelastine nasal spray in patients with allergic rhinitis compared to placebo and budesonide. Res 1993;43(II)/18:
909-12.
7. Davies RJ, Lund V, Harten-Ash UJ. The effect of intranasal Azelastine and Beclomethasone on the symptoms and signs of nasal allergy in patients with perennial allergic rhinitis. Rhinology 1993;31:159-64.
8. Gastpar H, Nolte D, Aurich R, Brendt P, Enzmann H, Giesemann G, et al. Comparative effect of Azelastine nasal spray and terfenadine in seasonal and perennial rhinitis. Allergy 1994;49:152-8.
9. Charpin D, Godard P, Garay RP, Baehre M, Herman D, Michel FB. A multicenter study on the efficacy and tolerability of Azelastine nasal spray in the treatment of seasonal allergic rhinitis: a comparison with oral cetirizine. Eur Arch Otorhinolaryngol 1995;252:455-8.
10. Gambardella R. Comparison of the efficacy of Azelastine nasal spray and Loratadine Tablets in the treatment of seasonal allergic rhinitis. J Internat Med Res 1993;21:268-75.
11. Kunkel C. Comparison of Azelastine versus new H1 blockers (Terfenadine, Astemizole). Symposium "A New Standard in the Treatment of allergic rhinitis". XV Congress of the European Academy of Allergology and Clinical Immunology (EAACI''92). Paris, mayo 1992.
12. Conde J, Palma JL, Delgado J. Investigation on the efficacy and tolerance of Azelastine (HCL) nasal spray versus ebastine tablets in patients with seasonal allegic rhinitis. Allergol et Immunopathol 1995;23:51-7.
13. Ebastine: a novel H1-receptor antagonist. Drugs of Today 1992;28 (Suppl. B):69.