El coste a largo plazo de la reparación endovascular de los aneurismas (REVA) aumenta respecto al del procedimiento inicial en un 44%. Las intervenciones secundarias y las endofugas incrementan significativamente el gasto total. Este estudio evalúa los costes a largo plazo específicos de los dispositivos tras su implantación utilizando 2 modelos diferentes. Se utilizaron endoprótesis AneuRx y Zenith para tratar a 250 pacientes con aneurismas aórticos abdominales entre diciembre de 1998 y junio de 2006 en un único centro. Se utilizó un sistema de contabilidad de costes hospitalarios sobre la base de unidades de valor relativo para calcular los costes departamentales tanto directos como indirectos. Los gastos indirectos del centro, el coste de los servicios profesionales y las visitas ambulatorias también se incluyeron en el análisis de costes. Todos los gastos se calcularon en dólares del año 2006. Para examinar los costes a largo plazo, se excluyeron los pacientes con un seguimiento<1 año. También se excluyeron los 50 primeros pacientes sometidos a REVA entre diciembre de 1995 y 1998, para limitar el efecto de la curva de aprendizaje. Los costes acumulados por paciente a los 5 años fueron 12.465 $ (AneuRx) y 10.606 $ (Zenith, p=0,22). La duración media del seguimiento fue de 38,5±5,2 meses (AneuRx) y de 32,8±3,8 meses (Zenith, p=0,12). Para ambos dispositivos, los componentes con mayor coste fueron las intervenciones secundarias (59,5% AneuRx frente a 56,4% Zenith) y los estudios radiológicos (29,2% AneuRx frente a 34,9% Zenith). La ausencia de intervenciones secundarias (80 frente a 51%, p<0,05) y de endofugas (83 frente a 58%, p=0,05) fue mayor en los pacientes tratados con endoprótesis Zenith frente a AneuRx, respectivamente. Se observó una reducción de las intervenciones secundarias y las endofugas en los pacientes tratados con la endoprótesis Zenith en comparación con el AneuRx. La correspondiente reducción de los costes de un 15%, sin embargo, no fue estadísticamente significativa. Es posible obtener reducciones adicionales de los costes relacionados con el dispositivo a través de mejoras en su diseño, en la técnica de implantación, así como en la estrategia de seguimiento por imagen.
Es bien conocido que, a pesar de una menor morbilidad perioperatoria, menor duración de la hospitalización, y reducción del tiempo de la intervención, los costes hospitalarios iniciales de la reparación endovascular de los aneurismas aórticos abdominales (REVA) sobrepasan los de la corrección abierta1-5. Esto se debe principalmente al coste elevado de la endoprótesis, que supone>50% del gasto total inicial de la implantación1. Además de los gastos iniciales de la REVA, existen otros costes significativos a largo plazo. Las intervenciones secundarias y los estudios radiológicos representan el 89,9% de los mismos6. Se estima que, a los 5 años, los costes postimplantación aumentan el coste global de la REVA en un 44%6.
Si bien la selección del modelo de endoprótesis puede influir en algunos resultados de la REVA7-10, no se ha evaluado con anterioridad su repercusión en los costes postimplantación. Este estudio compara los costes específicos de dos dispositivos a largo plazo y evalúa las diferencias entre ellos y sus causas. Las consideraciones de los costes son apropiados en el sistema sanitario actual y las diferencias en los específicos de cada dispositivo pueden ser determinantes para su elección.
MétodosSe utilizaron las endoprótesiss AneuRx (Medtronic/AVE, Santa Rosa, CA) y Zenith (Cook, Bloomington, IN) para realizar 250 REVA en el Ochsner Clinic Foundation Hospital (OCF) entre diciembre de 1998 y junio de 2006. Nuestra base de datos prospectiva de implantes de endoprótesis se revisó de forma retrospectiva para identificar la demografía de los pacientes, el tipo de dispositivo, los estudios radiológicos postimplantación, las intervenciones secundarias, las visitas ambulatorias, los estudios de laboratorio, y los reingresos hospitalarios relacionados. Los datos adicionales se obtuvieron a través de la revisión retrospectiva de las historias clínicas. Nuestros costes a largo plazo de la REVA han sido publicados con enterioridad6. Los costes postimplantación específicos del dispositivo se obtuvieron a través de análisis posteriores de los subgrupos de datos. Para evaluar los costes a largo plazo, se excluyeron los pacientes cuyo seguimiento en el OCF fue menor de un año. Para limitar los efectos de la curva de aprendizaje inicial en el coste, también se excluyeron los primeros 50 pacientes sometidos a REVA desde diciembre de 1995 hasta 1998. Los costes directos derivados del cuidado de los pacientes se establecieron a través del sistema de contabilidad de costes de nuestro centro (Eclypsis, Boca Raton, FL). El sistema de contabilidad de costes utiliza estadísticas de distribución o unidades de valor relativo para asignar los costes departamentales directos e indirectos a cada provisión o servicio. La suma de las unidades de provisiones o servicios utilizados por un paciente determina los costes postimplantación del mismo. Los costes específicos del dispositivo no incluyeron los gastos de la evaluación preoperatoria ni de la implantación. Estos datos, por tanto, representan los costes reales para el centro y no son las tarifas cobradas al paciente o a la mutua ni los datos de reembolso.
Los costes adicionales incluidos fueron las visitas ambulatorias, los costes indirectos del centro y los honorarios profesionales. Los gastos de las visitas ambulatorias se calcularon utilizando una fórmula en función del tiempo asignada mediante el uso de códigos de evaluación y gestión. Los costes indirectos se añadieron a los directos derivados del cuidado del paciente multiplicando por un factor de conversión del 30%. Este parámetro se aplica sistemáticamente por la administración del hospital con una variabilidad mensual mínima. Los costes indirectos del centro representan los gastos de los departamentos no implicados directamente en el cuidado de los pacientes (p. ej. limpieza, finanzas, mantenimiento), los costes de las instalaciones y de amortización. Los honorarios profesionales se calcularon utilizando un cociente coste-tarifa específico del departamento. La media de los costes de enero hasta junio de 2006 se aplicó a los de años anteriores para asegurar la coherencia de los datos.
Nuestro protocolo de seguimiento fue el mismo para ambos tipos de dispositivo. Los pacientes fueron sometidos a una visita ambulatoria inicial a las 2 semanas de la cirugía. Las visitas ambulatorias posteriores se produjeron al cabo de 1, 6, y 12 meses y posteriormente a intervalos anuales. Durante estas visitas, se realizaron radiografías abdominales (RXA; con proyecciones anteroposterior, lateral, y 2 oblicuas) y una tomografía computerizada (TC) del abdomen y la pelvis (imágenes axiales de 2,5-3mm, con y sin contraste intravenoso). En los pacientes con insuficiencia renal, se utilizó la ecografía abdominal para el seguimiento. Si un paciente fue sometido a una intervención secundaria, se reiniciaron las visitas de seguimiento. Todos los dispositivos fueron colocados por dos cirujanos adjuntos (W. C. S. y S. R. M.), quienes siguieron estrechamente este protocolo de seguimiento. Los pacientes que participaron en los ensayos de las endoprótesis de la Food and Drug Administration siguieron los mismos protocolos tras la hospitalización inicial. Para cada dispositivo se determinó el número y tipo de intervenciones secundarias y endofugas. La intervención secundaria se definió como cualquier procedimiento relacionado con el aneurisma o la endoprótesis tras el alta hospitalaria inicial.
También se determinó el número y tipo de endofugas de cada dispositivo. Solamente se incluyeron aquellas observadas en las pruebas de imagen después de 1 mes. Las indicaciones para las intervenciones secundarias fueron la presencia de una endofuga tipo I o III, o una endofuga de tipo II con una expansión significativa del saco (> 5mm). En los últimos años, se ha optado por la embolización translumbar con trombina o derivados selladores como tratamiento de las endofugas de tipo II, aunque con anterioridad se utilizaba la microembolización con espirales.
Análisis estadísticoLos datos se expresan como media ± error estándar (EE). La demografía de los pacientes, las visitas ambulatorias, y las imágenes se compararon utilizando el test chi cuadrado. Se analizaron los datos de los costes y la comparación del tiempo de seguimiento utilizando el test de Wilcoxon de dos muestras. El análisis de la tabla de vida de Kaplan-Meier se utilizó en las comparaciones entre dispositivos de las intervenciones secundarias y endofugas para controlar cualquier sesgo creado por los diferentes tiempos de seguimiento. Se consideró que p<0,05 fue estadísticamente significativa. El análisis estadístico se realizó utilizando el programa Statistical Analysis System (SAS), versión 8.2 (SAS Institute, Cary, NC).
ResultadosDe las REVA finalizadas durante el período del estudio, 131 se incluyeron en el análisis final de los costes. Las razones para la exclusión fueron: fallecimiento (n=35), < 1 año desde la REVA (n=32), ausencia de seguimiento (n=25), seguimiento en otro centro (n=15), y rechazo de tratamiento posterior (n=12). Esto dio lugar a un análisis final de costes con 55 pacientes AneuRx y 76 Zenith.
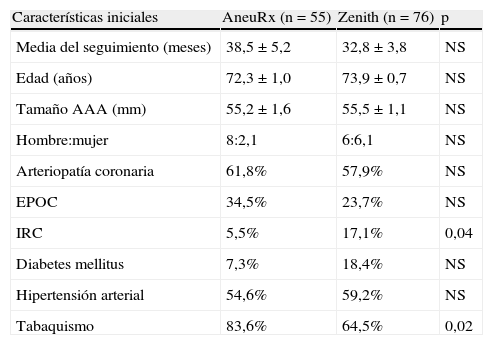
Se compararon las características de los pacientes para cada dispositivo. La edad de los pacientes, tamaño del aneurisma aórtico abdominal, cociente hombres-mujeres, arteriopatía coronaria, enfermedad pulmonar obstructiva crónica, diabetes mellitus, e hipertensión arterial no difirieron de forma significativa entre AneuRx y Zenith (tabla I). Solamente el porcentaje de insuficiencia renal crónica preoperatoria, definida como un valor inicial de creatinina≥1,5 (AneuRx 5,5%, Zenith 17,1%; p<0,05), y el tabaquismo (AneuRx 83,6%, Zenith 64,5%; p<0.05) difirieron entre los grupos. La media del tiempo de seguimiento en ambos grupos fue de 38,5±5,2 meses (AneuRx) y de 32,8±3,8 meses (Zenith, p=0,12). No se produjeron fallecimientos relacionados con el aneurisma durante el período de seguimiento en ambas cohortes.
Características de los pacientes
| Características iniciales | AneuRx (n=55) | Zenith (n=76) | p |
| Media del seguimiento (meses) | 38,5±5,2 | 32,8±3,8 | NS |
| Edad (años) | 72,3±1,0 | 73,9±0,7 | NS |
| Tamaño AAA (mm) | 55,2±1,6 | 55,5±1,1 | NS |
| Hombre:mujer | 8:2,1 | 6:6,1 | NS |
| Arteriopatía coronaria | 61,8% | 57,9% | NS |
| EPOC | 34,5% | 23,7% | NS |
| IRC | 5,5% | 17,1% | 0,04 |
| Diabetes mellitus | 7,3% | 18,4% | NS |
| Hipertensión arterial | 54,6% | 59,2% | NS |
| Tabaquismo | 83,6% | 64,5% | 0,02 |
AAA: aneurisma aórtico abdominal; EPOC: enfermedad pulmonar crónica obstructiva; IRC: insuficiencia renal crónica; NS: no significativo.
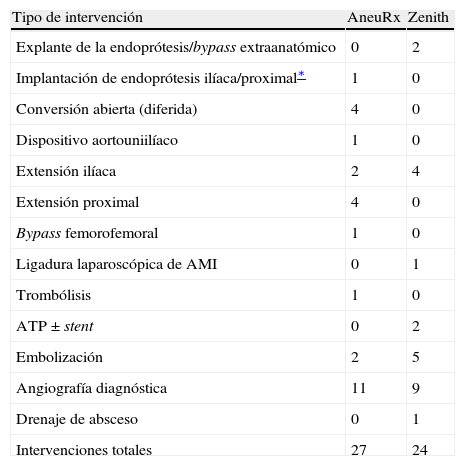
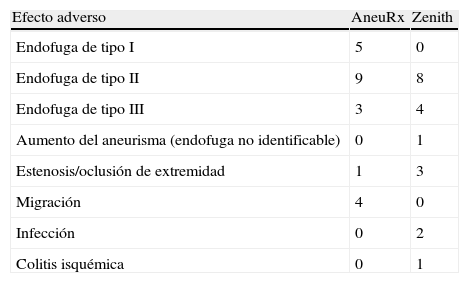
Se realizaron 51 intervenciones secundarias para los dos dispositivos (27 AneuRx en 17 pacientes, 24 Zenith en 10 pacientes) (tabla II). El mayor número de ellas se llevó a cabo en el grupo Zenith (2,4) en comparación con el AneuRx (1,6, p=0,39). Dos pacientes del grupo Zenith requirieron 6 intervenciones secundarias cada uno de ellos. El número más alto de intervenciones secundarias en el grupo AneuRx fue de 4 en un mismo paciente. El efecto adverso más frecuente en ambos dispositivos durante el seguimiento fue la endofuga tipo II (AneuRx n=9, Zenith n=8) (tabla III). Todos los efectos adversos llevaron a una intervención secundaria con la excepción de 8 endofugas tipo II que fueron monitorizadas sin necesidad de intervención.
Intervenciones secundarias
| Tipo de intervención | AneuRx | Zenith |
| Explante de la endoprótesis/bypass extraanatómico | 0 | 2 |
| Implantación de endoprótesis ilíaca/proximal∗ | 1 | 0 |
| Conversión abierta (diferida) | 4 | 0 |
| Dispositivo aortouniilíaco | 1 | 0 |
| Extensión ilíaca | 2 | 4 |
| Extensión proximal | 4 | 0 |
| Bypass femorofemoral | 1 | 0 |
| Ligadura laparoscópica de AMI | 0 | 1 |
| Trombólisis | 1 | 0 |
| ATP±stent | 0 | 2 |
| Embolización | 2 | 5 |
| Angiografía diagnóstica | 11 | 9 |
| Drenaje de absceso | 0 | 1 |
| Intervenciones totales | 27 | 24 |
AMI: arteria mesentérica inferior; ATP: angioplastia transluminal percutánea.
Efectos secundarios adversos de cada dispositivo
| Efecto adverso | AneuRx | Zenith |
| Endofuga de tipo I | 5 | 0 |
| Endofuga de tipo II | 9 | 8 |
| Endofuga de tipo III | 3 | 4 |
| Aumento del aneurisma (endofuga no identificable) | 0 | 1 |
| Estenosis/oclusión de extremidad | 1 | 3 |
| Migración | 4 | 0 |
| Infección | 0 | 2 |
| Colitis isquémica | 0 | 1 |
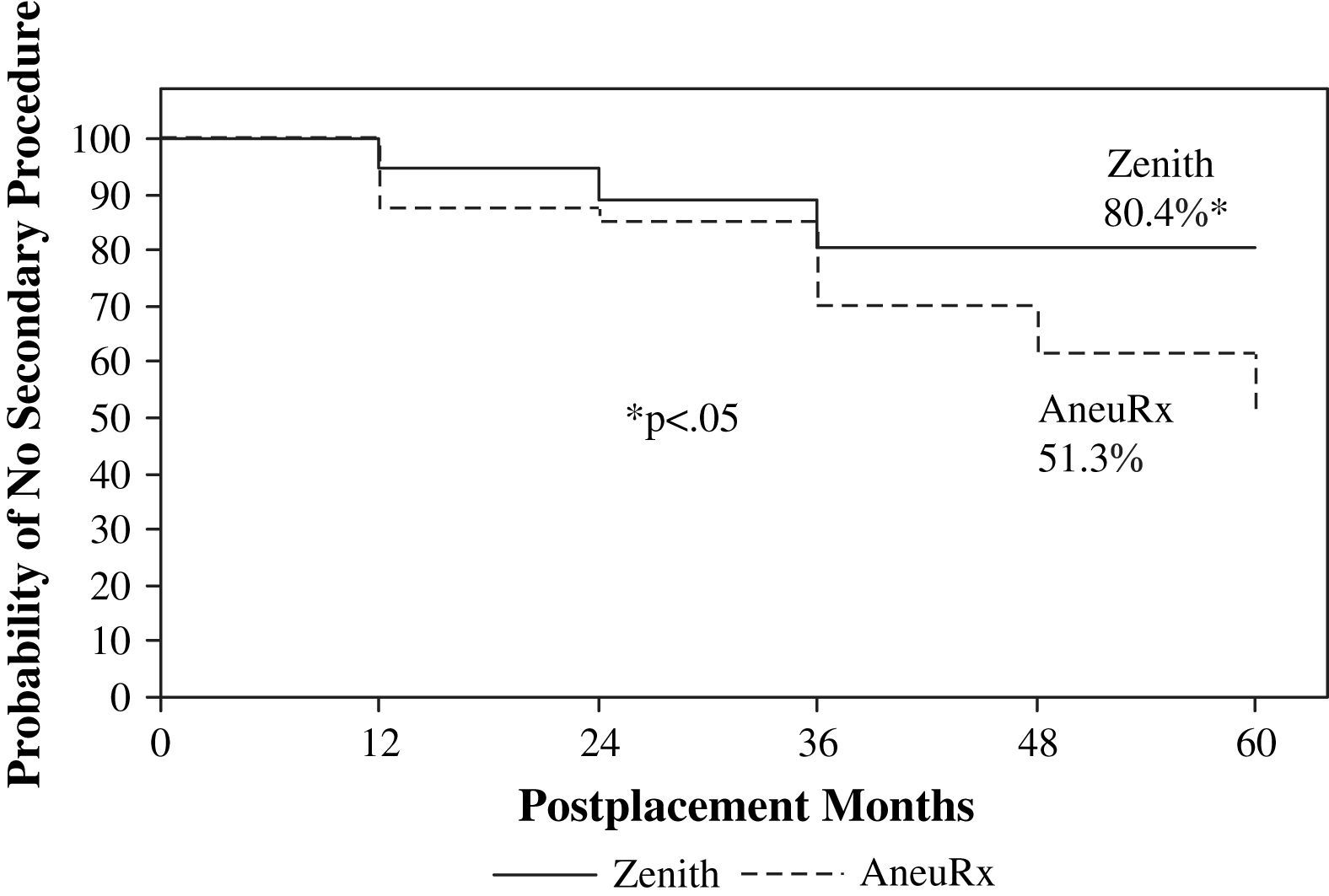
El análisis de Kaplan-Meier demostró una incidencia significativamente elevada de intervenciones secundarias a lo largo del tiempo con el dispositivo AneuRx en comparación con el Zenith (p<0,05) (fig. 1). La ausencia de intervenciones secundarias con la endoprótesis AneuRx fue del 87,3%, 85,0%, 69,8%, 61,6%, y 51,3% al cabo de 1, 2, 3, 4, y 5 años, respectivamente. En cuanto a la endoprótesis Zenith, la ausencia de intervenciones secundarias fue del 94,7%, 89,1%, y permaneció en el 80,4% durante los años 3, 4, y 5 (p<0,05), respectivamente. La intervención secundaria más frecuente en ambos grupos fue la angiografía diagnóstica (n=11 AneuRx, n=9 Zenith). En el grupo AneuRx, 9 pacientes fueron sometidos a intervenciones secundarias adicionales, mientras que en el Zenith todos los pacientes con angiografías diagnósticas fueron sometidos posteriormente a intervenciones adicionales. La intervención secundaria más cara en el grupo AneuRx fue la conversión abierta diferida (n=4) con un coste medio de 21.382±3.130 $. Dos conversiones se debieron solamente a endofugas (tipo I, tipo III), una por una migración y endofuga (tipo I), y una debido a la expansión del aneurisma (endotensión). La intervención más cara del grupo Zenith fue la explantación de una endoprótesis con un bypass extraanatómico (n=2) debido a una infección de la endoprótesis, con un coste medio de 57.681±6.464 $. Estas intervenciones secundarias poco frecuentes pero de elevado coste representaron el 26,2% de los acumulativos del grupo AneuRx y el 36,2% del grupo Zenith.
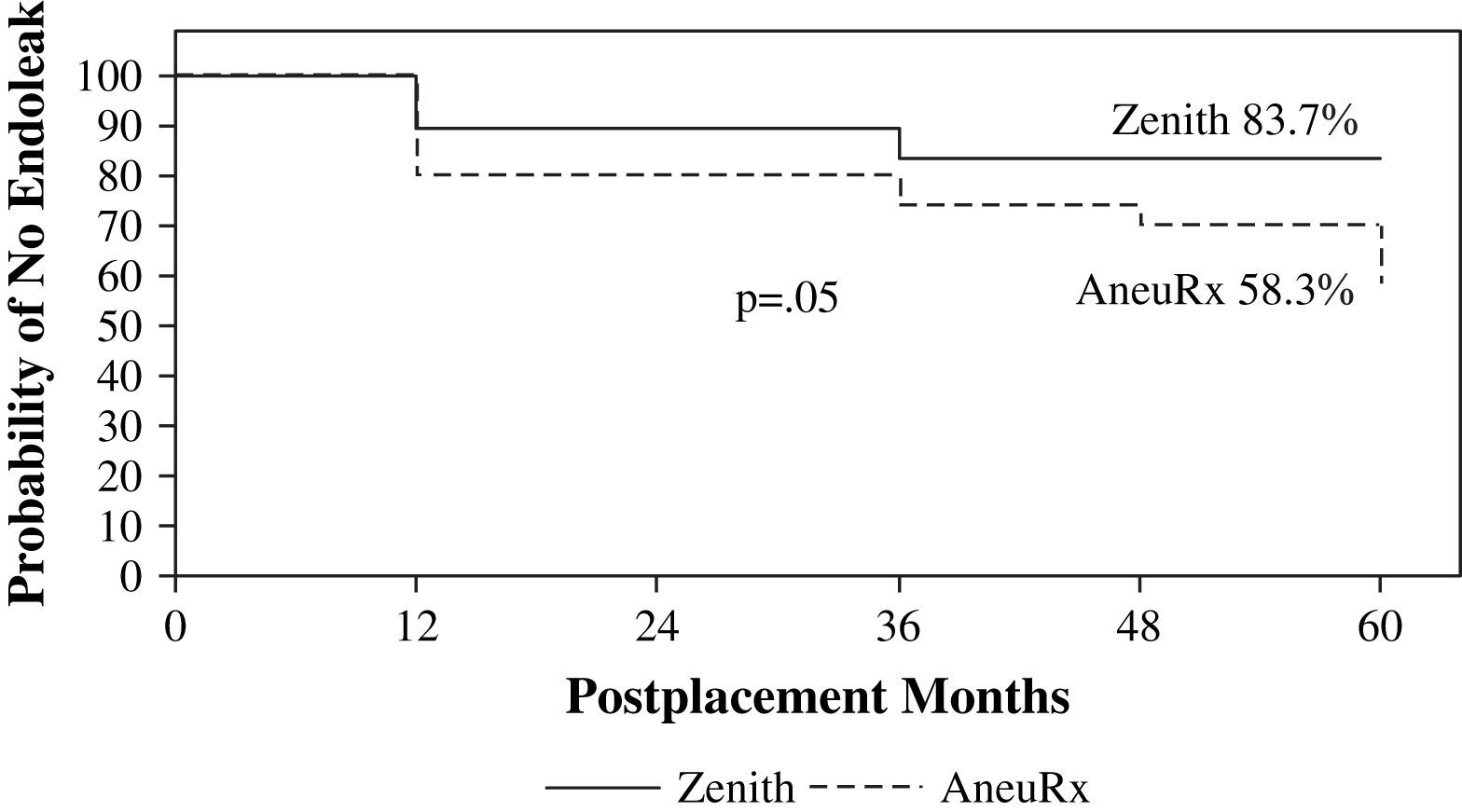
Utilizando el análisis Kaplan-Meier se detectó un porcentaje más elevado de endofugas con el implante AneuRx que con el Zenith a lo largo del tiempo (fig. 2). La ausencia de endofugas con AneuRx fue del 80,0, 80,0, 74,1, 70,0, y 58,3% al cabo de 1, 2, 3, 4, y 5 años tras la implantación, respectivamente. En cuanto al implante Zenith, la ausencia de endofugas fue del 89,5%, 89,5%, y permaneció en el 83,7% durante los años 3, 4, y 5 (p=0,05), respectivamente. Un total de 16 pacientes con AneuRx presentaron 17 endofugas (5 de tipo I, 9 de tipo II, 3 de tipo III), mientras que 11 de los pacientes con implantes Zenith presentaron 12 endofugas (0 de tipo I, 8 de tipo II, 4 de tipo III).
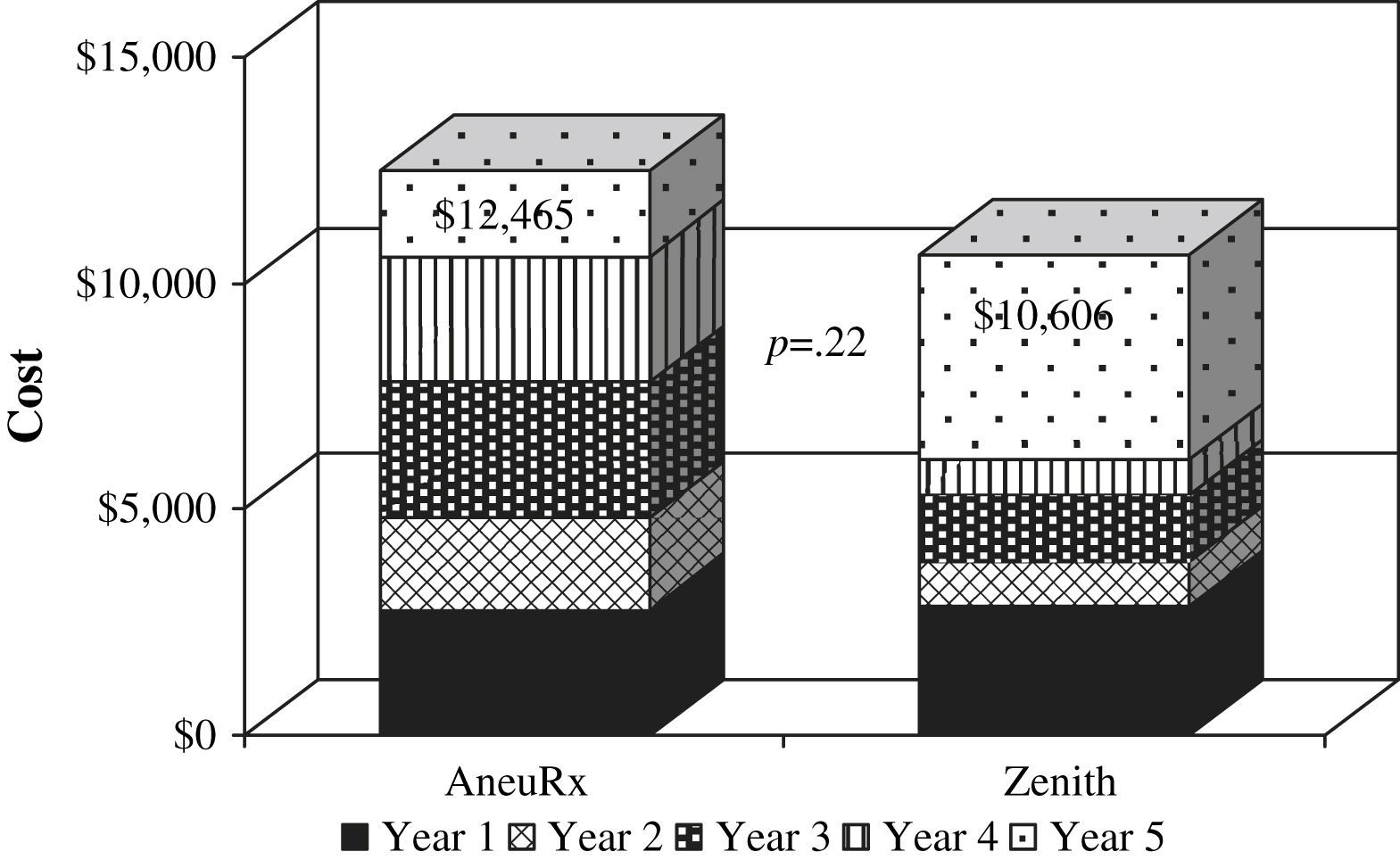
Costes postimplantaciónPara los pacientes con dispositivos AneuRx, el coste medio del primer año fue de 2.784±632 $. Durante los años 2-5, el coste fue de 2.056±910, 2.961±1.179, 2.794±1.225, y 1.871±848 $, respectivamente. Para los pacientes con dispositivos Zenith, el coste medio fue de 2.854±887 $ durante el primer año. Durante los años 2-5, el coste medio del dispositivo fue de 966±284, 1.516±815, 755±323, y 4.515±3.200 $, respectivamente. Los costes acumulativos a 5 años fueron de 12.465 $ (AneuRx) y de 10.606 $ (Zenith) (p=0,22) (fig. 3).
Durante el primer año postimplantación, la media de visitas ambulatorias de la cohorte AneuRx fue de 3,5±0,1 y la media de TC de 2,7±0,1, mientras que la media para el grupo Zenith fue de 3,9±0,1 visitas ambulatorias (p=0,08) y 2,7±0,1 TC (p=0,08). Se observó una diferencia significativa solamente en las RXA durante este año (AneuRx 2,3±0,1, Zenith 2,7±0,1; p<0,05). En los años posteriores, 2, 3, y 5 de seguimiento, el número de visitas ambulatorias (AneuRx 1,2 a 1,3±0,02, Zenith 0,9 a 1,0±0,02), TC (AneuRx 1 a 1,3±0,1, Zenith 0,8 a 1,0±0,1), y RXA (AneuRx 1,0 a 1,3±0,2, Zenith 0,9±0,1) fueron similares. Solamente a partir del cuarto año se observaron diferencias significativas en las visitas ambulatorias (AneuRx 1,8±0,2, Zenith 1,0±0,1; p<0,05), TC (AneuRx 1,5±0,2, Zenith 0,9±0,1; p<0,05), y RXA (AneuRx 1,5±0,2, Zenith 1,0±0,1; p<0,05).
Los componentes de los costes acumulativos de AneuRx fueron las intervenciones secundarias (59,4%), los estudios radiológicos (29,2%), las visitas ambulatorias (6,7%), los costes de laboratorio (0,2%), y los reingresos hospitalarios (4,2%). Los estudios radiológicos fueron el componente de mayor envergadura de los costes durante el primer año postimplantación, mientras que las intervenciones secundarias fueron el componente de mayor envergadura de los costes de los años restantes. En cuanto al dispositivo Zenith, los componentes de los costes fueron las intervenciones secundarias (56,4%), los estudios radiológicos (35,0%), las visitas ambulatorias (8,0%), y los costes de laboratorio (0,7%). Los estudios radiológicos fueron el componente de mayor envergadura de los costes durante los años 1 y 4, mientras que las intervenciones secundarias fueron el más importante durante el tiempo de seguimiento restante.
DiscusiónSe ha demostrado que los costes postimplantación a largo plazo tras una REVA contribuyen de forma significativa al gasto global1-5. La presencia de endofugas y la necesidad de intervenciones secundarias tienen un impacto significativo en los costes acumulativos postimplantación6. Varios estudios previos han demostrado respuestas y resultados específicos de cada dispositivo7-10. Sin embargo, no hay comparaciones previas específicas del dispositivo. En este estudio, se identifican los costes postimplantación de los modelo AneuRx y Zenith.
La media de los costes acumulativos postimplantación a 5 años de AneuRx fue de 12.465 $, mientras que el coste postimplantación de Zenith fue de 10.606 $ (p=0,22). Sin embargo, esta reducción del 15% en el dispositivo Zenith, no fue estadísticamente significativa. Dado su número relativamente bajo, es posible que se produjera un error estadístico de tipo II. Las intervenciones secundarias y los estudios radiológicos representaron los componentes con un mayor coste en ambos dispositivos. Se produjeron menos intervenciones secundarias y endofugas en la cohorte de Zenith.
Si bien no existen comparaciones directas anteriores sobre los costes específicos de los dispositivos, existen estudios que evalúan los costes del seguimiento predominantemente de un dispositivo. Prinssen et al11 informaron de los costes postimplantación de 77 pacientes con un seguimiento medio de 19,9 meses que utilizaron el sistema endovascular Ancure (Guidant, Menlo Park, CA) en todos los pacientes excepto en dos. El coste del seguimiento a los 5 años fue de 9.729 $. En una serie australiana de 54 pacientes con un seguimiento medio de 12 meses que utilizaron principalmente la endoprótesis Zenith, la media del coste anual fue de 999 $12. Nuestros costes fueron algo más elevados, pero también reflejan un seguimiento más largo e incluyen las intervenciones secundarias.
El componente de mayor envergadura en los costes de los dispositivos AneuRx y Zenith fue precisamente el de los procedimientos diferidos. A los 5 años, se observó una diferencia significativa en la ausencia de intervenciones secundarias utilizando el análisis de tabla de vida de Kaplan-Meier (AneuRx 51%, Zenith 80%; p<0,05). Dado que éstas tienen el mayor impacto en los costes postimplantación a largo plazo, esta diferencia pudo haber influido en la tendencia hacia un aumento de los costes con el dispositivo AneuRx. Las intervenciones diferidas también tuvieron un efecto considerable en los costes acumulativos a los 5 años. A los 4 años del implante, el coste en la cohorte AneuRx fue un 43% más alto que el de Zenith. Sin embargo, con la inclusión de dos intervenciones secundarias diferidas (explante de la endoprótesis y extensión ilíaca por una endofuga tipo III) en el quinto año, esta diferencia se redujo al 15%. A los 5 años, según el análisis de tabla de vida de Kaplan-Meier, también se produjo una reducción de la ausencia de endofugas utilizando el dispositivo Zenith (AneuRx 58%, Zenith 83%; p=0,05). Según nuestra experiencia, la presencia de endofugas aumentó la intensidad de la vigilancia mediante estudios de imagen a intervalos de 3-6 meses.
Otros componentes de los costes también contribuyeron a incrementar el gasto global. Los estudios radiológicos supusieron el 29,2 y el 34,9% del coste total en el caso de los dispositivos AneuRx y Zenith, respectivamente. Si bien solamente se observaron algunas diferencias en la media del número de estudios por imagen entre ambos dispositivos, estos estudios constituyen una fuente potencial de reducción de costes. En pacientes seleccionados, puede ser adecuado alternar los protocolos de vigilancia mediante estudios de imagen con diferentes modalidades o intervalos13,14. Los costes restantes proceden principalmente de las visitas ambulatorias (AneuRx 6,9%, Zenith 8,0%). La reducción de la frecuencia de estas visitas ambulatorias supondría una fuente menor de reducción de costes ya que ésta se relaciona con la realización de estudios de imagen. Aún deben definirse los pacientes adecuados para estos protocolos de vigilancia reducida y ello requerirá de posteriores estudios.
Existen algunas limitaciones al estudio. En primer lugar, las endoprótesis AneuRx se colocaron al principio de nuestra práctica, mientras que las de Zenith se utilizaron principalmente en los últimos años. Sin embargo, para minimizar el efecto de la curva de aprendizaje se excluyeron los 50 pacientes iniciales. Además, los cambios que se han producido en los protocolos de seguimiento a lo largo del tiempo, como el uso menos frecuente de angiografías diagnósticas, el tratamiento más conservador de las endofugas de tipo II, y la mayor tendencia al recubrimiento ilíaco en la intervención inicial, podrían facilitar la reducción de costes específicos de los dispositivos implantados en la actualidad. Así mismo, los dispositivos y las modificaciones técnicas de AneuRx y Zenith, así como las variaciones en los protocolos de seguimiento, posibilitan un menor coste postimplantación. En segundo lugar, existen limitaciones en los datos de los costes. Dado que este análisis incluye un único centro, pueden existir variaciones específicas de cada región u hospital en los gastos indirectos y otros componentes del coste relacionados. Además, no se pudo realizar el seguimiento en varios pacientes. No obstante, nuestros datos representan los costes postimplantación del ‘‘mundo real'’ en oposición a un coste postimplantación ideal. En un contexto clínico ideal con una mayor colaboración de los pacientes, los costes serían potencialmente más elevados.
ConclusionesSe observó una reducción de las intervenciones secundarias y endofugas con el dispositivo Zenith en comparación con el AneuRx. Sin embargo, la correspondiente reducción del 15% en los costes postimplantación a largo plazo no fue estadísticamente significativa. Las intervenciones secundarias y mediante técnicas de imagen representan>88% de los gastos del seguimiento para ambos dispositivos. Las mejoras en el diseño del dispositivo y en la técnica para minimizar las intervenciones secundarias, endofugas, y la necesidad posterior de estudios de imagen pueden reducir los costes postespecíficos de cada dispositivo.
Presentado en el Eighteenth Annual Meeting of the Peripheral Vascular Surger Society, Snowmass, Colorado, 1-3 de febrero de 2008.