El objetivo del presente estudio fue describir la experiencia de un centro en el tratamiento electivo de los aneurismas de la aorta torácica descendente (AATD) en la era del tratamiento endovascular. Desde julio de 1997 a mayo de 2005, operamos 173 pacientes. Un total de 52 pacientes (30,1%) se sometieron a reparación endovascular mediante endoprótesis (grupo I). La reparación endovascular se efectuó exclusivamente en pacientes en riesgo quirúrgico alto en los que habitualmente la arteriografía preoperatoria de la médula espinal demostró que el origen de la arteria de Adamkiewicz se localizaba fuera de la zona cubierta por la endoprótesis. Los 121 pacientes restantes (69,9%) se sometieron a la corrección quirúrgica abierta (grupo II), con un bypass cardiopulmonar parcial en 78 casos (64,5%) y paro circulatorio hipotérmico profundo en 43 (35,5%). Los dos grupos de tratamiento difirieron sustancialmente con respecto a la edad, prevalencia de enfermedad pulmonar obstructiva crónica, número de aneurismas que afectaban al segmento superior o a toda la longitud de la aorta torácica descendente, y el porcentaje de pacientes en los que la arteriografía de la médula espinal se consideró innecesaria o demostró que el origen de la arteria de Adamkiewicz se localizaba en la zona cubierta por el stent. La mortalidad hospitalaria fue del 15,4% (8/52) en el grupo I frente al 5,0% (6/121) en el grupo II (p = 0,02). Las cinco muertes después de la reparación vascular se debieron a causas técnicas. Todos los déficit neurológicos fueron debidos a isquemia de la médula espinal (9/121, 7,4%) incluido un 3,3% de los casos de paraplejía flácida irreversible que afectaron al grupo II (p = 0,04). Los hallazgos del presente estudio demuestran que con la corrección quirúrgica abierta se obtienen excelentes resultados cuando se recomienda la reparación endovascular en aquellos candidatos quirúrgicos de riesgo elevado. No obstante, puesto que la arteriografía preoperatoria de la médula espinal fue un criterio de selección para la reparación endovascular, la disminución de la mortalidad se acompañó de una concentración de complicaciones isquémicas de la médula espinal en los pacientes sometidos a corrección quirúrgica abierta. La elevada mortalidad asociada a la reparación endovascular en la serie del presente estudio debería disminuir a medida que se tenga mayor experiencia en el uso de las técnicas endovasculares.
La primera reparación endovacular de un aneurisma de aorta torácica descendente (AATD) fue efectuada por Dake et al1 y sin lugar a dudas constituyó un importante hito en el tratamiento de estas lesiones. Algunos investigadores han extendido las indicaciones hasta el punto de recomendar la reparación endovascular como tratamiento de elección de estas lesiones2-8. Otros investigadores describen excelentes resultados con la corrección quirúrgica abierta y, en apariencia, consideran que no está indicada una reparación endovascular9-11. En nuestro servicio hemos optado por una estrategia intermedia. Empezamos a efectuar la reparación endovascular de los AATD en 1997. Hasta esa fecha, excepto los pacientes que presentaban contraindicaciones quirúrgicas relacionadas con su estado general, todas estas lesiones eran tratadas a través de una toracotomía con asistencia circulatoria, es decir, bypass cardiopulmonar parcial en la mayoría de los casos. Desde 1997, hemos efectuado reparación endovascular en aquellos candidatos quirúrgicos de riesgo elevado siempre que la arteriografía de la médula espinal demuestre que el origen de la arteria de Adamkaiewicz se localiza fuera de la zona cubierta por la endoprótesis. Esta actitud prudente se basa en la ausencia de resultados a largo plazo en la mayor parte de las series publicadas sobre reparación endovascular de los AATD al igual que en el resultado relativamente decepcionante descrito en la única serie publicada con un período de seguimiento suficiente12. El objetivo del presente estudio fue evaluar los resultados de nuestra estrategia mediante un análisis de la mortalidad postoperatoria y de la isquemia de la médula espinal en función de la técnica de tratamiento utilizada.
MétodosDesde julio de 1997 a mayo de 2005, un total de 173 pacientes consecutivos se sometieron a tratamiento electivo de AATD en el servicio de cirugía vascular del Hospital Universitario Pitié-Salpêtrière. Los pacientes se dividieron en dos grupos de acuerdo con la técnica de tratamiento: grupo I, que incluyó a 52 pacientes (30,1%) que se sometieron a una corrección con endoprótesis, y grupo II, que incluyó a 121 pacientes (69,9%) que se sometieron a una corrección quirúrgica abierta.
Los datos sobre la población de pacientes, enfermedad aneurismática, técnica quirúrgica y resultado del tratamiento se obtuvieron prospectivamente y se analizaron retrospectivamente. Los datos demográficos incluyeron la edad del paciente (media, límite y porcentaje de los de 70 años en adelante) y comorbilidades (hipertensión arterial, coronariopatía, enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica, diabetes, insuficiencia vascular cerebral y aneurisma concomitante de aorta abdominal infrarrenal).
La etiología de la enfermedad aneurismática se clasificó en tres grupos: aneurisma degenerativo, aneurisma relacionado con disección crónica (incluido un hematoma intramural y úlcera penetrante), y aneurisma debido a otras causas, entre las que se incluyeron el postraumático, distrófico, inflamatorio, infectado, congénito e yatrógeno.
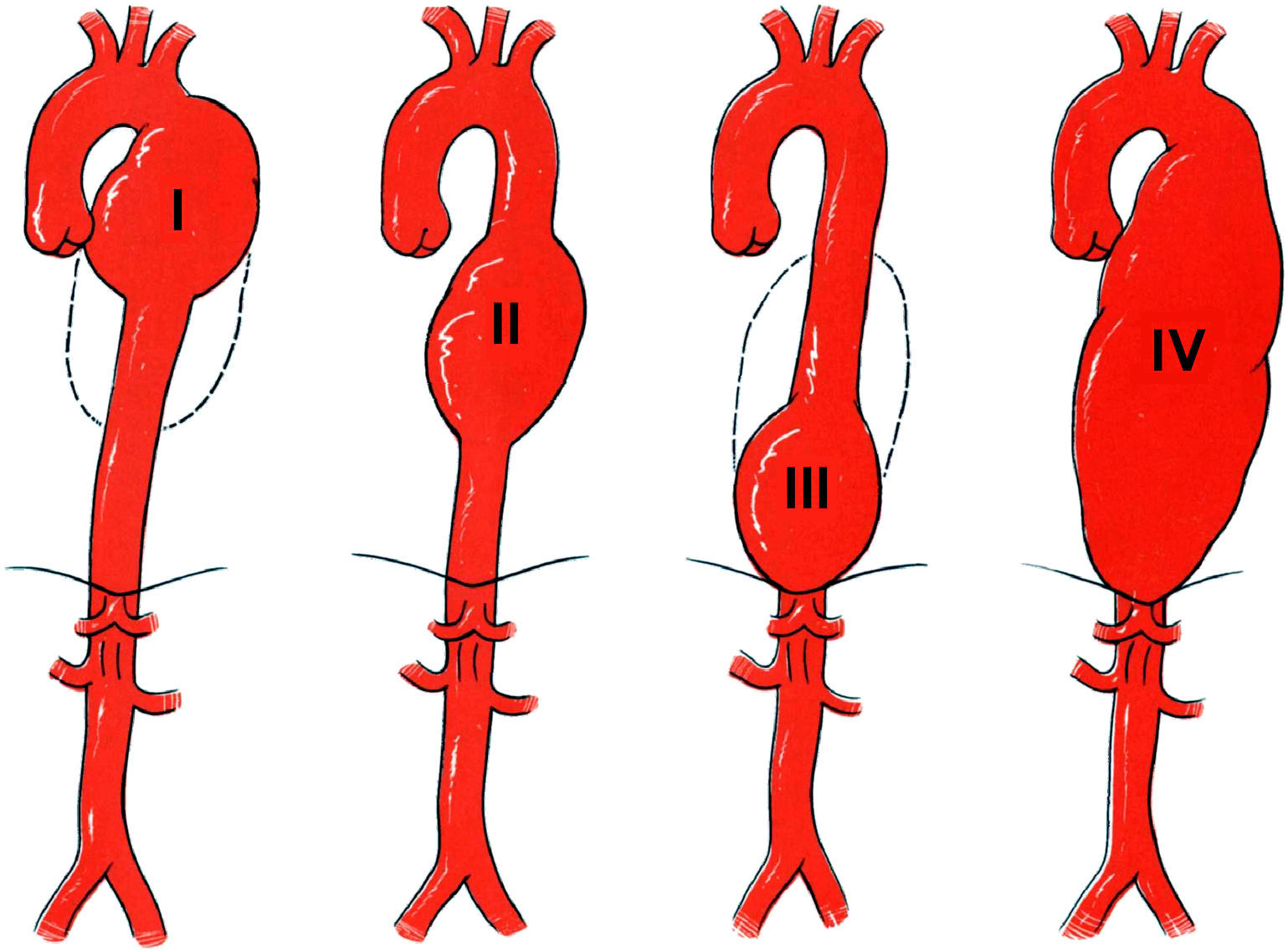
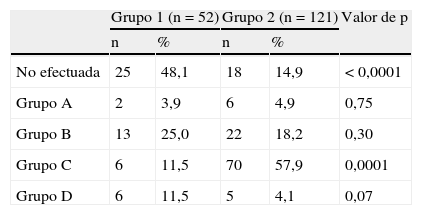
La topografía del aneurisma se evaluó mediante panaortografía y tomografía computarizada (TC). Las lesiones se clasificaron usando un sistema personal13 en las cuatro categorías mencionadas más adelante (fig. 1):
- •
Tipo I: aneurismas localizados en la parte proximal de la aorta torácica descendente en los que el límite inferior no sobrepasaba el punto medio. En general, este tipo de lesión requiere el clampaje del cayado aórtico entre la arteria carótida común izquierda y la arteria subclavia izquierda si se efectúa corrección abierta y transposición de la arteria subclavia izquierda en la arteria carótida común izquierda si se efectúa reparación endovascular.
- •
Tipo II: aneurismas localizados en la parte media de la aorta torácica descendente. Este tipo de lesión es la indicación más favorable desde un punto de vista técnico para la corrección tanto abierta como endovascular.
- •
Tipo III: aneurisma localizado en la parte distal de la aorta torácica descendente en el que el límite superior no se extendía sobre el punto medio. La exposición quirúrgica de este tipo de lesión suele ser difícil y puede requerir un control del flujo de la aorta con la arteria celíaca o entre la arteria mesentérica superior y la arteria celíaca. Con frecuencia, el origen de la arteria de Adamkiewicz se localiza en los límites de la lesión. En caso de reparación endovascular, se presenta el riesgo de cubrir esta arteria así como el tronco celíaco.
- •
Tipo IV: aneurisma que afecta a toda la longitud de la aorta torácica descendente. Este tipo de lesión combina los problemas del tipo tanto I como III.
Sistema de clasificación de los aneurismas de la aorta torácica descendente13.
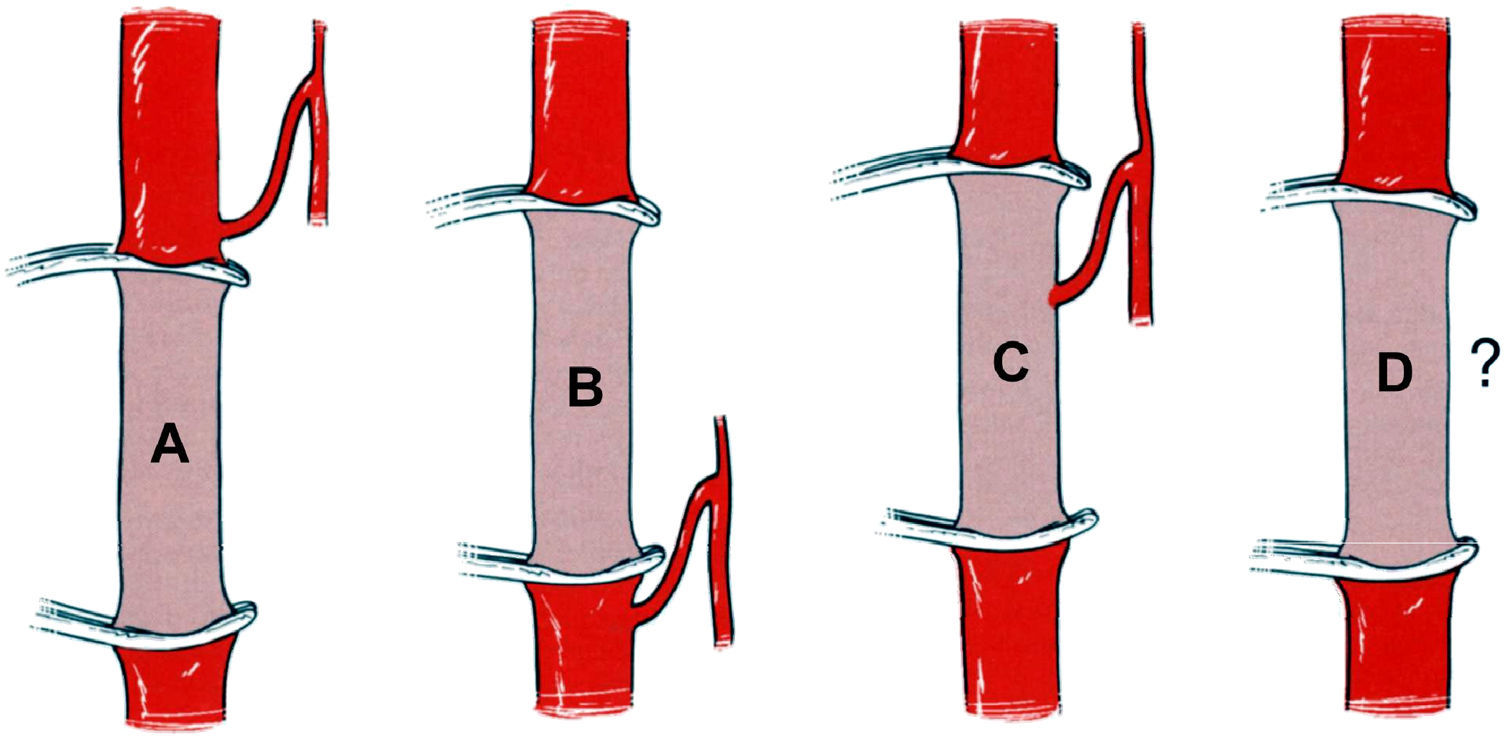
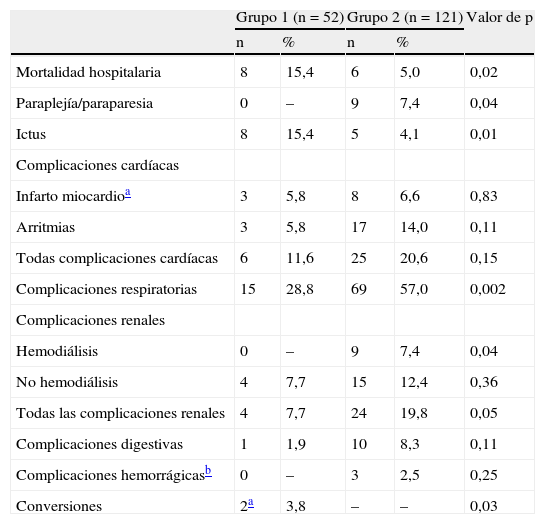
Se llevó a cabo una arteriografía preoperatoria de la médula espinal14 en todos los pacientes excepto en los que presentaron aneurismas estrictamente ístmicos o, más raramente, los que presentaban contraindicaciones para el cateterismo selectivo de las arterias intercostales o lumbares (aneurisma que se presentó con isquemia de la médula espinal o émbolos ateromatosos). Los resultados de la arteriografía de la médula espinal se clasificaron en cuatro categorias15, en función de la localización de la arteria de Adamkiewicz y su relación con la zona del clampaje aórtico o bien la zona cubierta por la endoprótesis (fig. 2):
- •
Grupo A: arteria de Adamkiewicz localizada por encima de la zona quirúrgica.
- •
Grupo B: arteria de Adamkiewicz localizada por debajo de la zona quirúrgica.
- •
Grupo C: arteria de Adamkiewicz localizada en la zona quirúrgica.
- •
Grupo D: imposibilidad de visualizar la arteria de Adamkiewicz.
Sistema de clasificación de los resultados de la arteriografía preoperatoria de la médula espinal15.
La corrección quirúrgica convencional se efectuó habitualmente mediante un abordaje estrictamente torácico, pero, en algunos casos, se utilizó una vía toracoabdominal o ambas técnicas. En todos los casos se usó una técnica de protección frente a los efectos del clampaje aórtico. En pacientes que presentaban indicaciones anatómicas, es decir, grandes aneurismas que impedían el control de la aorta proximal, lesión de la aorta o de la arteria pulmonar durante el control, disección retrógrada de la parte posterior del cayado aórtico y ateroma o disección que aumentaba el riesgo del clampaje aórtico, o que presentaban riesgo de isquemia de la médula espinal debido a la imposibilidad de visualizar la arteria de Adamkiewicz, se usó paro circulatorio hipotérmico profundo16. En todos los demás casos, se utilizó un bypass cardiopulmonar parcial, habitualmente femorofemoral17. En todos los pacientes, para mantener una presión del líquido cefalorraquídeo (LCR) de 10 mmHg o menor durante, como mínimo, 48 h, se utilizó un sistema de drenaje de LCR.
Habitualmente las endoprótesis se introdujeron por abordaje femoral pero en algunos casos se utilizó una vía ilíaca o aórtica. En la mayoría de los casos se utilizó un introductor de calibre 24F. Hasta 2003, usábamos endoprótesis a medida. Desde 2003, hemos utilizado la endoprótesis torácica TAG (W. L. Gore, Flagstaff, Estados Unidos).
Las variables analizadas postoperatorias incluyeron la mortalidad hospitalaria, isquemia de la médula espinal, déficits neurológicos centrales, hemorragia, manifestaciones cardíacas, complicaciones pulmonares e insuficiencia renal. Se tuvieron en cuenta las manifestaciones relacionadas con la isquemia de la médula espinal, incluida no sólo la paraplejía sino también déficits parciales y/o unilaterales, al igual que las manifestaciones esfinterianas aisladas, con independencia de que su inicio fuera inmediato o secundario después del procedimiento de corrección. Los déficits neurológicos centrales incluyeron las complicaciones isquémicas hemisféricas, vertebrobasilares, y las complicaciones hemorrágicas. Las de tipo local se definieron como cualquier hemorragia postoperatoria que requirió una nueva intervención para obtener hemostasia. Las manifestaciones cardíacas incluyeron infarto de miocardio con o sin onda Q, aumento aislado de los niveles de troponina Ic, insuficiencia cardíaca y arritmias supraventriculares o ventriculares. Las complicaciones pulmonares incluyeron neumonía, ventilación mecánica durante más de 48 h o necesidad de reintubación o traqueostomía. La insuficiencia renal se definió como un aumento de la concentración sérica basal de creatinina > 50% o la necesidad de hemofiltración o de hemodiálisis permanente o temporal.
El análisis estadístico se efectuó mediante comparación univariante utilizando la prueba de la χ2 o la prueba t exacta según fuera apropiado. Se consideró significativo un valor de p < 0,05.
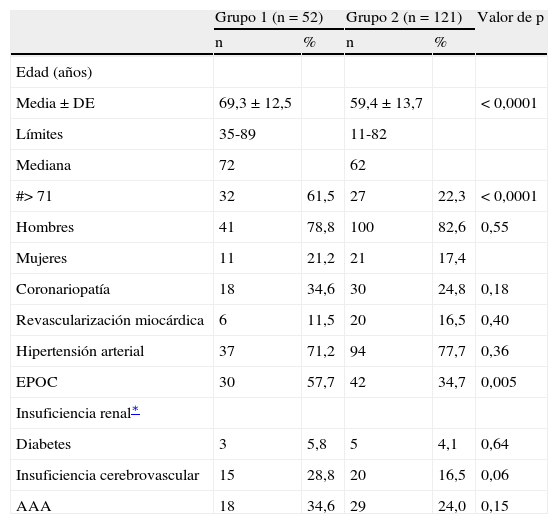
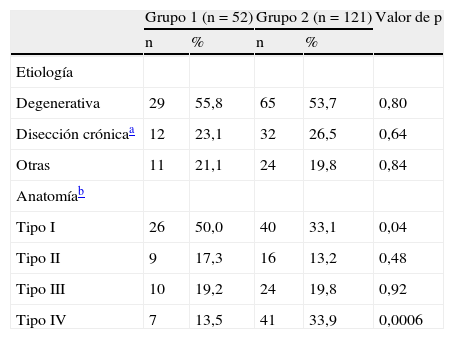
ResultadosDatos preoperatoriosEn las tablas I, II y III, respectivamente, se presentan los datos de los pacientes (sexo, edad y comorbilidades), características del aneurisma (etiología y anatomía) y los hallazgos de la arteriografía preoperatoria de la médula espinal. Se identificó una diferencia significativa entre los grupos I y II respecto a la edad, prevalencia de enfermedad pulmonar obstructiva crónica, número de aneurismas de tipo I o IV, número de casos en los que se consideró innecesaria la arteriografía de la médula espinal y el número de pacientes en los que el tratamiento incluía un riesgo de isquemia de la médula espinal asociado al clampaje temporal o exclusión definitiva de la zona que incluía el origen de la arteria de Adamkiewicz (grupo C). Por el contrario, no se obtuvieron diferencias entre grupos con respecto a la prevalencia de hipertensión arterial, coronariopatía, insuficiencia renal crónica, diabetes, insuficiencia vascular cerebral o aneurisma concomitante de aorta abdominal infrarrenal. Tampoco se detectaron diferencias significativas con respecto a la etiología, número de pacientes con aneurisma de tipo II o III, y número de pacientes en los que la arteria de Adamkiewicz se localizaba por encima (grupo A) o por debajo (grupo B) de la zona quirúrgica o en los que no se pudo visualizar.
Demografía y comorbilidades
| Grupo 1 (n = 52) | Grupo 2 (n = 121) | Valor de p | |||
| n | % | n | % | ||
| Edad (años) | |||||
| Media ± DE | 69,3 ± 12,5 | 59,4 ± 13,7 | < 0,0001 | ||
| Límites | 35-89 | 11-82 | |||
| Mediana | 72 | 62 | |||
| #> 71 | 32 | 61,5 | 27 | 22,3 | < 0,0001 |
| Hombres | 41 | 78,8 | 100 | 82,6 | 0,55 |
| Mujeres | 11 | 21,2 | 21 | 17,4 | |
| Coronariopatía | 18 | 34,6 | 30 | 24,8 | 0,18 |
| Revascularización miocárdica | 6 | 11,5 | 20 | 16,5 | 0,40 |
| Hipertensión arterial | 37 | 71,2 | 94 | 77,7 | 0,36 |
| EPOC | 30 | 57,7 | 42 | 34,7 | 0,005 |
| Insuficiencia renal∗ | |||||
| Diabetes | 3 | 5,8 | 5 | 4,1 | 0,64 |
| Insuficiencia cerebrovascular | 15 | 28,8 | 20 | 16,5 | 0,06 |
| AAA | 18 | 34,6 | 29 | 24,0 | 0,15 |
AAA: aneurisma aórtico abdominal; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica.
Características del aneurisma
| Grupo 1 (n = 52) | Grupo 2 (n = 121) | Valor de p | |||
| n | % | n | % | ||
| Etiología | |||||
| Degenerativa | 29 | 55,8 | 65 | 53,7 | 0,80 |
| Disección crónicaa | 12 | 23,1 | 32 | 26,5 | 0,64 |
| Otras | 11 | 21,1 | 24 | 19,8 | 0,84 |
| Anatomíab | |||||
| Tipo I | 26 | 50,0 | 40 | 33,1 | 0,04 |
| Tipo II | 9 | 17,3 | 16 | 13,2 | 0,48 |
| Tipo III | 10 | 19,2 | 24 | 19,8 | 0,92 |
| Tipo IV | 7 | 13,5 | 41 | 33,9 | 0,0006 |
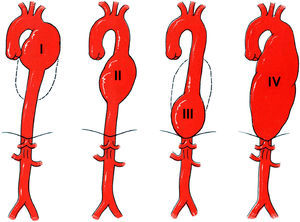
Arteriografía preoperatoria de la médula espinal∗
| Grupo 1 (n = 52) | Grupo 2 (n = 121) | Valor de p | |||
| n | % | n | % | ||
| No efectuada | 25 | 48,1 | 18 | 14,9 | < 0,0001 |
| Grupo A | 2 | 3,9 | 6 | 4,9 | 0,75 |
| Grupo B | 13 | 25,0 | 22 | 18,2 | 0,30 |
| Grupo C | 6 | 11,5 | 70 | 57,9 | 0,0001 |
| Grupo D | 6 | 11,5 | 5 | 4,1 | 0,07 |
∗Sistema de clasificación personal de acuerdo con la localización de la arteria de Adamkiewicz15
Los 52 stents endovasculares (grupo I) se introdujeron por vía femoral en 37 pacientes (71%), por vía ilíaca en ocho (15%) o por vía aórtica utilizando un injerto protésico accesorio en siete (14%), que se sometieron al tratamiento simultáneo de un aneurisma aórtico abdominal. Para obtener una zona de anclaje suficiente en 24 pacientes (46%), fue necesario efectuar una transposición de la arteria subclavia izquierda a la arteria carótida común homolateral o una revascularización de las arterias carótida común y subclavia izquierdas a partir de la arteria carótida común derecha mediante exposición cervical.
El tratamiento quirúrgico convencional se realizó en 121 pacientes (grupo II) utilizando un bypass cardiopulmonar parcial en 78 casos (64,5%) y paro circulatorio hipotérmico profundo en 43 (35,5%). El procedimiento quirúrgico más frecuente fue la resección con la implantación de un injerto, que se realizó en 108 pacientes (89,3%). La resección con anastomosis terminoterminal fue posible en seis pacientes (4,9%) con aneurisma postraumático del istmo aórtico. La angioplastia con parche protésico se efectuó en siete pacientes (5,8%) que presentaban aneurismas saculares. Las arterias intercostales se reimplantaron o preservaron en 63 pacientes (58,3%) que se sometieron a resección e implantación de un injerto.
Mortalidad postoperatoriaEn la serie la mortalidad hospitalaria en conjunto fue del 8,1% (14/173). Se identificó una diferencia estadísticamente significativa (p = 0,02) entre la mortalidad tras la reparación endovascular con endoprótesis (grupo I) y la corrección quirúrgica abierta (grupo II): 15,4% (8/52) comparado con 5,0% (6/121). Después de la reparación endovascular, tres muertes (grupo I) se debieron al estado general del paciente, es decir, cardiopatía en dos (día 2 en ambos) e insuficiencia multiorgánica en uno (día 5). Las otras cinco muertes tras la reparación endovascular se atribuyeron a causas técnicas, es decir, a perforación del ventrículo izquierdo (intraoperatoria), perforación de la aorta (día 4), ictus embólico (día 8), acodadura del stent (día 17), y disección retrógrada de la aorta ascendente (día 21). Todas las muertes después del tratamiento quirúrgico convencional (grupo 2) se debieron a factores relacionados con el estado general del paciente, es decir, insuficiencia multiorgánica en cuatro (días 2, 4, 8 y 72), insuficiencia cardíaca en uno (día 2) e insuficiencia respiratoria en otro (día 21).
Isquemia de la médula espinal postoperatoriaLa tasa de complicaciones isquémicas de la médula espinal en la serie en conjunto fue del 5,2% (9/173). Todas las complicaciones (9/121, 7,4%) se produjeron tras corrección quirúrgica abierta (grupo II). En tres casos (2,8%) la complicación consistió en paraplejía hipotónica irreversible inmediata que dio lugar a la muerte de un paciente. Las seis complicaciones restantes (4,6%) incluyeron déficits parciales o alteraciones aisladas de los esfínteres. La aparición de estas complicaciones se produjo más tardíamente en tres casos. En los seis, los síntomas desaparecieron o regresaron al cabo de semanas o meses después del procedimiento. Después de la reparación endovascular con stent no se produjeron complicaciones relacionadas con isquemia de la médula espinal (0/52) (grupo I). La diferencia entre ambos grupos fue estadísticamente significativa (p = 0,04).
Otras complicaciones postoperatoriasEn la tabla IV se mencionan todas las complicaciones neurológicas, cardíacas, respiratorias, renales, digestivas y hemorrágicas, tanto mortales como no mortales. Entre pacientes del grupo I se observó un menor número de complicaciones respiratorias (p = 0,002) y renales (p = 0,05), pero un número significativamente mayor de ictus (p = 0,01).
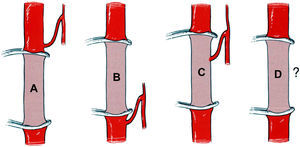
Complicaciones postoperatorias
| Grupo 1 (n = 52) | Grupo 2 (n = 121) | Valor de p | |||
| n | % | n | % | ||
| Mortalidad hospitalaria | 8 | 15,4 | 6 | 5,0 | 0,02 |
| Paraplejía/paraparesia | 0 | – | 9 | 7,4 | 0,04 |
| Ictus | 8 | 15,4 | 5 | 4,1 | 0,01 |
| Complicaciones cardíacas | |||||
| Infarto miocardioa | 3 | 5,8 | 8 | 6,6 | 0,83 |
| Arritmias | 3 | 5,8 | 17 | 14,0 | 0,11 |
| Todas complicaciones cardíacas | 6 | 11,6 | 25 | 20,6 | 0,15 |
| Complicaciones respiratorias | 15 | 28,8 | 69 | 57,0 | 0,002 |
| Complicaciones renales | |||||
| Hemodiálisis | 0 | – | 9 | 7,4 | 0,04 |
| No hemodiálisis | 4 | 7,7 | 15 | 12,4 | 0,36 |
| Todas las complicaciones renales | 4 | 7,7 | 24 | 19,8 | 0,05 |
| Complicaciones digestivas | 1 | 1,9 | 10 | 8,3 | 0,11 |
| Complicaciones hemorrágicasb | 0 | – | 3 | 2,5 | 0,25 |
| Conversiones | 2a | 3,8 | – | – | 0,03 |
La introducción de la tecnología endovascular en el arsenal terapéutico ha revolucionado el tratamiento de los aneurismas de la aorta torácica descendente. Sin embargo, aunque se han publicado numerosos estudios que describen la reparación endovascular, en dichas series no se aborda el papel que podría tener el tratamiento endovascular y la cirugía abierta en cada caso. Hasta lo que conocen los autores, el presente estudio es la primera investigación que analiza el impacto de esta “revolución” en una serie a gran escala de pacientes tratados en un solo centro, en los que la indicación del tipo de corrección se decidió en función de criterios de selección homogéneos. Glade et al18 describieron una serie multicéntrica con una población menor de pacientes seleccionados según unos criterios que cambiaron durante el curso del estudio.
En la presente serie la mortalidad hospitalaria postoperatoria tras corrección abierta y endovascular fue significativamente diferente, es decir, un 5% comparado con un 15,4%, respectivamente (p = 0,02). No obstante, es preciso destacar que el tratamiento endovascular se utilizó exclusivamente en pacientes de elevado riesgo quirúrgico. Este hallazgo coincide con los de estudios previos que demuestran tasas más bajas de mortalidad que varían del 1,5 al 9%2-8 después de la reparación endovascular electiva en pacientes de bajo riesgo quirúrgico. Sin embargo, deseamos hacer hincapié en que cinco de las ocho muertes tras la reparación endovascular se debieron a causas técnicas que probablemente podrían haberse evitado, al menos en parte, con mejores habilidades para desplegar la endoprótesis y mejora de la tecnología de los dispositivos endovasculares.
En la serie del presente estudio, tras la reparación endovascular no se observaron complicaciones isquémicas de la médula espinal. La explicación más probable es que tratamos de limitar el uso de stents sólo en pacientes de bajo riesgo de isquemia de la médula espinal (aneurismas de tipo I) y los evitamos en lo posible en aquellos pacientes de riesgo elevado (aneurismas de grupo C). En los estudios publicados, las tasas de complicaciones neurológicas documentadas en las principales series que describen la implantación de un stent en la aorta torácica descendente2-8, 19-21 han variado del 3 al 6%, pero nunca han sido de cero en las series de tamaño suficiente. Esto proporciona credibilidad a la importancia de realizar una arteriografía preoperatoria de la médula espinal para la prevención de complicaciones después de dicho tratamiento.
Los mecanismos subyacentes, manifestaciones clínicas y resultado de la isquemia de la médula espinal son diferentes después de ambos tipos de tratamiento. Esto es así porque en la reparación endovascular no es necesario el clampaje, y por tanto se evita una reperfusión de la médula espinal factores causales de isquemia. Tras ésta, sus causas principales son el tromboembolismo19 y, con más frecuencia, la obstrucción permanente de las arterias que irrigan la médula espinal (en particular, la de Adamkiewicz). Sin embargo, las mediciones con sensores electromagnéticos que demuestran una presión persistente tras la reparación endovascular de AATD22 demuestran que la circulación se mantiene dentro del saco aneurismático durante varias semanas. Es probable que la circulación continuada se deba a pequeñas endofugas de tipo II que se ocluyen de manera gradual, y, por consiguiente, permite un tiempo hasta el desarrollo de circulación colateral. La corrección quirúrgica abierta descarta dicho desarrollo porque se sutura la arteria intercostal o lumbar que da lugar al origen de la arteria de Adamkiewicz. La endofuga, seguida del desarrollo de circulación colateral junto con el hecho de que un número sustancial de pacientes se someten a la exclusión de un segmento limitado de aorta torácica descendente, probablemente explica la menor incidencia de isquemia después de cirugía endovascular de estas lesiones. Estos mecanismos también podrían explicar la mayor frecuencia de isquemia regresiva tardía de la médula espinal con estas técnicas2,6,19-21. Se ha descrito una regresión completa tras drenaje de LCR y/o aumento de la presión arterial sistémica2,19-21. El hecho de que la irrigación de la médula espinal dependa de la colateralidad tras la reparación endovascular es consecuente con la observación frecuente de déficits neurológicos en aquellos pacientes sometidos a corrección abierta previa o simultánea de un aneurisma aórtico abdominal infrarrenal2,6,7,19-21,23.
En resumen, el presente estudio describe nuestra experiencia en cirugía abierta y tratamiento endovascular para la corrección electiva de AATD. La reparación endovascular se utilizó exclusivamente en pacientes en riesgo quirúrgico elevado en los que la arteriografía habitualmente demostró que las arterias espinales se localizaban fuera de la zona cubierta por la endoprótesis. Mediante esta estrategia, obtuvimos una tasa de mortalidad postoperatoria del 5,0% tras la corrección abierta. Todos los déficits neurológicos debidos a isquemia de la médula espinal (7,4% incluido un 2,8% de paraplejía) se observaron después del tratamiento quirúrgico convencional. Después de la reparación endovascular, no se observaron estas complicaciones pero la tasa de mortalidad fue elevada (15,4%). Más de la mitad de las muertes de este grupo se debieron a causas técnicas relacionadas directamente con el método. La mejora de las habilidades de la liberación y de la tecnología endovascular debería dar lugar a mejores resultados. Dadas las preocupaciones todavía no resueltas sobre el resultado a largo plazo del tratamiento de los aneurismas torácicos con implantación de una endoprótesis12, en pacientes de bajo riesgo quirúrgico de momento seguiremos utilizando la corrección abierta.
Presentado en la 20 Reunión Anual de la Société de Chirurgie Vasculaire de Langue Française, Lyon, Francia, 30-31 de mayo 2005.