El objetivo del presente estudio fue evaluar los resultados a corto y largo plazo de la resección subadventicial de quemodectomas carotídeos y validar la importancia de la disección deliberada de la arteria carótida externa (ACE). Desde 1981 a 2006, en nuestro servicio se operaron 39 quemodectomas carotídeos de la bifurcación carotídea o de los nervios vecinos. Hubo 14 hombres y 22 mujeres, con una edad media de 44,4 ± 5 (límites 21-78) años. Una de estas intervenciones fue re-tratamiento por recidiva local. Una paciente presentó un tumor bilateral. Dos de los tumores secretaban catecolaminas. Todos estos tumores afectaban al glomus carotídeo; 10 de ellos también afectaban al nervio vago, y uno de estos 10 últimos también afectaba al plexo simpático. En 11 casos, el tumor se había extendido al espacio subcarotídeo y, en un caso, al cráneo. En dos casos, el tumor se puso de relieve por una isquemia hemisférica y, en todos los casos, por un síndrome tumoral. Todos los pacientes fueron seguidos mediante exploración clínica, eco-Doppler o tomografía computarizada hasta finales de 2006. En 38 casos, se efectuó una resección completa; en un caso con invasión craneal la resección efectuada fue incompleta. Con anestesia general, y en la mayoría de los casos sin una preparación farmacológica, la cirugía consistió en el sacrificio intencionado de la ACE, seguido de la resección subadventicial del tumor. En un caso se había llevado a cabo una embolización previa para facilitar la disección, lo que en realidad la complicó. En 22 casos, la resección afectó a la ACE; en siete casos, afectó a la arteria carótida común y la arteria carótida interna (ACI): en siete casos al nervio laríngeo superior, en nueve casos al nervio vago, en cinco casos al plexo simpático y en cuatro casos, a la vena yugular. En 13 casos, se asoció disección de los ganglios. En 20 casos se efectuó un procedimiento vascular adicional: nueve dilataciones para el espasmo de la ACI, cinco injertos venosos autólogos, dos derivaciones protésicas y una endarterectomía asociada a angioplastia con parche. Todos los pacientes fueron seguidos hasta 2006. A los 3 meses, las complicaciones observadas fueron las secuelas de un accidente hemisférico homolateral debido a trombosis del injerto venoso, ocho parálisis periféricas del nervio facial, 12 parálisis de las cuerdas vocales, siete síndromes de Claude Bernard-Horner (CBH), ocho parálisis palatinas y 10 síndromes de dolor nociceptivo. Algunas de estas complicaciones persistieron: nueve parálisis de las cuerdas vocales que se trataron satisfactoriamente con logopedia, tres síndromes leves de CBH y dolores nociceptivos en el 6% de los casos (15,4%), discapacitante en un caso. Con un seguimiento de 115 ± 27 (rango 1-298) meses, se registraron tres recidivas locales a los 6 y 10 años. En dos casos, la recidiva local se produjo cuando todavía no se había efectuado la resección inicial de la ACE. Dos pacientes presentaron una lesión contralateral a los 12 y 16 años, respectivamente. A los 40 meses, un paciente tuvo que ser reintervenido para una estenosis ateromatosa. A los 51 meses, la muerte de una paciente no relacionada con la intervención. La resección subadventicial de los tumores del glomus carotídeo con resección deliberada de la ACE es un procedimiento simple y eficiente. Es el tratamiento de elección para estos tumores localizados, de crecimiento lento.
Los tumores del cuerpo o glomus carotídeo, también llamados quemodectomas, pertenecen a los paragangliomas. Estos quemodectomas carotídeos (QC) también pueden afectar a los nervios craneales adyacentes y plantear problemas similares a los de aquellos tumores. Se considera que la prevalencia de estas lesiones es de 1/30.000 y 1/100.000, respectivamente. Su incidencia excepcional y su crecimiento lento dificultan la evaluación de los tratamientos recomendados. El presente estudio analiza retrospectivamente los resultados a largo plazo de las 39 resecciones quirúrgicas de QC efectuadas en nuestro servicio entre 1981 y 2006.
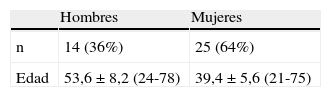
Materiales y MétodosDesde enero de 1981 a diciembre de 2006, se operaron 39 QC en 36 pacientes (14 hombres y 22 mujeres). Para simplificar la descripción, en nuestra serie se abordan las intervenciones y no los pacientes individuales. En la tabla I se muestra el sexo y la edad media de los pacientes en el momento de la cirugía; la mayor parte de los pacientes eran jóvenes, y mujeres.
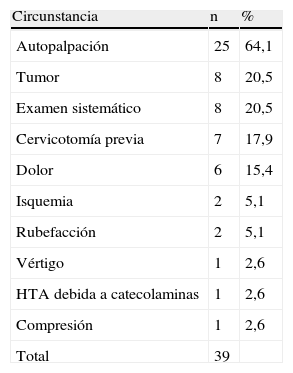
En la tabla II se muestran las causas del descubrimiento de la lesión; la más frecuente fue un síndrome tumoral, seguido a distancia, por dolor en seis casos.
Otras circunstancias fueron menos frecuentes, como episodios isquémicos transitorios en dos casos y vértigo en uno. Dos pacientes presentaron síntomas relacionados con la secreción de catecolaminas: una mujer de 28 años de edad que experimentó rubefacción aislada y una de 75 años con rubefacción e hipertensión arterial. Otros dos pacientes también presentaron hipertensión arterial pero elevación de catecolaminas circulantes. La falta de síntomas puede explicar el prolongado período de tiempo (desde más de 2 a 20 años) transcurrido entre el diagnóstico y la resección en 13 pacientes. Una mujer de 75 años de edad se sometió a una resección 15 años después del diagnóstico cuando el tumor se hizo secretor, en asociación con hipertensión arterial. Antes de la resección descrita en este artículo, siete pacientes se sometieron a una cervicotomía o biopsia negativa después del diagnóstico inicial de adenopatía o quiste cervical.
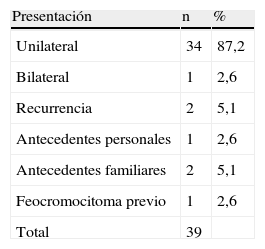
En la tabla III se muestra el modo de presentación del tumor. Una mujer de 28 años presentó un tumor bilateral. Dos pacientes tenían familiares que presentaban lesiones similares (una paciente con una hermana mencionada en esta misma serie y otro paciente cuyo hermano había sido intervenido en otro centro). Otro paciente de 30 años de edad había sido intervenido por un feocromocitoma suprarrenal y otro, para una resección de un QC 6 años atrás. Este último paciente también experimentaba una citopatía mitocondrial que daba lugar a un retraso psicomotor. No pudo observarse un predominio lateral ya que en 17 casos los tumores se localizaban en el lado izquierdo, y en 22 en el derecho.
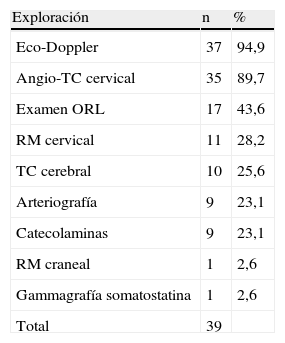
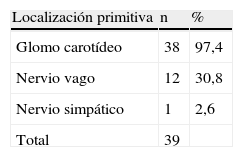
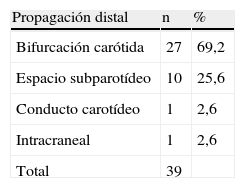
La tabla IV muestra las exploraciones complementarias realizadas para llevar a cabo el diagnóstico. Su diversidad es consecuencia del modo en que se incluyó a los pacientes y de la anamnesis. Hoy día, la detección del tumor se efectúa gracias a la ecografía y complementándose el estudio mediante TC. El diámetro tumoral máximo fue de 4,6 ± 3,7 (rango 3-10) cm. En la tabla V se muestra la localización primaria y en la tabla VI, la propagación. En cinco casos (12,8%), existía ya lesión neurológica preoperatoria: una parálisis velar, dos parálisis de las cuerdas vocales y dos parálisis linguales. Dos pacientes (5,1%) presentaron hirsutismo sin adenoma hipofisario asociado y otros dos (5,1%) presentaron hipertensión arterial generada por la secreción de catecolaminas. Un paciente presentó una estenosis carotídea ateromatosa del 60% (criterios del North American Symptomatic Carotid Endarteroctomy Trial [NASCET]).
Exploraciones complementarias
| Exploración | n | % |
| Eco-Doppler | 37 | 94,9 |
| Angio-TC cervical | 35 | 89,7 |
| Examen ORL | 17 | 43,6 |
| RM cervical | 11 | 28,2 |
| TC cerebral | 10 | 25,6 |
| Arteriografía | 9 | 23,1 |
| Catecolaminas | 9 | 23,1 |
| RM craneal | 1 | 2,6 |
| Gammagrafía somatostatina | 1 | 2,6 |
| Total | 39 |
TC: tomográfica computarizada; RM: resonancia magnética.
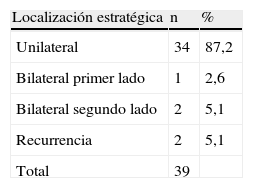
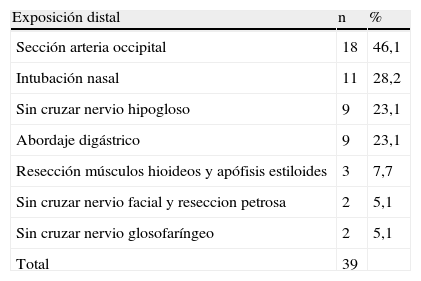
En todos los QC se efectuó una resección lo más completa posible preservando de la arteria carótida interna (ACI). En la tabla VII se muestra la lateralidad. Una paciente de 21 años de edad presentó un tumor bilateral inicial que se resecó en ambos lados con un intervalo de 2 meses en 1982. Debido a la recidiva en el lado derecho, esta misma paciente tuvo que ser reintervenida en 1988. En esta serie también se documentó otra recidiva a los 10 años. Los dos tumores secretores se inhibieron farmacológicamente con bloqueadores adrenérgicos alfa. Sólo una paciente había sido sometida a embolización en otro servicio antes de ser derivada a nuestro hospital. Todos los pacientes fueron operados con anestesia general, colocados en decúbito dorsal, y a través de un abordaje pre-esternocleidomastoideo. Para los tumores con mayor propagación distal, un otorrinolaringólogo efectuó una disección extensión pre y retroauricular bajo monitorización del nervio facial mediante reseccion de mastoides y tímpano. En la tabla VIII se proporcionan los detalles de los diferentes procedimientos llevados a cabo para facilitar el abordaje a la parte superior del tumor o para la corrección arterial. En diversos casos, se requirió más de un procedimiento.
Procedimientos que facilitaron el abordaje a la parte superior del tumor
| Exposición distal | n | % |
| Sección arteria occipital | 18 | 46,1 |
| Intubación nasal | 11 | 28,2 |
| Sin cruzar nervio hipogloso | 9 | 23,1 |
| Abordaje digástrico | 9 | 23,1 |
| Resección músculos hioideos y apófisis estiloides | 3 | 7,7 |
| Sin cruzar nervio facial y reseccion petrosa | 2 | 5,1 |
| Sin cruzar nervio glosofaríngeo | 2 | 5,1 |
| Total | 39 |
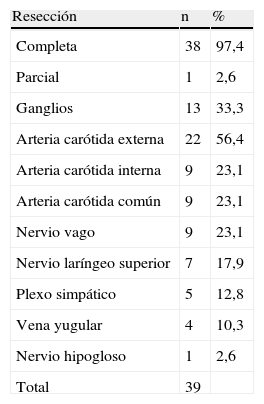
En la tabla IX se muestra la extensión de la resección efectuada. En todos los casos, la resección del tumor fue completa excepto en uno con propagación intracraneal que requirió un segundo abordaje intracraneal. Se resecaron los nervios craneales afectados macroscópicamente por el tumor, al igual que los ganglios linfáticos y la vena yugular cuando la extensión del tumor los incluyó. Se efectuó la resección intencionada de la arteria carótida externa (ACE) en 22 ocasiones (56,4%), con una frecuencia creciente al final de la presente serie. La sección facilitó el abordaje subadventicial del tumor.
Extensión de la resección
| Resección | n | % |
| Completa | 38 | 97,4 |
| Parcial | 1 | 2,6 |
| Ganglios | 13 | 33,3 |
| Arteria carótida externa | 22 | 56,4 |
| Arteria carótida interna | 9 | 23,1 |
| Arteria carótida común | 9 | 23,1 |
| Nervio vago | 9 | 23,1 |
| Nervio laríngeo superior | 7 | 17,9 |
| Plexo simpático | 5 | 12,8 |
| Vena yugular | 4 | 10,3 |
| Nervio hipogloso | 1 | 2,6 |
| Total | 39 |
En nueve casos (23,1%), la resección de la arteria carótida común (ACC) o de la ACI fue obligatoria: en siete casos debido a la falta de un plano de disección y en dos casos debido a un exceso de longitud. En siete casos, la corrección se efectuó con un injerto venoso o con un stent recubierto y en dos casos de longitud arterial excesiva en los que se efectuó una sección simple y reanastomosis.
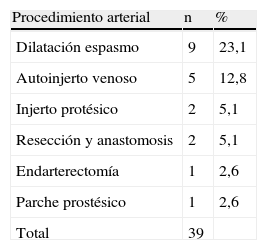
En la tabla X se proporciona una descripción de los procedimientos arteriales efectuados además de la resección. En 20 casos (53,1%), se efectuó un procedimiento vascular asociado. Fue necesario efectuar nueve dilataciones con un dilatador graduado porque se observó un espasmo de la carótida interna. El paciente que experimentaba una estenosis ateromatosa asociada se trató mediante endarterectomía y cierre con parche protésico. La pérdida media de sangre fue de 460 ± 270 (rango 150-2.000) ml. En cinco casos, se requirió una transfusión de sangre postoperatoria, administrándose una media de 2,6 unidades (210 x 2,6 ml) por paciente. Después de la cirugía, los pacientes permanecieron ingresados en la unidad de cuidados intensivos y acto seguido, se les trasladó a las salas hospitalarias hasta su alta. Antes de ésta, se efectuó un eco-Doppler junto con una angiografía TC o convencional, si fue necesaria. El seguimiento consistió en visita y eco-Doppler al mes, a los 3 meses y a los 12 meses y, acto seguido, con carácter anual. No se perdió ningún paciente para el seguimiento. Su duración media fue de 115 ± 27 (rango 1-298) meses.
ResultadosResultados a corto plazoNo se produjeron muertes postoperatorias. A las 5 h de la intervención, una paciente, que había sido sometida a revascularización con injerto autólogo de safena, presentó un episodio isquémico hemisférico homolateral. La nueva intervención quirúrgica reveló trombosis de la derivación bypass sin una causa evidente. La trombectomía que resultó permitió el restablecimiento neurológico completo.
En dos pacientes una parálisis velar provocó la ausencia del reflejo nauseoso, lo que requirió alimentación mediante nutrición enteral durante una semana. El paciente que experimentaba citopatía mitocondrial desarrolló una neumonía por aspiración que requirió ventilación mecánica durante 4 días y una estancia en la unidad de cuidados intensivos durante 29 días, junto con una gastrostomía temporal.
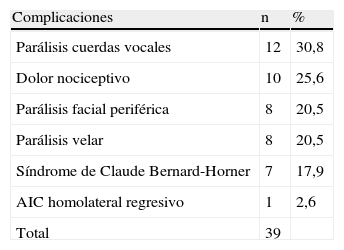
En la tabla XI se muestran los detalles de las complicaciones a los 3 meses. De los pacientes, 18 (46,2%) presentaron, como mínimo, una de ellas.
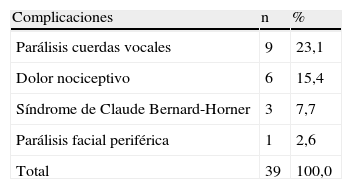
Resultados a largo plazoEn la última visita de seguimiento, 12 pacientes aún presentaban uno o varios déficits neurológicos periféricos o dolor; en la tabla XII se muestra su distribución. Todas las parálisis velares habían regresado al igual que las parálisis faciales periféricas excepto en un caso. En nueve casos (23,1%), gracias a la logopedia, la persistencia de la parálisis de las cuerdas vocales provocaba una disfonía tan sólo de carácter leve. En tres pacientes (7,7%) que referían una ptosis nocturna moderada, persistía un síndrome de Claude Bernard-Horner (CBH) ligeramente incapacitante. Por lo demás, los pacientes refirieron con frecuencia dolor nociceptivo con la masticación inicial que habitualmente desaparecía después de la primera mordida. A los 3 meses, 10 pacientes (25,6%) continuaban refiriendo este dolor, pero, en la última visita de seguimiento, sólo persistía en seis (15,4%). En la actualidad, un paciente refiere todavía dolor nociceptivo intenso para el que ha tenido que recibir ocasionalmente neurolépticos.
En la tabla XIII se muestran los acontecimientos críticos producidos durante este seguimiento medio de 9 años, que se prolongó durante un máximo de 25 años. Sólo falleció una mujer de 75 años de edad a los 51 meses, siendo la causa insuficiencia respiratoria. Esta paciente había sido tratada con una derivación protésica. Excepto en el caso de la trombosis inmediata del injerto de safena, mencionado previamente, durante el seguimiento, se produjeron dos anomalías anatómicas. La primera fue una reestenosis de la ACI en el paciente sometido a endarterectomía con angioplastia protésica durante el procedimiento inicial. Esta reestenosis se trató satisfactoriamente con una angioplastia percutánea en el mes 40, en otro centro. Al cabo de 11 años, otro paciente hombre, que había sido sometido a una resección subadventicial a los 61 años de edad, presentó una estenosis asintomática del 60%, de acuerdo con los criterios del ensayo NASCET. Este paciente se encuentra todavía bajo supervisión médica y, en el futuro, de acuerdo con la importancia de la evolución de la estenosis, podría requerir una endarterectomía. Durante el seguimiento, en dos pacientes se observaron tres recidivas locales. De éstas, dos se operaron en nuestro servicio: una 6 años después de la primera intervención y la otra, 10 años más tarde. Más adelante, al cabo de 10 años, el primer paciente experimentó otra recidiva, pero, desde 1998, ha permanecido estable y continúa bajo supervisión médica cuidadosa sin que se haya sometido a ninguna intervención quirúrgica. Después de la resección subadventicial con sección deliberada de la ACE, no se han producido recidivas.
De acuerdo con el método actuarial, las tasas anuales medias de mortalidad, episodios isquémicos hemisféricos, oclusión de la carótida homolateral, estenosis > 50% y recidivas locales fueron del 0,14%, 0,1%, 0,11%, 0,51%, y 0,63%, respectivamente. En la presente serie no se documentaron metástasis.
DiscusiónEl presente estudio confirma los datos clásicos y descritos en los estudios publicados: los quemodectomas de la bifurcación carotídea son poco frecuentes y se caracterizan por progresión básicamente local y una posible afectación contralateral. En la mayoría de los casos, es posible una resección subadventicial, que es más sencilla y ofrece mejores resultados a largo plazo si se efectúa junto con una sección deliberada de la carótida externa. En los estudios publicados, la mayor parte de las series descritas proceden de zonas geográficas endémicas o de centros de referencia (como nuestro hospital) en los que el muestreo se extiende durante un período de tiempo muy prolongado. Por lo tanto, consideramos la utilidad de efectuar este estudio de series de casos de nuestro hospital aun cuando se hayan publicado series mucho más extensas que la nuestra.
Los pacientes suelen ser jóvenes y principalmente mujeres. En dos casos (5,1%), observamos una forma familiar, que representa el 5-10% en las series publicadas1-5. Un estudio genético de las familias en las que diversos miembros presentan paragangliomas ayudaría a localizar el gen responsable del crecimiento de los tumores del glomus. Este gen se caracteriza por un patrón de herencia autosómica dominante con una tasa de penetrancia variable y se localiza en el cromosoma 11q236. Codifica para una subunidad de una enzima mitocondrial, la succinato deshidrogenasa, que interviene en el ciclo de Krebs7. Su falta de activación durante la embriogénesis en el ratón da lugar a hiperplasia de las células del glomus carotídeo8. En la serie del presente estudio no fue posible efectuar un estudio genético de estas características.
Reportes de series de casos publicados en Sudamérica9-12 y una de Norteamérica5 demuestran que estas lesiones aparecen más frecuentemente en mujeres y en individuos que viven en altitudes elevadas (los Andes y las Montañas Rocosas).
La mayoría de estas lesiones son asintomáticas y se caracterizan por un descubrimiento tardío, habitualmente tras la palpación por parte del propio paciente1. El diagnóstico de estos tumores se basa en el estudio morfológico mediante técnicas de imagen y su hipervascularización. La topografía de la lesión y su hipervascularización hacen de poca utilidad la confirmación histológica preoperatoria e incluso, en algunos casos, desaconsejable11.
En la serie del presente estudio, siete pacientes, que inicialmente habían sido tratados en otro centro, se sometieron a una cervicotomía o citopunción exploradora. De hecho, los conocimientos histológicos preoperatorios de estos tumores no permiten predecir su crecimiento y, por consiguiente, no afectan a la estrategia terapéutica. En la serie, un paciente que había sido operado de un tumor en el glomus carotídeo presentó un schwannoma del nervio vago. Este tumor forma parte, como mínimo en teoría, del diagnóstico diferencial. Entre los tumores del nervio vago, el 30% son schwannomas, junto con paragangliomas (50%) y neurofibromas13 (20%).
De acuerdo con el potencial de recidiva local, decidimos practicar una resección de todos los segmentos nerviosos macroscópicamente patológicos, lo que podría explicar que la tasa de complicaciones nerviosas periféricas fuera similar a la de otros grupos de investigadores. La mayor parte de éstas son parálisis de las cuerdas vocales1,3,4,9,12,14-18. También describimos un número significativo de casos de dolor nociceptivo.
La elevada morbilidad neurológica tras la resección de un tumor del glomus carotídeo es una constante. Antes de la década de los cincuenta, la resección era particularmente difícil ya que era imposible reparar las arterias (resección y ligadura de la carótida). En esta serie, al principio de esta experiencia, la mortalidad fue elevada.
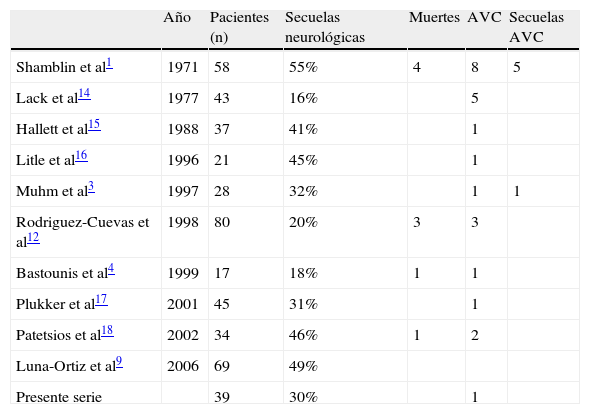
Desde entonces, gracias a las nuevas técnicas de corrección carotídea, la morbilidad neurológica periférica ha reemplazado a la elevada morbilidad neurológica central postoperatoria. En la experiencia de la Clínica Mayo, desde 1931, con un total de 58 pacientes intervenidos, Shamblin et al1 describieron un 55% de las lesiones postoperatorias de nervios craneales, cuatro muertes y ocho accidentes vasculares cerebrales (AVC).
En experiencias más recientes, la mortalidad y los AVC son menos frecuentes pero la morbilidad neurológica periférica sigue siendo alta. Entre los estudios publicados, la tasa media de esta morbilidad neurológica periférica es del 36% y comparable a la observada en la serie del presente estudio. En la tabla XIV se resumen los resultados de los estudios publicados.
Mortalidad postoperatoria y eventos neurológicos
| Año | Pacientes (n) | Secuelas neurológicas | Muertes | AVC | Secuelas AVC | |
| Shamblin et al1 | 1971 | 58 | 55% | 4 | 8 | 5 |
| Lack et al14 | 1977 | 43 | 16% | 5 | ||
| Hallett et al15 | 1988 | 37 | 41% | 1 | ||
| Litle et al16 | 1996 | 21 | 45% | 1 | ||
| Muhm et al3 | 1997 | 28 | 32% | 1 | 1 | |
| Rodriguez-Cuevas et al12 | 1998 | 80 | 20% | 3 | 3 | |
| Bastounis et al4 | 1999 | 17 | 18% | 1 | 1 | |
| Plukker et al17 | 2001 | 45 | 31% | 1 | ||
| Patetsios et al18 | 2002 | 34 | 46% | 1 | 2 | |
| Luna-Ortiz et al9 | 2006 | 69 | 49% | |||
| Presente serie | 39 | 30% | 1 |
AVC: accidente vascular cerebral.
Consideramos obligatorio efectuar una resección intencionada de la carótida externa porque facilita y mejora la resección. Utilizada ampliamente en la actualidad, esta estrategia consiste en la escisión entre ligaduras de las ramas de la ACE. Por consiguiente, el tumor se pediculiza en el eje ACC/ACI y se desvasculariza parcialmente, lo que facilita su disección en un plano subadventicial. Más adelante, el tumor se pediculiza en el origen de la ACE, cuyo ostium se elimina con el tumor al mismo tiempo que se efectúa un clampaje breve del eje principal. La resección intencionada de la ACE permite la extirpación del pedículo nutricio del tumor que procede de las ramas de la ACE, como la arteria faríngea ascendente predominantemente. Por lo tanto, confirmamos las conclusiones extraídas por Van den Berg19. A largo plazo, la resección intencionada de la ACE debería reducir el número de recidivas locales. Un estudio prospectivo, aleatorizado, sería el único método para evaluar la validez de este procedimiento, pero la ejecución de un estudio de estas características parece muy difícil porque esta patología y sus recidivas son relativamente infrecuentes en nuestro país.
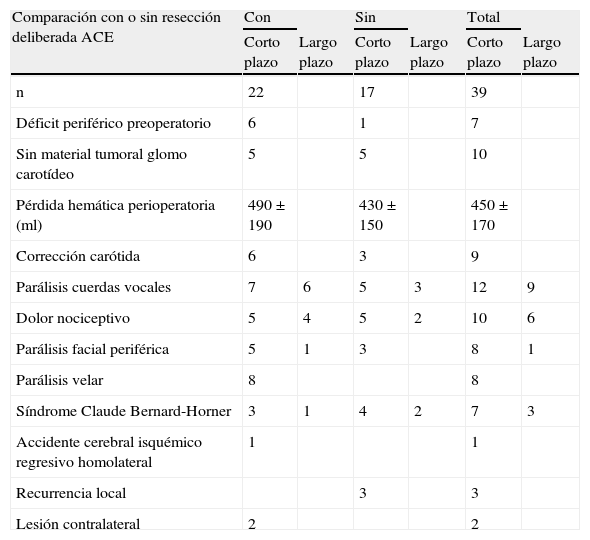
En la tabla XV se comparan los resultados observados en pacientes que se sometieron a resección intencionada de la ACE. Entre las diferencias observadas, de acuerdo con la metodología, no permite establecer conclusiones; no obstante, en el primer grupo, no observamos recidivas locales. Este posible beneficio, no parece añadir una mayor morbilidad.
Influencia de la resección deliberada de la arteria carótida externa (ACE)
| Comparación con o sin resección deliberada ACE | Con | Sin | Total | |||
| Corto plazo | Largo plazo | Corto plazo | Largo plazo | Corto plazo | Largo plazo | |
| n | 22 | 17 | 39 | |||
| Déficit periférico preoperatorio | 6 | 1 | 7 | |||
| Sin material tumoral glomo carotídeo | 5 | 5 | 10 | |||
| Pérdida hemática perioperatoria (ml) | 490 ± 190 | 430 ± 150 | 450 ± 170 | |||
| Corrección carótida | 6 | 3 | 9 | |||
| Parálisis cuerdas vocales | 7 | 6 | 5 | 3 | 12 | 9 |
| Dolor nociceptivo | 5 | 4 | 5 | 2 | 10 | 6 |
| Parálisis facial periférica | 5 | 1 | 3 | 8 | 1 | |
| Parálisis velar | 8 | 8 | ||||
| Síndrome Claude Bernard-Horner | 3 | 1 | 4 | 2 | 7 | 3 |
| Accidente cerebral isquémico regresivo homolateral | 1 | 1 | ||||
| Recurrencia local | 3 | 3 | ||||
| Lesión contralateral | 2 | 2 |
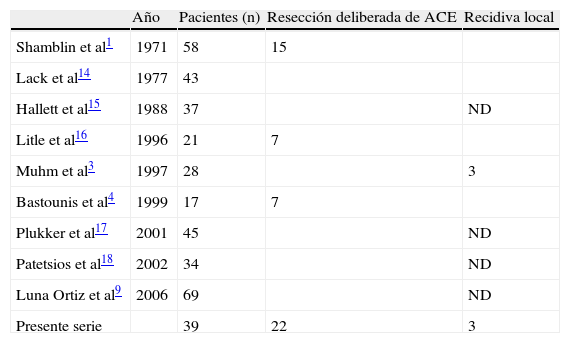
Como se muestra en la tabla XVI, que resume los resultados de los estudios publicados, en la mayoría de los casos no se menciona la disección deliberada de la ACE. En la amplia experiencia de la Clínica Mayo, Shamblin et al1 describen 15 casos de resección de la ACE y no mencionan recidivas en este subgrupo. No obstante, no se especifica el seguimiento a largo plazo de estos pacientes, lo cual no permite extraer conclusiones. El mismo comentario se aplica al estudio de Litle et al16 concerniente a siete casos de resección de la ACE de los 21 que incluyó la serie cuyo seguimiento medio fue de 33 (rango 1-105) meses. Esta limitación también se aplica al estudio de Bastounis et al4, en el que se mencionan cinco casos no seguidos y dos muertes en la serie, pero sin precisar el seguimiento. Hasta la fecha, el presente estudio de cohorte parece ser el que ha incluido un seguimiento más prolongado.
Estudios publicados sobre resección deliberada de la arteria carótida externa (ACE)
| Año | Pacientes (n) | Resección deliberada de ACE | Recidiva local | |
| Shamblin et al1 | 1971 | 58 | 15 | |
| Lack et al14 | 1977 | 43 | ||
| Hallett et al15 | 1988 | 37 | ND | |
| Litle et al16 | 1996 | 21 | 7 | |
| Muhm et al3 | 1997 | 28 | 3 | |
| Bastounis et al4 | 1999 | 17 | 7 | |
| Plukker et al17 | 2001 | 45 | ND | |
| Patetsios et al18 | 2002 | 34 | ND | |
| Luna Ortiz et al9 | 2006 | 69 | ND | |
| Presente serie | 39 | 22 | 3 |
ND: no documentado.
También se ha propuesto la embolización para facilitar la resección mediante la oclusión del pedículo nutricio del tumor. En 1980, se describió la primera embolización; correspondió a un paciente con un tumor voluminoso16,20. Pese a una desvascularización tumoral del 90%, la resección se acompañó de una hemorragia de 4 l. Desde entonces, se ha descrito una limitada casuística concerniente a este procedimiento y las conclusiones consiguientes son contradictorias. Una embolización preoperatoria eficaz no parece reducir la pérdida hemática o la morbilidad neurológica periférica1,9,15,16,18. La experiencia de nuestro grupo con la embolización preoperatoria sólo es ocasional pero parece demostrar que este procedimiento dificulta la disección en el plano subadventicial. Persky et al21 documentaron los resultados de la resección después de embolización sistemática de 53 paragangliomas cervicales, que además de tumores del glomus carotídeo incluían otros tumores (14 yugulares, cinco vagales, tres timpánicos y otros tres no especificados). Se embolizaron 28 tumores del glomus. En este estudio se encontró que la embolización sólo fue eficaz para los tumores yugulares y vagales. Tripp et al22 describieron una técnica original para extirpar el pedículo vascular de los tumores del glomus utilizando stents recubiertos. Después de la exéresis, la resección del tumor parece más sencilla. Hasta la fecha, carecemos de experiencia con esta técnica; consideramos que la resección intencionada de la ACE es más simple, entraña menos riesgos y es más rápida16.
En general se considera que los paragangliomas son radio-resistentes. No obstante, desde 1975, Spector et al23 han propuesto la radioterapia para los tumores yugulares. Aun cuando la radioterapia no es eficaz como tratamiento del propio tumor, parece inducir una esclerosis con la involución de la luz del vaso.
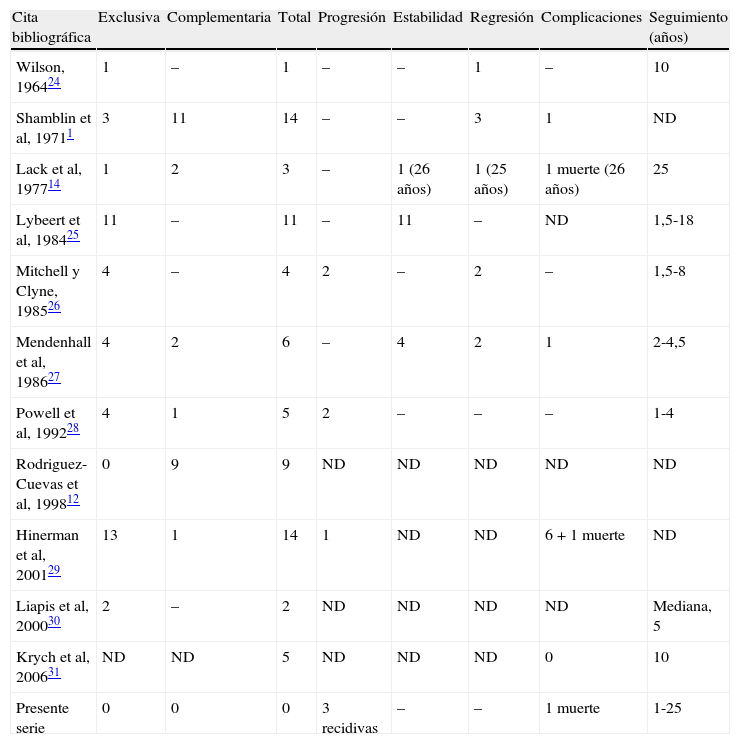
En la actualidad la radioterapia para tratar este tipo de tumor considerado “benigno” continúa siendo un tema controvertido. Históricamente, se propuso la radioterapia como complemento para una resección considerada insuficiente1,14,24 porque la opinión prevaleciente es que este tumor era maligno desde un punto de vista histológico. Los mejores conocimientos sobre su evolución natural y la ausencia de criterios reales de malignidad histológica han dado lugar a un cambio de esta opinión. El potencial evolutivo, como reconocen todos los investigadores, es la capacidad de recidiva local, aunque, entre los estudios publicados, la diseminación metastásica es un hallazgo muy poco frecuente. Además, sin duda, tiene más relación con la enfermedad global del sistema paraganglionar que con una diseminación originada a partir del tumor primario. En la serie de Shamblin et al1, 11 pacientes con tumor residual fueron tratados con radioterapia complementaria. Los autores no ofrecen precisiones sobre la evolución de estos pacientes durante el seguimiento. Otras series son incluso más limitadas y sólo se describen paragangliomas diversos y, con menos frecuencia, tumores del glomus carotídeo. Si se menciona un seguimiento individual, es más difícil de entender. En la tabla XVII se resumen estos estudios publicados24-31. No obstante, Lybeert et al25 e Hinerman et al29 son los únicos investigadores que han descrito series de pacientes tratados exclusivamente con radioterapia.
Estudios publicados sobre radioterapia
| Cita bibliográfica | Exclusiva | Complementaria | Total | Progresión | Estabilidad | Regresión | Complicaciones | Seguimiento (años) |
| Wilson, 196424 | 1 | – | 1 | – | – | 1 | – | 10 |
| Shamblin et al, 19711 | 3 | 11 | 14 | – | – | 3 | 1 | ND |
| Lack et al, 197714 | 1 | 2 | 3 | – | 1 (26 años) | 1 (25 años) | 1 muerte (26 años) | 25 |
| Lybeert et al, 198425 | 11 | – | 11 | – | 11 | – | ND | 1,5-18 |
| Mitchell y Clyne, 198526 | 4 | – | 4 | 2 | – | 2 | – | 1,5-8 |
| Mendenhall et al, 198627 | 4 | 2 | 6 | – | 4 | 2 | 1 | 2-4,5 |
| Powell et al, 199228 | 4 | 1 | 5 | 2 | – | – | – | 1-4 |
| Rodriguez-Cuevas et al, 199812 | 0 | 9 | 9 | ND | ND | ND | ND | ND |
| Hinerman et al, 200129 | 13 | 1 | 14 | 1 | ND | ND | 6 + 1 muerte | ND |
| Liapis et al, 200030 | 2 | – | 2 | ND | ND | ND | ND | Mediana, 5 |
| Krych et al, 200631 | ND | ND | 5 | ND | ND | ND | 0 | 10 |
| Presente serie | 0 | 0 | 0 | 3 recidivas | – | – | 1 muerte | 1-25 |
ND: no documentado.
Las dos series de radioterapia más explícitas son las de estos autores. Lybeert et al trataron 11 tumores del glomus con radioterapia exclusiva y sin ninguna complicación asociada pero, excepto para un paciente, el seguimiento fue inferior a 5 años, por lo que se requiere precaución cuando se leen las conclusiones de este estudio. Hinerman et al trataron a 14 pacientes durante un período de 30 años (1968-1998): 13 tratados exclusivamente con radioterapia y uno con radioterapia complementaria después de la resección incompleta del tumor. Un paciente falleció con un tumor cuyo crecimiento había continuado y otros seis presentaron complicaciones de la radioterapia, como mucositis grave con deshidratación, dos ulceraciones del hueso temporal, un trismus, una otitis serosa, una aberración de la conducta y una parálisis facial a los 10 meses. El estudio no aporta información sobre la evolución del tumor a largo plazo.
Aun cuando estos autores han establecido la validez carcinológica de la radioterapia exclusiva, no estamos de acuerdo con dicho tratamiento porque sus pacientes eran muy jóvenes y no efectuaron un seguimiento a largo plazo real. Además, la radioterapia representa un riesgo demasiado alto para tratar tumores que se consideran benignos. Por otra parte, estos tumores se caracterizan por un crecimiento muy lento, lo que también establece un límite. En la serie del presente estudio, las recidivas sólo se presentaron después de un período prolongado de 6 y 10 años, más tarde que en la mayoría de las series en las que los pacientes fueron tratados con radioterapia exclusiva (seguimiento medio de 5 años).
La aparente estabilidad de la lesión se relaciona muy probablemente con el proceso tumoral de crecimiento extremadamente lento. En la serie descrita por Rodriguez-Cuevas et al12, ninguno de los 41 pacientes mexicanos con tumores del glomo carotídeo se sometió a tratamiento quirúrgico. Durante el seguimiento de 47 meses, ningún paciente manifestó nuevos síntomas, crecimiento tumoral o lesiones secundarias. En 1977, en la serie de Lack et al14 también se describe este mismo hecho; los autores siguieron a tres pacientes durante un período de 13 años sin que se demostraran complicaciones relacionadas con el tumor. Sin embargo, no podemos recomendar la abstención quirúrgica ya que la resección es más compleja cuando los tumores son grandes y distales. Consideramos que la radioterapia sólo está indicada como medida paliativa.
En conclusión, creemos que la resección subadventicial con la resección intencionada de la arteria carótida externa es el procedimiento más simple y de menos riesgos para la exéresis de los quemodectomas de la bifurcación carotídea.
Presentado en la 22 Reunión Anual de la Société Française de Chirurgie Vasculaire, Lyon, Francia, 2-5 de junio de 2007.