Tras la angioplastia con balón, la denudación de la capa de células endoteliales da lugar a la exposición de las células musculares lisas (CMLs) subyacentes a fuerzas tangenciales derivadas de la restauración del flujo sanguíneo. La respuesta de las CMLs frente a estas fuerzas mecánicas consiste en apoptosis, diferenciación, migración, hipertrofia y proliferación. La lesión inducida por la angioplastia con balón puede ser la desencadenante del cambio del fenotipo contráctil de las CMLs por un fenotipo sintético1. La proliferación del músculo liso (ML) parece ser una respuesta aguda frente a la lesión y puede tener lugar hasta 7 días después de la angioplastia con balón, aunque la mayor parte de las células del ML inicia su ciclo de crecimiento durante los 2-3 primeros días tras la lesión2. Tras la respuesta aguda, el número de CMLs existentes en la capa íntima permanece relativamente constante durante un período de hasta 1 año desde la realización del procedimiento endovascular. Dada la estabilidad de la población de CMLs con el transcurso del tiempo, se considera que los incrementos adicionales en la hiperplasia intimal se deben a la producción de matriz extracelular y de tejido conjuntivo, así como a la hipertrofia de las células ya existentes3. Generalmente, el engrosamiento máximo de la capa íntima en el ser humano tiene lugar durante los 2-3 primeros meses desde la lesión4.
Las CMLs normales se localizan principalmente en la capa media del vaso sanguíneo y presentan un fenotipo contráctil, tras la angioplastia con balón, CMLs pueden modificar su fenotipo contráctil por un fenotipo sintético1. Estas células con capacidad de síntesis presentan migración hacia la capa íntima, proliferan y segregan componentes de la matriz extracelular, como elastina, colágeno y proteoglicanos5. La producción de la matriz extracelular por parte de las CMLs sintéticas tiene un volumen 4-5 veces mayor que el correspondiente a las CMLs con fenotipo contráctil. Se ha estimado que el 50% de las CMLs que presentan migración desde la capa media a consecuencia de la angioplastia con balón se dividen hasta en tres ocasiones2. Estas células constituyen hasta el 89% de la población de CMLs en la íntima resultante2. El 11% restante CMLs está constituido por el 50% de las CMLs activadas a consecuencia de la angioplastia y que simplemente presentan migración hacia la capa íntima pero no muestran replicación2. Las CMLs con capacidad de síntesis se caracterizan por un aumento en el número de orgánulos de síntesis como retículo endoplásmico rugoso, incremento de la capacidad proliferativa, disminución en la producción de actina µ, pérdida de la capacidad de contracción e incremento del volumen celular6. Por el contrario, las CMLs contráctiles suelen tener una configuración fusiforme, carecen de capacidad proliferativa, pueden contraerse y contienen una cantidad de ac-tina µrelativamente mayor que las CMLs sintéticas6. En resumen, se ha propuesto la hipótesis de que el grado de activación de las CMLs tras la angioplastia influye en sus características de migración y proliferación CMLs, contribuyendo directamente al grado de engrosamiento e hiperplasia de la capa íntima.
Las indicaciones de la angioplastia transluminal percutánea (ATP) y de la angioplastia con balón dependen del estado de vascularización, preferencias del cirujano, diámetro del balón, longitud de la lesión y otros factores relacionados. La intensidad de la lesión, en términos de la presión transmural ejercida sobre la pared vascular y sobre las células existentes en la misma, puede influir en la respuesta celular. En estudios previos se ha demostrado que una lesión importante sin afectación de la capa media es capaz de iniciar la replicación de las CMLs, pero no se asocia a proliferación de la capa íntima7. La lesión debida a la angioplastia con balón puede causar diversas alteraciones tales como la agregación plaquetar, denudación endotelial, producción de factores de crecimiento por parte de las CMLs lesionadas, atracción de leucocitos y macrófagos secundaria a la respuesta inflamatoria y la distensión mecánica sostenida de las propias CMLs, todo lo cual puede contribuir a la proliferación de estas células8.
Hasta el momento se han realizado numerosos estudios para investigar la respuesta in vivo de las CMLs frente a la lesión causada por la angioplastia. Dadas las dificultades para mantener la aplicación concurrente de fuerzas tangenciales y de tensión, con objeto de evaluar sus efectos sobre las CMLs in vitro, el número de estudios de este tipo ha sido limitado. En este artículo se presenta por primera vez un modelo in vitro de la respuesta de las CMLs frente a la lesión mecánica, con uso de un simulador de fuerzas tangenciales y de tensión desarrollado para conseguir niveles clínicamente significativos de fuerzas de tensión y tangenciales, con aplicabilidad estadística.
Con este modelo es posible aislar las fuerzas mecánicas de las señales bioquímicas y de su influencia en la respuesta de las CMLs frente a la lesión. El uso de este modelo/simulador permite la obtención de datos que pueden constituir un paso preliminar para la manipulación farmacológica de las CMLs y para la investigación de la reducción y prevención final de la hipertrofia y la proliferación de estas células tras la realización de procedimientos endovasculares.
MATERIALES Y MÉTODOSDiseño del simuladorEl sistema del simulador posee seis canales independientes que permiten la evaluación de seis poblaciones celulares independientes con objeto de conseguir un incremento de la aplicabilidad estadística y del uso de múltiples métodos de análisis. El sistema está constituido por dos equipos, cada uno de ellos con tres canales, tal como se muestra en la figura 1a. Los parámetros de diseño fueron seleccionados para imitar las condiciones fisiológicas existentes en las situaciones de compromiso mínimo, con flujo laminar, flujo aplicado sobre las células y flujo con aplicación de fuerzas tangencia-les. Las células se mantienen sobre una membrana de silicona flexible que oscila con una frecuencia de 60 ciclos/min (1 Hz) durante la evaluación mecánica.
Fig. 1. Demostración del canal individual del simulador de la mecánica vascular. a. Configuración del sistema. b. Uno de los simuladores de la mecánica vascular durante la experimentación. c. Vista superior del canal individual con la longitud del canal de entrada y la localización del cultivo celular sobre silicona. d. Esquema lateral de la zona de entrada, con indicación de la superficie transversal del canal.
Para esta aplicación se seleccionó una geometría de membranas paralelas, con el objetivo de exponer una muestra plana de células a las fuerzas concurrentes tangenciales y de tensión. La figura 1 recoge una serie de imágenes que explican el diseño del simulador mecánico. La longitud del canal de entrada permite que el flujo en la zona de localización de las células esté plenamente estabilizado; se ajustó el flujo para conseguir un número de Reynolds de 151 a partir de un flujo de entrada (Qin) de 350 ml/min. El número de Reynolds (Re) se determinó a partir de la ecuación aplicada a un canal de configuración rectangular9:
Re= µQin / µb
donde b es la anchura del canal (cm), µes la densidad del líquido (kg/cm3) y µes su viscosidad ([dinas * s]/cm2). El número de Reynolds también se utilizó para establecer el flujo laminar en el canal. En nuestro modelo, el flujo de entrada fue considerado fuertemente laminar debido a que el número de Reynolds fue muy inferior a 2.000 para este canal rectangular9. Esta ecuación asume que el líquido se comporta como un fluido newtoniano no compresible.
El parámetro de longitud del canal de entrada mínimo para un perfil de velocidad plenamente desarrollado, Le (cm), fue estimado de la manera siguiente10:
Le = 0,05Re
La longitud mínima necesaria calculada del canal de entrada de 7,5 cm se aumentó hasta casi el doble, 13,95 cm, para conseguir un perfil de velocidad plenamente estabilizado en el lado de las células, tal como se muestra en la figura 1d.
Sobre la membrana de silicona se aplicó un perfil de tensión biaxial mediante un sistema de vacío similar a la tecnología implementada por Flexcell International (Hillsborough, NC). Para el control de la tensión aplicada y la regulación de la presión de vacío se utilizó el programa informático Flexcell 3000. Otros investigadores11 han demostrado que aproximadamente el 30% de la parte externa de las membranas de silicona localizadas sobre el poste estático en el sistema Flexcell no presenta perfiles de tensión radial y circunferencial constantes. Dado que el diseño del sistema utilizado en nuestro estudio aplicó una geometría de poste estático similar, las células se mantuvieron confinadas en la parte central de la membrana con objeto de que sufrieran una tensión radial y circunferencial constantes en la zona del cultivo celular durante la evaluación mecánica, mediante el uso de un anillo de Teflon con una superficie interna de 2,75 cm2 y una altura aproximada de 1,75 cm, centrado sobre la superficie de silicona en la parte central de un poste de lexano, durante el período de cultivo celular. Este anillo de Teflon fue retirado antes de la evaluación mecánica y solamente se utilizó para mantener confinadas las células durante el cultivo celular.
Cultivo celularEn el estudio se utilizaron células musculares lisas de la aorta de la rata (CMLsAR, generaciones 1114) obtenidas a través de VEC Technologies (Rensselaer, NY). Las células se mantuvieron en un medio de Eagle con la modificación de Dulbecco (DMEM, Dulbecco’s modification of Eagle medium) (10-013-CV; Mediatech, Herndon, VA), suplementado con un 10% de suero bovino fetal inactivado por calor (FBS, F4135; Sigma-Aldrich, St. Louis, MO) y con un 1% de antibióticos-antimicóticos (A5955, Sigma-Aldrich). Las células fueron separadas con tripsina al 0,25% en 0,2 mg/ml de ácido etilenodiaminotetraacético (EDTA, E6511; Sigma, St. Louis, MO).
Utilización de las células para la evaluación mecánicaEn cada estación se utilizaron membranas (5,25 cm de diámetro) recortadas a partir de láminas de silicona de uso biomédico (lote SM04106803; Specialty Manufacturing, Saginaw, MI) y que tenían un grosor de 0,381 mm y una durometría de 40. Después, estos fragmentos fueron homogeneizados mediante ondas ultrasónicas en agua desionizada y colocados en las placas base designadas. Más tarde, las placas unidas entre sí fueron esterilizadas mediante vapor (3870M; Tuttnauer Brinkmann, Jerusalén, Israel) a una temperatura de 121 °C durante 30 min, siendo colocadas después en el aparato simulador sobre aproximadamente 0,2 cm3 de lubricante de silicona (51360; Loctite, Rocky Hill, CT). El lubricante fue distribuido mediante un tapón de silicona estéril con aplicación de una tensión mecánica del 5% con el sistema de generación de tensión FlexerCell (FlexCell International). El sistema ya montado fue esterilizado mediante rayos ultra-violeta (UV) durante 3 h. Tras la esterilización, los anillos estériles de Teflon fueron centrados en la superficie de silicona. El área central de la silicona constituida por los anillos de Teflon fue recubierta con colágeno de tipo I (Vitrogen 100, 3 mg/ml; Cohesion Tech, Palo Alto, CA) diluido en agua estéril hasta una concentración de 50,0 mg/ml; después, se permitió su secado en una campana estéril de flujo laminar durante 72 h, según el protocolo Cohesion Tech para la formación de una fina lámina de colágeno. Antes de la aplicación de las células, las membranas fueron lavadas con 1,0 ml de tampón fosfato de Dulbecco (DPBS, 21-031 CM; Mediatech). Finalmente, se realizó el recuento de las células mediante un hemocitómetro, teñidas con el colorante azul trípano; se seleccionó una densidad de 7,5 x 104/ml y las células fueron incubadas durante 48 h para que pudieran presentar dispersión y adherencia. A las 24 h se añadió 1 ml adicional del medio.
Grupos en el experimento de simulaciónEn nuestro estudio se investigaron dos grupos experimentales con simulación de las condiciones in vivo, además de un grupo control en el que las células no estuvieron expuestas a fuerzas tangencia-les ni de tensión. El grupo de modelo de lesión (MoL) estuvo constituido por células expuestas a fuerzas de tensión intensas generadas durante la angioplastia con balón, seguido de la exposición a fuerzas tangenciales y de tensión. Estas células representaron las CMLs que quedan expuestas directamente al flujo sanguíneo tras la denudación de la monocapa de células endoteliales. En el grupo de tensión cíclica (TC) se simuló un control fisiológico en el que las células fueron sometidas a una tensión cíclica entre el 0% y el 4%, sin presentar una exposición directa al flujo. Como controles del comportamiento de adherencia y del comportamiento fenotípico se utilizaron controles estáticos no sometidos a ningún tipo de fuerza (N). Los controles de adherencia (A), que fueron determinados y contados antes del inicio del experimento, facilitaron la evaluación de los problemas de la adherencia a consecuencia de la exposición a las fuerzas mecánicas.
Evaluación mecánicaAntes de la evaluación mecánica, se estudió la confluencia mediante el análisis microscópico de los controles estáticos no sometidos a tensión alguna. Se retiró el medio de FBS al 10% y se mantuvieron las CMLsAR en un medio quiescente constituido por DMEM sin suplemento con FBS durante el período de evaluación mecánica. Este medio se utiliza con frecuencia en la evaluación dinámica con el objetivo de investigar los efectos de las modificaciones sobre la proliferación. Durante la aplicación de la evaluación mecánica, los grupos experimentales dinámicos fueron sometidos en primer lugar a un régimen de reacondicionamiento de una tensión cíclica del 0-4% durante 2 h, con frecuencias progresivamente mayores de 0,1 (30 min), 0,5 (30 min) y 1,0 (60 min) Hz. Tras este régimen de reacondicionamiento, el grupo TC (n = 6) fue sometido a una tensión cíclica del 0-4% durante 8 h, mientras que el grupo MoL (n = 6) fue sometido a dos episodios de distensión circunferencial estática del 12% mantenidos cada uno de ellos durante 75 s, con intervalos de 30 s entre los episodios de distensión, tal como ocurre generalmente durante la angioplastia con balón. Tras el despliegue simulado de la sonda de globo, el flujo tangencial se reanudó con una tasa de flujo de 350 ml/min y se aplicó una tensión cíclica del 0-4% durante 8 h. La tasa de flujo de 350 ml/min aplicó una fuerza tangencial parietal baja (0,25 dinas/cm2) para estimular la proliferación celular. Las muestras N estáticas, que no fueron sometidas a exposición frente a una fuerza dinámica, sirvieron como control (n = 6), mientras que los controles A (n = 6), que se establecieron antes de la evaluación dinámica, sirvieron para determinar el número de células perdidas a consecuencia de la falta de adherencia celular.
Evaluación de la respuesta celularProliferación celular. Cada grupo experimental estuvo constituido por seis muestras. La proliferación celular fue evaluada mediante métodos cuantitativo (n = 3) y cualitativo (n = 3). El abordaje cuantitativo consistió en la tinción de los núcleos celulares con 40,6-diamidino-2-fenilindol (DAPI, D1306; Molecular Probes, Eugene, OR). Para este método, tras la evaluación mecánica las células fueron introducidas en DPBS, fijadas con etanol al 100% durante 30 min y, después, introducidas de nuevo en DPBS. Las muestras fueron cubiertas con 0,5 ml de una solución DAPI durante 10 min y lavadas con DPBS. Después, las muestras fueron visualizadas mediante microscopia fluorescente (Diaphot 300; Nikon, Melville, NY) en 10 localizaciones distribuidas en toda la muestra. Para la cuantificación del número de células presentes se utilizó el programa informático ImagePro Plus Analysis (versión 5.1; Media Cybernetics, Silver Spring, MD).
El análisis cualitativo implicó el uso del método Cell Titer 96 AQueous ONE Solution Cell Proliferation Assay (3-(4,5-dimetiltiazol-2-il)-5-(3-carboxi-metoxifenil)-2-(4-sulfofenil)-2H-tetrazolium sal interna [MTS], G-3580; Promega, Madison, WI), del que se añadieron 1,25 ml a cada pocillo, con incubación durante 3 h. Los sobrenadantes se recogieron individualmente, se colocaron en tubos y se agitaron suavemente para facilitar la uniformidad de la muestra. Cuatro muestras de 125 µl procedentes de cada sobrenadante fueron colocadas en una placa de espectrofotometría UV con 96 pocillos. La densidad óptica se determinó en 490 nm (modelo DU640B; Beckman Instruments, Fullerton, CA).
Marcador fenotípicoEn los estratos celulares se evaluó la actina µdel músculo liso como marcador del fenotipo celular6 utilizando para ello técnicas de inmunotransferencia tipo Western convencionales. También se evaluó la expresión de la gliceraldeído-3-fosfato deshidrogenasa (GAPDH, glyceraldehyde-3-phosphate dehydrogenase), que, después, se utilizó como método de normalización y control de la cantidad de proteínas. Las células fueron extraídas de la membrana de silicona y lisadas con un tampón de extracción constituido por Triton X-100 al 0,5% (T-9284, Sig-ma-Aldrich), dodecil sulfato sódico al 1% (SDS, L4522, Sigma-Aldrich), 20 mM Tris (161-0716, Bio Rad, Hércules, CA) y un cóctel inhibidor de proteasas con una concentración de 10 µl/ml (P8340, Sigma-Aldrich). Después, se utilizó el BCA Protein Assay Kit (23225; Pierce, Rockford, IL) para determinar el contenido total de proteínas de cada muestra. Más adelante, las muestras fueron diluidas en 1 µg/ml utilizando tampón de muestra constituido por µ-mercaptoetanol, Tris-HCl 0,5 M, SDS al 10%, azul bromofenol al 0,5%, glicerol y agua destilada. Cada muestra fue normalizada hasta 10 µg/ml. Antes de la electroforesis en gel las muestras fueron hervidas durante 5 min para la linealización de las proteínas. En la electroforesis se utilizó un gel de poliacrilamida al 10% (161-0158, Bio Rad) con 17,5 µl de solución celular en cada banda. La inmunotransferencia Western se realizó con la transferencia a una membrana de polivinilideno difluoruro (PVDF) (162-0184, Bio Rad). Para la detección de los niveles de actina µy la expresión de GAPDH se utilizó el Western Breeze® cromógeno Western Blot Immunodetection Kit (WB7103; Invitrogen, Carlsbad, CA). Se aplicó el Chromogenic Immunodetection Protocol con el anticuerpo monoclonal primario antirratón frente a actina µdel ML (ab18460-1; Abcam, Cambridge, MA), con una dilución de 1:1.000 y con el anticuerpo monoclonal primario anti-GAPDH de ratón (6C5) (CB1001; Calbiochem, San Diego, CA) con una dilución de 1:1.500. La densitometría se llevó a cabo sobre las transferencias Western desarrolladas, con objeto de evaluar las diferencias de expresión de la actina µdel ML entre los grupos N (n = 3), TC (n = 3) y MoL (n = 6). La densidad óptica integrada (DOI) de las bandas se determinó mediante un densitómetro de imagen (GS-700, Bio Rad) equipado con el programa informático de análisis Quantity One (versión 4.1.1, 170-9600; Bio Rad). Las proporciones entre la actina µdel ML y la GAPDH fueron evaluadas para normalizar los datos, y estos valores se utilizaron en los análisis estadísticos adicionales.
Análisis estadísticoSe llevó a cabo un análisis de la varianza para datos apareados según el método de Tukey y con uso del programa informático SigmaStat (Systat Software, San José, CA), con objeto de obtener los datos relativos a la proliferación celular y a la actina µdel ML; los valores p < 0,05 indicaron una diferencia significativa.
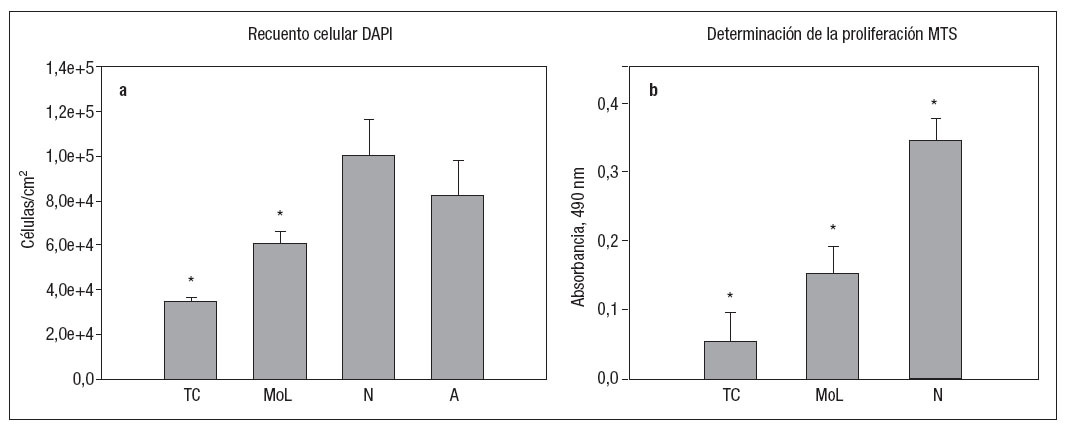
RESULTADOSProliferaciónEn nuestro estudio de fase aguda (8 h) y en el que se utilizaron CMLsAR, se demostró la existencia de una proliferación celular significativa tras la lesión por angioplastia y la exposición a fuerzas tangenciales (grupo MoL), en comparación con lo observado en el grupo de exposición a fuerzas de tensión cíclicas “de función fisiológica” (grupo TC). En el análisis DAPI se observó un incremento del 75% en el número de células en el grupo MoL, en comparación con el grupo TC (p = 0,001). Los números promedio de células según el recuento celular DAPI fueron 3,45 x 104 (± 1,7 µ103 desviación están-dar [DE]) de células/ml en el grupo TC; 6,07 µ104 (± 5,0 µ103 DE) células/ml para el grupo MoL; 10,0 µ104 (± 15,8 µ103 DE) células/ml para los promedios combinados del grupo N estático, y 8,2 µ104 (± 16,1 x 103 DE) células/ml en el grupo A, tal como se muestra en la figura 2a. Según se puede observar en la figura 2b, los resultados MTS apoyaron las tendencias de los resultados DAPI, con unos niveles medios resultantes para 490 nm de 0,062 (± 0,028 DE) en el grupo TC, 0,153 (± 0,04 DE) el grupo MoL y 0,345 (± 0,034 DE) en el grupo N.
Fig. 2. Comparación de la proliferación celular entre los grupos de tensión cíclica (TC), modelo de lesión (MoL), sin aplicación de fuerzas (N) y de adherencia (A) (únicamente datos DAPI). a. La cuantificación celular DAPI indicó una diferencia significativa; los grupos MoL y N fueron diferentes de los demás grupos (*p = 0,001). b. Comparación de la proliferación celular MTS, con confirmación de la diferencia significativa entre los grupos experimentales (*p = 0,001).
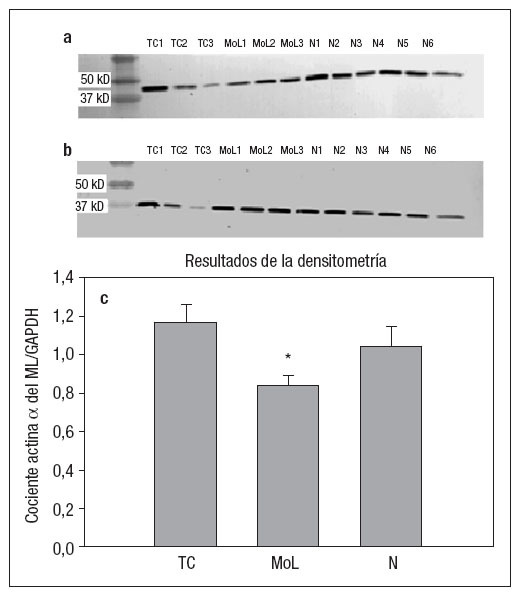
Inmunotransferencia WesternEl análisis de inmunotransferencia Western se realizó para detectar las concentraciones del marcador fenotípico contráctil actina µdel ML. La disminución en los niveles de expresión de actina µdel ML indicaría un fenotipo más sintético de las CMLs. Las muestras estáticas no sometidas a ninguna forma de carga (N1-N6) expresaron una DOI normalizada de la actina µdel ML de 1,038 (± 0,103 DE). La simulación de la función normal en el grupo TC (TC1-TC3) demostró un incremento del 12% en la actina µdel ML, con niveles de DOI de 1,162 (± 0,098 DE); sin embargo, estos resultados no presentaron diferencias estadísticamente significativas. Sí se observaron diferencias con significación estadística en el modelo de lesión por angioplastia (MoL1-MoL3), con disminución de la expresión de actina µdel ML normalizada hasta un nivel de DOI de 0,841 (± 0,046 DE) (p = 0,006), y con una reducción del 19% en la expresión de actina µdel ML en la comparación del grupo MoL con las muestras estáticas pertenecientes al grupo N.
DISCUSIÓNLos efectos de las fuerzas mecánicas individuales sobre el comportamiento de las CMLs en modelos in vitro han sido bien documentados por otros autores. Sin embargo, el modelo desarrollado por nuestro grupo posee la capacidad de representar con mayor precisión las fuerzas mecánicas concurrentes debido a que permite evaluar la respuesta de lesión adicional de las CMLs frente a la aplicación de un dispositivo de angioplastia con balón, así como también la respuesta frente a fuerzas tangenciales parietales de baja intensidad que estimulan la proliferación de las CMLs.
Uno de los objetivos del modelo de lesión ha sido el de simular las importantes fuerzas que se aplican sobre las células tras el despliegue delbalón, en comparación con los niveles normales de fuerzas aplicadas a consecuencia de la expansión de los vasos sanguíneos por efecto del flujo de sangre. Durante la angioplastia la aplicación de fuerzas de 5-10 atmósferas puede influir negativamente en las CMLs adyacentes. A menudo, el procedimiento de la angioplastia con balón se describe como la compresión de la placa arterial en el interior del vaso sanguíneo, con el objetivo de restablecer el diámetro luminal normal. Sin embargo, la importante rigidez de la placa, en comparación con el tejido adyacente, hace que tenga lugar una transferencia importante de la fuerza aplicada hacia los tejidos y las CMLs adyacentes8. La exposición adicional de las CMLs frente a una fuerza dinámica de tensión fisiológica del 0-4% en arterias con disminución de la elasticidad, y con una frecuencia de 1 Hz, dio lugar a la aplicación de fuerzas de tensión parecidas a las que soportan normalmente las CMLs in vivo.
El cambio del fenotipo contráctil de las CMLs por un fenotipo más sintético desempeña una función significativa en la hiperplasia de la capa íntima tras la realización de procedimientos endovasculares. In vivo, las CMLs normales y no alteradas se localizan principalmente en la capa media del vaso sanguíneo y muestran un fenotipo contráctil. Tras la angioplastia, las CMLs de la capa media pueden cambiar su fenotipo contráctil por un fenotipo sintético1. Estas modificaciones celulares hacen que las células pierdan su capacidad de contracción, incrementen su producción de proteínas y muestren una reactividad aumentada frente a los factores de crecimiento autocrinos y paracrinos12-14. Las CMLs con fenotipo contráctil contienen una cantidad de actina µdel ML relativamente mayor que las CMLs con fenotipo sintético, razón por la cual se seleccionó este marcador en nuestro estudio6. Desde el punto de vista mecánico, se ha demostrado que el grado de rigidez de las CMLs con fenotipo contráctil es mayor que el de las CMLs con fenotipo sintético, y se ha propuesto que la razón de ello es la mayor cantidad de actina en el interior de las CMLs contráctiles15.
Las líneas celulares in vitro se caracterizan generalmente por un fenotipo sintético. Cuando son transferidas a un cultivo estático, las CMLs vasculares con fenotipo contráctil tienden a modificar su fenotipo adquiriendo el fenotipo sintético. Se ha demostrado que el aumento en los niveles de las fuerzas de tensión aplicadas (> 10%) da lugar a un incremento de la proliferación de las CMLs16,17, además de una reducción en la expresión de marcadores, como la actina µdel ML 17. Al evaluar los resultados obtenidos en nuestro estudio, las CMLs estáticas y no sometidas a tensión alguna (normales en el cultivo in vitro) sirvieron como elementos basales para evaluar la expresión de actina µdel ML. Incluso tras un período de tiempo tan corto como 8 h después de la lesión, la aplicación de un nivel bajo de fuerzas de tensión similar al que tiene lugar in vivo produjo un incremento en la expresión de actina µdel ML, tal como se puede observar en la figura 3. A pesar de que este resultado no fue significativo, indica que la aplicación de un nivel bajo de fuerzas de tensión podría estimular la diferenciación de las CMLs hacia la adquisición de un fenotipo más contráctil con el paso del tiempo. Para evaluar esta hipótesis serían necesarios nuevos estudios con evaluación de los resultados obtenidos a más largo plazo. La disminución significativa en la expresión de actina µdel ML que se puede observar en la figura 3 al cabo de 8 h en la exposición a fuerzas tangenciales y de tensión tras la angioplastia in vitro es un dato de gran utilidad para demostrar el cambio de fenotipo que tiene lugar a consecuencia de la aplicación de fuerzas mecánicas.
Fig. 3. Resultados de la inmunotransferencia Western para la actina α del ML en los grupos de tensión cíclica (TC), modelo de lesión (MoL) y sin aplicación de fuerzas (N). a. Imagen densitométrica de la actina α del ML utilizada para evaluar la densidad óptica integrada con objeto de comparar sus niveles de expresión. b. Imagen densitométrica de la GAPDH como control de la cantidad de proteínas. c. Normalización de la expresión de actina α del ML en el control GAPDH, indicativa de la existencia de una diferencia significativa de la expresión de actina α del ML en el modelo de lesión (*p = 0,006).
Los resultados de la proliferación, que se muestran en la figura 2, apoyaron el concepto de un cambio fenotípico precoz En comparación con los grupos dinámicos TC y MoL, los resultados DAPI indicaron un incremento significativamente diferente del 75% en el número de células existentes en el grupo MoL, en comparación con el grupo TC de simulación de la función arterial normal, lo que indica que la lesión y la exposición a fuerzas concurrentes tangenciales y de tensión dieron lugar a un incremento de la proliferación celular en el modelo de lesión. Dado que la adherencia celular es un problema que se manifiesta en los experimentos dinámicos con los grupos TC y MoL, la comparación de la proliferación directa entre ambos grupos y el grupo estático carece de relevancia. Esta posibilidad fue apoyada por los datos obtenidos en el grupo A, que indicaron una pérdida significativa de células debido a la exposición dinámica. Por esta razón, en la comparación señalada no se incluyó el grupo N estático.
La aplicación de una fuerza tangencial a las CMLs puede dar lugar a efectos diversos sobre la respuesta celular. Las variaciones en el comportamiento del flujo pueden inducir respuestas diferentes en relación con la magnitud de la fuerza tangencial. Los estudios realizados con aplicación de fuerzas tangenciales demuestran que la aplicación de niveles elevados de este tipo de fuerzas da lugar a la inhibición de la proliferación in vitro de las CMLs18. En términos generales, las fuerzas tangenciales superiores a 10 dinas/cm2 se consideran elevadas y protectoras frente a la ateroesclerosis19. Por el contrario, las áreas en las que se aplican fuerzas tangenciales bajas (< 10 dinas/cm2) muestran una respuesta aterogénica incrementada y un aumento en la proliferación de las CMLs19. Las alteraciones en la geometría arterial pueden dar lugar a la aparición de áreas de separación, estancamiento y recirculación del flujo sanguíneo. Estas modificaciones en los perfiles de la velocidad pueden hacer que algunas áreas parietales presenten fuerzas tangenciales bajas, lo que da lugar a una estimulación de la proliferación de las CMLs. La aplicación de las fuerzas de tensión sobre las células tiene lugar generalmente en forma de fuerzas circunferenciales, uniaxiales o biaxiales. La dirección de estas fuerzas se suele ajustar al método de aplicación. Las células vasculares muestran una deformación cíclica a consecuencia de la dilatación y la relajación de los vasos sanguíneos, lo que generalmente queda representado en las evaluaciones de las fuerzas circunferenciales o uniaxiales. La respuesta de tensión cíclica que sufren las células vasculares es importante para la función celular normal y patológica. Puede influir en la proliferación, la migración, la apoptosis, la morfología y la alineación celulares20.
La diferenciación celular es una cuestión importante tanto para el desarrollo como para la evaluación in vitro. Cuando son transferidas a un cultivo estático, las CMLs con fenotipo contráctil tienden a modificar su fenotipo hacia uno de tipo sintético. Se ha demostrado que la aplicación cíclica de fuerzas de tensión incrementa la expresión de algunos de los marcadores del estado diferenciado de las CMLs. En un estudio realizado por Birukov et al16, además del incremento de h-caldesmon, se observó un aumento de la proliferación indicativo de un comportamiento sintético contradictorio; sin embargo, el nivel de fuerzas aplicadas sobre las células fue mayor que el correspondiente al estrés fisiológico (15%), lo que pudo influir en el comportamiento proliferativo de las células. Butcher et al17 demostraron un cambio de fenotipo en un modelo tridimensional de colágeno con CMLsAR sometidas a fuerzas de tensión correspondientes a un 10% superior al estrés habitual, con una frecuencia de 1 Hz y durante un período de 48 h, utilizando para ello un sistema de aplicación de fuerzas multiaxiales. Los resultados obtenidos en los grupos en los que se aplicaron las fuerzas de tensión demostraron un incremento de la viabilidad celular, una disminución del alargamiento morfológico, una reducción en la expresión de actina µy de calponina, y un incremento en la expresión de vimentina, en comparación con lo observado en el grupo estático.
Estos resultados indican el cambio del fenotipo contráctil por un fenotipo más sintético.
Para el estudio de los efectos de las fuerzas mecánicas aplicadas in vitro se han utilizado diversos sistemas. Por ejemplo, las fuerzas tangenciales se suelen aplicar mediante el uso de líquidos en una cámara de flujo con placas paralelas basada en las diferencias de presión, o mediante un dispositivo de cono situado sobre una placa rotacional. La evaluación de las fuerzas de tensión in vitro se lleva a cabo con uso de dispositivos que aplican fuerzas de tensión en direcciones unidireccional, bidireccional y radial/circunferencial. La ventaja de este sistema en nuestro estudio ha sido el efecto de combinación de la aplicación de fuerzas mediante el uso de los principios combinados de la aplicación de fuerzas de tensión radial/circunferencial y de la aplicación de fuerzas tangenciales en placas paralelas.
Aunque el sistema desarrollado representa un modelo in vitro mejorado, también tiene limitaciones que se deberían solucionar en estudios futuros. Tal como ya se ha señalado, la aplicación de fuerzas mecánicas puede dar lugar a una variedad de respuestas, como apoptosis, migración, hipertrofia, diferenciación y proliferación celulares. Son necesarios estudios adicionales para su investigación. Además, existen otros marcadores fenotípicos que indican los comportamientos sintético o contráctil. La investigación de otros marcadores, además de la actina µdel ML, puede facilitar una caracterización mejor de los efectos sobre la diferenciación de la aplicación de las fuerzas mecánicas sobre las CMLs vasculares.
CONCLUSIÓNEn este estudio se presenta un modelo in vitro diseñado para simular la angioplastia con balón in vitro, seguido de la aplicación de fuerzas de tensión y tangenciales a las CMLs expuestas al flujo vascular. Los resultados obtenidos en el mismo demuestran la eficacia del modelo desarrollado para evaluar la angioplastia in vitro y para simular el entorno mecánico de las células. Además, la significativa respuesta observada en la fase aguda hace que esté justificada la investigación adicional de la aplicación de fuerzas mayores en distintos momentos de tiempo, con objeto de evaluar el incremento de la respuesta de las CMLs.
La significación clínica de nuestro modelo de proliferación celular in vitro consiste en su capacidad para imitar las fuerzas mecánicas clínicamente adecuadas y para aplicar un régimen más complejo que pueda simular la intervención clínica combinada con una exposición normal. Esperamos que nuestro modelo pueda ser implementado en última instancia, por parte de la investigación farmacológica preliminar que trabaja en el desarrollo de posibles agentes antiproliferativos frente a las CMLs, con el objetivo de prevenir la hiperplasia y la reestenosis que tienen lugar tras las intervenciones endovasculares.
Los autores agradecen a Cassie Gregory, Rebecca Cribb y la Dra. Agneta Simionescu su ayuda en el proceso de investigación, y al Greenville Hospital System, la financiación de este trabajo.
Correspondencia: Martine LaBerge, Department of Bioengineering,
Clemson University, 401 Rhodes Hall, Clemson, SC 29634, EE.UU.Correo electrónico: laberge@clemson.eduAnn Vasc Surg. 2007;•:1-8
DOI: 10.1016/j.avsg.2007.07.013 ©Annals of Vascular Surgery Inc. Publicado en la red: ••,•