El stenting de arteria carótida (SAC) protegida con filtro y abordaje transfemoral ha irrumpido como alternativa válida de la cirugía convencional carotídea. Para resolver los inconvenientes del abordaje femoral de la SAC y reducir la carga embólica, algunos investigadores han propuesto un abordaje cervical con inversión del flujo de la arteria carótida interna (ACI). Describimos el resultado clínico y las tasas de embolización intraoperatoria evaluadas mediante resonancia magnética ponderada en difusión (RMPD) en una serie de pacientes de alto riesgo para abordaje femoral que se sometieron a SAC transcervical con flujo inverso en la ACI. Desde septiembre de 2004 a julio de 2007, se seleccionó una serie de 48 pacientes para SAC transcervical con inversión de flujo. Las indicaciones utilizadas para esta técnica fueron edad≥80 años, tortuosidad acusada o calcificación extensa del arco aórtico o vasos supraórticos, arteriopatía oclusiva aortoilíaca grave, gran aneurisma aórtico abdominal y prótesis aortobifemorales. Durante el procedimiento, no se usaron maniobras adyuvantes, como oclusión con balón de la arteria carótida externa. De los 48 pacientes, 43 se sometieron a RMPD cerebral pre y postoperatoria La tasa de mortalidad/ictus de la serie fue del 2,1% (un episodio isquémico transitorio, un ictus menor, y ninguna muerte). Ninguno de los procedimientos dio lugar a disecciones carotídeas o complicaciones en el lugar de abordaje. Entre los 43 pacientes sometidos a RMPD, se identificaron 16 nuevas lesiones isquémicas en seis (13,9%), 4 (9,3%) de las cuales permanecieron asintomáticas. Todas las lesiones isquémicas eran homolaterales a la arteria carótida tratada. En pacientes en riesgo alto para abordaje transfemoral, la implantación transcervical de un stent en la carótida con inversión de flujo consigue buenos resultados técnicos y clínicos y parece capaz de reducir la incidencia de lesiones isquémicas en la RMPD postoperatoria descritas previamente para la SAC transfemoral protegida con filtro.
Durante los últimos años la colocación de un stent en la arteria carótida (SAC) como alternativa válida a la endarterectomía carotídea para tratar a pacientes con estenosis de la arteria carótida ha ido ganando adeptos1. Los sistemas de protección cerebral usados en la actualidad en algunas series han reducido las tasas de ictus y mortalidad hasta valores casi superponibles a los de la cirugía2,3. Aunque los resultados a largo plazo del SAC por lo que respecta a la prevención de ictus y a la permeabilidad del stent siguen siendo parciales, parecen confirmar la validez de la técnica4.
A pesar de la disminución de las complicaciones clínicas la embolización cerebral durante el SAC sigue siendo un problema abierto, ya que numerosos estudios que han utilizado resonancia magnética con ponderación en difusión (RMPD), la técnica con la que en la actualidad se obtiene la mayor sensibilidad y precisión en el diagnóstico de isquemia cerebral5, documentan una elevada incidencia de nuevas lesiones isquémicas cerebrales asintomáticas después del procedimiento6,7. Dichas lesiones, muchas de las cuales también afectan al hemisferio contralateral8, pueden aparecer incluso después de un simple examen angiográfico de los troncos supraaórticos9, lo que demuestra que se originan principalmente por el cateterismo del arco aórtico. Por lo tanto, este problema suscita especial preocupación en pacientes de edad avanzada, muchos de los cuales presentan un cayado aórtico ateromatoso y tortuoso10,11. Una última preocupación es la duda de si los filtros distales, hoy en día los dispositivos de protección cerebral más utilizados, pueden prevenir completamente una embolización intraoperatoria12.
Para reducir la carga embólica inherente y superar las posibles dificultades relacionadas con un abordaje femoral, algunos autores han aplicado una inversión del flujo en la arteria carótida interna (ACI), un sistema de protección cerebral desarrollado y usado previamente por Parodi et al13 vía femoral, a través de un pequeño abordaje quirúrgico en la base del cuello14,15. Aunque en diversos estudios se demuestra que el SAC transcervical con inversión del flujo de la carótida es viable y no entraña riesgos como técnica de revascularización en pacientes en alto riesgo16-19, se requiere información más objetiva que demuestre que la inversión del flujo de la carótida confiere una protección cerebral eficaz. Realizamos el presente estudio para evaluar los resultados clínicos y las tasas de embolización en pacientes con alto riesgo para un abordaje femoral que se sometieron a revascularización de la carótida utilizando SAC transcervical con inversión del flujo. La embolización cerebral se evaluó con una RMPD postoperatoria para la detección de nuevas lesiones isquémicas sintomáticas y asintomáticas.
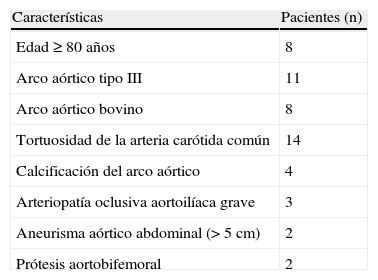
Materiales y métodosDesde septiembre de 2004 a julio de 2007, entre 290 pacientes programados para someterse a SAC en el servicio universitario de nuestro hospital, seleccionamos a 52 (17,2%) para SAC transcervical. Este abordaje se programó cuando la evaluación preoperatoria, basada en hallazgos clínicos y de imagen, reveló un aumento del riesgo para el abordaje transfemoral17. Los factores de riesgo considerados fueron la edad≥80 años, importante tortuosidad del arco aórtico y vasos supraórticos (arco de tipo III, arco bovino, tortuosidades y angulaciones de la arteria carótida común [ACC]), calcificación extensa que afectaba al arco aórtico o el origen de los vasos supraórticos, arteriopatía oclusiva aortoilíaca grave, gran aneurisma aórtico abdominal (> 5cm) o prótesis aortobifemoral (tabla I). Las contraindicaciones del abordaje cervical fueron enfermedad ateromatosa circunferencial y difusa de la ACC o una bifurcación carotídea anatómicamente baja (< 5cm por encima de la clavícula). Se excluyó a dos pacientes con estas contraindicaciones. Todos dieron su consentimiento informado al procedimiento, que fue aprobado por el comité de ética del hospital.
Indicaciones de abordaje transcervical en los 52 pacientes seleccionados
| Características | Pacientes (n) |
| Edad≥80 años | 8 |
| Arco aórtico tipo III | 11 |
| Arco aórtico bovino | 8 |
| Tortuosidad de la arteria carótida común | 14 |
| Calcificación del arco aórtico | 4 |
| Arteriopatía oclusiva aortoilíaca grave | 3 |
| Aneurisma aórtico abdominal (> 5cm) | 2 |
| Prótesis aortobifemoral | 2 |
Todos los pacientes excepto uno presentaban lesiones ateroscleróticas primarias, según lo documentado en el eco-Doppler. El grado de estenosis carotídea se evaluó de acuerdo con criterios velocimétricos y morfológicos. La estructura de la placa se evaluó mediante ecografía en modo B y se definió de acuerdo con los criterios de Geroulakos et al20: tipo 1, ecotransparencia uniforme; tipo 2, ecotransparencia predominante con<50% de las áreas ecogénicas; tipo 3, de predominio ecogénico con<50% de las áreas ecotransparentes; tipo 4, ecogenicidad uniforme; y tipo 5, no clasificable debido a las grandes calcificaciones productoras de una sombra acústica. Todos los pacientes se sometieron a angiografía por resonancia magnética (ARM) o angiografía tomográfica computarizada (ATC) preoperatoria para estudiar el arco aórtico y los vasos supraaórticos.
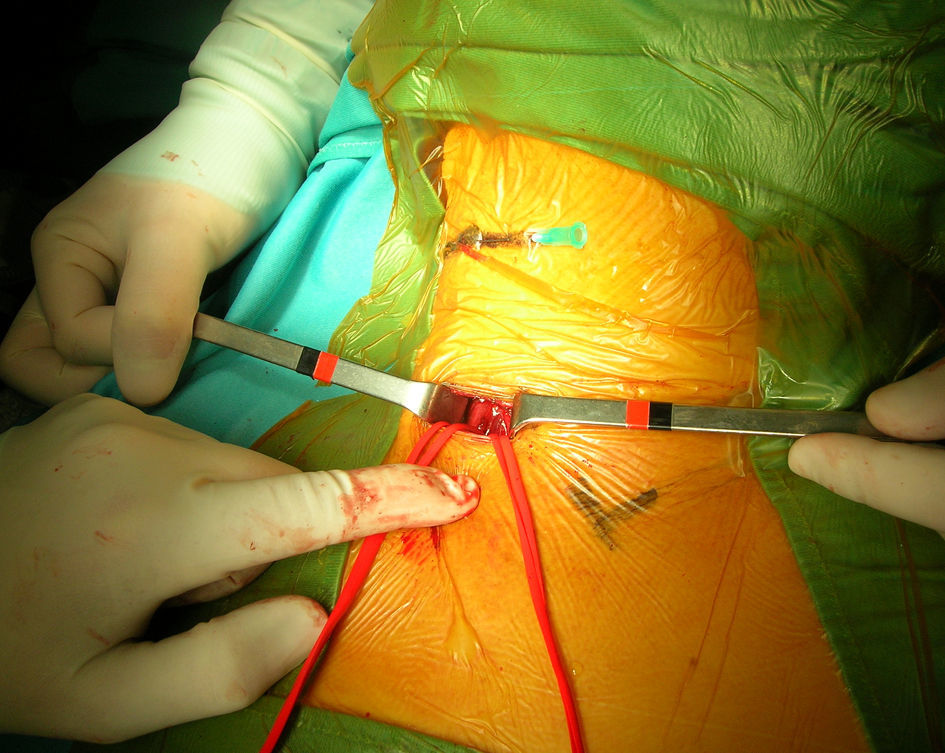
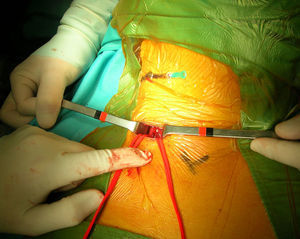
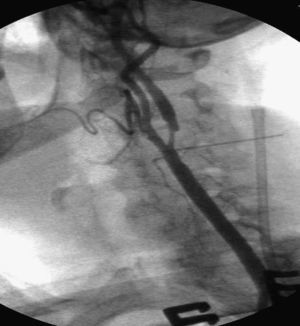
Un cirujano vascular con amplia experiencia en técnicas endovasculares efectuó el procedimiento. Todos los pacientes estaban tomando ácido acetilsalicílico antes de la intervención y recibieron una dosis de carga oral de clopidogrel (300mg) como mínimo 3h antes del procedimiento. Antes del clampaje de la ACC se administró un bolo intravenoso (IV) de heparina (80 UI/kg). Durante el procedimiento, si se detectó un tiempo de coagulación activada<250 s, el paciente recibió una dosis adicional de heparina. En todos los pacientes excepto el primero tratado de esta serie, se marcó la piel a nivel de la bifurcación carotídea bajo guía ecográfica antes del procedimiento. Acto seguido, en el quirófano, se colocó una aguja transversal sobre la marca de piel para identificar la bifurcación carotídea bajo fluoroscopia (figs. 1 y 2). Tras administrar anestesia local, se efectuó un pequeño abordaje longitudinal, con una extensión estimada de 2-3cm, a lo largo del músculo esternocleidomastoideo por encima de la clavícula. La ACC se disecó circunferencialmente unos 2-3cm y se controló con un loop para su posterior clampaje. Acto seguido se clampó la ACC proximal, prestando atención para evitar una lesión del nervio vago. Después se evaluó clínicamente la tolerancia al clamplaje de la carótida. En 4 pacientes se consideró dudosa y el cirujano prefirió usar un filtro distal como protección cerebral. Por lo tanto, de los 52 pacientes seleccionados inicialmente, 48 completaron el estudio (tabla II).
Características demográficas y clínicas de los pacientes sometidos a revascularización carotídea mediante implantación de un stent en la arteria carótida con inversión de flujo y abordaje transcervical
| Características | n (%) | Características | n (%) |
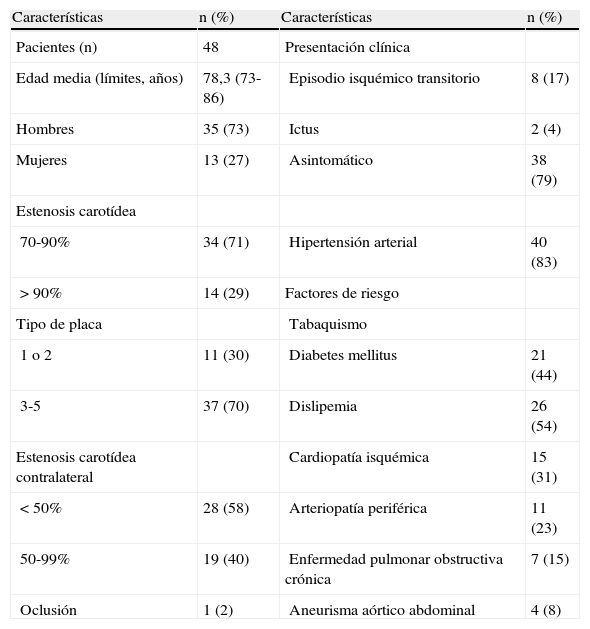
| Pacientes (n) | 48 | Presentación clínica | |
| Edad media (límites, años) | 78,3 (73-86) | Episodio isquémico transitorio | 8 (17) |
| Hombres | 35 (73) | Ictus | 2 (4) |
| Mujeres | 13 (27) | Asintomático | 38 (79) |
| Estenosis carotídea | |||
| 70-90% | 34 (71) | Hipertensión arterial | 40 (83) |
| > 90% | 14 (29) | Factores de riesgo | |
| Tipo de placa | Tabaquismo | ||
| 1 o 2 | 11 (30) | Diabetes mellitus | 21 (44) |
| 3-5 | 37 (70) | Dislipemia | 26 (54) |
| Estenosis carotídea contralateral | Cardiopatía isquémica | 15 (31) | |
| < 50% | 28 (58) | Arteriopatía periférica | 11 (23) |
| 50-99% | 19 (40) | Enfermedad pulmonar obstructiva crónica | 7 (15) |
| Oclusión | 1 (2) | Aneurisma aórtico abdominal | 4 (8) |
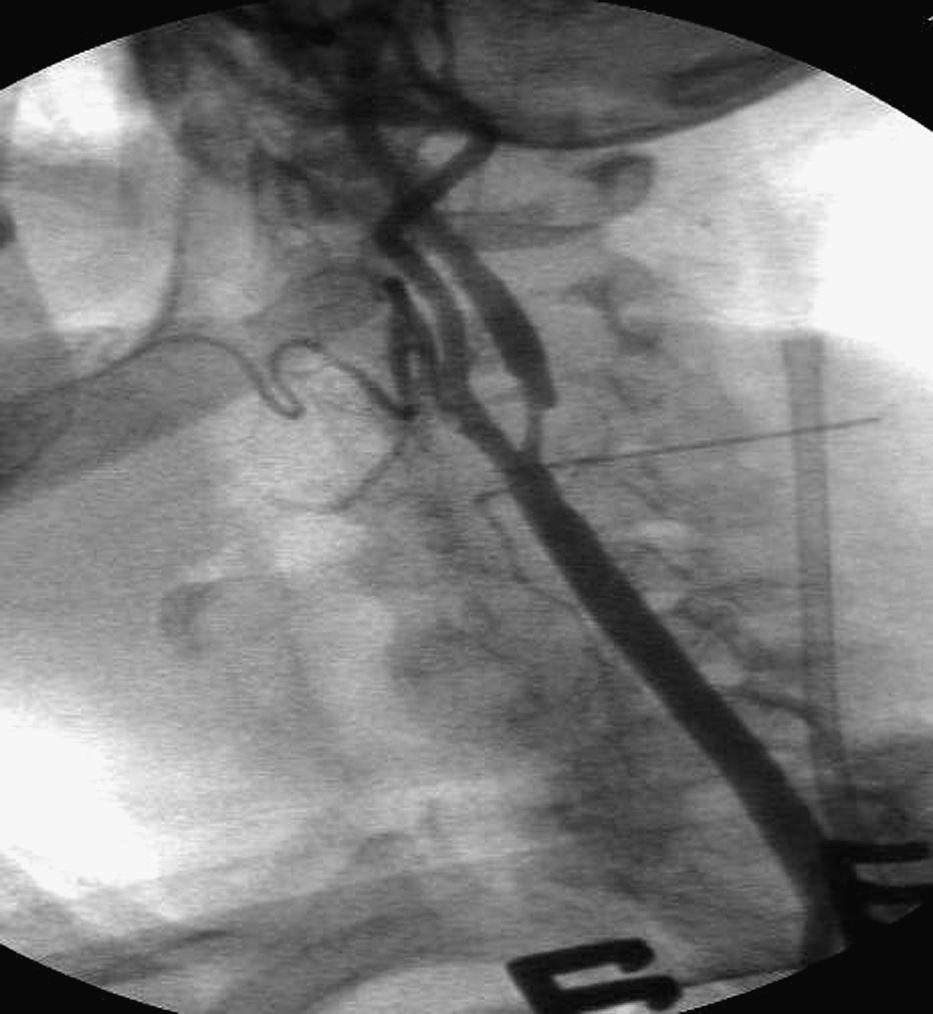
Para el SAC, se estableció una fístula arteria carótida-vena yugular. Después de disecar la vena yugular interna homolateral (VYI), se insertó un introductor 8 F x 11cm de longitud (Togo Medikit, Tokio, Japón) retrógradamente. Acto seguido, se insertó un introductor 8 F x 5,5cm (Brite Tip Sheath; Cordis, Miami, Estados Unidos) en la ACC por encima del clampaje. Se hizo avanzar la punta radioopaca bajo fluoroscopia en la ACC prestando atención a no sobrepasar la aguja de la bifurcación. Después se conectaron los puertos laterales del introductor de la VYI y del introductor de la ACC mediante un segmento corto de tubos para permitir el flujo directo desde la ACC hasta el sistema venoso de presión más baja. Se activó el shunt arteriovenoso y se verificó el flujo retrógrado de la ACI con fluoroscopia mediante la inyección de un medio de contraste en la ACC y la visualización de su drenaje desde la ACI hasta la VYI. Tras cruzar la estenosis con una guía metálica de 0,014 pulgadas, se liberó un stent autoexpandible (Carotid Wallstent; Boston Scientific, La Garene, Francia; Precise Carotid Stent, Cordis) y se dilató con un balón de 5 o 6mm de diámetro (Ultrasoft, Boston Scientific). En pacientes con un trayecto recto de la carótida se eligieron Wallstents (41 pacientes), mientras que en las bifurcaciones tortuosas se utilizó un stent de nitinol (7 pacientes). Se administró sistemáticamente atropina IV profiláctica (1mg) antes de la dilatación con balón. Según lo efectuado habitualmente por Criado et al18, no se realizó otra maniobra intraoperatoria, como la oclusión con balón de la arteria carótida externa (ACE) o la aspiración manual. En pacientes con drenaje lento del medio de contraste, antes de implantar el stent, se obtuvo una angiografía venosa para confirmar la correcta colocación del introductor venoso. Se obtuvo una angiografía al completar el procedimiento para confirmar el tratamiento satisfactorio de la estenosis y evaluar el eventual espasmo distal de la ACI. Cuando éste se observó, se inyectó nitroglicerina intraarterial (200 μg). Acto seguido se dio un punto en U de Prolene 6/0 alrededor del introductor en el lugar de punción arterial. Para eliminar los detritos acumulados en último término en el lugar del clampaje, antes de la retirada del clampaje, se obtuvo una hemorragia retrógrada y anterógrada a través de la punción arterial. Después se colocó un pequeño drenaje a través de la punción de la piel, se aproximó el músculo cutáneo del cuello con una sutura absorbible interrumpida y los bordes de piel se aproximaron con una sutura absorbible intradérmica.
Se adquirieron secuencias de RM con 1,5T con un imán superconductor de imágenes cerebrales. Se adquirieron secuencias FLAIR (Fluid Attenuated Inversion Recovery) ponderadas en T2 (tiempo de repetición [TR] 8.000 mseg, tiempo de eco [TE] 100 mseg, tiempo de inversión 2.200 mseg, campo de visión 240mm, factor turbo 14, número de excitaciones 2), y se adquirieron secuencias PD en los tres planos con un grosor de 5mm (TR 3.000 mseg, TE 84 mseg, valor b 0, 500 y 1.000 seg/mm2). Los pacientes se sometieron a la RM en un plazo de 3 días antes y después del procedimiento. Cuando no estuvo disponible un aparato RM en un plazo de 3 días o la RM estaba contraindicada (pacientes portadores de un marcapasos o que sufrían claustrofobia), el paciente se excluyó de esta exploración. Dos neurorradiólogos expertos, que no participaron en los procedimientos del SAC, compararon las imágenes pre y postprocedimiento y evaluaron la presencia de lesiones isquémicas recientes. Las lesiones homolaterales se definieron como las del territorio de la arteria carótida operada y las contralaterales como las de los territorios de la no operada y de la arteria vertebrobasilar.
Antes y después del procedimiento todos los pacientes se sometieron a un examen neurológico. Los nuevos déficit neurológicos que persistieron más de 24h se definieron como ictus, y su gravedad se clasificó en la escala de Rankin modificada. Un ictus se definió como mayor si la puntuación obtenida en la escala fue de 3 y como menor si la puntuación fue inferior a 3. Para calcular las diferencias entre grupos de los datos para los factores que influyeron en el desarrollo de lesiones RM-PD se usó el test de Fisher. Se consideró estadísticamente significativo un valor de p≤0,05.
ResultadosDe los 52 pacientes seleccionados inicialmente, en 48 se demostró tolerancia clínica al clampaje carotídeo y se sometieron a la implantación de un stent carotídeo con inversión del flujo en la ACI. En todos los casos, el SAC tuvo éxito técnico (sin estenosis residual o estenosis persistente<20% al completar la angiografía). La duración media del procedimiento fue de 68min (límites 50-75) con un tiempo medio de clampaje de 47min (38-52). En todos los casos, la angiografía intraoperatoria confirmó la inversión del flujo en la ACI aunque la velocidad de drenaje del contraste varió entre pacientes. Los 48 que toleraron el clampaje también toleraron la inversión del flujo carotídeo. La estenosis de un paciente requirió predilatación con balón coronario después de activar el shunt arteriovenoso. De los 48 pacientes tratados, un hombre de 83 años, con una estenosis asintomática del 70% de la ACI izquierda y una placa de tipo 3, experimentó un ictus menor (2,1%), desarrollado poco después de insertar el introductor en la ACC. Se trataba de nuestro primer procedimiento de SAC transcervical con inversión de flujo y no se insertó una aguja sobre la piel para identificar la bifurcación. Este paciente se seleccionó para este abordaje porque era portador de una prótesis aortobifemoral. La angiografía efectuada antes de liberar el stent demostró un drenaje satisfactorio del medio de contraste. La RM-PD postoperatoria demostró un área isquémica en el lóbulo frontal. En el momento del alta, el paciente presentaba hemiparesia leve de la extremidad superior derecha. Otro hombre de 62 años de edad con una estenosis asintomática del 80% de la ACI derecha y una placa de tipo 2 experimentó una hemiparesia postoperatoria del brazo izquierdo que se resolvió al cabo de horas (episodio isquémico transitorio, 2,1%). Se seleccionó para este abordaje porque en la RM se documentó un arco aórtico de tipo III. La angiografía antes de la liberación del stent demostró un drenaje satisfactorio del medio de contraste. La RM-PD postoperatoria reveló un área isquémica en el lóbulo parietal. Ningún paciente falleció o presentó déficit de los pares craneales o hematomas que requirieran corrección quirúrgica. Ninguno de los procedimientos dio lugar a disecciones de la ACI homolateral. En seis pacientes se observó un espasmo de la ACI distal pero en todos los casos respondió al tratamiento con nitroglicerina intraarterial. En cinco pacientes (10%) se observó hipotensión grave, y en 10 (20%), bradicardia postoperatoria. En un paciente la hipotensión y bradicardia dieron lugar a un aumento de las enzimas de necrosis miocárdica y un diagnóstico de infarto de miocardio que requirió el traslado preventivo a la unidad de cuidados intensivos cardiológicos. En este paciente, en el momento del alta, la fracción de eyección ventricular izquierda era similar al valor preoperatorio. En los pacientes restantes la hipotensión y bradicardia respondieron al tratamiento farmacológico y se normalizaron en el momento del alta. Todos los pacientes fueron dados de alta al cabo de 3 días de la intervención. En todos el eco-Doppler practicado 24h después del SAC demostró la permeabilidad del stent.
De los 48 pacientes incluidos en la serie del presente estudio, 43 (89,6%) se sometieron a RM-PD. La comparación de la exploración pre y postoperatoria reveló 16 nuevas lesiones isquémicas en seis pacientes (6/43, 13,9%), con una media de 2,7 lesiones por paciente (2-4). Todas las lesiones eran homolaterales a la arteria carótida intervenida. En cuatro de estos seis pacientes, las lesiones RM-PD permanecieron asintomáticas, lo que deparó una incidencia del 9,3% de las lesiones isquémicas asintomáticas. Ningún factor preoperatorio, como los síntomas de presentación (pacientes sintomáticos comparados con asintomáticos), tipo de placa de la carótida (tipo 1 o 2 comparado con tipo 3-5), o edad (≥ 80 frente a<80 años), tuvo una influencia significativa en la incidencia postoperatoria de estas lesiones. De forma parecida, en la serie no se encontró una relación significativa entre el desarrollo de nuevas lesiones isquémicas y el tipo de stent (Wallstent frente a Precise) o el balón de dilatación utilizado (5 frente a 6mm).
En el examen a los 6 meses de seguimiento, todos los stents carotídeos estaban permeables y no se detectó una reestenosis sustancial en la ACI o la ACC. Durante el seguimiento ninguno de los pacientes experimentó eventos neurológicos.
DiscusiónEn el presente estudio efectuado en un solo centro en pacientes de riesgo elevado para someterse a un abordaje femoral, el SAC transcervical con inversión del flujo carotídeo se asoció a una baja tasa de complicaciones neurológicas y locales. En nuestra serie un paciente experimentó un ictus menor, lo que deparó una tasa de mortalidad/ictus del 2,1%; y ninguno de los procedimientos dio lugar a disección arterial, lesiones nerviosas o hematoma cervical. El ictus menor afectó al primer paciente en el que se usaba esta técnica de revascularización y probablemente se produjo a partir de una embolia al hacer avanzar el introductor una distancia excesiva dentro de la ACC. Por lo tanto, aunque la tasa de ictus coincide con las de las series publicadas en las que se ha usado el stenting transfemoral21,22, en los pacientes tratados más adelante en nuestra serie redujimos aún más las complicaciones neurológicas permanentes al mejorar nuestra técnica quirúrgica, y lo que es más importante, a través de la localización de la bifurcación carotídea con más precisión mediante ecografía y colocación del introductor bajo vía fluoroscópica. Otra ventaja que tendrá que confirmarse a partir de otros estudios fue la menor incidencia de cambios en el ritmo cardíaco o la presión arterial descritos habitualmente para la técnica de revascularización transfemoral23,24.
Un punto importante en el presente trabajo es que, a diferencia de los estudios publicados previamente que han usado SAC transcervical con inversión del flujo carotídeo16-18, también evaluamos las complicaciones asintomáticas. En nuestra serie la RM-PD reveló una incidencia relativamente baja de lesiones isquémicas asintomáticas. Aunque la incidencia del 9,3% es mucho menor que la incidencia postoperatoria más baja de lesiones asintomáticas detectadas en la RM-PD, del 17%, descrita hasta la fecha tras SAC transfemoral con filtro de protección6, otros investigadores, que han usado filtro de protección distal, han descrito una incidencia que alcanza incluso el 40%7,8. Por consiguiente, el procedimiento de inversión del flujo que utilizamos en el presente estudio demostró ser capaz de reducir la incidencia de complicaciones isquémicas asintomáticas y, por lo tanto, la carga embólica intraprocedimiento hasta niveles equiparables a los descritos después de cirugía25,26. En primer lugar, la disminución de la embolización observada depende del abordaje transcervical que elimina la carga embólica bien conocida relacionada con las maniobras efectuadas en el arco aórtico27. En un estudio en el que usaron angiografía cerebral diagnóstica y procedimientos neurointervencionistas, Bendszus et al9 demostraron que, incluso un estudio angiográfico diagnóstico simple de los troncos supraaórticos, puede dar lugar a una tasa de lesiones detectadas en la RM-PD posprocedimiento del 26%, similar a lo descrito por otros autores después de SAC28. Los mismos investigadores también destacan la estrecha asociación entre la incidencia de lesiones observadas con esta técnica y los indicadores de un procedimiento difícil (dosis de contraste usado, tiempo de fluoroscopia y uso de catéteres adicionales), demostrando la importancia determinante de las maniobras complejas en el arco aórtico en la etiología de lesiones isquémicas. Las pruebas adicionales que confirman la eficacia del abordaje cervical en la reducción de fenómenos embólicos proceden de la ausencia de lesiones isquémicas detectadas en los territorios cerebrales contralaterales28,29. Una segunda razón de la reducida carga embólica observada en la serie del presente estudio es la protección cerebral conferida por la inversión del flujo de la carótida. Numerosos estudios confirman que la inversión del flujo o su bloqueo es más eficiente que los sistemas de protección distal con filtro en la reducción del recuento de señales microembólicas durante el procedimiento27,30,31. A pesar de todo, en pacientes sometidos a SAC con abordaje transfemoral, la protección cerebral ofrecida por el bloqueo o la inversión del flujo no redujo las lesiones isquémicas detectadas en la RM-PD. Aunque El-Koussy et al32 describieron una incidencia del 28% de las lesiones isquémicas detectadas en la RM-PD después de SAC con bloqueo del flujo ACI, Asakura et al33 documentaron una incidencia del 18% después de SAC con inversión del flujo en la ACI. Estos datos demuestran claramente que la protección cerebral proximal es insuficiente para reducir significativamente la carga embólica si el SAC incluye la navegación dentro del arco aórtico. Por lo tanto, la inversión de flujo combinada con un abordaje cervical parece garantizar a los pacientes una mejor protección cerebral.
Aunque el SAC transcervical con inversión del flujo carotídeo deparó una menor incidencia global de lesiones isquémicas en la RM-PD que la documentada para otras técnicas de SAC, en el presente estudio el 9% de los pacientes presentaron nuevas lesiones isquémicas en la RM-PD. Este hallazgo indica que la técnica que usamos tampoco produce la abolición de las microembolias durante el procedimiento. En consecuencia, en un estudio previo en el que se usó monitorización con eco-Doppler transcraneal, Matas et al34 describieron que en el 5,7% de los pacientes las señales microembólicas persistieron mientras el shunt arteriovenoso estaba funcionando. Estos autores atribuyeron este acontecimiento al flujo procedente de la ACE que, en algunos pacientes, puede impedir una inversión adecuada del flujo en la ACI, lo que, por tanto, favorecería el desarrollo de émbolos cerebrales. Por consiguiente, el uso de maniobras adyuvantes, como oclusión con balón de la ACE14,17 o la aspiración manual del riego arterial durante las fases de riesgo del SAC19, podría contribuir a reducir aún más la carga embólica del procedimiento. Obviamente, se requieren otros estudios con RM-PD para validar estas mejoras técnicas.
ConclusionesEl SAC transcervical se asocia a una incidencia aceptable de complicaciones clínicas y a una incidencia reducida de lesiones isquémicas asintomáticas. A pesar de ser más cruenta que el abordaje femoral percutáneo y más difícil de aplicar en pacientes que no toleran el clampaje, puede ofrecer una alternativa válida al SAC transfemoral, en especial en pacientes en los que el acceso endovascular del eje carotídeo se considere demasiado difícil o peligroso.