El injerto de derivación infrainguinal se realiza con frecuencia como tratamiento de la arteriopatía periférica. En varios estudios se ha demostrado la superioridad de la vena safena autóloga sobre el injerto protésico como conducto para la derivación infrainguinal. La vena autóloga no solamente actúa como conducto para el flujo de sangre, sino que también inhibe la formación de trombos mediante la producción de activador del plasminógeno tisular y de óxido nítrico1-3. En un metaanálisis en el que se evaluaron las tasas de permeabilidad a los 5 años del injerto de derivación, la permeabilidad acumulada del injerto primario fue del 77,2% respecto a las derivaciones efectuadas con una vena con anastomosis en la arteria poplítea supragenicular, y del 64,8% cuando la derivación se realizó por debajo del nivel de la rodilla4. Sin embargo, la realización previa de otros procedimientos o la presencia de flebitis o varicosidades hace que las venas del paciente no tengan características idóneas para su utilización.
La necesidad de un conducto alternativo aceptable ha constituido un problema importante en cirugía vascular. Se han desarrollado varios conductos sintéticos, valorando la utilidad de los injertos textiles de poliéster (Dacron®; DuPont, Wilmington, DE) y los no textiles de poliuretano y de politetrafluoroetileno expandido (ePTFE, expanded polytetrafluoroethylene) para la reconstrucción vascular. En un estudio, la tasa acumulada de permeabilidad primaria fue del 57,4% para las prótesis de ePTFE utilizadas para la derivación hasta la arteria poplítea supragencular4. Además de ofrecer unos resultados inferiores de permeabilidad, estos injertos son susceptibles de infección y de fatiga del material. Hasta el momento, ninguna prótesis ha alcanzado los resultados de durabilidad conseguidos con el uso de una vena en las derivaciones realizadas por debajo del nivel de la rodilla. Se han evaluado diversos segmentos venosos complementarios a los conductos protésicos, con una cierta mejoría en la permeabilidad en comparación con el uso aislado de las prótesis.
La heparina es un inhibidor indirecto de la trombina que se ha utilizado como medida complementaria para reducir la trombogenicidad de los injertos protésicos5-9. Sin embargo, este tipo de injertos se acompaña de diversos problemas. Los injertos recubiertos por heparina dan lugar a un exceso de hemorragia a partir de los poros del injerto10 y a la eliminación de heparina a largo plazo11. A pesar de estos inconvenientes, en varios estudios se han obtenido resultados favorables con el uso de injertos vasculares revestidos con heparina12,13 (IVRH).
Además, la heparina es un fármaco de comportamiento inmunógeno en algunos pacientes, lo que da lugar a la aparición de anticuerpos antiplaquetarios relacionados con la heparina (AAH). Estos anticuerpos pueden desempeñar una función importante en la aparición de trombocitopenia inducida por heparina (TIH). La forma de TIH mediada por mecanismos inmunológicos se caracteriza por la aparición de complicaciones trombóticas y, en ocasiones, hemorrágicas en el contexto de la administración de heparina. Se ha demostrado que la heparina liberada por los injertos o los catéteres intravasculares puede provocar TIH. Su incidencia oscila entre el 0,5% y el 1%14. Se ha observado que los IVRH inducen un estado protrombótico en presencia de AAH11,15.
Nuestro estudio ha tenido como objetivo el determinar si un IVRH comercial de Dacron® da lugar a liberación sustancial de heparina y, si ésta, puede causar agregación plaquetar en presencia de AAH.
MATERIALES Y MÉTODOSMaterialesPara el estudio se utilizó un IVRH de Dacron® de 8 mm de diámetro (injerto de poliéster tejido con heparina InterGard®; InterVascular, Montvale, NJ).
El injerto utilizado como control tenía el mismo diámetro pero no presentaba recubrimiento alguno (injerto de poliéster tejido InterGard®).
Métodos generalesTodas las determinaciones fueron repetidas por triplicado. Los experimentos se llevaron a cabo con enmascaramiento hasta finalizar el análisis de los datos. Todos los parámetros estadísticos fueron analizados mediante la prueba t de Student.
El IVRH fue seccionado en tiras o fragmentos de 1 cm de longitud. Los del injerto control fueron tratados de la misma manera que los de las muestras problema. Los fragmentos de los injertos fueron incubados en 5 cm3 de plasma sin plaquetas (PSP), con temperaturas y duraciones variables. Las condiciones de tratamiento fueron 24 h a 37 °C. Tras la incubación, partes del PSP fueron remitidas a un laboratorio independiente para la determinación de la concentración de heparina con objeto de comprobar la cantidad de heparina que había pasado desde el injerto hasta el PSP (American Red Cross, Columbia, MO).
Determinación de la agregación plaquetarNuestro método para la detección de los AAH ha sido descrito previamente16. De manera resumida, se preparan plasma rico en plaquetas (PRP) procedente de donantes sanos y PSP procedente tanto de donantes sanos como de pacientes con TIH conocida, realizando para ello la centrifugación diferencial de la sangre completa introducida en una solución de citrato al 3,8%. Las muestras de PRP y PSP (tras la incubación con un IVRH o con un injerto control) fueron combinadas e incubadas a 37 °C durante 3 min. Después, la mezcla fue incubada de nuevo durante 15 min adicionales en un agregómetro plaquetario, con 25 µl de una de las tres fuentes siguientes de heparina (concentración final, 1 anti-Xa U/ml): mucosa intestinal porcina (Solopak Laboratories, Elk Grove, IL), heparina pulmonar bovina (Upjohn, Kalamazoo, MI) y enoxaparina (Lovenox; Rhone-Poulenc Rorer Pharmaceuticals, Collegeville, PA). La agregación plaquetar se determinó mediante un agregómetro de doble canal (Chronolog, Havertown, PA), definiendo ésta a partir de una modificación de la densidad óptica superior al 20%.
En los casos en los que no se produjo la agregación, se añadieron 25 µl de difosfato de adenosina (solución de 10–4 mol/l) para garantizar la reactividad apropiada del PRP donante. La especificidad de esta prueba se incrementó en dos puntos con el uso de una técnica de agregación plaquetar. Todas las muestras fueron evaluadas con una concentración elevada de heparina no fraccionada (concentración final, 100 anti-Xa U/ml). En los casos en los que se detectó agregación debido a la aplicación de una concentración elevada de heparina, las reacciones fueron consideradas inespecíficas.
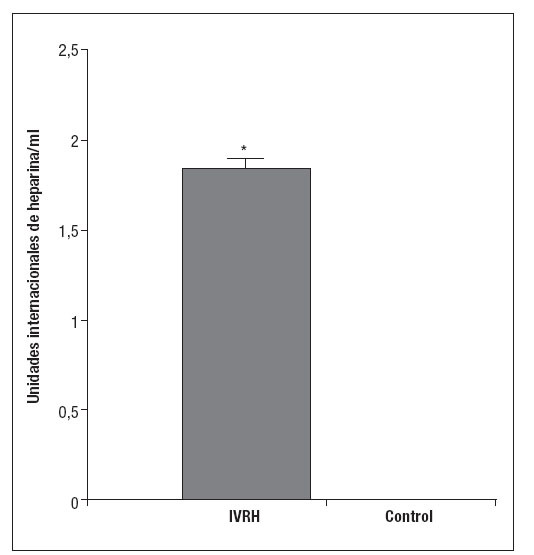
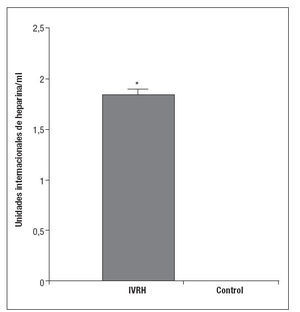
RESULTADOSLa heparina fue eliminada por el 100% de las muestras de IVRH. La eliminación de heparina a partir de las muestras de IVRH tuvo lugar con una concentración de 1,82 ± 0,08 unidades/cm3. En el grupo control no se detectó la presencia de heparina en el PSP (0,00 unidades/cm3; p < 0,05) (fig. 1).
Fig. 1. Concentración media (± una desviación están-dar) de heparina en el líquido tras la incubación de cantidades iguales de injerto en PSP. Se observa una liberación constante de heparina por el IVRH, mientras que ésta no se detecta en el injerto control. *p < 0,05. IVRH: injerto vascular recubierto con heparina.
Se produjo agregación plaquetar en el 85,7% de las muestras del IVRH y en ninguna de las del injerto control (p < 0,05). Estos estudios demostraron la existencia de reacciones con potencias variables, lo que podría reflejar la variabilidad que se observa entre los donantes y en la reacción de los anticuerpos con diversos epítopos17,18.
DISCUSIÓNTodavía no se ha conseguido diseñar un conducto vascular alternativo con características ideales. La gran disponibilidad de los materiales sintéticos hace que las prótesis constituyan una opción atractiva, siempre y cuando las modificaciones que se efectúen en las mismas permitan conseguir tasas de permeabilidad comparables a las obtenidas con los conductos venosos. Las prótesis no modificadas, tanto de poliéster como de ePTFE, se acompañan de tasas de permeabilidad bajas cuando se aplican sobre el sector arterial infragenicular. Una modificación química que podría reducir la trombogenicidad de estos injertos es su recubrimiento con heparina, fármaco inhibidor indirecto de la trombina, anticoagulante sistémico efectivo y con otros efectos distintos de los anticoagulantes19-24.
En un estudio realizado en 2001 por McCollum et al12 se demostró que los IVRH se acompañaban de tasas de permeabilidad primaria superiores a las conseguidas con los injertos de PTFE. Al cabo de 1 año, la permeabilidad primaria en los IVRH era del 70%, mientras que en los injertos no recubiertos por heparina era del 56%. En un estudio de seguimiento realizado en 2004 participaron 179 pacientes en los que se realizaron derivaciones por encima del nivel de la arteria poplítea en la rodilla, así como 30 pacientes en los que se realizaron derivaciones por debajo del nivel de la arteria poplítea en la rodilla; a pesar de que las tasas de permeabilidad de los IVRH fueron mejores al cabo de 3 años, a los 5 no hubo diferencias estadísticamente significativas entre los IVRH y los injertos de PTFE respecto a las tasas de permeabilidad13. Lambert et al25 revisaron su experiencia con el uso de IVRH y observaron una permeabilidad primaria del 69% a los 4 años en los pacientes con derivaciones suprageniculares. Sus resultados también demostraron una tasa de permeabilidad primaria del 58% durante el mismo período de tiempo en las derivaciones efectuadas por debajo de la rodilla en las que se utilizó un injerto venoso. Estos resultados sugerían la ausencia de ventajas asociadas al uso de IVRH. En esta serie, fue necesaria la realización de ocho amputaciones mayores, con una tasa del 17%. Según los datos del fabricante, el uso de este injerto se asocia a una tasa de amputación del 2,7%; de trombosis, del 27,7%, y de permeabilidad primaria, del 70,6%. Sin embargo, los resultados obtenidos con el injerto tejido de Dacron® InterGard® sin recubrimiento con heparina fueron unas tasas de amputación, trombosis y permeabilidad primaria del 0,4%, 17,1% y 91,6%, respectivamente.
En los estudios anteriormente citados no se abordó la posibilidad de que se produjeran una TIH o un estado pro-coagulante. La TIH y las complicaciones trombóticas asociadas a este síndrome no están en relación con la dosis de heparina, de manera que la simple presencia de heparina en el injerto podría constituir el elemento desencadenante14,15. Los resultados obtenidos en nuestro estudio demuestran que la heparina liberada por el injerto hacia el suero del paciente puede dar lugar a una agregación plaquetar en el plasma susceptible. Existe la posibilidad de que incluso la heparina liberada en la fase de recubrimiento pueda dar lugar al desarrollo de AAH y TIH. Además, el método utilizado para el recubrimiento del injerto puede influir en la aparición de AAH, un aspecto que no fue analizado en nuestro estudio. El injerto evaluado utilizó heparina originada en mucosa porcina y aplicada sobre la superficie del injerto de poliéster utilizando para ello moléculas de cloruro tridodecil metil amoníaco (TDMAC, tridodecyl methyl ammonium chloride). Heparina y TDMAC forman un complejo insoluble de manera que la primera se une a la superficie del injerto por acción de las fuerzas hidrófilas de las moléculas de TDMAC y del poliéster. La cobertura con colágeno (de origen bovino) se realiza en la superficie del injerto para disminuir la hemorragia a través del mismo y para retrasar la liberación de heparina procedente del propio injerto.
Una vez que se establece el diagnóstico de TIH, la morbilidad estimada por TIH oscila entre el 5% y el 20%, y suele asociarse a complicaciones trombóticas26. Los cirujanos deben ser conscientes de que la incidencia de TIH es mayor en los pacientes con enfermedades vasculares que en las personas de la población general15. El tratamiento de la TIH requiere la eliminación de todas las fuentes de heparina. En el caso del IVRH, ello conllevaría la eliminación del injerto vascular si todavía estuviera en fase de liberación, o incluso ante persistencia de cantidades residuales de recubrimiento. Una vez que se ha eliminado la fuente de heparina, en muchos pacientes todavía persiste un estado de coagulación excesiva y en muchos casos es necesario el tratamiento con un anticoagulante alternativo, tal como un inhibidor directo de la trombina.
CONCLUSIÓNLa posibilidad de TIH a consecuencia de la eliminación de heparina por parte del injerto estudiado constituye un riesgo real. Además, la superficie luminal del mismo facilita la exposición de heparina al plasma circulante y puede dar lugar a la formación de AAH incluso en los casos en los que ésta no se libera hacia el plasma. Nuestra experiencia se ha limitado a un solo tipo de injerto. No hemos evaluado otros IVRH, incluyendo los fabricados con ePTFE. A pesar de que todavía no se han publicado casos de TIH secundaria a la heparina utilizada en el recubrimiento de injertos vasculares o tras su liberación, es necesaria una gran prudencia al utilizarlos en pacientes con cualquier antecedente de AAH o de TIH. Todos los pacientes deben recibir información sobre la posibilidad de que se produzca una TIH.
Correspondencia: Leila Mureebe, MD, Division of Vascular Surgery, New York Presbyterian Hospital, Columbia University Medical Center, 5141 Broadway, Suite 3-169, Nueva York, NY 10034, EE.UU. Correo electrónico: leila.mureebe@duke.edu
Ann Vasc Surg. 2007;21:719-22 DOI: 10.1016/j.avsg.2007.07.016©Annals of Vascular Surgery Inc. Publicado en la red: 5 de noviembre de 2007