La presencia de un seroma tras la corrección abierta de un aneurisma aórtico abdominal se ha descrito en raras ocasiones. La mayoría de los casos descritos en la literatura hacen referencia al uso de implantes de politetrafluoroetileno. Presentamos el caso de un paciente con un gran seroma sintomático periaórtico 10 años después de la corrección convencional (abierta) de un aneurisma de aorta. La etiología de dichos seromas tiene una importancia significativa en la reparación aórtica endovascular.
El paciente era un hombre de 83 años que había sido sometido 10 años antes a una corrección de aneurisma aórtico abdominal (AAA) abierta programada. La intervención consistió en la colocación de un bypass aortobifemoral con prótesis de politetrafluoroetileno (PTFE) Goretex (W. L. Gore, Flagstaff, AZ) a través de una laparotomía media. El paciente había acudido un año antes para ser sometido a una tomografía computarizada (TC) del abdomen y la pelvis, solicitada por su médico de cabecera, preocupado por una posible hepatomegalia. Los resultados de la TC alertaban de un gran AAA, posiblemente con fisuración. El paciente fue derivado a urgencias.
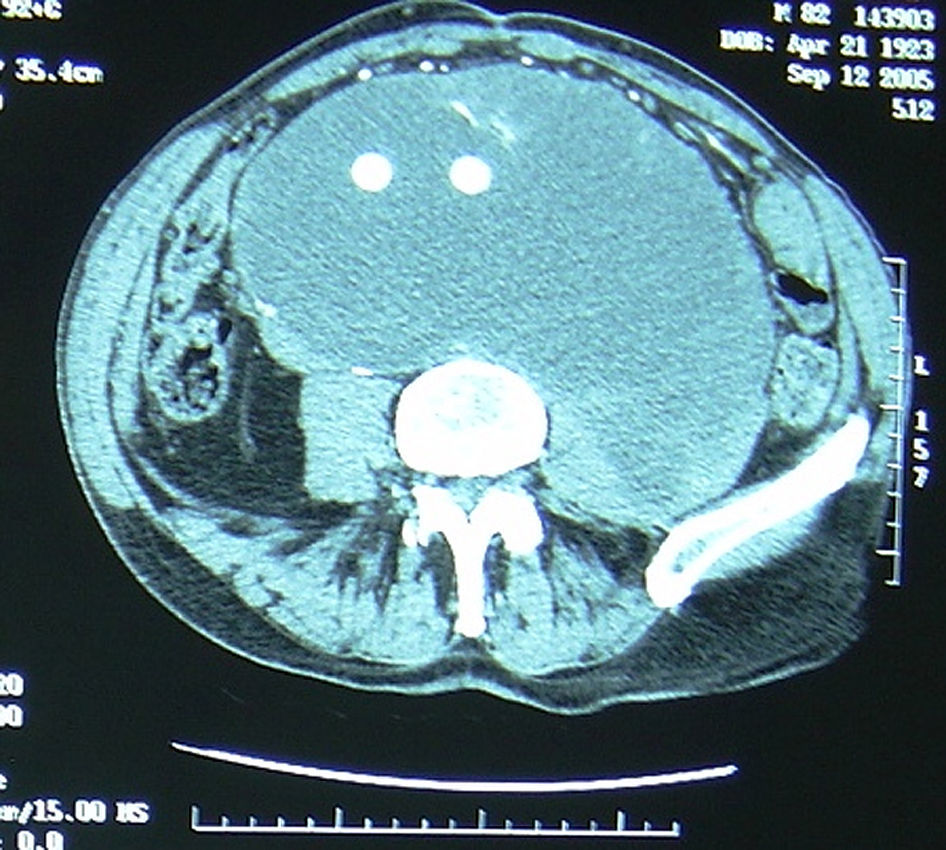
La TC mostraba un gran seroma afectando no sólo al cuerpo principal del bypass aortobifemoral, sino también a la extremidad, extendiéndose principalmente al abdomen izquierdo. El paciente no manifestaba síntomas, a pesar de que se apreció una masa abdominal pulsátil y palpable. El diámetro máximo de la masa era de 18 cm. El examen vascular no reveló datos destacables. El paciente estaba hemodinámicamente estable, con niveles normales de hemoglobina y hematocrito.
Se realizó una biopsia ecoguiada y aspiración de la masa retroperitoneal. Se obtuvo una pequeña cantidad de material sólido; durante el procedimiento también se aspiró un líquido amarillento a través de la aguja de biopsia. La masa tenía un aspecto parcialmente sólido y quístico, probablemente con múltiples tabicaciones. La muestra obtenida evidenció características inflamatorias crónicas, sin signos de hemorragia aguda. No se observaron indicios de neoplasia o procesos infecciosos. Se obtuvo un material fibrinoso y acelular, con áreas adyacentes de tejido fibroso y leve inflamación focal crónica. Todos los cultivos fueron negativos.
Se optó entonces por seguir al paciente de forma conservadora mediante TC repetidas. A los 6 meses la TC mostró un aumento de la masa, que alcanzó los 22 cm de diámetro máximo, pero sin indicios de extravasación de contraste. Seis meses después, el paciente describió nuevos síntomas, como disnea, náuseas, reflujo gástrico y cansancio generalizado, todo ello había empeorado en los 2 meses anteriores. La repetición de la TC mostró una masa de 28 cm, de nuevo sin extravasación (fig. 1). Se sospechó que los síntomas eran secundarios a la presión extrínseca en varias estructuras abdominales del saco lleno de líquido.
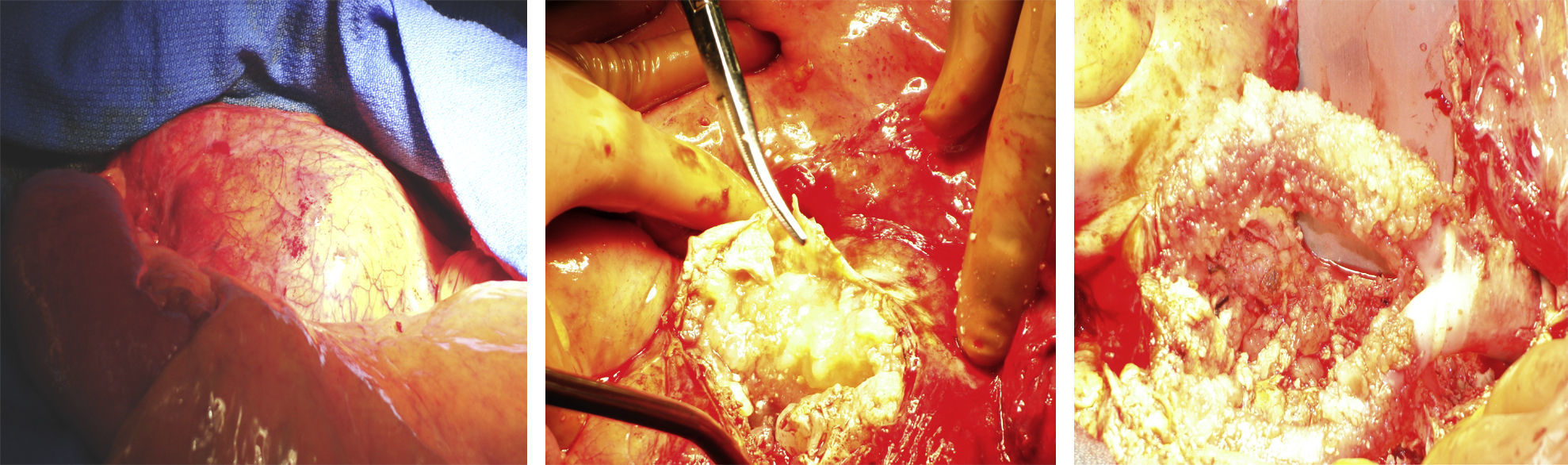
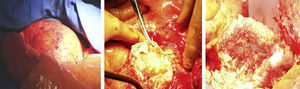
Se realizó una laparotomía exploratoria, apreciándose fácilmente en el retroperitoneo el saco del aneurisma agrandado (fig. 2). El saco estaba cubierto por una capa ligeramente gelatinosa y contenía líquido seroso (fig. 2). No se observó ningún hematoma ni hemorragia en el saco del aneurisma.
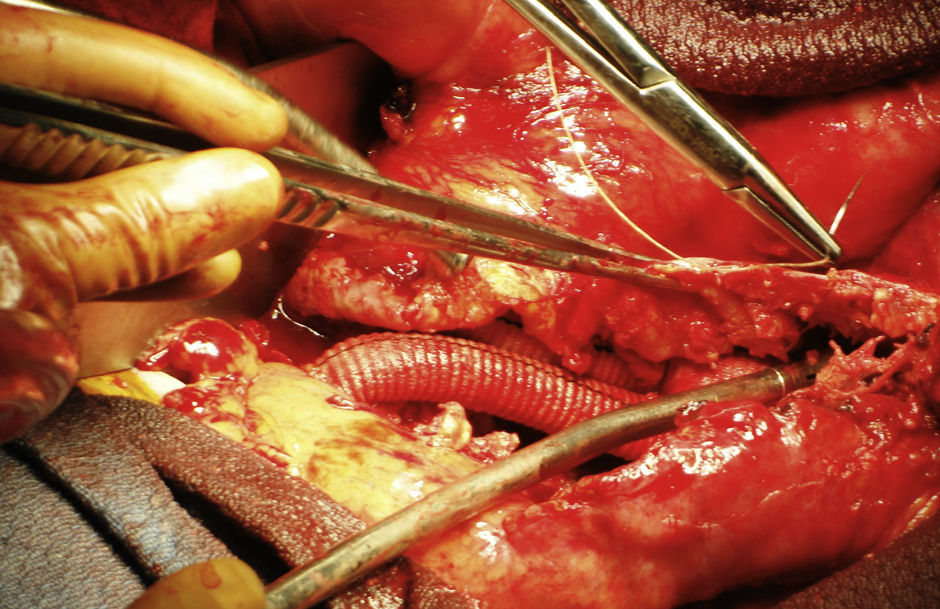
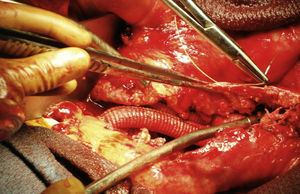
El implante de PTFE estaba intacto, recubierto por una sustancia viscosa de aspecto gelatinoso (fig. 2). El material se evacuó y se extrajo el implante de PTFE, que fue sustituido por una prótesis Hemashield Platinum (Dacron) de Boston Scientific (Watertown, MA) (fig. 3). Se resecó el saco sobrante y se suturó alrededor del implante.
Los cultivos del líquido, el recubrimiento gelatinoso y el material del implante extirpado fueron negativos. Los síntomas del paciente se resolvieron y recibió el alta hospitalaria a los 6 días de la intervención. Dos semanas después, el paciente volvió a ingresar por un íleo intestinal, que se resolvió con tratamiento conservador. Después de 24 meses, el paciente sigue asintomático. La TC de seguimiento mostró un pequeño seroma recurrente de aproximadamente 10 cm.
DiscusiónEs raro que se produzca el aumento del saco tras una corrección abierta de AAA sin infección1,2. Se han descrito seromas periimplantes asociados a una gran variedad de intervenciones vasculares1-4. Evidentemente, los seromas de implantes profundos se producen con mucha menos frecuencia que en los colocados de forma más superficial5.
No se han dilucidado las causas exactas de la formación de seromas periimplantes. Se han sugerido 4 posibles mecanismos. El primero es una infección leve, con formación de una biopelícula y un seroma reactivo. Esto suele observarse en infecciones inocuas, años después de la colocación del injerto. La segunda etiología posible es una reacción inmunitaria frente al material implantado4. Al parecer existe una elevada incidencia de seroma en pacientes con implantes de Dacron e implantes de PTFE. La resolución del seroma se ha logrado al sustituir un implante de Dacron por otro de PTFE y viceversa, lo que indica una tolerancia específica del paciente a determinados materiales4-6. La tercera causa posible está relacionada con la extravasación de un ultrafiltrado seroso a través de la pared del injerto. Esto se ha observado con implantes de PTFE in vitro y en situaciones clínicas1-5. La última teoría es que el seroma se forma como consecuencia del aumento de la activación de la cascada fibrinolítica, con una colección de líquido proteináceo periprotésico que aumenta la atracción de líquido a través de la membrana de PTFE2.
Risberg et al2 describieron la hiperfibrinolisis como la hipótesis más atractiva. La presencia de hemorragia, coagulación y licuefacción repetidas podría explicar el crecimiento continuado del saco, pero no se ha dilucidado por completo el origen de la actividad fibrinolítica2.
Varios autores han descrito recientemente seromas, aumento del tamaño del saco del aneurisma, y endotensión sin indicios de endofiltración asociados a los injertos y endoprótesis de PTFE1,2,7-13 (W. L. Gore, comunicación personal, noviembre de 2004). El aumento del saco del aneurisma sin endofiltración no es un proceso benigno. La presurización recurrente o persistente del saco del AAA puede acabar provocando su rotura13. No se ha definido el tratamiento para esta situación.
Thoo et al13 describieron el aumento sintomático del saco aórtico tras una corrección abierta con implantes de PTFE en 5 de 256 pacientes (2,3%) y la rotura en 2 de los 256 (0,4%). Sin embargo, desconocían la incidencia de aumento asintomático del saco. Demostraron que el tratamiento conservador, solamente con observación, es razonable en pacientes seleccionados.
Williams1 postuló que el líquido seroso alrededor del implante era un ultrafiltrado procedente del mismo. También notificó que la presencia o ausencia de células inflamatorias agudas en el líquido periimplante podría predecir qué pacientes requerirían tratamiento quirúrgico y la resección de la extirpación del implante.
Entre las opciones terapéuticas para los seromas periprotésicos destacan la observación simple, el drenaje, la aspiración del líquido, la imbricación del saco mediante suturas, y la sustitución del implante. Otra opción para el tratamiento del aumento del saco del aneurisma sin endofiltración es la fenestración laparoscópica o abierta del aneurisma9. Todos los procedimientos mencionados pueden asociarse a comorbilidad significativa9. La conversión tras una reparación aórtica endovascular se asocia a una mortalidad perioperatoria del 20-30%14.
En resumen, no se conoce bien la génesis de un seroma tras una corrección abierta de AAA o tras una reparación aórtica endovascular, y su tratamiento tampoco está bien definido. Deben realizarse estudios adicionales que permitan aumentar el conocimiento de este proceso y definir su tratamiento más eficaz, en particular en una era con un número creciente de reparaciones aórticas endovasculares.