Los dispositivos mecánicos de soporte circulatorio (DMSC) suponen actualmente una opción terapéutica fundamental para el manejo de los pacientes con fallo cardiaco grave refractario a fármacos, ya que permiten sostener artificialmente la circulación, normalizando la distribución de oxígeno y nutrientes a los tejidos, hasta que se produzca la recuperación de la función miocárdica o, en su defecto, hasta que se pueda realizar un trasplante cardiaco.
De todos los DMSC, el más empleado actualmente en la edad pediátrica es el ECMO (oxigenación por membrana extracorpórea)1,2, dispositivo que exige la canulación vascular del paciente y que ofrece soporte cardiorrespiratorio durante cortos periodos (2–3 semanas). Por otro lado, y aunque la experiencia en pediatría es más limitada, los dispositivos de asistencia ventricular (VAD) exigen la canulación de las cavidades cardiacas y permiten soportar la circulación durante periodos mucho más prolongados (meses), lo que es especialmente importante cuando la probabilidad de recuperación miocárdica es escasa, tardía o nula y, por tanto, la posibilidad de precisar un trasplante es elevada3–6.
Puntos clave
Los dispositivos de asistencia ventricular (VAD) permiten sostener artificialmente la circulación de pacientes en situación de insuficiencia cardiaca grave refractaria a fármacos, hasta que se produzca la recuperación de la función miocárdica o, en su defecto, hasta que se pueda realizar un trasplante cardiaco.
Para su funcionamiento se requiere la canulación directa de las cavidades cardiacas y de los grandes vasos arteriales (arteria aorta y/o arteria pulmonar) del paciente, permitiendo soportar a uno o a los 2 ventrículos.
Los VAD de corta duración ofrecen tratamientos de hasta 2–3 semanas de duración y se emplean habitualmente como terapia puente a recuperación, en pacientes con disfunción ventricular grave postoperatoria.
Los VAD de larga duración permiten tratamientos de meses de duración y se emplean fundamentalmente como terapia puente a trasplante, en pacientes portadores de miocardiopatías, especialmente la dilatada, o de cardiopatías congénitas no subsidiarias de cirugía.
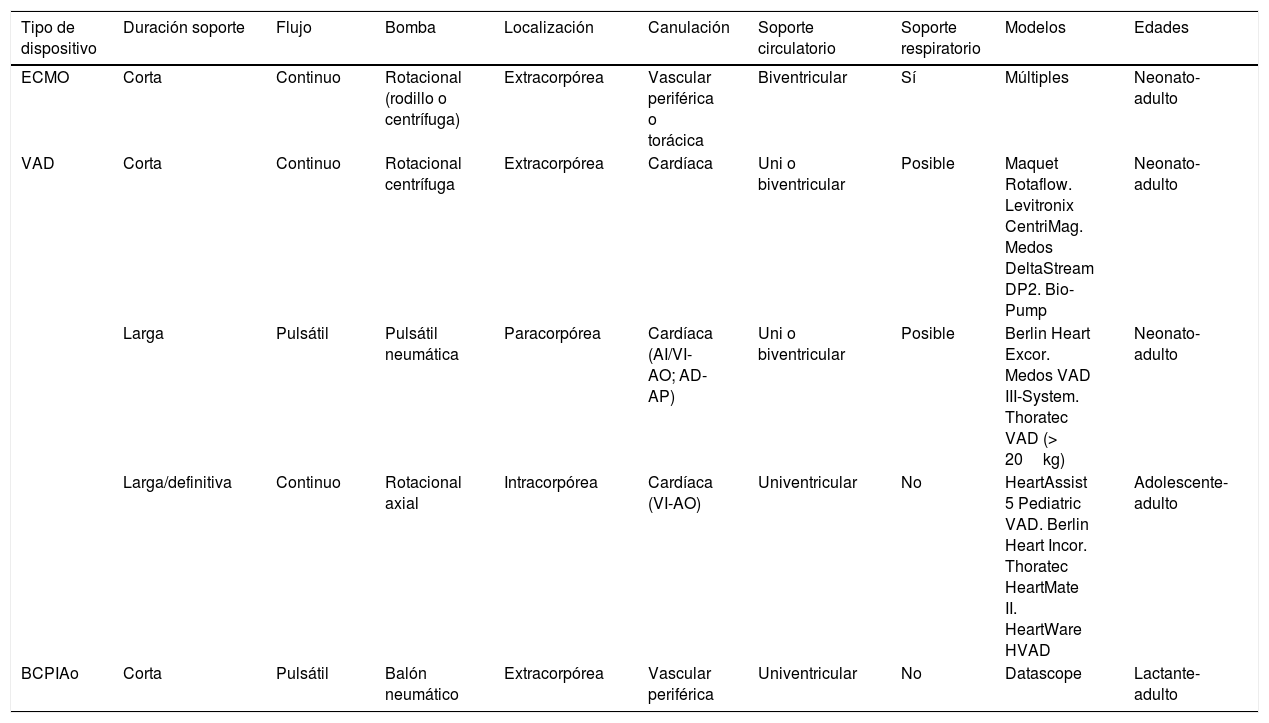
En la tabla 1 se clasifican los principales DMSC de utilidad en la edad pediátrica, atendiendo a varias de sus características más fundamentales. Conviene precisar que se denominan VAD, en sentido estricto, a aquellos DMSC que permiten la descarga directa de uno o ambos ventrículos, lo cual exige la canulación de las cavidades cardiacas, independientemente de que el flujo generado sea continuo o pulsátil. También conviene aclarar que, aunque clásicamente sólo los dispositivos tipo ECMO ofrecían soporte circulatorio y respiratorio, actualmente es posible intercalar un oxigenador en los circuitos de diferentes VAD, pudiendo, por tanto, soportar eficazmente a pacientes con insuficiencia respiratoria grave asociada al fallo circulatorio.
Clasificación de los principales dispositivos de soporte circulatorio mecánico de utilidad en el paciente pediátrico
| Tipo de dispositivo | Duración soporte | Flujo | Bomba | Localización | Canulación | Soporte circulatorio | Soporte respiratorio | Modelos | Edades |
|---|---|---|---|---|---|---|---|---|---|
| ECMO | Corta | Continuo | Rotacional (rodillo o centrífuga) | Extracorpórea | Vascular periférica o torácica | Biventricular | Sí | Múltiples | Neonato-adulto |
| VAD | Corta | Continuo | Rotacional centrífuga | Extracorpórea | Cardíaca | Uni o biventricular | Posible | Maquet Rotaflow. Levitronix CentriMag. Medos DeltaStream DP2. Bio-Pump | Neonato-adulto |
| Larga | Pulsátil | Pulsátil neumática | Paracorpórea | Cardíaca (AI/VI-AO; AD-AP) | Uni o biventricular | Posible | Berlin Heart Excor. Medos VAD III-System. Thoratec VAD (> 20kg) | Neonato-adulto | |
| Larga/definitiva | Continuo | Rotacional axial | Intracorpórea | Cardíaca (VI-AO) | Univentricular | No | HeartAssist 5 Pediatric VAD. Berlin Heart Incor. Thoratec HeartMate II. HeartWare HVAD | Adolescente-adulto | |
| BCPIAo | Corta | Pulsátil | Balón neumático | Extracorpórea | Vascular periférica | Univentricular | No | Datascope | Lactante-adulto |
AD: aurícula derecha; AI: aurícula izquierda; AO: arteria aorta; AP: arteria pulmonar; BCPIAo: balón de contrapulsación intraaórtico; ECMO: oxigenación con membrana extracorpórea; soporte de corta duración: 2–3 semanas; soporte de larga duración: meses-años; VAD: dispositivo de asistencia ventricular; VI: ventrículo izquierdo.
A la hora de establecer la indicación de tratamiento con un VAD, y con vistas a seleccionar el más adecuado, es fundamental tener en cuenta los objetivos terapéuticos que se persiguen. A continuación se resumen los más importantes:
- 1.
Puente a recuperación (bridge to recovery). En los pacientes con altas probabilidades de recuperar rápidamente la función ventricular (fallo cardiaco poscardiotomía, miocarditis aguda fulminante, rechazo agudo del injerto en el paciente trasplantado, cardiotoxicidad farmacológica o séptica, o traumatismo cardiaco), los DMSC de elección son los de corta duración y flujo continuo (ECMO o VAD con bomba centrífuga). Sin embargo, si las posibilidades de recuperación son escasas y/o tardías (miocardiopatía dilatada idiopática, miocarditis crónica o miocardiopatía inflamatoria/posviral), los dispositivos de elección son los VAD de larga duración, destacando fundamentalmente los pulsátiles (Berlin Heart EXCOR®) en la edad pediátrica. Si, finalmente, se produce la recuperación cardiaca, se explanta el dispositivo. En caso contrario, se puede plantear implantar un dispositivo de larga duración y/o realizar un trasplante cardiaco.
- 2.
Puente a trasplante (bridge to transplantation). El soporte circulatorio de pacientes que precisan un trasplante cardiaco y que son portadores de miocardiopatías o de cardiopatías congénitas sin opción quirúrgica o en situación de fallo cardiaco irreversible supone actualmente la indicación más frecuente de tratamiento con VAD en el paciente pediátrico. La decisión de tratar a estos pacientes con dispositivos de corta o larga duración dependerá de diferentes factores, siendo el fundamental el tiempo medio de espera en lista de trasplante, lo que se ve muy influido por la tasa de donantes pediátricos de cada país en particular y por la edad, el peso y el grupo sanguíneo del paciente. En este sentido, cuando el tiempo estimado de espera para trasplante sea inferior a 2 semanas, estarán indicados los DMSC de corta duración (ECMO o VAD tipo bomba centrífuga). Sin embargo, cuando éste sea superior a 2–3 semanas, como ocurre en nuestro país, los dispositivos de elección son los VAD de larga duración, preferiblemente pulsátiles, como el Berlin Heart EXCOR®7.
- 3.
Puente a decisión (bridge to decission). Con relativa frecuencia, los pacientes en situación de fallo cardiaco grave pueden asociar complicaciones graves, como lesiones cerebrales hipóxico-isquémicas o síndrome de disfunción multiorgánica, sin que se pueda precisar de antemano la reversibilidad de las mismas. En estos casos, el tratamiento con DMSC de corta duración, al mejorar la circulación, ofrece la posibilidad de, en el plazo de días, evaluar si existe o no recuperación de los órganos dañados. De esta manera, permiten tomar la decisión de implantar otros dispositivos de larga duración, como puente a recuperación o trasplante, en el caso de recuperación del paciente, o de limitar el esfuerzo terapéutico, en el caso contrario.
- 4.
Terapia definitiva (bridge to destination therapy). Aunque este objetivo terapéutico es excepcional en el paciente pediátrico, podría plantearse en adolescentes en los que el trasplante cardiaco no esté indicado o se rechace por parte del paciente o la familia. En este caso, los dispositivos de elección serían los implantables intracorpóreos de larga duración, tipo flujo axial o tipo corazón artificial total.
Los VAD de corta duración más empleados actualmente en el paciente pediátrico son: Maquet Rotaflow® (Maquet Cardiopulmonay AG, Hirrlingen, Alemania) y Levitronix CentriMag® (Levitronix LLC, Zurich, Suiza).
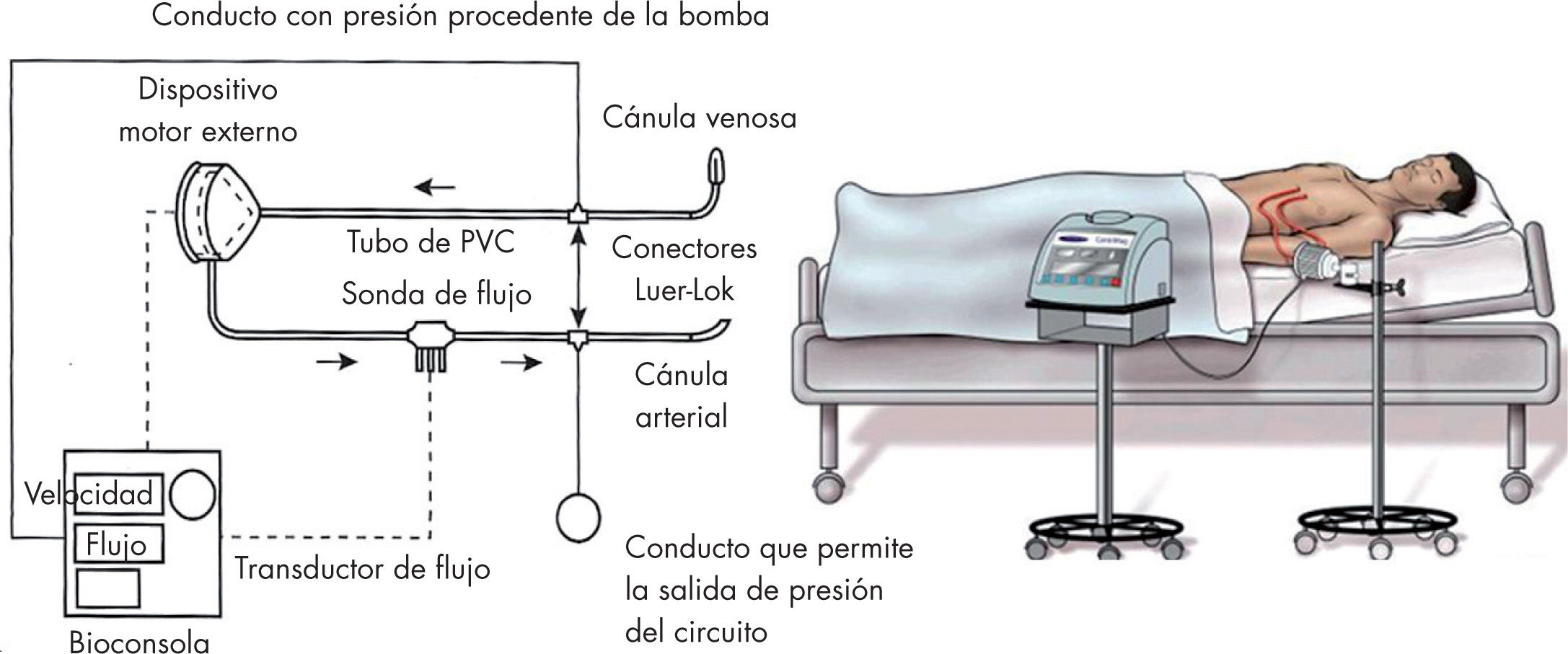
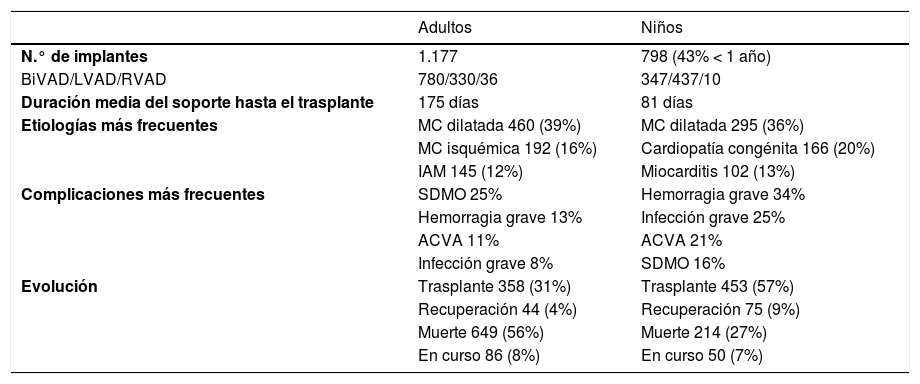
Esquemáticamente, el circuito de un VAD de corta duración consta de los siguientes componentes:
- –
Cánulas: para soportar el ventrículo izquierdo (VI) se canulan el ápex del VI (excepcionalmente la aurícula izquierda) y la aorta ascendente. Para soportar el ventrículo derecho (VD) se canulan la aurícula derecha (ocasionalmente el ápex del VD) y el tronco de la arteria pulmonar.
- –
Circuito extracorpóreo: es habitualmente sencillo (fig. 1), sin reservorio de sangre ni oxigenador (normalmente), y con pocos o ningún sensor de presión. Dispone de un sensor de flujo y de una bomba rotacional de tipo centrífuga. No existen válvulas y el flujo sanguíneo generado es continuo.
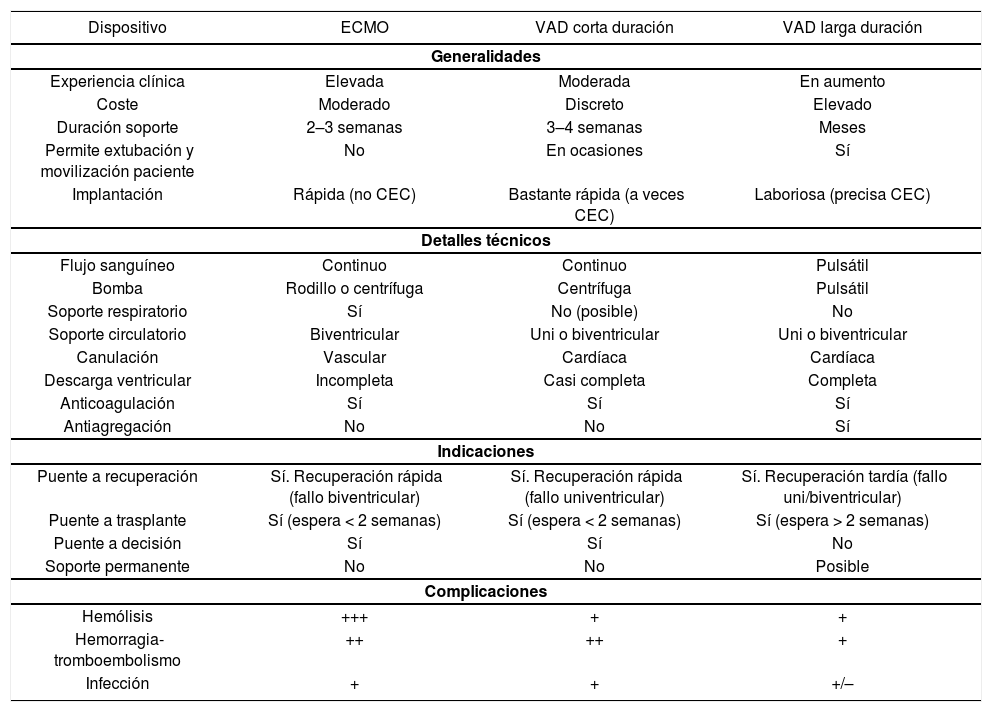
En la tabla 2 se comparan los aspectos más fundamentales de los tres DMSC de uso más extendido en la edad pediátrica8.
Comparación de los principales dispositivos mecánicos de soporte circulatorio de uso en la edad pediátrica.
| Dispositivo | ECMO | VAD corta duración | VAD larga duración |
|---|---|---|---|
| Generalidades | |||
| Experiencia clínica | Elevada | Moderada | En aumento |
| Coste | Moderado | Discreto | Elevado |
| Duración soporte | 2–3 semanas | 3–4 semanas | Meses |
| Permite extubación y movilización paciente | No | En ocasiones | Sí |
| Implantación | Rápida (no CEC) | Bastante rápida (a veces CEC) | Laboriosa (precisa CEC) |
| Detalles técnicos | |||
| Flujo sanguíneo | Continuo | Continuo | Pulsátil |
| Bomba | Rodillo o centrífuga | Centrífuga | Pulsátil |
| Soporte respiratorio | Sí | No (posible) | No |
| Soporte circulatorio | Biventricular | Uni o biventricular | Uni o biventricular |
| Canulación | Vascular | Cardíaca | Cardíaca |
| Descarga ventricular | Incompleta | Casi completa | Completa |
| Anticoagulación | Sí | Sí | Sí |
| Antiagregación | No | No | Sí |
| Indicaciones | |||
| Puente a recuperación | Sí. Recuperación rápida (fallo biventricular) | Sí. Recuperación rápida (fallo univentricular) | Sí. Recuperación tardía (fallo uni/biventricular) |
| Puente a trasplante | Sí (espera < 2 semanas) | Sí (espera < 2 semanas) | Sí (espera > 2 semanas) |
| Puente a decisión | Sí | Sí | No |
| Soporte permanente | No | No | Posible |
| Complicaciones | |||
| Hemólisis | +++ | + | + |
| Hemorragia-tromboembolismo | ++ | ++ | + |
| Infección | + | + | +/– |
CEC: circulación extracorpórea; ECMO: oxigenación con membrana extracorpórea; VAD: dispositivos de asistencia ventricular.
Las ventajas fundamentales de los VAD de corta duración con bomba centrífuga son:
- –
Permiten soporte uni o biventricular, con descarga directa de los ventrículos, lo que aumenta las posibilidades de recuperación de la función miocárdica9.
- –
La tasa de hemólisis generada por la bomba es reducida10.
- –
Los circuitos son cortos y sencillos técnicamente, lo que justifica el menor volumen de purga, la mayor facilidad en su manejo y, lo que es más importante, el bajo riesgo de coagulación del circuito, especialmente los realizados con modernos materiales biocompatibles recubiertos de heparina (BioLine®, Carmeda®). Por ello, las dosis de anticoagulación necesarias son más reducidas, existiendo menos riesgo de complicaciones hemorrágicas y tromboembólicas11,12.
- –
En caso de necesitar soporte respiratorio, es posible intercalar un oxigenador en el circuito.
Los principales inconvenientes de los VAD con bomba centrífuga son:
- –
Permiten soporte sólo de corta duración (no más de 3–4 semanas).
- –
El flujo sanguíneo generado por la bomba no es fijo a lo largo del tiempo, ya que depende tanto de características propias del circuito (tamaño, localización y permeabilidad de las cánulas), como del paciente (fundamentalmente estado de volemia y tono vascular).
- –
La canulación requiere anestesia general y esternotomía media, por lo que, en comparación con la ECMO, es más lenta y más compleja.
Las indicaciones para el empleo de los VAD de corta duración son:
- –
Indicación fundamental: disfunción ventricular postoperatoria. La indicación fundamental de estos dispositivos es la disfunción sistólica grave del ventrículo izquierdo, que se presenta en el postoperatorio de pacientes con cardiopatías congénitas (especialmente, cirugía tipo Norwood, transposición de grandes arterias, arteria coronaria anómala [ALCAPA] y otras cirugías complejas sobre la raíz aórtica), utilizándose como terapia puente a recuperación de la función miocárdica, habiéndose descrito supervivencias de 50–70%13–15.
- –
Otras indicaciones: ocasionalmente, se han empleado como terapia puente a recuperación o trasplante, en pacientes con miocarditis aguda fulminante, miocardiopatía dilatada, disfunción aguda del injerto en pacientes trasplantados o hipertensión pulmonar grave y, excepcionalmente, en situaciones de fallo cardiaco agudo secundario a sepsis, traumatismo torácico o intoxicación por cardiotóxicos16,17. También pueden ser de utilidad como terapia puente a decisión18.
Las contraindicaciones más importantes para su empleo son:
- –
Lesión neurológica o fallo multiorgánico (no renal-hepático) grave e irreversible.
- –
Coagulopatía o infección grave y no controlada.
- –
Situación anatómica o circulatoria incompatible (insuficiencia aórtica moderada-grave).
La oferta de VAD de larga duración de aplicación en la edad pediátrica es relativamente escasa, reduciéndose casi en exclusiva al grupo de los paracorpóreos pulsátiles, entre los que destaca el dispositivo Berlin Heart EXCOR® (Berlin Heart AG, Berlín, Alemania), por ser con el que, hoy en día, se tiene más experiencia en el ámbito mundial, habiéndose empleado en f 1.200 pacientes adultos y 800 pediátricos (véase la tabla 3)19–21. Este dispositivo permite realizar soporte uni o biventricular durante largos periodos a pacientes pediátricos de todas las edades, pues existen cánulas y bombas (10, 25, 30, 50, 60, 80 ml) de diferentes tamaños.
Resumen de la experiencia mundial con el dispositivo Berlin Heart Excor®.
| Adultos | Niños | |
|---|---|---|
| N.° de implantes | 1.177 | 798 (43% < 1 año) |
| BiVAD/LVAD/RVAD | 780/330/36 | 347/437/10 |
| Duración media del soporte hasta el trasplante | 175 días | 81 días |
| Etiologías más frecuentes | MC dilatada 460 (39%) | MC dilatada 295 (36%) |
| MC isquémica 192 (16%) | Cardiopatía congénita 166 (20%) | |
| IAM 145 (12%) | Miocarditis 102 (13%) | |
| Complicaciones más frecuentes | SDMO 25% | Hemorragia grave 34% |
| Hemorragia grave 13% | Infección grave 25% | |
| ACVA 11% | ACVA 21% | |
| Infección grave 8% | SDMO 16% | |
| Evolución | Trasplante 358 (31%) | Trasplante 453 (57%) |
| Recuperación 44 (4%) | Recuperación 75 (9%) | |
| Muerte 649 (56%) | Muerte 214 (27%) | |
| En curso 86 (8%) | En curso 50 (7%) |
ACVA: accidente cerebrovascular; IAM: infarto agudo de miocardio; MC: miocardiopatía; SDMO: síndrome de disfunción multiorgánica.
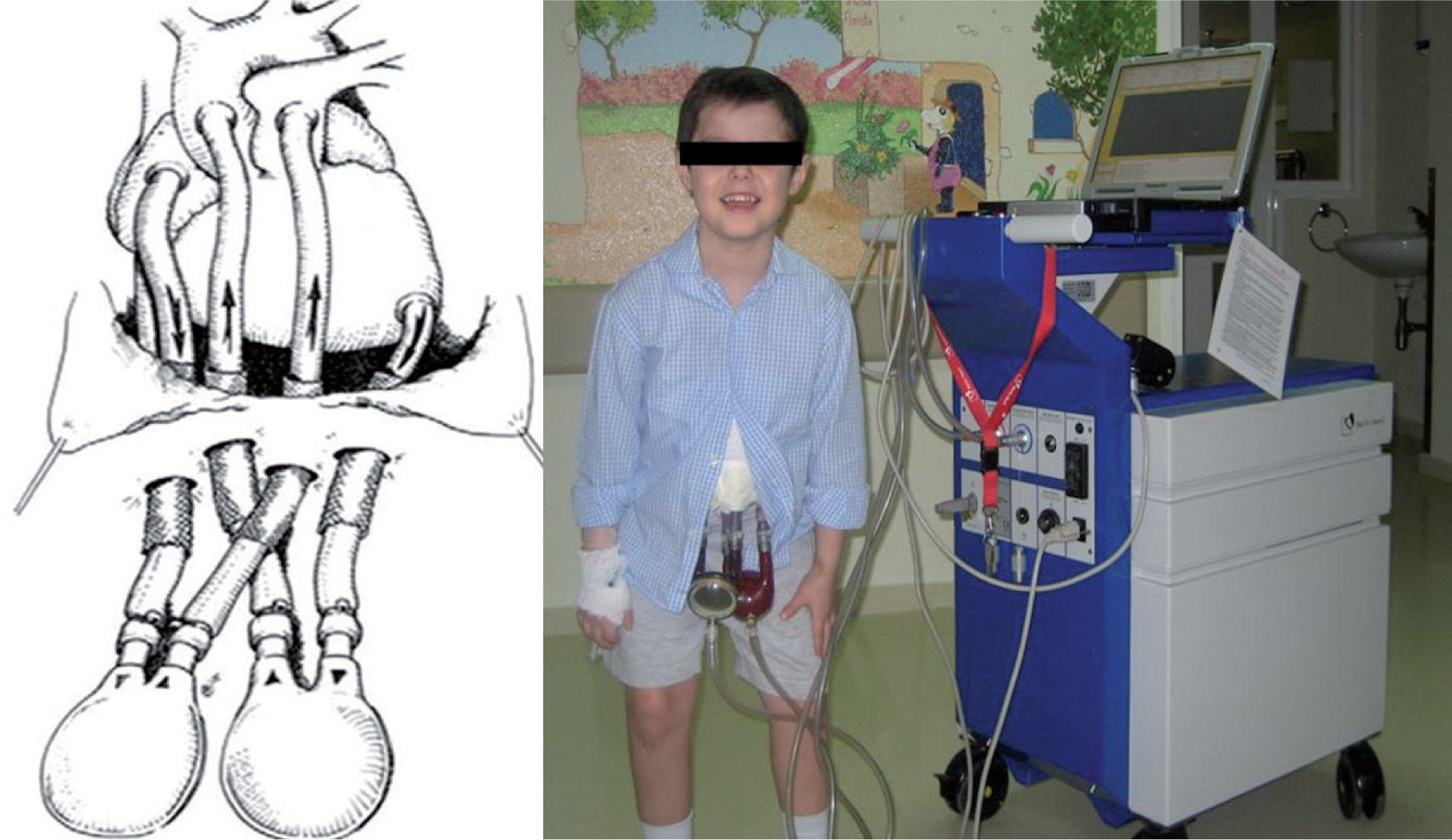
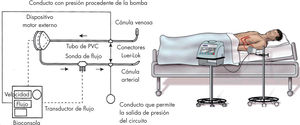
Esquemáticamente, consta de los siguientes componentes (fig. 2):
- –
Cánulas: se canula el ápex del VI y la aorta ascendente, en caso de asistencia ventricular izquierda (L-VAD), la aurícula derecha y el tronco de la arteria pulmonar, en caso de asistencia ventricular derecha (R-VAD), o todo lo anterior, en caso de asistencia biventricular (Bi-VAD).
- –
Bombas: de localización paracorpórea, constan de una cámara sanguínea y de otra aérea, separadas ambas por una membrana rígida e impermeable. Disponen de válvulas en los conectores de entrada y salida de sangre, para que el flujo sanguíneo sea unidireccional. La cámara sanguínea se conecta al paciente a través de las cánulas. La cámara aérea se conecta a los compresores de aire a través de unos latiguillos. El llenado y el vaciado de la cámara aérea de la bomba (sistema motriz neumático) conllevan, a su vez, y de manera opuesta, el llenado y vaciado de la cámara sanguínea, generándose un flujo sanguíneo pulsátil. De esta manera, la sangre se extrae directamente de las cavidades cardiacas y, tras ser impulsada por la bomba neumática, se devuelve a las arterias principales del paciente.
- –
Consola: en la que residen los compresores de aire y la computadora que permite programar los parámetros de funcionamiento del dispositivo.
Las principales ventajas son:
- –
Permiten soporte uni o biventricular, de larga duración (meses-años), en niños de cualquier edad.
- –
Presentan menos riesgo de complicaciones en forma de hemólisis, eventos trombótico-hemorrágicos y de infección que los dispositivos de corta duración.
- –
Consiguen una rápida estabilización hemodinámica, lo que permite la extubación, movilización y nutrición enteral precoces, acelerando la recuperación de los pacientes.
Los principales inconvenientes son:
- –
Mayor complejidad en su implantación, requiriéndose un equipo multidisciplinar especializado, anestesia general y, habitualmente, circulación extracorpórea.
- –
Mayor coste del dispositivo a corto plazo.
- –
Utilidad limitada en pacientes con patología respiratoria grave asociada, aunque es posible intercalar transitoriamente un oxigenador en el circuito para ofrecer también soporte respiratorio.
Las indicaciones para el empleo de VAD de larga duración son:
- –
Indicación fundamental: soporte circulatorio como puente a trasplante cardiaco. Se suelen indicar en pacientes con miocardiopatías, especialmente la miocardiopatía dilatada, o con cardiopatías congénitas no subsidiarias de cirugía. Estudios recientes demuestran que la probabilidad de sobrevivir hasta el trasplante es mayor en pacientes soportados con VAD pulsátiles (86%) que con ECMO (57%), especialmente en el grupo de lactantes pequeños (90%)22–24. Además, la supervivencia a largo plazo tras el trasplante, en los pacientes que requirieron tratamiento con VAD, no difiere significativamente de los pacientes trasplantados sin soporte circulatorio previo25.
- –
Otras indicaciones: soporte circulatorio como puente a recuperación en pacientes en los que la probabilidad de recuperación sea tardía y/o escasa: miocarditis agudas (no fulminantes) o crónicas, las miocardiopatías (especialmente la dilatada) y las disfunciones ventriculares graves poscardiotomía o postrasplante cardiaco, si bien este último grupo suele soportarse inicialmente con dispositivos de corta duración.
Las contraindicaciones son muy similares a las descritas para los VAD de corta duración.