La ultrasonografía cerebral convencional (USC) es el instrumento más utilizado para el diagnóstico y el cribado de anomalías en el cerebro del neonato. Se puede realizarla a pie de cuna, lo que la convierte en una técnica idónea para pacientes críticos que no pueden ser trasladados de la unidad de cuidados intensivos.
La técnica Doppler con imagen de flujo en color (CDFI) y más recientemente la energía Doppler color han permitido el estudio de diversos aspectos del cerebro neonatal1-3.
Puntos clave
La ultrasonografía cerebral (USC) es la técnica más usada para el diagnostico y el cribado de anomalías en el cerebro del neonato y lactante. La técnica Doppler con imagen de flujo en color (CDFI) ha permitido el estudio de diversos aspectos del cerebro neonatal.
El uso seriado de la USC y de técnicas de monitorización de la hemodinámica cerebral como el Doppler nos va a permitir un diagnóstico precoz de las lesiones en el prematuro y un adecuado seguimiento. Las lesiones cerebrales que en general se acompañan de déficits motores espásticos, con o sin alteraciones intelectuales, son la leucomalacia periventricular y el infarto hemorrágico periventricular, este último asociado en general a la hemorragia de matriz germinal/intraventricular severa.
En la EHI los indicadores de mal pronóstico por USC serían: persistencia de ventrículos virtuales más allá del primer día de vida, ecogenicidad gangliotalámica persistente, línea hipoecoica entre las áreas de ecogenicidad aumentada entre el tálamo y el núcleo lentiforme, traduciendo una lesión del brazo posterior de la cápsula interna y ecogenicidad patológica córtico-subcortical. Por medio de CDFI, índices de resistencia bajos (<0,55) y ondas de VFSC fluctuantes y/o dícrotas.
Los estudios de CDFI y de resonancia magnética con difusión son capaces de detectar precozmente un infarto isquémico. Con la USC se podrá visualizar entre 48 y 72h después del inicio de la sintomatología neurológica.
Deberemos usar equipos que permitan el uso de transductores multifrecuencia.
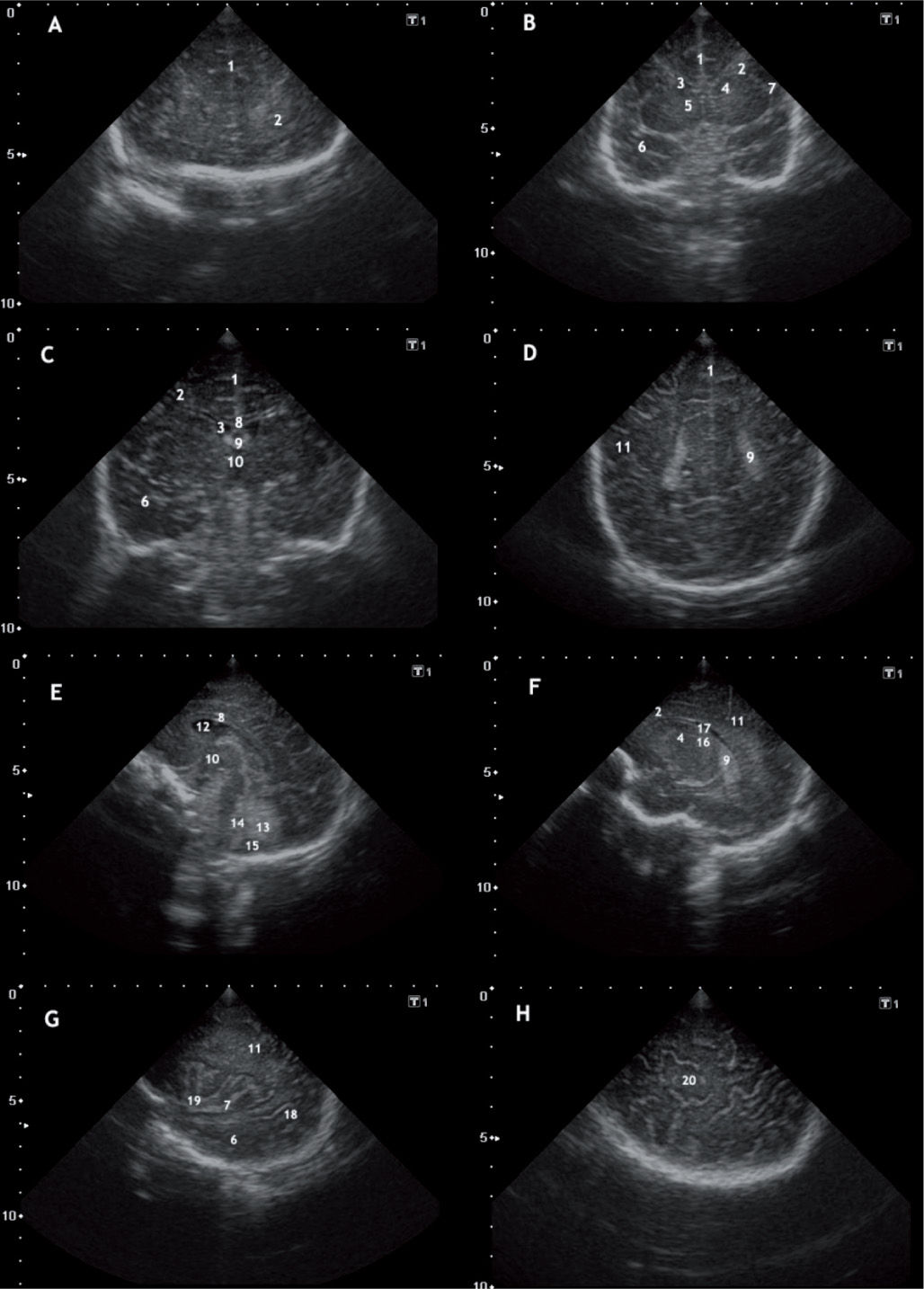
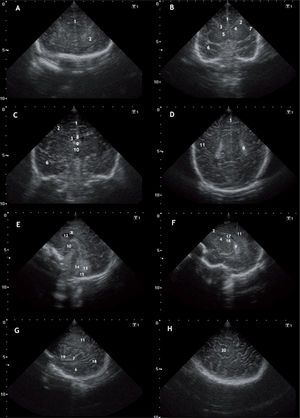
En general, utilizaremos la fontanela anterior como ventana acústica (fig. 1). El uso de ventanas acústicas adicionales (posterior, posterolateral y temporal) nos permite una mejor valoración del parénquima occipital, de las astas occipitales de los ventrículos laterales y de la fosa posterior2.
A) Corte coronal a nivel de lóbulos frontales. (1) Fisura interhemisférica. (2) Lóbulo frontal. B) Corte coronal. Cisura interhemisférica (1), lóbulo frontal (2), asta frontal del ventrículos laterales(3), núcleo caudado(4), ganglios basales (5), lóbulo temporal (6), cisura de Silvio (7). C) Corte coronal. Cisura interhemisférica (1), lóbulo frontal (2), asta frontal del ventrículos laterales(3), lóbulo temporal (6), cuerpo calloso (8), plexo coroideo (9), tercer ventrículo (10). D) Corte coronal. Cisura interhemisférica (1), lóbulo parietal (11), plexo coroideo (9). E) Corte sagital a nivel de la línea media. Cuerpo calloso (8), cavum septum pellucidum (12), tercer ventrículo (10), vermis cerebeloso (13), cuarto ventrículo (14), cisterna magna (15). F) Corte parasagital. Lóbulo frontal (2), núcleo caudado (4), plexo coroideo (9), lóbulo parietal (11), tálamo (16), ventrículo lateral (17). G) Corte parasagital. Lóbulo temporal (6), lóbulo parietal (11), lóbulo occipital (18), gyrus de la ínsula (7), arteria cerebral media ramificándose a nivel de la cisura de Silvio (19). F) Proyección parasagital tangencial, visualizándose la región córtico-subcortical.
Deberemos realizar un estudio completo y sistemático4:
- –
Valoración de las diferentes estructuras anatómicas.
- –
La maduración-surcación cerebral, ¿parece acorde a la edad gestacional?
- –
La corteza y la sustancia blanca, ¿están bien diferenciadas?
- –
Valoración de la ecogenicidad de la sustancia blanca periventricular y subcortical.
- –
Valoración de la ecogenicidad del tálamo y los núcleos de la base.
- –
Tamaño y morfología del sistema ventricular.
- –
Valoración del espacio subaracnoideo.
- –
Valoración de la línea media.
Las indicaciones de la neuroultrasonografía (USC) y del CDFI se resumen en la tabla 15.
Indicaciones de la neuroultrasonografía (USC) y del Doppler con imagen de flujo en color (CDFI)7.
| Sospecha de alteración/malformación del SNC en ecografía intrauterina |
| Sospecha o malformación del SNC: encefalocele, mielomeningocele etc. |
| Riesgo o sospecha de malformación vascular cerebral |
| Recién nacidos menores de 32 semanas de gestación o menores de 1.500g |
| Recién nacidos con malformaciones, rasgos dismórficos, alteraciones craneofaciales, angiomas |
| Parto traumático. Traumatismo posnatal |
| Encefalopatía hipóxico-isquémica o asfixia perinatal moderada-severa |
| Alteración neurológica clínica |
| Situaciones de hipoperfusión cerebral |
| Coagulopatía |
| Macrocefalia o crecimiento rápido del perímetro cefálico |
| Insuficiencia cardiaca de etiología no filiada |
| Crecimiento intrauterino retardado. Microcefalia |
| Riesgo o sospecha de infección perinatal |
| Sepsis |
| Alteración en el LCR: hemorrágico o alteración en el estudio neurobioquímico |
| Uso intraoperatorio o postoperatorio Implantación de catéter de derivación intraventricular, aperturas de quistes al sistema ventricular o al espacio subaracnoideo, drenaje de abscesos, resección de tumores, control de funcionamiento y complicaciones de derivación ventrículo peritoneal (impactación en parénquima cerebral, aislamiento de ventrículos, etc.) |
LCR: líquido cefalorraquídeo; SNC: sistema nervioso central.
Cerca del 80-85% de los recién nacidos con peso inferior a 1.500 sobreviven, oscilando la prevalencia de parálisis cerebral entre un 5 y un 15%1.
En general, se recomienda un estudio protocolizado en recién nacidos < 32 semanas de gestación y en < 1.500g que incluye los siguientes controles4,6:
- –
< 24h de vida.
- –
Tercer día de vida.
- –
Dos veces por semana durante las 2 primeras semanas de vida.
- –
Cada 1-2 semanas hasta el alta.
- –
Entre la semana 38-40 de edad corregida.
- –
Ante empeoramientos clínicos (sepsis, inestabilidad hemodinámica, NEC).
- –
De forma más frecuente, si los hallazgos lo requieren.
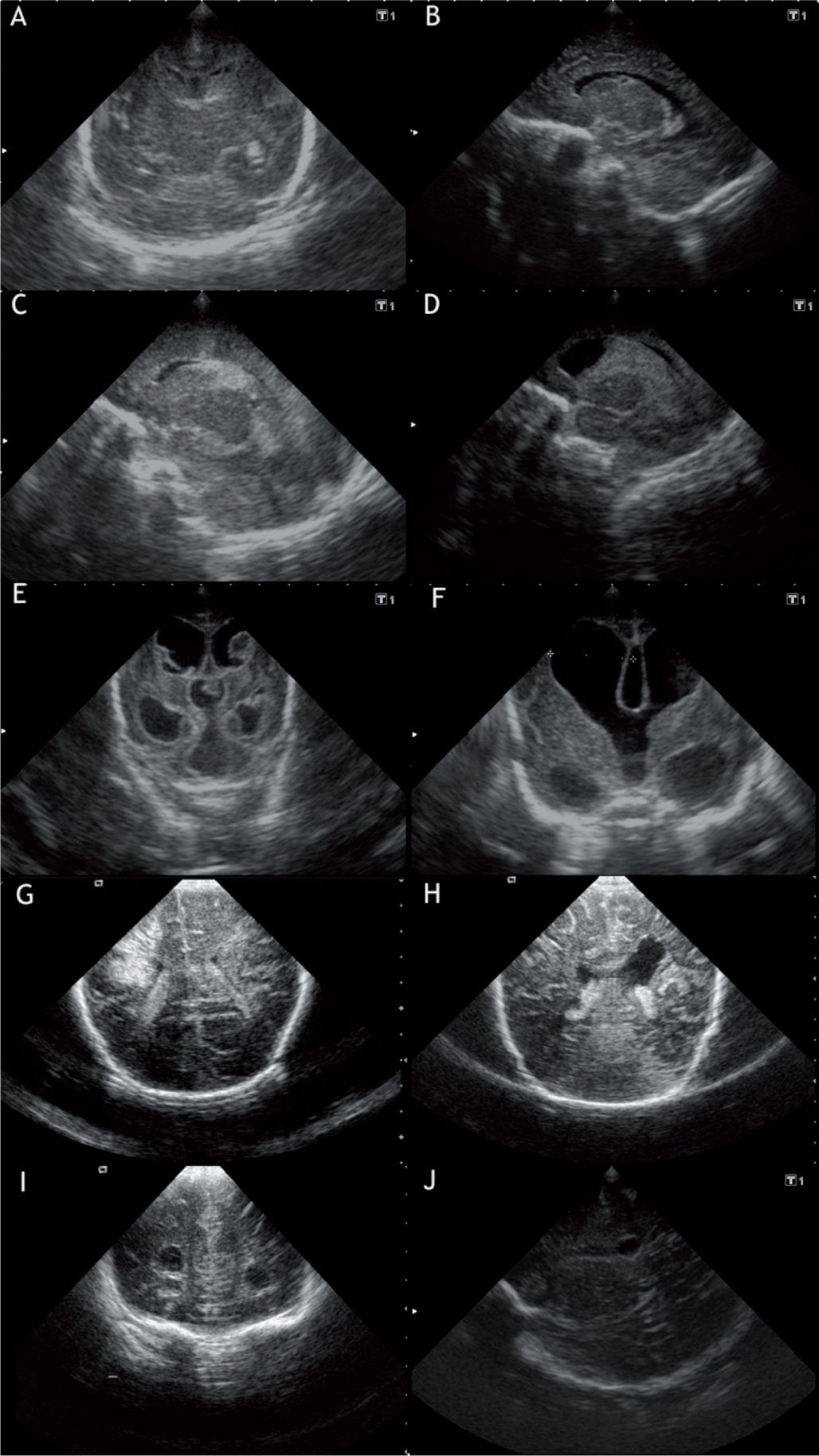
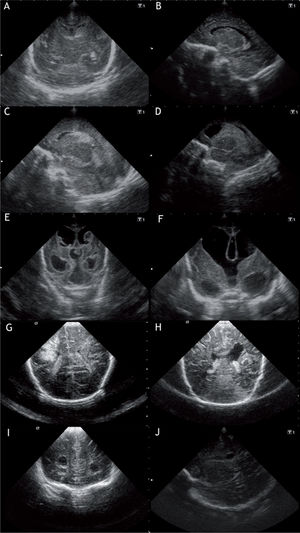
Las lesiones cerebrales que, en general, se acompañan de déficit motores espásticos, con o sin alteraciones intelectuales, son la leucomalacia periventricular (LPV) y el infarto hemorrágico periventricular (IHP)1,5,7 (fig. 2).
A) Corote sagital: hemorragia subependimaria derecha. B) Corte sagital, imagen anecoica en hendidura ganglio-talámica. Germinólisis evolutiva secundaria a hemorragia subependimaria. C) Corte parasagital, hemorragia subependimaria con componente intraventricular. D) Corte parasagital. HIV II-III. E) Corte coronal, HIV III con ventriculomegalia de ventrículos laterales, tercer y cuarto ventrículos. F) Corte coronal. Hidrocefalia post hemorrágica, medición del index ventricular. G) Corte coronal, infarto periventricular frontoparietal izquierdo. H) Corte coronal, infarto periventricular evolucionado abierto al ventrículo (cavidad porencefálica). I) Corte coronal, leucomalacia periventricular quística a nivel frontal. J) Corte sagital, leucomalacia periventricular parietal y subcortical.
La hemorragia de la matriz germinal-intraventricular (HMG/HIV) es la lesión cerebral más frecuente del recién nacido prematuro. La incidencia de esta afección entre los prematuros con peso al nacer menor de 1.500g es del 20-30%1.
En un 90% de los casos, la HMG/HIV en el recién nacido prematuro tiene su inicio en la matriz germinal subependimaria, en el núcleo caudado.
Según los hallazgos ecográficos, podemos clasificar la HMG/
- 1.
Grado 1: la hemorragia está localizada en la matriz germinal subependimaria.
- 2.
Grado 2: contenido de sangre intraventricular que ocupa menos del 50% del área intraventricular.
- 3.
Grado 3:
- –
3A: la sangre ocupa > 50% y distiende el ventrículo.
- –
3B: existe una sobredistensión importante de ventrículos laterales y en general de todo el sistema ventricular.
El IHP y la LPV son las 2 entidades de mayor importancia.
Infarto hemorrágico periventricularAproximadamente un 15% de los niños prematuros que presentan una HMG-HIV presentan además un IHP asociado. La USC muestra una imagen hiperecogénica y unilateral con forma triangular. Su localización más habitual es la región frontal o parietal y en los casos más graves puede extenderse hasta la región córtico-subcortical. Evolutivamente, observaremos una progresiva disminución de la ecogenicidad de la lesión, apareciendo áreas hipoecoicas que traducen lesiones destructivas quísticas que generalmente confluyen en un gran quiste que comunica con el ventrículo lateral o la cavidad porencefálica1,7.
Leucomalacia periventricularLa LPV constituye la necrosis de la sustancia blanca periventricular, dorsal y lateral a los ángulos externos de los ventrículos laterales.
Los hallazgos ultrasonográficos que traducen esta lesión son una hiperecogenicidad bilateral adyacente a los ángulos externos de los ventrículos laterales. Esta hiperecogenicidad puede persistir en el tiempo o aparecer en su interior lesiones anecoicas (LPV quística).
Es importante señalar que las hiperecogenicidades periventriculares persistentes (más de 15 días) deben considerarse formas de LPV.
Existen diferentes estadios de la LPV7,8:
- 1.
Grado 1: hiperecogenicidad periventricular que persiste más de 15 días y que, en general, produce un ensanchamiento ventricular.
- 2.
Grado 2: evolución quística localizada en el ángulo externo del ventrículo lateral.
- 3.
Grado 3: evolución quística que se extiende a las regiones periventriculares frontoparietales y/u occipital.
- 4.
Grado 4: Evolución quística que se extiende a región córtico-subcortical.
La prevalencia global de esta complicación en pacientes con antecedente de HMG/HIV (fundamentalmente las más cuantiosas) es del 35%.
La mayoría de las ventriculomegalias post hemorrágicas (VPH) son comunicantes y la obstrucción ocurre en las cisternas de la fosa posterior y en las vellosidades aracnoideas. Sin embargo, la obstrucción puede estar localizada en el acueducto de Silvio o a la salida del cuarto ventrículo (Luschka y Magendie). Se puede estudiar la circulación del líquido cefalorraquídeo (LCR) por medio de Doppler color para localizar el punto de obstrucción.
Los signos ecográficos en los que nos basamos para evaluar el incremento del tamaño ventricular son tanto cualitativos (redondeamiento de las cavidades ventriculares), como cuantitativos (índice ventricular de Levene: distancia entre la línea media hasta el borde externo del ventrículo lateral, en una proyección coronal a nivel del foramen de Monro)9,10.
Lesión cerebelosaSe han descrito lesiones isquémicas y hemorrágicas cerebelosas en niños prematuros, con una incidencia de un 3% en < 1.500g y de hasta un 19% en < 750g. El uso de ventanas acústicas accesorias, como la posterior y la posterolateral, ha facilitado su diagnóstico y se recomienda su realización en niños considerados de riesgo (< 30 semanas, presencia de hemorragia supratentorial)2.
Encefalopatía hipóxico-isquémicaLos hallazgos ultrasonográficos asociados a encefalopatía hipóxico-isquémica (EHI) son11,12:
- –
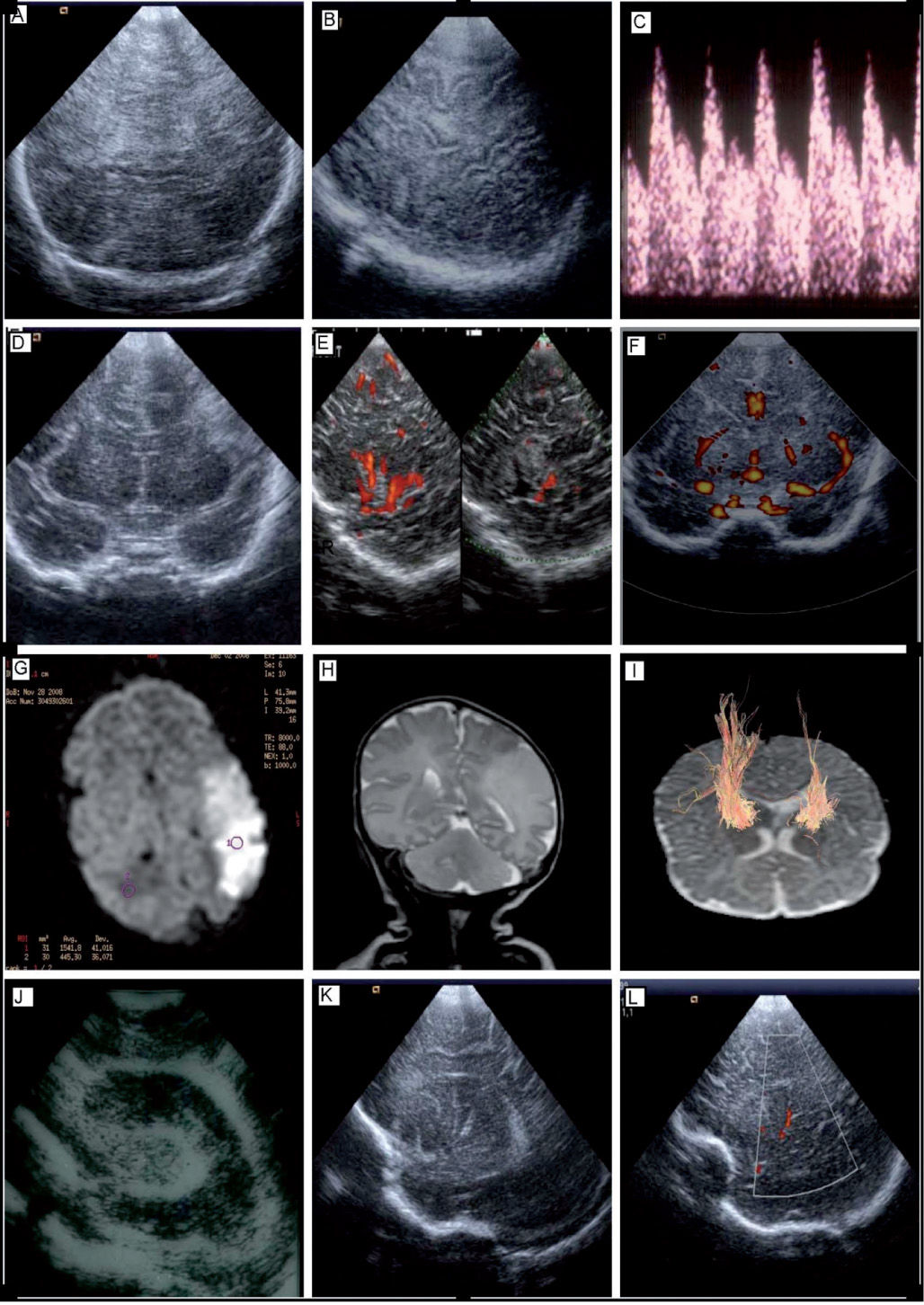
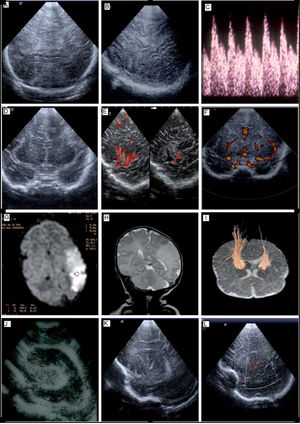
Edema cerebral: caracterizado como un aumento difuso de la ecogenicidad del parénquima cerebral con pérdida de los detalles anatómicos, borramiento de surcos y ventrículos virtuales (fig. 3A). Un hallazgo de valor pronóstico es que los ventrículos virtuales persistan más allá del primer día de vida.
Figura 3.A) USC. Proyección coronal en un paciente con EHI. Se observa un aumento de la ecogenicidad difusa en el parénquima cerebral. B) USC. Proyección parasagital tangencial en un paciente con EHI. Pobre diferenciación córtico-subcortical. Foco hiperecogénico a nivel su cortical. C) CDFI. Paciente con EHI, ondas de VFSC fluctuantes y/o dícrotas. D) USC. Proyección coronal, se observa hiperecogénica parietal derecha, por infarto isquémico en el territorio de la arteria cerebral media derecha. E) Doppler con imagen de flujo en color (power Doppler) proyección sagital a través de la escama del temporal. Se observa una asimetría de flujo entre la arteria cerebral media derecha sana (imagen izquierda) y la arteria cerebral media izquierda afectada (imagen derecha). F) Doppler con imagen de flujo en color (power Doppler) proyección coronal. Se observa una asimetría de flujo entre la arteria cerebral media derecha sana y la arteria cerebral media izquierda afecta. G) RM por difusión. Infarto cerebral parietal izquierdo. H) RM convencional. Secuencia T2, observándose un área extensa parietal izquierda hiperintensa. I) RM con tractografía en paciente con infarto cerebral izquierdo, muestra afectación de las fibras del haz corticoespinal izquierdo. J) USC. Proyección coronal en un paciente con ventriculitis. Se observa una dilatación del ventrículo lateral que presenta refuerzo ependimario y material ecogénico en su interior. K) USC. Paciente con vasculopatía en arterias estriadas. Proyección parasagital mostrando hiperecogenicidades localizadas en las arterias estriadas. L) Doppler con imagen de flujo en color (power Doppler). Paciente con vasculopatía en arterias estriadas. Proyección parasagital mostrando hiperecogenicidades localizadas en arterias estriadas, como lo demuestra el Doppler color. CDFI: Doppler con imagen de flujo en color; EHI: encefalopatía hipóxico-isquémica; RM: resonancia magnética; USC: ultrasonografía cerebral; VFSC: velocidad de flujo sanguíneo cerebral.
(0.24MB). - –
Incremento de la ecogenicidad gangliotalámica: de 2 a 4 días después del evento hipóxico-isquémico. Si este hallazgo es manifiesto y persistente, se acompaña de mal pronóstico11,13. En una proyección coronal, la visualización en la región gangliotalámica de una línea hipoecoica entre las áreas de ecogenicidad aumentada entre el tálamo y el núcleo lentiforme traduce una lesión del brazo posterior de la cápsula interna.
- –
Lesiones corticales: visualizadas como áreas de aumento de ecogenicidad en región córtico-subcortical (fig. 3B).
- –
Lesión de sustancia blanca: puede haber afectación de la sustancia blanca periventricular5,14,15. Este patrón de lesión refleja afectación de un área de vascularización limítrofe14.
- –
Lesiones evolutivas, pueden aparecer lesiones quísticas, cambios en la ecogenicidad, generalmente parcheados, y en el parénquima cerebral atrofia cerebral sugerida por la ventriculomegalia o el aumento del espacio extraaxial o el ensanchamiento de la cisura interhemisférica, además la región gangliotalámica puede mostrar signos de atrofia13,16.
Los estudios de hemodinámica cerebral mediante Doppler-color (preferentemente power Doppler) permiten detectar alteraciones hemodinámicas en los pacientes más severamente afectados, objetivándose signos indirectos de perfusión cerebral presión pasiva con aumento de la velocidad diastólica e IR bajos. Esto traduciría una pérdida de autorregulación cerebral. Un IR menor de 0,55 en las primeras 62h de vida predice un pronóstico adverso, con una sensibilidad del 100% y una especificidad del 81%5,17.
La ausencia de flujo diastólico o la presencia de un flujo diastólico invertido puede traducir «muerte cerebral»; sin embargo, es importante descartar un cortocircuito izquierda-derecha, que puede conducir también a este mismo hallazgo5,18.
En el recién nacido con EIH grave podemos encontrar también patrones de ondas alternantes o bifásicas, estas últimas probablemente debidas a alteración en la regulación vascular (fig. 3C)19.
Infarto cerebral perinatal isquémicoEl infarto cerebral perinatal isquémico (ICPI) tiene una incidencia aproximada de 1:2.300-5.000 recién nacidos vivos20; sin embargo, según la serie de autopsias, esta cifra podría estar infraestimada (entre un 60 y un 75% de los infartos podrían ser silentes)21. El ICPI causa el 30-70% de la parálisis cerebral hemipléjica en los recién nacidos a término y otras alteraciones neurológicas, como la epilepsia y el retraso cognitivo22.
En la USC precoz en ocasiones no se observan los cambios ecogénicos en el parénquima, apareciendo estos entre 48 y 72h después del inicio de la sintomatología neurológica. Se manifiesta como un área hiperecogénica focal, más o menos extensa, en el parénquima cerebral23-25(fig. 3D). Por medio de la CDFI hemos podido observar un flujo color disminuido o ausente en las arterias infartadas de forma precoz (fig. 3E y F). Otros hallazgos detectables con CDFI son la hiperperfusión en la zona de penumbra en la fase aguda y, en el seguimiento, crecimiento de pequeñas arterias en las zonas que rodean al infarto24.
Sólo las técnicas de resonancia magnética (RM) por difusión, y como ha sido referido mediante CDFI, son capaces de detectar precozmente un infarto26 (fig. 3G). Pasados 5 días, cuando las lesiones dejan de ser evidentes con técnicas de difusión, son más visibles con T1 y T2 (fig. 3H). Los estudios de RM de difusión con tractografía (fig. 3I) pudieran tener un valor relevante a la hora de detectar lesión en vía piramidal.
Infección del sistema nervioso centralCuando existe una ventriculitis bien establecida, se observan signos ecográficos característicos, entre ellos el refuerzo ependimario, material ecogénico intraventricular, tabiques intraventriculares o ventriculomegalia (fig. 3J).
La infección intrauterina, generalmente por agentes denominados del grupo TORCH, produce en el feto una serie de alteraciones cerebrales, como la presencia de calcificaciones, tanto en sustancia blanca periventricular como córtico-subcorticales, o la vasculopatía en arterias estriadas y/o talámicas. Otras anomalías asociadas a la infección por citomegalovirus son la germinólisis en núcleos caudados y los trastornos en la migración neuronal27,28.
Vasculopatía en arterias estriadas y talámicasEn los últimos años se han descrito imágenes lineales hiperecogénicas, en la región gangliotalámica, como una entidad asociada a diferentes patologías en el periodo neonatal (fig. 3K y L). Esta alteración puede ser inespecífica pero está asociada a un amplio espectro de alteraciones, fundamentalmente infecciosas perinatales (fundamentalmente citomegalovirus y toxoplasmosis), anomalías cromosómicas (un alto porcentaje de síndrome de Down), síndromes dismorfológicos y lupus eritematoso materno28,29.
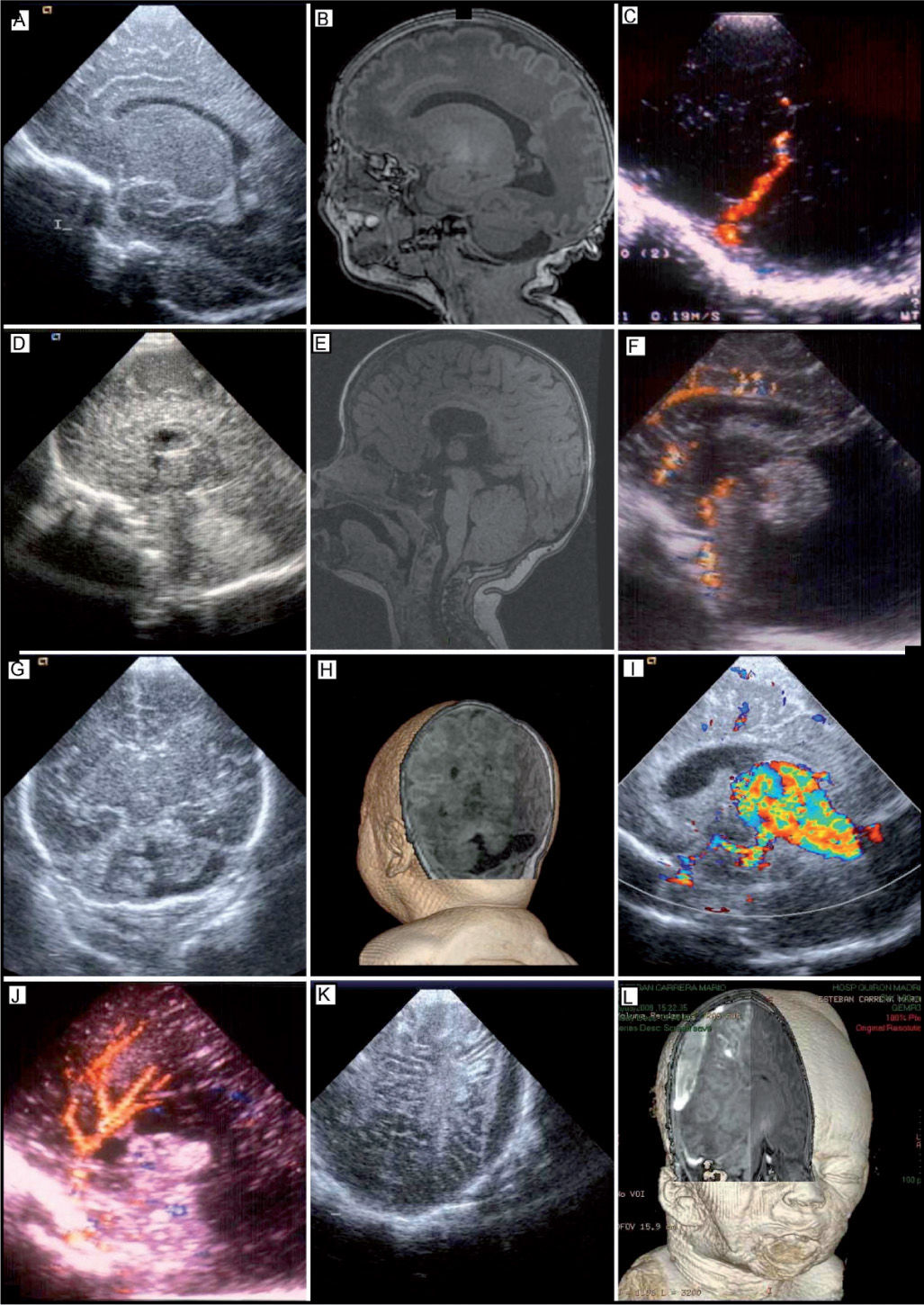
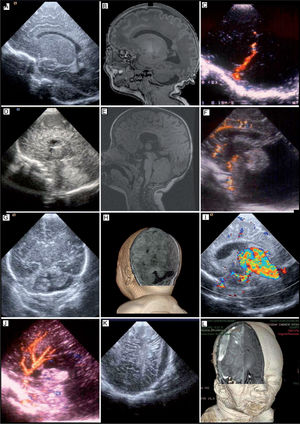
Trastornos en la migración neuronalLa USC y la CDFI permiten diagnosticar alteraciones de la migración neuronal, tales como el complejo agiria-paquigiria (lisencefalia), esquisencefalia (de labios abiertos y fusionados), megalencefalia unilateral y heterotopias neuronales (fig. 4A y B). En la agiria-paquigiria con CDFI se identifica siempre la arteria cerebral media en la cisura de Silvio, en estos pacientes, el vaso muestra un curso recto sin observarse el patrón normal ramificado (fig. 4C)30.
A) y B) USC y RM. Paciente con displasia frontonasal. Múltiples nódulos de heterotopias de sustancia blanca periventricular. C) CDFI. Proyección parasagital tangencial. Existe una pobre surcación y la arteria cerebral media en la cisura de Silvio muestra un curso recto sin divisiones. D) y E) Paciente con mielomeningocele. USC: en la línea media se observa un cuerpo calloso fino y disgenético. RM: agenesia del esplenio y del rostrum del cuerpo calloso con un acortamiento del eje anteroposterior. F) CDFI. Proyección sagital, donde se visualiza la línea media. Secuencia de Dandy Walker, con gran cavidad en la fosa posterior, ausencia de vermis inferior y cuarto ventrículo abierto a la cavidad. G) y H) USB y RM 3D con alteración de fosa posterior. Hipoplasia de hemisferio cerebeloso derecho y leve hipoplasia del vermis con aumento secundario de LCR en fosa posterior y amplia comunicación del cuarto ventrículo con la cisterna magna. I) CDFI. Malformación arteriovenosa de la vena de Galeno. Proyección sagital en la línea media. Se pueden observar sus aferencias arteriales. J) CDFI. Agenesia de cuerpo calloso con vascularización anormal. No se visualiza el normal trayecto de la arteria pericallosa y callosa marginal, con ramas verticales provenientes de la arteria cerebral anterior. K y L) Recién nacido con traumatismo obstétrico. USC proyección coronal. Imagen hipoecoica biconvexa. Hematoma epidural. RM 3D. Hematoma epidural con afectación parenquimatosa contigua. CDFI: Doppler con imagen de flujo en color; LCR: líquido cefalorraquídeo; RM: resonancia magnética; USC: ultrasonografía cerebral.
La USC es la técnica ideal para el cribado de malformaciones cerebrales, si bien en algunos casos el estudio más detallado por medio de RM es necesario para una mejor evaluación y extensión.
Un alto porcentaje de las malformaciones cerebrales neonatales las ocupan las hidrocefalias congénitas, como la estenosis del acueducto de Silvio, anomalías del cuerpo calloso (fig. 4D y E), la malformación de Arnold-Chiari en pacientes con mielomeningocele o la secuencia de Dandy-Walker (fig. 4F).
Con estudios seriados podemos monitorizar los cambios hemodinámicos que ocurren en las malformaciones vasculares, así como la VFSC de las diferentes arterias cerebrales. Con CDFI pueden diagnosticarse no sólo malformaciones arteriovenosas de la vena de Galeno (fig. 4I), sino de otras localizaciones, como por ejemplo, aquellas tributarias de la arteria cerebral media31.
Por medio de la CDFI podemos configurar mejor las malformaciones cerebrales. Por ejemplo, si no se observase bien con USC convencional el cuerpo calloso la presencia y buena configuración de la arteria pericallosa va a indicarnos que el cuerpo calloso, aunque rudimentario y fino, existe (fig. 4J).
Hemorragia intracranealLa hemorragia intraventricular puede observarse en neonatos nacidos a término o incluso en lactantes; el origen principal del sangrado es el plexo coroideo.
La hemorragia intraparenquimatosa se diagnostica bien por medio de USC. La repercusión del hematoma, esto es, el posible «efecto masa», con desplazamiento de estructuras, y la ventriculomegalia secundaria que puede acontecer, son bien identificadas por la USC.
Las hemorragias en el espacio extraaxial (hemorragias epidurales, subdurales y subaracnoideas supratentoriales) pueden ser correctamente diagnosticadas por USC.
El hematoma epidural adquiere una característica morfología hipoecoica extracerebral, con contorno biconvexo (fig. 4K y L), a diferencia del hematoma subdural, con forma de lente cóncava-convexa.
En la hemorragia subaracnoidea a nivel supratentorial podemos observar un aumento de la ecogenicidad de la cisura de Silvio por la sangre. También puede dibujar el espacio subaracnoideo, delimitando perfectamente los surcos cerebrales. A nivel infratentorial el dato más objetivo es la ocupación por sangre de la cisterna magna3.
Ecografía tridimensional: orientaciones futurasLa ecografía tridimensional (US3D) se ha introducido en los últimos 10 años en la práctica clínica, fundamentalmente en ginecología y obstetricia. Con la ecografía 3D obtenemos una imagen multiplanar, pudiendo realizar cálculos de volumen, con lo que disponemos de una mayor información con respecto a la USC que nos presenta imágenes en 2 planos. A nivel neonatal se han descrito varias aplicaciones32,33.