Puntos clave
- •
La cetoacidosis diabética (CAD) es la causa principal de morbimortalidad en los niños diabéticos, pudiendo aparecer como manifestación de comienzo o en el paciente diagnosticado, fundamentalmente por omisión del tratamiento y sus criterios diagnósticos son glucemia > 200mg/dl, pH < 7,3 o bicarbonato < 15mmol/l, y la presencia de glucosuria, cetonuria y cetonemia.
- •
Para su tratamiento se debe comenzar con fluidoterapia con salino al 0,9% o Ringer con bolos de volumen a 10–20ml/kg en 1–2h si se precisan, rehidratando posteriormente tras un cálculo cuidadoso del grado de deshidratación para reponer el volumen en 48h con soluciones de salino > 0,45%.
- •
La insulina se iniciará a dosis de 0,1U/kg/h tras 1–2h del comienzo de la hidratación y se mantendrá hasta corregir la acidosis y, si disminuye la glucemia por debajo de 250mg/dl, se añadirán aportes de glucosa al suero.
- •
Existe un déficit de potasio, por lo que tras la rehidratación se comenzarán aportes de potasio en el suero y antes en pacientes hipocaliémicos. El bicarbonato no está indicado, salvo acidosis grave con pH < 6,9.
- •
El edema cerebral es la complicación más grave y que produce la mayoría de la morbimortalidad de los pacientes con CAD y, ante su sospecha, se debe pautar manitol o suero salino hipertónico al 3%.
La diabetes mellitus (DM) constituye una de las enfermedades crónicas más frecuentes en niños y adolescentes. La cetoacidosis diabética (CAD) es la causa principal de morbimortalidad en los niños afectados de DM tipo 1 (DM1), siendo su mortalidad debida fundamentalmente al edema cerebral, que ocurre entre un 0,3 y un 1% de las CAD. Es frecuente su aparición como síntoma de comienzo de la enfermedad o bien por omisión del tratamiento en niños ya diagnosticados. La prevención del edema cerebral y la reversión de las alteraciones metabólicas son los propósitos principales del tratamiento. La rehidratación con fluidos adecuados y la insulinoterapia intravenosa constituyen la base de su tratamiento.
Lectura rápida
La cetoacidosis diabética (CAD) se debe a una disminución en la insulina efectiva circulante, así como al aumento de hormonas contrarreguladoras, produciendo hiperglucemia > de 200mg/dl, acidosis con pH < 7,3 y bicarbonato < 15mmol/l, glucosuria, cetonemia y cetonuria.
La CAD puede aparecer como manifestación de comienzo o en diabéticos conocidos, en estos últimos sobre todo por incumplimiento del tratamiento, y son factores de riesgo el mal control metabólico los episodios previos de CAD, pacientes peripuberales y chicas adolescentes, enfermedad psiquiátrica añadida, ambiente familiar desfavorable, incumplimiento del tratamiento y las bombas de insulina.
Se debe realizar la determinación de glucemia, gasometría con iones con potasio, sodio, calcio, fósforo y magnesio, perfil renal con nitrógeno ureico en sangre (BUN) y creatinina, osmolalidad, gasometría para valorar acidosis, pCO2 y bicarbonato, hemograma y cetonemia/cetonuria, siendo útil el cálculo del sodio corregido por glucemia (Na corregido = Na medido + 1,6 [(glucosa plasmática en mg/dl – 100)/100]) y de la osmolalidad efectiva (Osm efectiva = 2 × (Na + K) + glucosa plasmática mOsm/kg) y, si es posible, se valorará la HbA1c y el β-hidroxibutirato, que puede ayudar a monitorizar la respuesta al tratamiento.
Para el tratamiento, los principios generales de la fluidoterapia son comenzar la fluidoterapia antes del tratamiento con insulina, administrando expansión con volumen solo si es preciso para restablecer la circulación periférica, calcular las necesidades hídricas para rehidratar durante 48h, siendo infrecuente tener que administrar más de 1,5 a 2 veces las necesidades basales.
Se recomienda administrar suero salino 0,9% o Ringer lactato a una velocidad inicial de 10–20ml/kg en 1–2h, pudiéndose repetir este bolo de volumen si es preciso clínicamente, para posteriormente mantener la reposición con suero salino 0,9% o Ringer durante al menos 4–6h y después de esta fase utilizar una solución salina con una tonicidad ≥0,45% añadiendo potasio y corrigiendo el déficit en no menos de 48h, sin añadir las pérdidas urinarias.
La insulinoterapia se administrará 1 a 2h después de comenzar la rehidratación a una dosis baja por vía intravenosa a 0,1U/kg/h, manteniéndola hasta resolver la cetoacidosis, ya que la glucemia desciende de forma más precoz.
Se deberán iniciar soluciones glucosadas cuando la glucosa caiga a alrededor de 250–300mg/dl o antes si el descenso es muy marcado, pudiendo ser preciso administrar soluciones de glucosa del 10% o incluso del 12,5%.
En la CAD existe un déficit de potasio, por lo que se debe iniciar la administración de potasio inmediatamente durante la expansión inicial de volumen en el paciente hipocaliémico a 20mmol/l, en los normopotasémicos cuando se inicie la insulina y, ante niveles séricos elevados, cuando se inicie la diuresis y en general a 40mmol/l o a más dosis si persiste la hipocaliemia, manteniéndose durante toda la rehidratación por vía intravenosa. En los pacientes con CAD existe depleción de fosfato que puede persistir varios días, aunque no se ha demostrado beneficio en su administración, pudiéndose emplear fosfato potásico como alternativa o en combinación con cloruro potásico o acetato en la fluidoterapia.
El empleo de bicarbonato está en general contraindicado y únicamente se restringe a los casos de acidosis grave con pH < 6,9 y en aquellos con hipopotasemia grave.
La principal complicación es el edema cerebral, que típicamente aparece entre las 4 y 12h tras el inicio del tratamiento, con síntomas como cefalea, recurrencia de los vómitos, irritabilidad o alteración de la consciencia, focalidad neurológica, bradicardia y aumento de la presión arterial, siendo factores de riesgo el incremento atenuado del sodio durante el tratamiento de la CAD, la gravedad de la acidosis, el tratamiento con bicarbonato, el grado de hipocapnia al comienzo y el aumento del BUN sérico a la presentación. Su tratamiento consiste en manitol (0,25–1g/kg en 20min), que se puede repetir entre los 30min a 2h si no hay respuesta o salino hipertónico al 3% (5–10ml/kg en 30min), la restricción de la fluidoterapia en un tercio y elevar la cabecera, además de instaurar las medidas de soporte necesarias, pudiendo ser precisa la intubación.
En la prevención son fundamentales las campañas de concienciación para la detección precoz y los programas de educación y soporte de los pacientes ya diagnosticados.
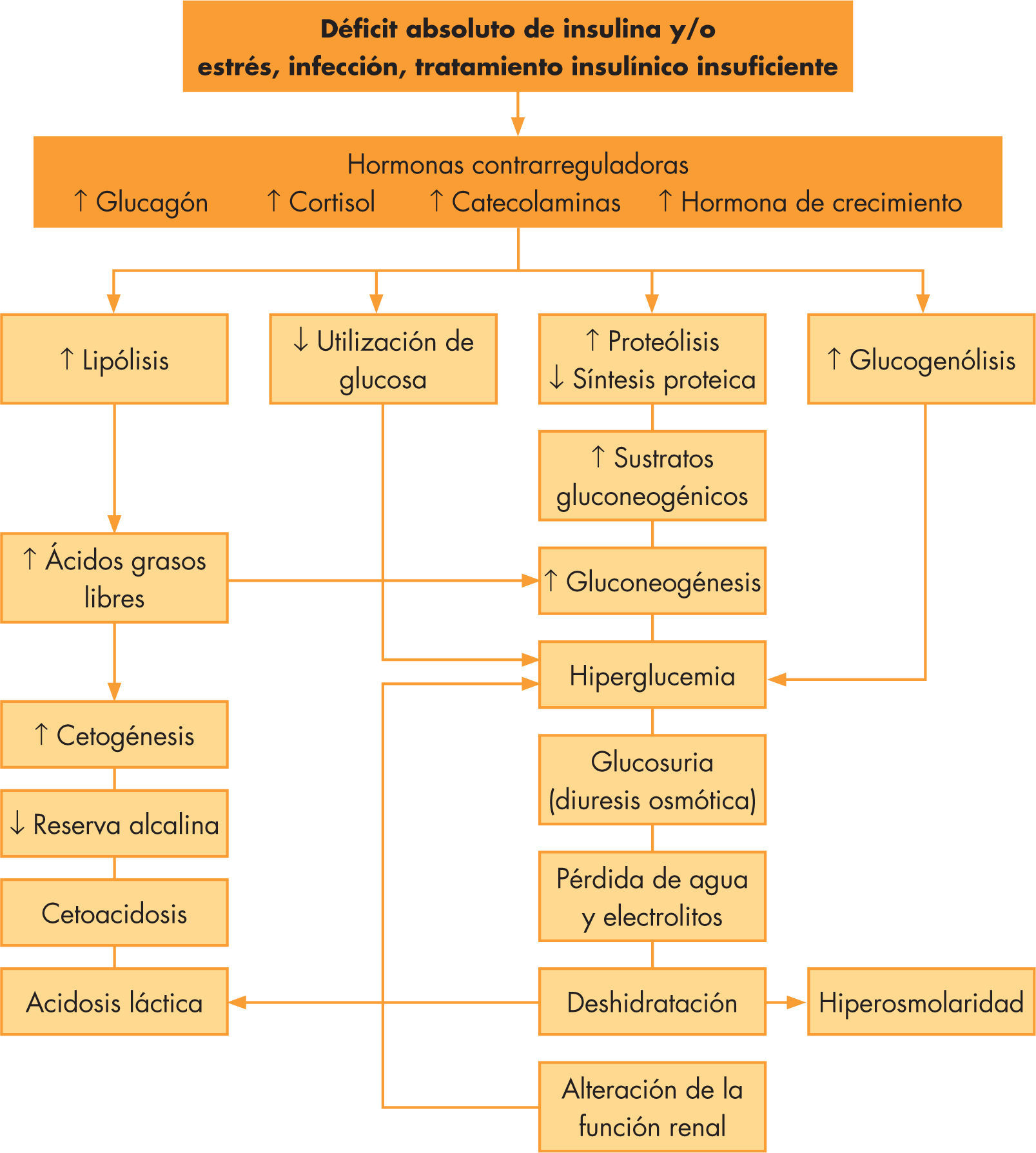
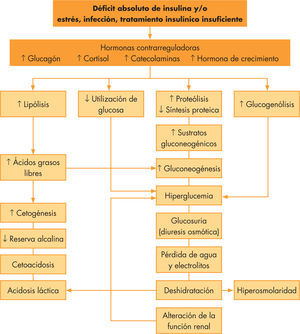
La CAD se debe a una disminución en la insulina efectiva circulante así como al aumento de hormonas contrarreguladoras, como glucagón, catecolaminas, cortisol y hormona de crecimiento1. Ambos producen un aumento en la producción de glucosa por el hígado y el riñón, y una disminución en su utilización periférica con hiperglucemia e hiperosmolaridad. El incremento de la lipólisis causa cetonemia y acidosis metabólica, produciendo dicha cetonemia, junto a la hiperglucemia existente, una diuresis osmótica y deshidratación (véase la fig. 1). Los criterios diagnósticos bioquímicos2 están recogidos en la tabla 1. Según el grado de acidosis, la CAD se cataloga en leve (pH venoso 7,3–7,2; bicarbonato < 15mmol/l), moderada (pH 7,2–7,1; bicarbonato < 10mmol/l) o grave (pH < 7,1; bicarbonato < 5mmol/l)3. En pacientes con DM tipo 2, la CAD también puede constituir la sintomatología de comienzo, apareciendo incluso en hasta un 25%, y es fundamental realizar un correcto diagnóstico diferencial con el síndrome hiperglucémico hiperosmolar que pueden desarrollar estos pacientes y cuyos criterios diagnósticos se recogen en la tabla 24.
Criterios diagnósticos de cetoacidosis diabética.
| Glucosa en sangre > 11mmol/l (> 200mg/dl) |
| pH venoso < 7,3 y/o bicarbonato < 15mmol/l |
| Glucosuria, cetonuria y cetonemia |
| Pueden existir valores de glucosa casi normales en pacientes parcialmente tratados o adolescentes embarazadas (cetoacidosis euglucémica) |
Criterios diagnósticos del síndrome hiperglucémico hiperosmolar.
| Glucosa plasmática > 33,3mmol/l (> 600mg/dl) |
| pH arterial > 7,3 y bicarbonato sérico > 15mmol/l |
| Leve cetonemia, cetonuria inexistente o leve (β-hidroxibutirato sérico 1±0,2 (SEM) mmol/l |
| Osmolalidad sérica efectiva > 320mOsm/kg |
| Estupor o coma |
La aparición de la CAD como manifestación de comienzo de la diabetes tiene una gran variabilidad geográfica, siendo su incidencia inversamente proporcional a la incidencia de DM1, debido a la menor concienciación y, por ello, diagnóstico más tardío en los países con menor incidencia de la enfermedad. La aparición de CAD como comienzo se sitúa entre un 15 y un 70% en diferentes series de Europa y Norteamérica, pudiendo ser mayor en países en desarrollo. En un estudio multicéntrico español con datos recogidos entre 2004 y 2008, se situó en un 39,5%5. Es más frecuente en niños menores de 5 años, sin antecedentes familiares de primer grado de DM1 y en niveles socioeconómicos bajos. Algunos fármacos, como los glucocorticoides, algunos antipsicóticos, diazóxido e inmunosupresores, se relacionan con su aparición. En niños ya diagnosticados de DM1, el riesgo de presentar una CAD se sitúa entre el 1 y el 10% por paciente y año6, siendo mayor en pacientes con mal control metabólico o con episodios previos de CAD, peripuberales y chicas adolescentes, enfermedad psiquiátrica añadida, ambiente familiar desfavorable, incumplimiento del tratamiento y usuarios de bombas de insulina, ya que administran únicamente insulina rápida, por lo que un fallo en su funcionamiento produce alteraciones metabólicas en un corto espacio de tiempo. La omisión del tratamiento insulínico constituye la causa más importante de CAD en niños con diagnóstico previo7. Los episodios recurrentes de CAD aparecen con una frecuencia de 8 episodios/100.000 pacientes y año según algunos estudios, y el 20% de los pacientes presentaban el 80% de estos episodios.
Clínica de la cetoacidosis diabéticaPuede aparecer la clínica clásica de poliuria, polidipsia con o sin polifagia y pérdida de peso, acompañada de deshidratación, respiraciones de Kussmaul (profundas y rápidas), náuseas, vómitos y dolor abdominal, hasta sintomatología de edema cerebral con alteración del estado de consciencia, focalidad neurológica o coma. En niños pequeños, a veces la clínica no es típica y se confunde con alteraciones respiratorias o abdominales, retrasando el diagnóstico. Pueden aparecer también síntomas derivados de la deshidratación y la pérdida de electrolitos, como debilidad y calambres musculares. La existencia de infecciones candidiásicas persistentes o de incontinencia urinaria de nueva aparición deben también hacer sospechar la enfermedad. La aparición de alteración en el estado mental, respiración de Kussmaul o aliento afrutado indican CAD evolucionada.
Diagnóstico de la cetoacidosis diabéticaSe debe realizar analítica completa, incluyendo glucemia, electrolitos (incluyendo potasio, sodio, calcio, fósforo y magnesio), perfil renal con nitrógeno ureico en sangre (BUN) y creatinina, osmolalidad, gasometría para valorar acidosis, pCO2 y bicarbonato, hemograma (teniendo en cuenta que la leucocitosis puede deberse al estrés por la CAD y no es indicativa de infección)8,9. La determinación de gasometría, glucemia e iones y la cetonemia/ cetonuria se realizará cada hora en la fase de mayor gravedad, pudiéndose espaciar posteriormente. Se calculará el anión Gap (AG = Na – [Cl + HCO3]) y corregido por albúmina (AG corregido = AG – 2,5 x [albúmina sérica en g/dl]10, cuyos valores normales oscilan en 12±2mmol/l y que en CAD suele rondar entre 20–30mmol/l, indicando valores mayores de 35mmol/l la coexistencia de acidosis láctica). También es útil el cálculo del sodio corregido por glucemia (Na corregido = Na medido + 1,6 [(glucosa plasmática en mg/ dl – 100)/100]) y de la osmolalidad efectiva (Osm efectiva=2 × (Na + K) + glucosa plasmática mOsm/kg). Si es posible, se valorará la hemoglobina glucosilada (HbA1c), que nos dará idea de la duración y gravedad de la hiperglucemia en las CAD de comienzo y del cumplimiento del tratamiento en los diabéticos ya diagnosticados, y el β-hidroxibutirato, que puede monitorizar la respuesta al tratamiento, existiendo estudios que demuestran que el tratamiento así guiado acorta las estancias en la Unidad de Cuidados Intensivos Pediátricos (UCIP) y disminuye los costes. Se pedirá también analítica urinaria para valorar la cetonuria. En los diabéticos diagnosticados, puede ser útil la determinación de insulina sérica libre para detectar omisión del tratamiento. Ante signos indicativos de infección, se recogerán los cultivos pertinentes y se valorará iniciar antibioterapia.
Tratamiento de la cetoacidosis diabéticaLos niños con signos de CAD grave, con sintomatología de larga duración, compromiso hemodinámico o disminución del nivel de consciencia, o aquellos con aumento del riesgo de edema cerebral, deben ingresar en una UCIP, monitorizando las constantes según la gravedad. En los casos más leves, en familias con alta formación en la enfermedad y con adecuada supervisión y un seguimiento detallado, puede ser posible el tratamiento ambulatorio, siempre que se asegure la tolerancia oral. Es importante calcular meticulosamente el grado de deshidratación, teniendo en cuenta múltiples signos físicos, ya que la valoración clínica suele ser inexacta. En general, si aparece relleno capilar prolongado, pérdida de la turgencia cutánea y patrón respiratorio anormal se debe calcular al menos una deshidratación del 5%. Si los pulsos periféricos están ausentes, hay hipotensión y oliguria la pérdida de fluidos será ≥ del 10%. Se deberán monitorizar cuidadosamente los balances, pesando al paciente y pudiendo ser necesario el sondaje vesical en los casos más graves. La monitorización electrocardiográfica puede resultar útil para evidenciar las alteraciones electrolíticas (como la onda T por alteraciones del potasio). Además, la clínica debe ser valorada con frecuencia para descartar signos de alarma de edema cerebral (véase la tabla 3).
La elevada osmolalidad del compartimento extracelular provoca un movimiento de agua desde el compartimento intracelular, presentando en general deshidrataciones de grado variable al diagnóstico, que con frecuencia son difíciles de estimar clínicamente. La medida del sodio sérico no es un marcador fiable del grado de deshidratación en los pacientes con CAD, debiéndose corregir sus valores (véase la fórmula previa) y monitorizar sus cambios durante el tratamiento, aumentando la natremia al disminuir la glucemia con los líquidos y la insulinoterapia, lo que no es indicativo de un empeoramiento del estado hipertónico. Si el sodio se mantiene o continúa descendiendo pese a la terapia, puede constituir un marcador ominoso de la aparición de edema cerebral11. La elevación del BUN y del hematocrito pueden ser mejores marcadores de la deshidratación extracelular grave12. La osmolalidad efectiva suele oscilar entre los 300 y 350 mOsm/l y es otro buen marcador de la eficacia del tratamiento. La terapia con fluidos mejora el filtrado glomerular y con ello la eliminación de glucosa y cetonas, provocando mejoría de la hiperglucemia por sí sola. Los objetivos de la fluidoterapia son el restablecimiento del volumen circulante, la reposición del sodio y del déficit de agua, la normalización del filtrado glomerular y evitar el edema cerebral. Aunque no existe aún una demostración convincente de la asociación entre reposición líquida y edema cerebral13, la presión intracraneal aumenta más con la reposición agresiva y rápida de líquidos, sobre todo si son hipotónicos, por lo que se recomienda una corrección más paulatina con fluidos isotónicos con el suero salino fisiológico o el Ringer lactato, sin haberse demostrado, de momento, diferencias significativas entre ambos.
Los principios generales de la fluidoterapia son: comenzar la fluidoterapia antes del tratamiento con insulina, administrando expansión con volumen solo si es preciso para restablecer la circulación periférica, calcular las necesidades hídricas para rehidratar durante 48h, siendo infrecuente tener que administrar más de 1,5 a 2 veces las necesidades basales.
Para evitar la administración de fluidos excesiva, también se deben tener en cuenta en el cálculo de balances los líquidos orales ingeridos o administrados previo al tratamiento de la CAD y la rapidez de administración dependerá del estado circulatorio, aunque en general se recomienda una velocidad inicial de 10–20ml/kg en 1–2h de salino 0,9% o Ringer lactato, pudiéndose repetir este bolo de volumen si es preciso clínicamente. No hay datos para recomendar el empleo de coloides. Posteriormente, se mantendrá la reposición con suero salino 0,9% o Ringer durante al menos 4–6h14,15. Después de esta fase, se debe utilizar una solución salina con una tonicidad≥0,45% añadiendo potasio16, corrigiendo el déficit en no menos de 48h. Dado que la deshidratación se puede sobreestimar, conviene recordar nuevamente que la fluidoterapia que se debe administrar no suele tener que sobrepasar en 1, 5-2 veces las necesidades basales diarias y, en general, no habrá que añadir las pérdidas urinarias. Puede ser necesario aumentar el contenido de sodio en el suero si la natremia es baja y no aumenta apropiadamente con la caída de la glucemia17. El empleo de salino al 0,9% en exceso se ha asociado a la aparición de acidosis láctica18.
InsulinoterapiaLa insulinoterapia es esencial para normalizar las alteraciones de la CAD, ya que se debe bien a un déficit insulínico absoluto o relativo. En general, se administrará 1 a 2h después de comenzar la rehidratación una dosis baja por vía intravenosa a 0,1 U/kg/h, que consigue unos niveles plasmáticos de alrededor de 100 a 200μU/ml en 60min, capaces de revertir la resistencia insulínica e inhibir la lipólisis y la cetogénesis. La acidosis siempre tardará más en corregirse que la hiperglucemia, por lo que esta dosis se debe mantener hasta resolver la cetoacidosis19 (véase criterios en la tabla 3). Con la fluidoterapia inicial, la glucemia típicamente desciende bruscamente. Tras el inicio de la insulinoterapia, desciende a un ritmo de unos 2–5mmol/l/h. Se deberán iniciar soluciones glucosadas cuando la glucosa caiga a alrededor de 250–300mg/dl o antes si el descenso es muy marcado, pudiendo ser preciso administrar soluciones de glucosa del 10% o incluso del 12,5%. No hay evidencias para recomendar bolo de insulina al inicio de la terapia, ya que puede aumentar el riesgo de edema cerebral20. Si el paciente presenta marcada sensibilidad a la insulina (p. ej., pacientes pequeños con CAD, síndrome hiperglucémico hiperosmolar o algunos niños mayores con diabetes establecida), se puede disminuir la dosis a 0,05U/kg/h, siempre que continúe mejorando la acidosis.
PotasioAunque no hay datos sobre el déficit de potasio que presentan los niños con CAD, está claro que la pérdida mayor corresponde al compartimento intracelular, ya que la hipertonicidad causa su salida de las células, además de que en la CAD existen pérdidas incrementadas por los vómitos y la diuresis osmótica. Los niveles séricos de potasio al diagnóstico pueden ser normales, altos o bajos. Si están disminuidos, suelen corresponder a una mayor duración de la enfermedad, mientras si están elevados se puede deber a alteración renal. La insulina, al corregir la acidosis, disminuirá los niveles al reintroducir el potasio en la célula. Si esto ocurre de forma brusca, puede predisponer a la aparición de arritmias cardiacas. Se debe iniciar la administración de potasio inmediatamente durante la expansión inicial de volumen en el paciente hipocaliémico, aunque se añadirá a 20mmol/l; en los demás, en general, cuando se inicie la insulina y, ante niveles séricos elevados, cuando se inicie la diuresis y en general a 40mmol/l, manteniéndose durante toda la rehidratación intravenosa. En ocasiones, es necesario aumentar los aportes hasta 80mmol/l. La existencia en el electrocardiograma de ondas T aplanadas, intervalos QT ensanchados y existencia de onda U son indicativas de alteraciones del potasio. Se puede emplear fosfato potásico con cloruro o acetato potásico y su administración máxima no debe sobrepasar los 0,5mmol/kg/h. Si persiste la hipopotasemia con esta reposición, se puede disminuir la infusión de insulina.
FosfatoExiste depleción del fosfato intracelular debido a la diuresis osmótica, que se exacerba con la insulinoterapia al penetrar el fosfato en la célula21. La depleción de fosfato puede persistir varios días, aunque no se ha demostrado beneficio en su administración22, que puede ocasionar hipocalcemia, aunque la hipofosfatemia grave con debilidad inexplicada debe ser corregida siempre. Si se administra fosfato, es fundamental monitorizar los niveles de calcio cuidadosamente. Se puede emplear fosfato potásico como alternativa o en combinación con cloruro potásico o acetato en la fluidoterapia.
AcidosisLa acidosis grave, en general, responde a la fluidoterapia y la insulina, que además frena la producción de cetoácidos y permite su metabolización. Su metabolismo produce bicarbonato, corrigiendo espontáneamente la acidosis, al igual que la mejoría hemodinámica, al corregir la deshidratación, mejora la perfusión tisular y revierte la acidosis láctica. Las indicaciones de la terapia con bicarbonato son cada vez más restringidas, ya que su administración puede empeorar la acidosis del sistema nervioso central y la corrección rápida de la acidosis provocar hipopotasemia, acentuando la hipernatremia y la hipertonicidad sérica, además de incrementar la producción hepática de cetonas, retrasando, por tanto, la recuperación23,24. Por todo ello, su empleo se restringe a los casos de acidosis grave con pH < 6,9, en los que la contractilidad cardiaca y la vasodilatación pueden empeorar aún más la hipoperfusión tisular y los inotropos ser menos eficaces y en aquellos con hipopotasemia grave que amenace la vida25, en los que se pueden administrar 1–2mmol/kg en 1h.
Introducción de líquidos orales y transición a insulina subcutáneaSe comenzará la tolerancia oral con líquidos tras recuperación importante, pudiendo persistir acidosis leve o cetosis. Si se toleran, se debe disminuir la fluidoterapia por vía intravenosa. Una vez resuelta la cetoacidosis, se suele iniciar insulina subcutánea previa a una comida, 15–30min antes (insulina rápida) o 1–2h (insulina regular) de cesar la infusión por vía intravenosa.
ComplicacionesLa principal complicación es el edema cerebral, que típicamente aparece entre las 4 y 12h tras el inicio del tratamiento, aunque puede presentarse previamente y en cualquier momento de la evolución26. Su clínica es variable y puede comprender cefalea, recurrencia de los vómitos, irritabilidad o alteración de la consciencia, focalidad neurológica, bradicardia y aumento de la presión arterial. Su fisiopatología no se conoce exactamente y puede incluir isquemia e hipoxia, activación inflamatoria cerebral, aumento del flujo cerebral y disrupción del transporte iónico de la membrana celular y los canales de aquaporina, con generación de osmolitos orgánicos intracelulares. Parece más frecuente en el comienzo de CAD, pacientes menores y mayor duración de los síntomas. Entre los factores de riesgo de edema cerebral se barajan un incremento atenuado del sodio durante el tratamiento de la CAD, la gravedad de la acidosis, el tratamiento con bicarbonato, el grado de hipocapnia al comienzo y el aumento del BUN sérico a la presentación.
Tratamiento del edema cerebralSe debe iniciar tan pronto como se sospeche y reducir la fluidoterapia. Se puede añadir además manitol (0,25–1g/kg en 20min) y repetir entre los 30min y las 2h si no hay respuesta o salino hipertónico al 3% (5–10ml/kg en 30min), sobre todo si no hay respuesta inicial al manitol27. Se debe restringir la sueroterapia en un tercio y elevar la cabecera de la cama a 30°. En casos graves, serán necesarias la intubación y la ventilación mecánica, habiéndose relacionado la hiperventilación agresiva con peores resultados. No hay datos para recomendar el empleo de corticoides. Tras el inicio del tratamiento, se debe realizar una tomografía computarizada craneal para descartar otras causas de alteración neurológica, que aparecen en un 10%, sobre todo trombosis o hemorragia28.
Otras complicacionesOtras complicaciones causantes de morbimortalidad en los pacientes con CAD son las alteraciones electrolíticas (hipopotasemia, hipofosfatemia), la hipoglucemia, otras alteraciones intracerebrales (fundamentalmente trombosis o hemorragias), trombosis venosa periférica, mucormicosis, rabdomiólisis, sepsis, fallo renal, pancreatitis y complicaciones pulmonares.
Morbilidad y mortalidadLa mortalidad varía entre un 0,15 y un 0,3% en series de EE. UU.29,30, constituyendo el edema cerebral la causa en el 60–90% de los casos31.
Prevención de la cetoacidosis diabéticaTodos los casos de CAD recurrentes son potencialmente prevenibles, pero también el diagnóstico precoz por pruebas genéticas o cribado inmunológico en niños de alto riesgo ha demostrado disminuir la incidencia de la CAD que aparece como comienzo de la diabetes. Las campañas de concienciación sobre la DM, tanto en familiares de pacientes como en escuelas y en el colectivo médico, también pueden ser útiles, consiguiendo la detección precoz de la DM y evitando la CAD. En pacientes diagnosticados de DM, los programas de entrenamiento y ayuda telefónica han reducido la aparición de CAD, al igual que los algoritmos educacionales para pacientes portadores de bombas de insulina. En estos pacientes, la causa fundamental de CAD es la omisión del tratamiento insulínico, por lo que los programas educativos, la valoración psicosocial y la supervisión del tratamiento32 por un adulto pueden ser eficaces.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.