Puntos clave
- •
La colitis alérgica eosinofílica, o proctocolitis alérgica, se caracteriza por la presentación de deposiciones mucosanguinolentas en lactantes sin afectación del estado general.
- •
Se manifiesta por cambios inflamatorios en el colon y el recto, como respuesta a la ingestión de proteínas alimentarias, tratándose de una reacción alérgica no mediada por inmunoglobulina E. Aunque se han asociado muchos antígenos alimentarios al desarrollo de la colitis alérgica, los más importantes son las proteínas de leche de vaca
- •
Afecta a niños en el primer año de vida, siendo cada vez más frecuente su incidencia en recién nacidos y lactantes alimentados exclusivamente con lactancia materna
- •
El tratamiento consiste en la retirada de las proteínas de leche de vaca de la dieta, manteniendo la lactancia materna en niños amamantados, pero retirando de la alimentación de la madre los alimentos lácteos
- •
El «patrón de oro» en el diagnóstico de la colitis alérgica eosinofílica es la desaparición de las heces mucosanguinolentas tras la retirada de las proteínas de leche de vaca de la dieta y la reaparición de los síntomas tras la reintroducción de estas en la alimentación del lactante.
La colitis alérgica eosinofílica, proctocolitis alérgica o colitis hemorrágica del lactante es un trastorno descrito hace más de 40 años, aunque su incidencia se está viendo aumentada en nuestro medio a lo largo de las 2 últimas décadas1.
Clásicamente, se relacionaba con niños alimentados con lactancia artificial (LA), concretamente con fórmulas adaptadas sobre la base de leche de vaca (LV), pero se ha descrito un aumento de la prevalencia en lactantes alimentados exclusivamente con lactancia materna (LM).
Se caracteriza por la presentación de deposiciones mucosanguinolentas en lactantes en el primer semestre de vida, con preservación del estado general, aunque puede aparecer desde los primeros días de vida.
El diagnóstico se realiza basándose en la clínica descrita y habitualmente no es necesaria la realización de otras pruebas más invasivas. Cuando la rectorragia persiste, la rectosigmoidoscopia es una técnica de gran utilidad, observándose una mucosa eritematosa, nodular en ocasiones, y erosiones múltiples superficiales. Las biopsias rectales presentan cambios inflamatorios, con aumento del número de eosinófilos.
Una vez retiradas las proteínas de leche de vaca (PLV) de la alimentación del lactante, o en los niños amamantados al pecho, de la dieta de la madre, se resuelve la sintomatología, que vuelve a reaparecer si se reintroducen las PLV en la dieta.
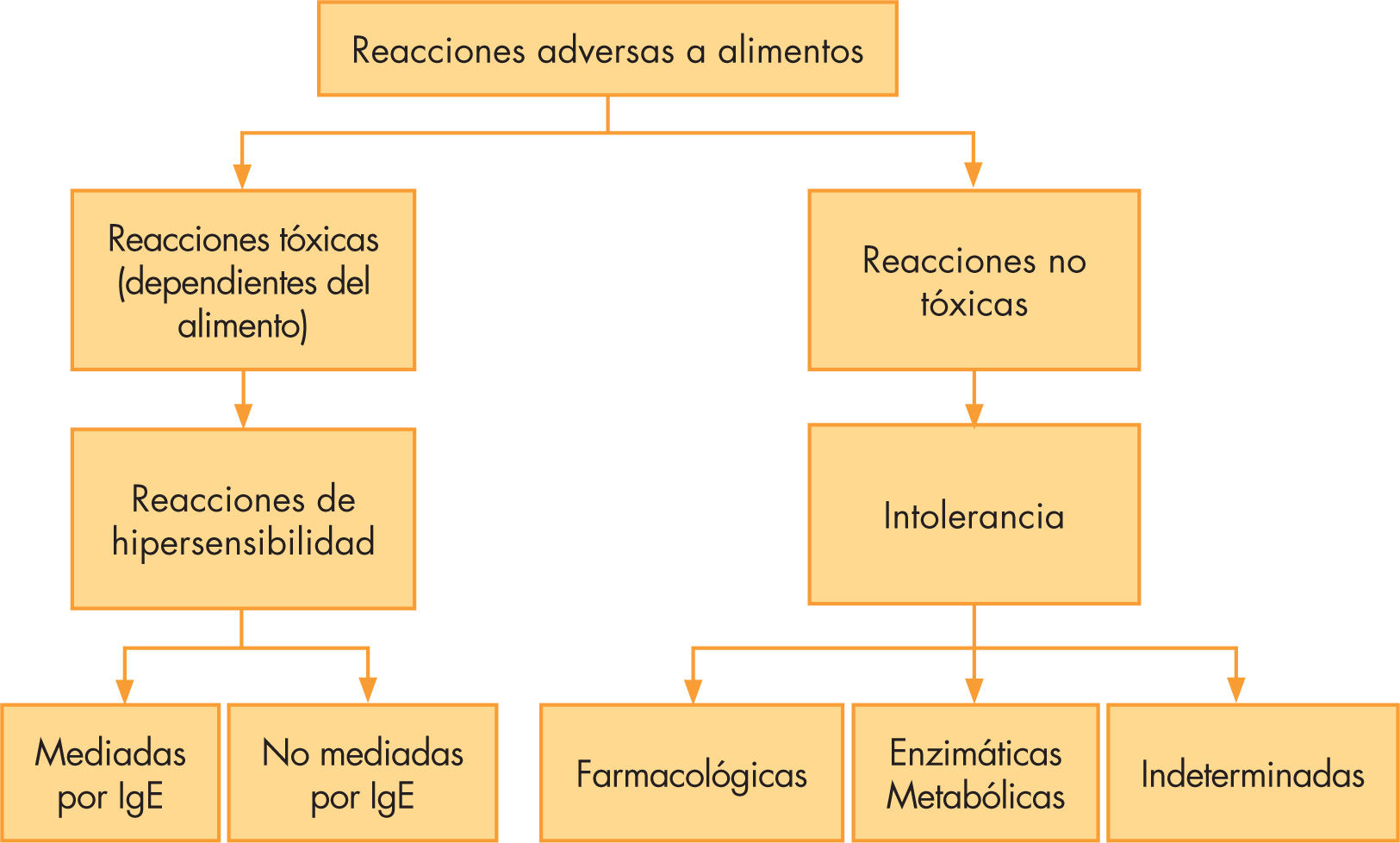
Reacciones adversas a alimentos y a proteínas de lecha de vacaLas definiciones de reacción adversa a alimentos, intolerancia alimentaria y reacciones alérgicas a alimentos se han prestado a confusión hasta hace unos años, cuando estos términos fueron revisados, inicialmente por la Academia Europea de Alergología e Inmunología clínica (EAACI)2 y, posteriormente, en 2004 por la Organización Mundial de Alergia (WAO)3, llegándose al consenso actual de los mismos (fig. 1).
Clasificación de las reacciones adversas a alimentos. Documento de posición de la Academia Europea de Alergología e Inmunología Clínica, 2001. Tomado de: Johansson et al2.
Se conoce como alergia alimentaria al conjunto de reacciones adversas a alimentos, debidas a su ingesta, contacto o inhalación, de patogenia inmunitaria comprobada. Solo se produce en algunos individuos y puede ocurrir después de la toma de muy pequeñas cantidades del alimento. El término alergia alimentaria se ha utilizado de manera abusiva, aplicándolo de forma incorrecta para referirse a cualquier tipo de reacción adversa o secundaria a un alimento o a un aditivo alimentario.
Se pueden distinguir diferentes tipos de reacciones adversas frente a los alimentos: las reacciones alérgicas a alimentos, las reacciones de intolerancia alimentaria y las reacciones tóxicas a los alimentos. Estas 2 últimas se caracterizan por ser dependientes de la dosis, es decir, las manifestaciones secundarias que producen son tanto más intensas cuanto mayor sea la cantidad del alimento o del aditivo ingerido.
Lectura rápida
Aunque clásicamente se había relacionado con lactantes alimentados con lactancia artificial, y más concretamente con fórmulas adaptadas a base de leche de vaca (LV), también se está describiendo un aumento de la prevalencia en lactantes alimentados exclusivamente con lactancia materna (LM).
Sin embargo, este fenómeno puede no manifestarse en las reacciones alérgicas, de manera que pequeñas cantidades pueden dar a lugar a una respuesta exagerada. Tanto en las reacciones alérgicas como en las de intolerancia, las manifestaciones clínicas que tienen lugar tras la ingestión de una determinada cantidad de un alimento concreto vienen determinadas por la idiosincrasia del individuo, por lo que la misma dosis de ese alimento en cuestión es perfectamente tolerada en un individuo sano. Es decir, en estos casos existiría una hipersensibilidad del individuo al alimento (tabla 1).
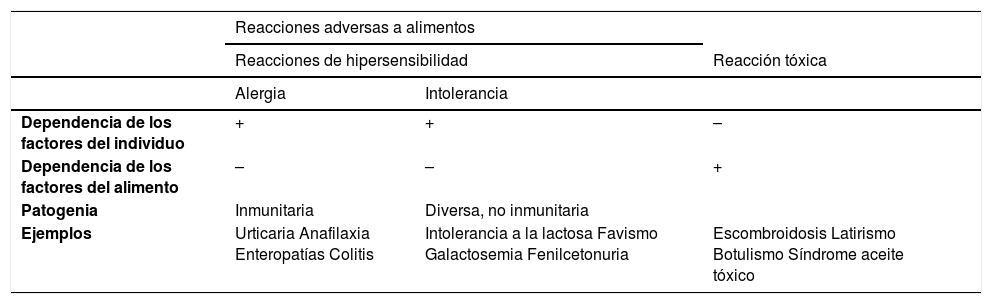
Diferencias y similitudes entre los distintos tipos de reacciones adversas a alimentos: reacciones alérgicas, reacciones de intolerancia y reacciones tóxicas a alimentos.
| Reacciones adversas a alimentos | |||
|---|---|---|---|
| Reacciones de hipersensibilidad | Reacción tóxica | ||
| Alergia | Intolerancia | ||
| Dependencia de los factores del individuo | + | + | – |
| Dependencia de los factores del alimento | – | – | + |
| Patogenia | Inmunitaria | Diversa, no inmunitaria | |
| Ejemplos | Urticaria Anafilaxia Enteropatías Colitis | Intolerancia a la lactosa Favismo Galactosemia Fenilcetonuria | Escombroidosis Latirismo Botulismo Síndrome aceite tóxico |
Dentro de las alergias alimentarias, se incluyen tanto las reacciones de patogenia inmunitaria mediadas por inmunoglobulina E (IgE) (alergia de tipo inmediato), como las producidas por cualquier otro mecanismo inmunitario conocido, las no mediadas por IgE. Es característico que en las primeras se encuentren títulos elevados de anticuerpos de clase IgE frente al alimento. En las segundas podemos encontrar aumento de anticuerpos pertenecientes a otras clases de inmunoglobulinas, complejos inmunitarios o respuestas de inmunidad mediada por células. También es posible una participación inmunitaria mixta.
Los alimentos más frecuentemente implicados dependen del grupo de edad, la localización geográfica y los hábitos alimentarios en la comunidad estudiada. En nuestro medio, son fundamentalmente por orden de importancia el huevo, la LV, el pescado, las frutas, los frutos secos y las leguminosas4. La LV suele ser el primer alimento no homólogo que reciben los seres humanos y, en consecuencia, se corresponde con el primer antígeno alimentario con el que entra en contacto el lactante. Estudios publicados en España muestran una incidencia entre el 0,36 y el 1,9% de alergia a PLV (APLV) en niños a lo largo del primer año de vida5,6.
En el caso de producirse una reacción a las PLV, esta podría ser mediada o no mediada por IgE:
- –
Reacciones alérgicas a PLV mediadas por IgE: son reacciones con patogenia inmunológica demostrada que se presentan de manera inmediata (generalmente en minutos y siempre en periodos inferiores a 1h). Se trata de reacciones comúnmente conocidas como de alergia o hipersensibilidad inmediata a PLV.
- –
Reacciones alérgicas a PLV no mediadas por IgE: son reacciones con patogenia no inmunológica o no precisada y que se presentan de manera tardía, en periodos superiores a 1h y que pueden demorarse hasta varios días. Se corresponden con las reacciones conocidas previamente, como de intolerancia a PLV y suelen localizarse en el tubo digestivo.
La APLV mediada por IgE presenta los signos y síntomas característicos de la hipersensibilidad inmediata, con una presentación aguda. Así, hasta en un 70% de los casos se observan reacciones de tipo cutáneo-mucoso (urticaria aguda, angioedema, eritema peribucal o en zonas de contacto, prurito faríngeo, enantema, edema de glotis, prurito y rash perianal) y un 13% de los pacientes presenta reacciones de tipo digestivo (vómitos, diarrea aguda, cólicos, rechazo del biberón, etc.). Únicamente un 1% presenta síntomas respiratorios (sibilancias recurrentes, estridor, tos, rinoconjutivitis o anafilaxia generalizada).
En cambio, los signos y síntomas de la APLV no mediada por IgE suelen tener una aparición tardía, en periodos superiores a 1h, y si bien puede presentar manifestaciones agudas como vómitos o diarreas tras la ingesta, por lo general, progresan a un carácter más crónico (diarrea crónica, fallo de medro, malabsorción intestinal con repercusión intestinal). En este contexto, debe tenerse en cuenta que el paciente experimenta una mejoría tras la supresión de las PLV y vuelve a recaer tras su reintroducción.
Según el tipo de mecanismo inmunológico implicado, tendremos diferentes cuadros clínicos con afectación de distintos aparatos y dentro de las alergias no mediadas por IgE vamos a encontrar, entre otras, la colitis alérgica eosinofílica, la proctocolitis alérgica o la proctocolitis hemorrágica del lactante (tabla 2).
Manifestaciones clínicas de la alergia a proteínas de leche de vaca en niños según el mecanismo inmunológico implicado.
| Síntomas | APLV mediada por IgE | APLV no mediada por IgE |
|---|---|---|
| Cutáneos | Urticaria Angioedema Dermatitis atópica Síndrome alérgico oral | Dermatitis atópica Rash de contacto |
| Digestivos | Vómitos Diarrea Síndrome alérgico oral | Estreñimiento Cólicos Enteropatía/enterocolitis Proctocolitis/colitis alérgica Regurgitaciones/vómitos Rechazo del alimento Fallo de medro |
| Respiratorios | Rinoconjuntivitis Asma (tos/sibilancias) | |
| Generales | Disfonía Shock anafiláctico |
APLV: alergia a proteínas de leche de vaca. Tomado de: Ortigosa L y García Merida29.
La colitis alérgica eosinofílica se caracteriza por 2 aspectos clínicos fundamentales. El primero es que la ingesta oral de proteínas induce una reacción inflamatoria limitada al recto y al colon sigma distal que va a provocar un cuadro de diarrea mucosanguinolenta, con conservación del estado general. El segundo es que la gran mayoría de los pacientes afectados de esta enfermedad son amamantados al pecho y, en menor medida, aparece en los lactantes alimentados con fórmulas basadas en PLV o de soja.
De hecho, se está observando un aumento de la incidencia de esta afección en lactantes alimentados exclusivamente al pecho7–11. Estos niños son generalmente sanos y tienen buen estado general, llamando la atención las deposiciones sanguinolentas y/o con moco que presentan. En algunas ocasiones, el número de deposiciones se ve aumentado, pero sin llegar a presentar una diarrea franca.
Habitualmente, la colitis alérgica eosinofílica se presenta en el primer semestre de vida, con una media entre los 30–60 días de vida, aunque pueden existir antecedentes de sangrado rectal recurrente (deposiciones con manchas o estrías visibles de sangre, mezcladas con moco, con o sin diarrea) durante varias semanas antes del diagnóstico, atribuidas erróneamente a fisuras anales12. Algunos autores han descrito cuadros de colitis alérgica presentados en la primera semana de vida, e incluso en el primer día de vida, postulando que son debidos a una sensibilización al antígeno ocurrido prenatalmente13–15.
Con la eliminación completa de las PLV de la dieta de la madre, el sangrado rectal suele desaparecer en las siguientes 48–72h.
Diagnóstico de colitis alérgica eosinofílicaEl diagnóstico se suele hacer basándose en la presentación clínica, en la resolución de los síntomas tras la exclusión de las PLV de la dieta y en la recaída, tras la reintroducción nuevamente de las PLV en la dieta del lactante. Como comentamos previamente, al ser esta una alergia no mediada por IgE, los estudios inmunoalérgicos (IgE total, RAST específicos a alérgenos alimentarios, pruebas cutáneas) son de escasa rentabilidad diagnóstica.
Lectura rápida
Se caracteriza por la presentación de deposiciones mucosas y con sangre macroscópica, generalmente en lactantes en el primer semestre de vida, con una edad media al diagnóstico de 30–60 días.
Puede ser incluso un cuadro de inicio desde el primer día de vida, y en lactantes alimentados exclusivamente con LM, como respuesta a las proteínas de LV (PLV) que está ingiriendo la madre en su dieta, y que pasan a través de la leche materna al lactante, produciendo un cuadro de diarrea mucosanguinolenta, pero con conservación del estado general del niño.
Lectura rápida
El diagnóstico se realiza fundamentalmente sobre la base de los hallazgos clínicos descritos y habitualmente no es necesaria la realización de pruebas invasivas, como la rectosigmoidoscopia (pero si se realiza, es característica la presencia de signos inflamatorios endoscópicos e infiltrados de eosinófilos en la piezas de mucosa rectal analizadas).
Pero cuando la rectorragia persiste durante varios días, la realización de exámenes complementarios puede servir de gran ayuda para el diagnóstico. Entre los datos analíticos generales podemos encontrar anemia, hipoalbuminemia y eosinofilia, pudiendo considerarse en esos casos como marcadores de mayor gravedad. En la ecografía de abdomen se puede observar engrosamiento de la pared colónica o de rectosigma. En el enema opaco se puede constatar mucosa en empedrado, espiculaciones y ulceraciones mucosas11.
En aquellos pacientes en los que persista el sangrado a pesar de la eliminación de las PLV de la dieta, podría plantearse una evaluación más invasiva, como la rectosigmoidoscopia, observándose macroscópicamente una colitis distal leve con eritema irregular y pérdida de la vascularización16,17.
También es característica la visualización de la mucosa con aspecto granulado. Microscópicamente, las biopsias suelen mostrar eosinofilia en la lámina propia y en la muscularis mucosa. No está bien establecido el número de eosinófilos precisos para el diagnóstico, pero para la mayor parte de los autores es suficiente que presenten un número de eosinófilos superior a 10 por campo de alta definición17–19.
La presencia de eosinófilos en el colon no siempre es sinónimo de colitis eosinofílica. Frecuentemente, se suele observar en estos niños hiperplasia nodular linfoide, sin que exista una clara asociación con esta entidad. La criptitis, los abscesos crípticos con predominio de polimorfonucleares, la distorsión glandular y la metaplasia de las células de Paneth característica de la enfermedad inflamatoria intestinal (EII) son poco frecuentes, aunque siempre hay que hacer un preciso diagnóstico diferencial con la EII dado el creciente aumento en la prevalencia de enfermedad de Crohn y colitis ulcerosa en niños y adolescentes, con presentación cada vez más frecuente en edades tempranas, incluso a lo largo del primer año de vida20.
Dada la benignidad de la colitis alérgica eosinofílica, en la mayoría de los casos el diagnóstico se basa en los datos clínicos y en la respuesta positiva a la retirada de las PLV de la dieta. Actualmente, la necesidad de realizar un estudio endoscópico y biopsias rectales en todos los lactantes con sospecha de colitis alérgica está en controversia, debiendo reservarse estas exploraciones para aquellos casos con sangrado rectal en el que fracasen los medios terapéuticos o que presenten importante repercusión clínica21.
Por ello, la prueba de eliminación/provocación con PLV va a ser el método de referencia diagnóstico para la colitis alérgica eosinofílica, aunque no es necesaria su realización en todos los casos. Está contraindicada en pacientes con reacción anafiláctica grave a la leche y tampoco es necesaria su realización cuando la historia clínica del paciente sea claramente compatible y reciente en relación con la exposición a la LV o cuando haya existido respuesta positiva a transgresiones o mínimos contactos.
Lectura rápida
El diagnóstico de esta entidad es clave, puesto que el tratamiento consiste fundamentalmente en la retirada de las PLV de la dieta del lactante o bien en las madres que amamantan a sus hijos, y en aquellos casos necesarios el cambio de la LM a una fórmula adaptada hidrolizada extensa o incluso elemental, con la consiguiente exposición a un riesgo nutricional para el lactante y su madre y un aumento importante en el gasto económico, algunas veces innecesario.
Lectura rápida
Una vez retirada la LV del lactante, o en los niños amamantados al pecho, de la dieta de la madre, se resuelve la sintomatología, que vuelve a reaparecer si se realiza una prueba de provocación con LV. El pronóstico de esta entidad es muy bueno, puesto que la mayoría de los lactantes van a tolerar PLV tras el año de vida.
Es de suma importancia un diagnóstico correcto de esta entidad. En un estudio realizado por Xanthakos et al22, en el que se incluyó a 22 lactantes con sangrado rectal, finalmente fueron diagnosticados de colitis eosinofílica el 64% de los casos estudiados. Asimismo se realizó una encuesta entre los miembros de la Sociedad Norteamericana de Gastroenterología, Hepatología y Nutrición Pediátrica y el 84% de ellos respondieron que empíricamente indicarían el cambio de la dieta a una fórmula extensamente hidrolizada o cambios en la dieta materna en lactantes con sangrado rectal. Concluyen diciendo que un número significativo de niños con sangrado rectal pueden no tener colitis alérgica y un diagnóstico incorrecto puede conducir a restricciones dietéticas, cambios a fórmulas lácteas más caras o en la dieta de la madre, e incluso retirar la lactancia materna de forma innecesaria22.
Por tanto, el diagnóstico de la colitis alérgica eosinofílica exige la exclusión de otras causas de colitis: de origen infeccioso, enterocolitis necrotizante, fisura anal, malformaciones vasculares, invaginación intestinal, divertículo de Meckel y la enfermedad inflamatoria intestinal, entre otras.
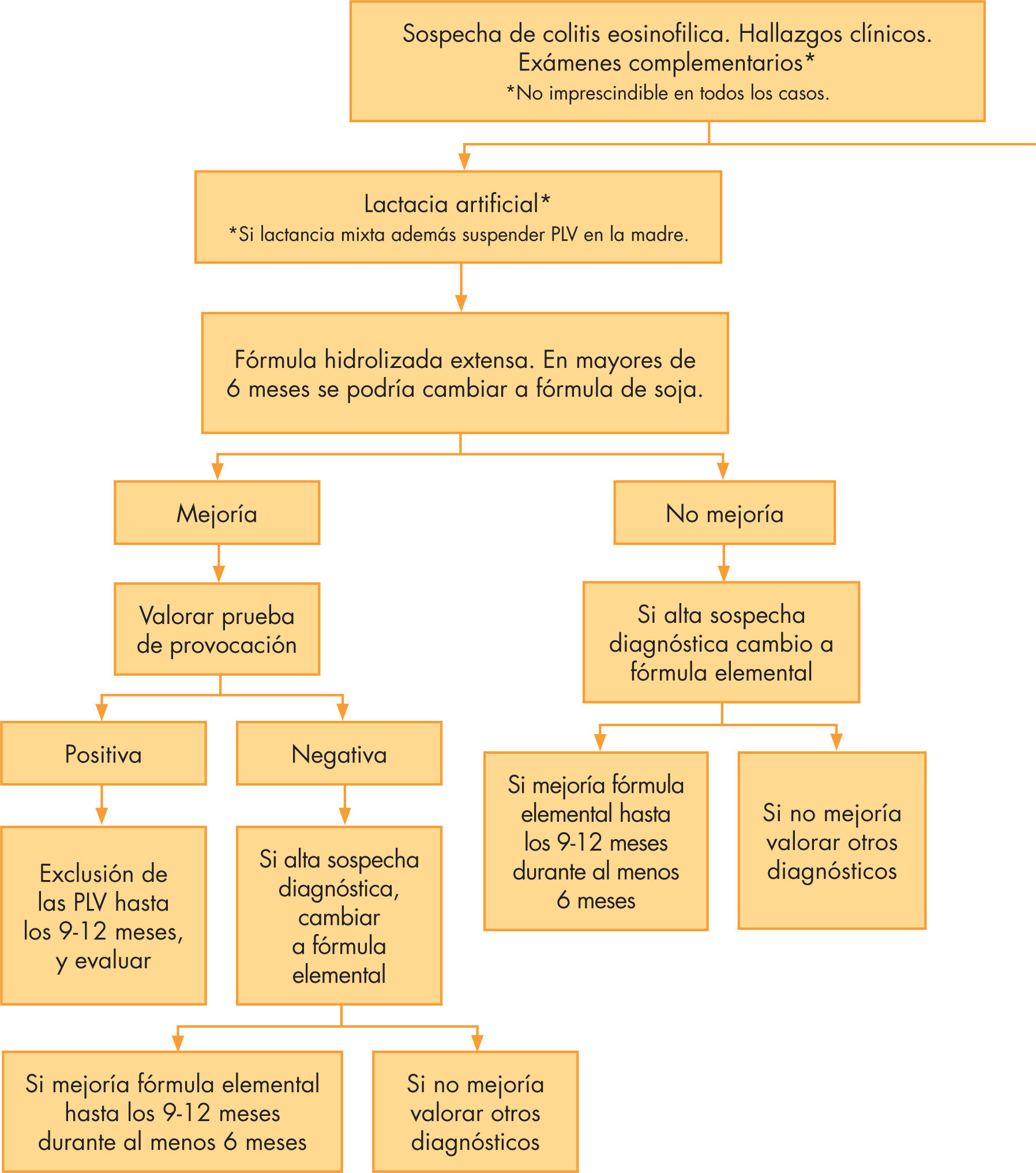
ManejoEl tratamiento de la colitis alérgica consiste en la eliminación de la LV de la dieta del lactante. En los lactantes alimentados a pecho exclusivamente, se debe retirar el aporte de PLV de la dieta de la madre mediante una dieta estricta sin leche de vaca ni derivados lácteos. La gran mayoría de los casos responden en un plazo de 72h; sin embargo, hasta una semana después de la eliminación de las PLV puede permanecer sangre oculta en heces.
Algunos autores abogan por mantener la restricción dietética materna durante más tiempo, al menos 2 semanas. Si existe mejoría, se debe reintroducir las PLV en la dieta materna durante una semana y, si reaparecen los síntomas, se debe suspender definitivamente hasta que el lactante cumpla 9–12 meses de edad, con al menos un periodo mínimo de 6 meses de exclusión de las mismas. En cambio, si persisten los síntomas y existe alta sospecha de colitis alérgica, se debe plantear la retirada de otros alérgenos de la dieta, puesto que se ha visto que asociado a la APLV pueden existir otras alergias alimentarias (huevo, pescados, frutos secos, trigo, etc.).
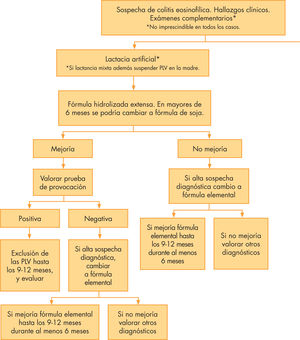
Si el lactante está siendo alimentado con lactancia artificial se debe sustituir la fórmula adaptada por una fórmula extensamente hidrolizada. No se recomienda la sustitución por fórmulas de soja, puesto que un porcentaje sustancial de pacientes pueden presentar conjuntamente APLV y a la soja (en torno a un 5–10%). En aquellos casos que no respondan al tratamiento con una fórmula extensamente hidrolizada, se debe modificar por una fórmula elemental, ya que hasta un 10% de estos pacientes pueden no tolerar las fórmulas hidrolizadas (fig. 2).
Después de los 6 meses de edad, el 50% de lactantes alimentados a pecho con restricción de PLV en la dieta materna van a tolerar el cambio a una fórmula adaptada y después de los 9 meses de edad, el 95%. Por tanto, el pronóstico de estos pacientes es excelente, siendo la gran mayoría de los niños capaces de tolerar la LV tras el año de vida. En el seguimiento a 20 años de estos pacientes, la progresión de esta entidad a una alergia alimentaria o a una colitis crónica es extremadamente rara.
PrevenciónDurante las últimas décadas estamos asistiendo a un incremento alarmante de enfermedades alérgicas, siendo cada vez más frecuentes el diagnóstico de lactantes con alergia frente a PLV.
Se ha debatido mucho, y sigue siendo objeto de continua controversia, acerca del papel que puede desempeñar la dieta durante la época del embarazo, la lactancia y el primer año de vida para el desarrollo o no de la enfermedad atópica, y en el caso que nos ocupa en la presentación de manifestaciones alérgicas a las distintas PLV.
En relación con la prevención para el desarrollo de APLV en lactantes y niños pequeños, no hay consenso unánime de cuáles son las recomendaciones universales que hay que utilizar para todos los niños, fundamentalmente durante el primer año de vida.
Hasta hace pocos años se recomendaba la utilización de estrictas dietas «hipoalergénicas», sobre todo para los lactantes considerados de alto riesgo (con padres y/o hermanos con alergia bien documentada), pero últimamente se están publicando los resultados de metaanálisis y estudios rigurosos que ponen en duda la efectividad de esas dietas tan restrictivas, que en ocasiones pueden conducir a problemas nutricionales a los lactantes que las siguen.
El Comité de Nutrición y la Sección de Alergia e Inmunología de la Academia Americana de Pediatría sugieren un cambio de las propias recomendaciones de este comité, en las que se aconsejaba el uso de fórmulas infantiles hipoalergénicas y recomendaciones restrictivas dietéticas para el manejo en la prevención de la enfermedad atópica23,24.
Así, se han puesto en duda los supuestos beneficios de esas intervenciones nutricionales precoces en la prevención o el retraso del comienzo de la enfermedad alérgica en niños de riesgo alto.
No existen evidencias científicas en la actualidad que aconsejen ningún tipo de restricción dietética durante el embarazo o la lactancia y, sin embargo, cada vez existen más argumentos a favor del mantenimiento de la lactancia materna exclusiva, al menos durante los primeros 4 meses, comparada con el empleo de fórmulas adaptadas elaboradas con proteína intacta de LV como método de prevención o retraso en la aparición de dermatitis atópica, APLV o asma en la primera infancia25–27.
En distintas series publicadas sobre estudios en niños de riesgo atópico alto que no estaban siendo alimentados exclusivamente con LM durante los primeros 4 a 6 meses, hay cierta evidencia de que el inicio de la enfermedad atópica se puede retrasar o prevenir si se utilizan fórmulas hidrolizadas en lugar de fórmulas adaptadas.
En este mismo sentido, hay poca evidencia de que el retraso en la introducción de la alimentación complementaria mas allá de los 4 a 6 meses pueda prevenir la presentación de enfermedad atópica, tal como indica el Comité de Nutrición de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica28.
Durante años, se ha venido preconizando y recomendando que las mujeres embarazadas de posibles niños con riesgo atópico evitasen en su alimentación la toma de alimentos potencialmente alergizantes (como frutos secos, huevos, leche de vaca, etc.), como una medida de prevención pasiva para el desarrollo de futuras alergias de su hijo, pero se ha demostrado que estas medidas no son eficaces para la prevención de la alergia alimentaria y, por otro lado, retirar estos alimentos de la dieta de la madre mientras dura la lactancia tampoco impide que en años posteriores se desarrollen enfermedades alérgicas en el niño, aunque puedan evitar o aminorar la manifestación de reacciones de alergia alimentaria durante los meses en los que se ha mantenido esa dieta de exclusión28,29.
Para intentar poner orden en toda esta controversia, a lo largo de los últimos años diversos paneles de expertos y los comités de Nutrición, Gastroenterología y Alergia Pediátrica de distintas sociedades científicas están publicando documentos de consenso, recomendaciones y guías para el diagnóstico, manejo y tratamiento de la APLV en niños, incluyendo recomendaciones para la prevención primaria de niños de riesgo atópico alto30–36, que se puede resumir en las siguientes recomendaciones:
Recomendaciones para lactantes de riesgo para el desarrollo de alergia a las proteínas de leche de vacaLas alergias alimentarias, sobre todo a las proteínas de leche de vaca, son un problema emergente en la edad pediátrica. Estas dependen de la predisposición genética del individuo, su inmunidad y factores ambientales, dando lugar a una reacción en el individuo, mediada o no por inmunoglobulina E. La clínica que provoca en el individuo puede ser diversa y será el aspecto fundamental para el diagnóstico, junto con el apoyo de exámenes complementarios y sobre todo con las pruebas de provocación.
Con los datos de medicina basada en la evidencia, y entendiendo como lactante de riesgo a aquel que tenga un familiar en primer grado (padre o hermano) con enfermedad alérgica suficientemente documentada, actualmente se pueden hacer las siguientes recomendaciones:
- –
Si el lactante está siendo alimentado con lactancia artificial, se la puede mantener y no es necesaria la utilización de ninguna fórmula especial, mientras se encuentre asintomático, con buen desarrollo pondero-estatural y sin manifestaciones clínicas indicativas de APLV.
- –
Si el lactante está siendo alimentado con LM, y se va a iniciar un suplemento de fórmula artificial, comenzándose con lactancia mixta, aunque existe cierto grado de controversia sobre qué tipo de fórmula utilizar, se puede recomendar el empleo de fórmulas hidrolizadas, al menos hasta cumplir los 4–6 meses de edad1,23,25,29–31.
En estas recomendaciones preventivas se insiste en la advertencia de evitar la exposición al tabaco, ya desde el momento del embarazo, y el empleo inadecuado de dietas hipoalergénicas/hipoantigénicas extremas y restrictivas que puedan conducir a una disminución a pérdida de tolerancia en estos lactantes de alto riesgo.
Recomendaciones para todos los lactantes- –
Las madres lactantes no tienen que realizar dietas especiales ni a lo largo del embarazo ni durante el tiempo que se prolongue la lactancia materna.
- –
Mantener y prolongar hasta los 4–6 meses la LM exclusiva.
- –
En caso de lactancia mixta, si se necesita un suplemento lácteo, recomendar la utilización de fórmulas adaptadas de LV, en lugar de leche entera.
- –
Retrasar la introducción de la alimentación complementaria hasta los 4–6 meses.
- –
No se recomienda el uso de preparados de soja para prevenir el desarrollo de APLV.