Puntos clave
- •
La AI suele ser leve o moderada, normocrómica, normocítica e hiporreticulocitaria, aunque si se mantiene el proceso puede llegar a ser microcítica e hipocroma, especialmente en los niños
- •
En la anemia de inflamación/infección (AI) hay un bloqueo del hierro como mecanismo de defensa, con hiposideremia, hipotransferrinemia e hiperferritinemia, principalmente por acción de la hepcidina estimulada por la interleucina-6
- •
Es importante diferenciar la AI aislada de la que se acompaña de anemia ferropénica (anemia mixta), pues tienen un manejo distinto
- •
Un índice alto de receptor soluble de la transferrina/log ferritina orienta hacia la anemia mixta
- •
La ferroterapia por vía intravenosa es más eficaz que la oral, pero no debe darse en infección activa y si no hay ferropenia asociada o falta de respuesta a la eritropoyetina
- •
La eritropoyetina puede mejorar la anemia, como en la insuficiencia renal crónica, pero son necesarios más estudios para su empleo en otras situaciones clínicas.
Desde hace tiempo se sabe que en la anemia inflamatoria (anemia de inflamación/infección [AI]) se produce una ferropenia funcional con secuestro de hierro en sus lugares de almacenamiento, y secundariamente una eritropoyesis restrictiva en hierro. El descubrimiento de la hepcidina como principal regulador del hierro a nivel sistémico ha permitido conocer que también es la principal proteína implicada en este bloqueo de hierro en respuesta a la liberación de citocinas inflamatorias. La AI engloba no solo procesos inflamatorios expresivos (anemia de infección, enfermedades autoinmunitarias), sino también a otras enfermedades donde la actividad inflamatoria es menor (insuficiencia renal crónica [IRC], insuficiencia cardiaca, enfermedad neoplásica, envejecimiento) y la anemia de enfermedad crítica. La expresión final de la anemia dependerá de cómo se expresen las diferentes citocinas en dichas enfermedades produciendo esa ferropenia funcional y contribuyendo además a la anemia por otros mecanismos adicionales1,2.
FisiopatologíaEl principal mecanismo de la AI es la situación de ferropenia funcional o de bloqueo del hierro, mecanismo de defensa en las infecciones para evitar que sea empleado por los microorganismos patógenos para su proliferación1,2. Dada la relación estrecha del estatus del hierro con este tipo de anemia, es importante hacer un resumen del metabolismo del hierro, para poder entender mejor los cambios que aparecen en situación de inflamación e infección. Se emplean las siglas inglesas de proteínas, citocinas y genes para su mejor reconocimiento por su mayor difusión internacional.
Homeostasis del hierro: una breve revisiónCiclo del hierro en el organismoNormalmente, el hierro disponible en el organismo para ser utilizado por los eritroblastos en la síntesis de hemoglobina proviene de 3 fuentes: una pequeña parte, de la absorción duodenal del hierro de los alimentos (1–2mg/día); otra, proveniente del hierro almacenado en el hígado, y la tercera, la más importante, del hierro liberado por los macrófagos proveniente del metabolismo de los hematíes senescentes fagocitados (20–30mg/día). El hierro trivalente Fe3+ de los alimentos se absorbe a través del transportador de metales divalentes (DMT-1) del borde en cepillo del enterocito tras la reducción a Fe2+ por una ferrorreductasa. También puede pasar directamente al interior de la célula duodenal en forma de heme. El hierro intracelular del enterocito, hígado o macrófago pasa a la circulación general a través de una proteína transportadora, la ferroportina, y desde ahí es oxidada a Fe3+ por la hefestina (membrana duodenal) o la ceruloplasmina (circulación sanguínea) para su transporte por la transferrina (TF). La TF saturada con 2 átomos de Fe (transferrina diférrica) se une al receptor 1 de la transferrina (TFR-1) de la membrana celular de los tejidos periféricos y eritroblastos, pasando al citoplasma por endocitosis. En los eritroblastos, el hierro es liberado desde el endosoma a través del DMT-1 hacia el citoplasma y la mitocondria donde se produce la síntesis del heme. En el macrófago, el hierro entra a través de la TF/TFR-1, pero principalmente lo hace por eritrofagocitosis. El almacenamiento del hierro en la célula se realiza por medio de la ferritina1–5.
Regulación sistémica1–6La hepcidina es la principal proteína implicada en la regulación del hierro. Se produce fundamentalmente en el hígado, y su función es unirse a la ferroportina, promoviendo su
Lectura rápida
La anemia de inflamación/infección (anemia inflamatoria [AI]) no solo acompaña procesos inflamatorios manifiestos, sino también a muchas enfermedades crónicas, a la enfermedad aguda crítica, al cáncer y al envejecimiento.
El mecanismo principal se debe a un bloqueo del hierro por los altos niveles de hepcidina circulatorios debidos al estímulo que sobre el promotor de su gen realiza la interleucina-6 liberada en la inflamación.
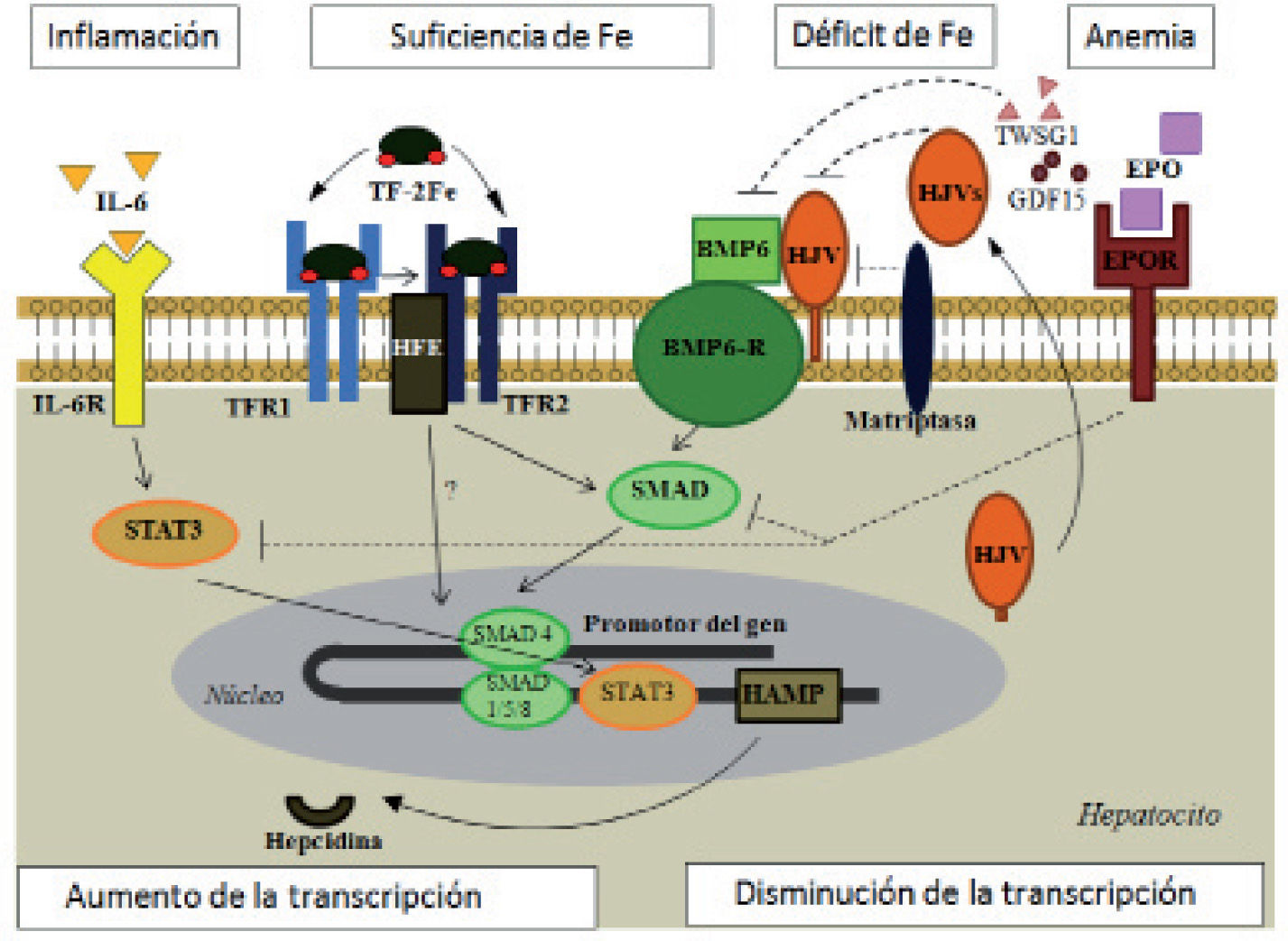
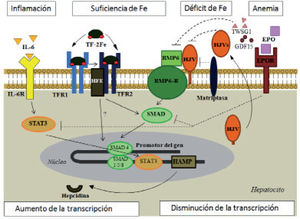
Vías de regulación de la hepcidina (adaptado de Muñoz4, Arrizabalaga23 y Coyne29).
BMP: proteína morfogénica del hueso; BMPR: receptor de BMP; EPO: eritropoyetina; EPOR: receptor de EPO; GDF: factor de diferenciación del crecimiento; HFE: gen de la hemocromatosis; HAMP: gen de la hepcidina; HJV: hemojuvelina; HJVs: HJV soluble; IL-6: interleucina-6; IL-6R: receptor de IL-6; SMAD: proteínas «small mothers against decantaplegic»; STAT: transductor de señal y activador de la transcripción; TF-2Fe: transferrina diférrica; TFR: receptor de la transferrina; TWSG1: homólogo 1 del «twisted gastrulation». Flechas continuas: estimulación; flechas discontinuas: inhibición.
Estatus del hierro. La sobrecarga férrica estimula la síntesis de hepcidina por las proteínas de la hemocromatosis (HFE), la hemojuvelina (HJV) y el receptor 2 de la transferrina (TFR-2), que lo hacen a través de la vía de señalización de la proteína-6 morfogénica del hueso (BMP-6)/SMAD4 o quizá directamente (HFE/TFR2-TFR1) induciendo la transcripción del gen de la hepcidina. En la ferropenia, la matriptasa actúa en sentido inverso, escindiendo la HJV, por lo que se dificulta la señal BMP/SMAD y disminuye la transcripción y síntesis de la hepcidina.
Hipoxia. En la anemia y la hipoxia se produce un estímulo de la producción de eritropoyetina (EPO) renal a través del factor 1α inducible por hipoxia (HIF-1α)7. Al unirse al receptor de la EPO, bloquea las vías SMAD y STAT impidiendo la transcripción del gen de la hepcidina8. Además el HIF-1α libera la isoforma soluble de la HJV (HJVs) que actúa de forma competitiva con la membranosa (HJVm), bloqueando la vía BMP/SMAD9 y puede añadirse una inhibición directa sobre el promotor de la hepcidina. Su unión al promotor del DMT1 incrementa su expresión en los enterocitos.
Señales eritropoyéticas. En la anemia con eritropoyesis restrictiva en hierro o ineficaz se generan 2 eritrocinas, el factor 15 de diferenciación del crecimiento (GDF15) y la TWSG1, que bloquean la vía BMP/SMAD.
Inflamación. Se libera interleucina-6 (IL-6), que se une a su receptor de membrana y estimula la expresión de la hepcidina a través de un activador de la transcripción (STAT3) en el promotor del gen.
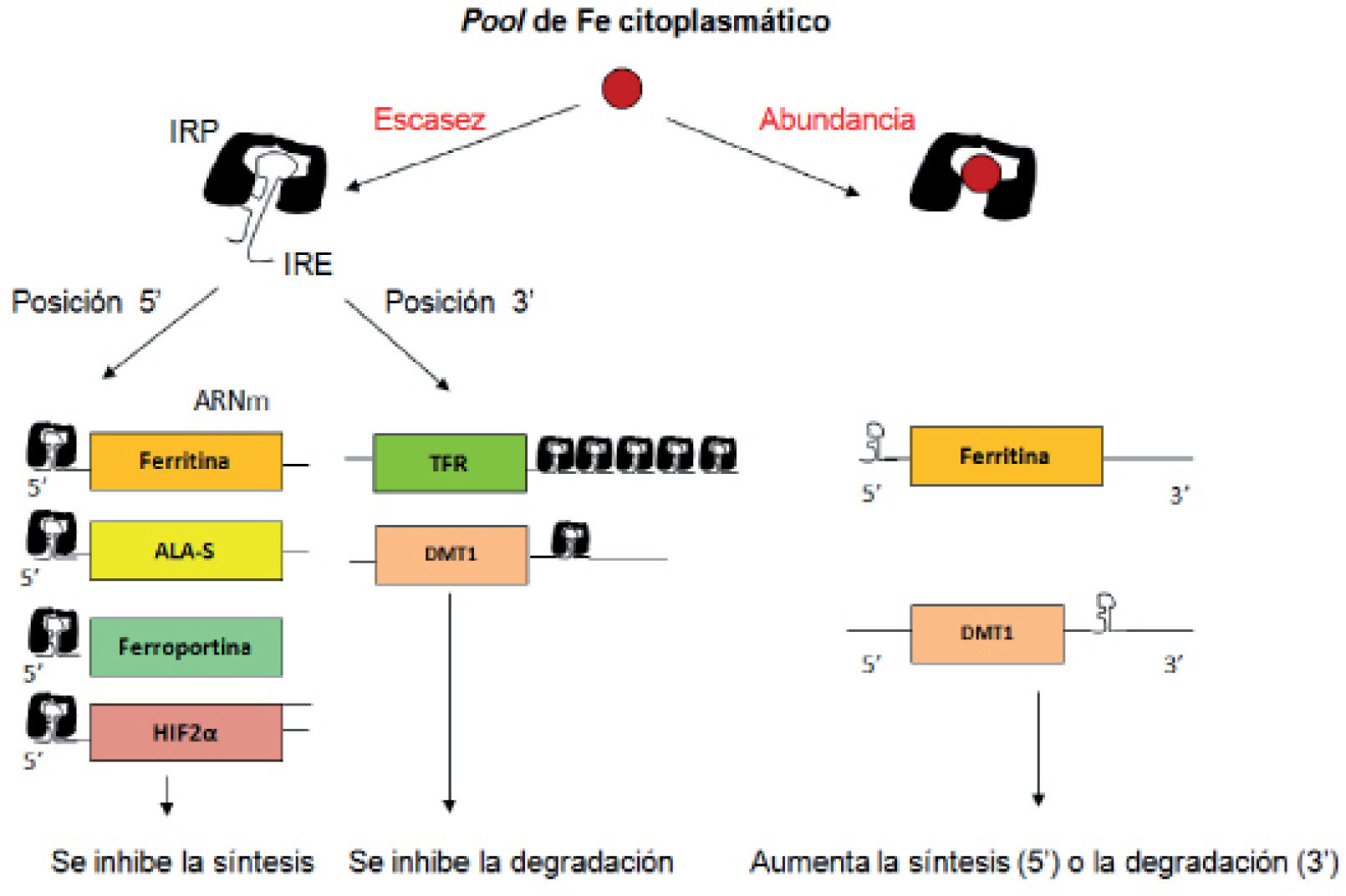
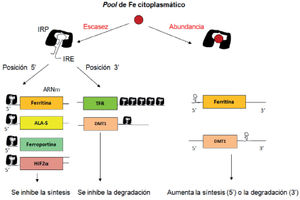
Regulación celular3,4Hay una regulación postranscripcional en la traducción del ARNm a proteína. Varias proteínas implicadas en la homeostasis del hierro (ferritina, ferroportina, TFR-1, DMT1, etc.) tienen un elemento silente que responde al hierro (iron-responsive element [IRE]) en el ARNm que no se traduce a proteína y que se une a unas proteínas citoplasmáticas respondedoras al hierro (IRP) cuando los niveles de hierro son bajos, siendo la situación inversa si hay sobrecarga de hierro. Si el IRE está en posición 5’ la unión del IRE con las IRP impide la síntesis de la proteína (ferritina, ferroportina); si el IRE está en posición 3’ impide su degradación (DMT1, TFR-1), por lo que aumentan sus niveles (fig. 2).
Regulación intracelular de la síntesis de proteínas relacionadas con el metabolismo del hierro.
ALA-S: ácido aminolevulínico sintetasa; DMT1: transportador 1 de metales divalentes; HIF-2α: factor 2α inducible por hipoxia IRE: elemento respondedor al hierro; IRP: proteínas respondedoras al hierro; TFR: receptor de la transferrina.
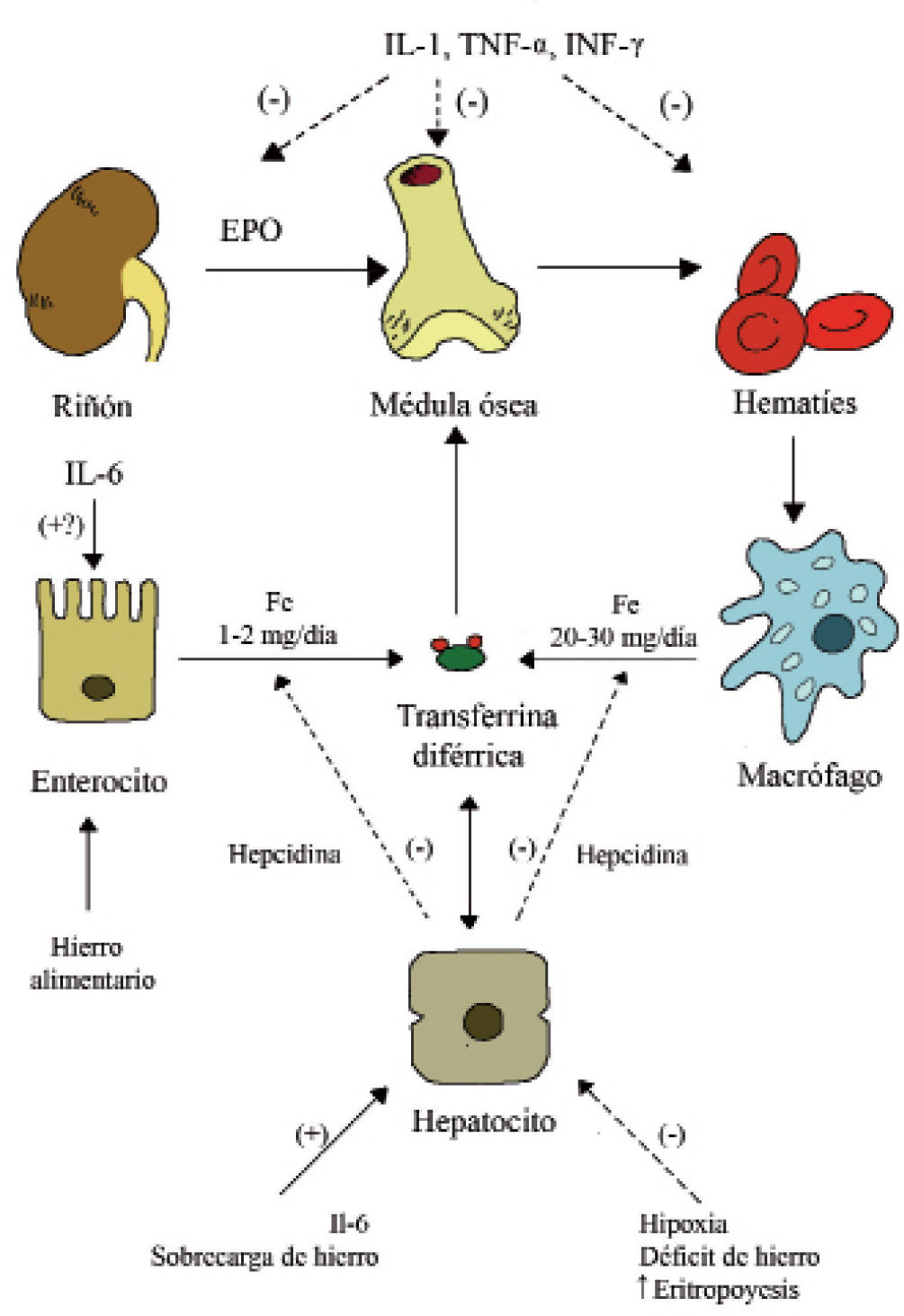
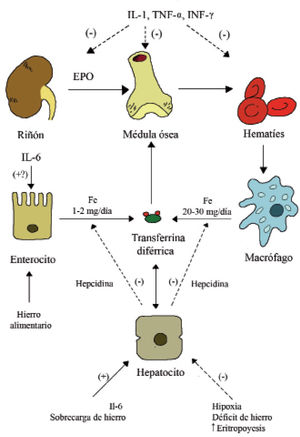
La AI se ha llamado también «anemia de enfermedad crónica» porque se ha asociado a múltiples procesos inflamatorios crónicos; sin embargo, se desarrolla rápidamente10 y no se ve en muchas enfermedades crónicas. En general, se debe a la liberación de citocinas inflamatorias cuya producción es diferente según el proceso sea agudo o crónico, variando a su vez en los distintos procesos y a lo largo de la evolución de los mismos2. Los mecanismos por los que se produce la anemia se resumen a continuación (fig. 3):
Efectos de la inflamación sobre la eritropoyesis y la homeostasis del hierro en los mamíferos. (–) y flechas discontinuas: efecto negativo. (+) y flechas continuas: efecto positivo.
EPO: eritropoyetina; IL: interleucina; INF: interferón; TNF: factor de necrosis tumoral. Modificado de Muñoz et al4.
El bloqueo de hierro tiene un efecto defensivo: a) priva a la circulación de hierro, necesario para el crecimiento y proliferación de los microorganismos y lo deriva hacia las células inmunitarias; b) el aumento de hierro en los macrófagos cataliza la formación de especies reactivas de oxígeno (ROS) contribuyendo a la muerte intracelular de los microorganismos11.
Vía hepcidina. Este es el principal mecanismo en la AI1. De todas las proteínas inflamatorias, la IL-6 es la que se correlaciona más claramente con los niveles de hemoglobina2, especialmente en la fase aguda1,4. Cuando en humanos se inyecta lipopolisacárido (LPS), componente mayoritario de la membrana externa de bacterias Gram–, se produce una inducción precoz y transitoria de factor de necrosis tumoral-α (TNF-α) e interferón-γ (INF-γ), seguido de un pico intenso de IL-6 a las 3–4h, apareciendo hipoferremia junto con la expresión máxima de hepcidina a las 6h12. La IL-6 actúa a través de la vía STAT3 aumentando la transcripción de la hepcidina. Esta degrada la ferroportina bloqueándose la absorción del hierro intestinal y quedando «secuestrado» el hierro en el macrófago1,2,4. A ello se suma una hiperproducción directa autocrina de hepcidina en los macrófagos como respuesta a la IL-613,14. Son características de la AI la hipoferremia, TF baja y valores normales o altos de ferritina1,15. La reducción de la disponibilidad del hierro, produce una eritropoyesis restrictiva en hierro. A
Lectura rápida
El bloqueo de hierro supone un mecanismo de defensa, pues limita el hierro para el metabolismo y la proliferación de los microorganismos. La hepcidina actúa degradando la ferroportina, principal exportador de hierro desde el citoplasma hacia la circulación, por lo que se bloquean la absorción de hierro duodenal y la liberación del hierro desde los macrófagos, quedando secuestrado en el interior de los mismos. Eso limita el hierro disponible para la hemoglobinización en los eritroblastos.
Lectura rápida
A la AI también contribuye una disminución de la eritropoyesis tanto por acción directa, como por disminución de la síntesis de eritropoyetina y aumento de la resistencia a su acción, debida a diferentes citocinas, junto con una disminución de la vida media de los hematíes.
La AI se presenta como una anemia de leve a moderada, independientemente del tiempo de evolución, es normocrómica y normocítica, aunque puede llegar a ser hipocroma y microcítica si se mantiene el proceso, especialmente en niños. La diferencia patogénica con la anemia ferropénica (AF), que puede llegar a ser grave, podría radicar en el diferente comportamiento del hierro citoplasmático del eritroblasto en ambas situaciones.
Aunque la IL-6 actúa por la vía STAT3, parece que también precisa de la vía del BMP/SMAD para que se produzca una actividad completa del promotor de la hepcidina4,14. Por esta vía actúa el TNF-α sorprendentemente en sentido inverso suprimiendo de forma potente la HJV y, por tanto, disminuyendo la hepcidina. Por otro lado, varias vías de respuesta al estrés inflamatorio del retículo endoplásmico, estimulan el promotor de la hepcidina través de la IL-6 e IL-1β3,4,15.
En algunos estudios clínicos no se ha visto correlación entre los niveles de IL-6 con los niveles de hepcidina, especialmente por la coexistencia de ferropenia, pero sí de la hepcidina con la ferritina y la hemoglobina, lo que indica que la demanda eritroide para el hierro es un estímulo mucho más potente para la expresión de hepcidina que el inflamatorio16,17.
Independiente de hepcidina. Las citocinas pueden actuar además sobre otras proteínas del metabolismo férrico, aumentando la síntesis de ferritina, la expresión del DMT-1, disminuyendo la transcripción de ferroportina, etc. (tabla 1)5,15,18,19. A esto se puede añadir el mecanismo intracelular traduccional: la síntesis de ferroportina se inhibe por la unión del IRP1 al IRE en posición 5’ de su ARNm, como respuesta a la inflamación y estrés oxidativo1; en el caso de la ferritina, los niveles altos de hierro intracelular aumentan su expresión por este mecanismo pero también por una región «de fase aguda» en la posición 5’ del ARNm1,15. La proteína DMT-1, que transporta el hierro desde el fagosoma, limita la disponibilidad del hierro en el macrófago para ser empleado por los organismos invasores en la inflamación. Por último, la lactoferrina, proteína estructuralmente parecida a la TF, presente en la leche y las secreciones mucosas y también producida por los neutrófilos en la inflamación, actúa captando el hierro en los lugares de infección y en las superficies mucosas, en especial frente a algunos microorganismos15.
| IL-6 | Incrementa la transcripción de hepcidina (vía STAT) |
| Induce la transcripción de ferritina | |
| INF-γ | Disminuye la proliferación y diferenciación de los precursores eritroides |
| Altera la respuesta de los precursores eritroides a la EPO | |
| Disminuye la expresión de la ferroportina | |
| Estimula la expresión del DMT1 | |
| TNF-α | Inhibe la producción de EPO renal |
| Disminuye la respuesta de los precursores eritroides a la EPO | |
| Disminuye la proliferación y diferenciación de los precursores eritroides | |
| Disminuye la vida media de los hematíes (diseritropoyesis, daño celular, aumento de eritrofagocitosis) | |
| Induce la transcripción de ferritina | |
| Disminuye la transcripción de hemojuvelina | |
| Aumenta la expresión del DMT1 | |
| IL-1 | Inhibe la producción de EPO renal |
| Disminuye la respuesta de los precursores eritroides a la EPO | |
| Disminuye la proliferación y diferenciación de los precursores eritroides | |
| Induce la transcripción de ferritina | |
| IL-1020,21 | Aumenta el TFR-1 en los macrófagos |
| Estimula la traducción de ferritina |
DMT-1: transportador 1 de metales divalentes; EPO: eritropoyetina; IL: interleucina; INF: interferón;; STAT: transductor de señal y activador de la transcripción; TNF: factor de necrosis tumoral; TFR: receptor de la transferrina.
Hay unos mecanismos que intentan superar esa situación de secuestro del hierro como son el aumento de la ceruloplasmina, que favorece el transporte de Fe3+ por la TF que, junto con la disminución de los valores de TF, aumenta la proporción de TF-diférrica capaz de ser captada por los eritroblastos2, como protección frente a la anemia. Además, hay otro mecanismo que también podría explicar el diferente comportamiento de la AI frente a la anemia ferropénica (AF) carencial, el reciente hallazgo de que existe una ferroportina que carece de IRE en el enterocito y eritroblasto20. En condiciones de ferropenia, seguiría habiendo ferroportina funcionante a pesar de la inhibición del ARNm por el IRE/IRP. En el eritroblasto, la ferroportina funcionante permitiría el paso de hierro para mantener las necesidades críticas sistémicas (mioglobinización, citocromos, etc.) pero disminuiría la hemoglobinización provocando microcitosis y a la larga, anemia grave. En la inflamación, sin embargo, los altos niveles de hepcidina degradan toda la ferroportina. Por tanto, el hierro es retenido en los eritroblastos, manteniéndose la producción de hemoglobina y el volumen corpuscular, resultando una anemia leve o moderada21.
Disminución de la eritropoyesis- 1.
Alteración en la proliferación y diferenciación de los progenitores eritroides debida a la acción de INF-γ, IL-1, TNF-α, y alfa-1-antitripsina4,5,22. De ellos, el INF-γ parece ser el más potente inhibidor y sus niveles guardan una relación inversa a la concentración de hemoglobina y el número de reticulocitos; actúa induciendo la apoptosis, disminuyendo la expresión de otros factores del crecimiento como el factor de células madre y también de un modo tóxico directo sobre los eritroblastos a partir del óxido nitroso formado en los macrófagos vecinos5,11,17,23. En la infección puede haber una verdadera aplasia o paralización de la proliferación de precursores eritroides (p ej., parvovirus9).
- 2.
Disminución de la respuesta de los precursores eritroides a la EPO por acción del INF-γ, IL-1, TNF-α2,4,22,23. Parece que los niveles altos de hepcidina pueden contribuir a la resistencia a la eritropoyetina. El empleo de un anticuerpo monoclonal antihepcidina restaura la respuesta a la eritropoyetina en un modelo de AI de ratón1.
- 3.
Respuesta inadecuada de producción de EPO a nivel renal como respuesta a la anemia4,5,22,23, que parece debida al factor nuclear-kβ (NF-kβ), uno de los principales factores de transcripción que inician y perpetúan la inflamación7, a través de la estimulación de las citocinas IL-1 y el TNF-α4,7 (tabla 1).
Lectura rápida
El diagnóstico se basa en los parámetros de hierro con hiposideremia, hipotransferrinemia e hiperferritinemia, acompañado de elevación de marcadores de la inflamación como la proteína C reactiva, la alfa-1-antitripsina o velocidad de sedimentación globular.
El diagnóstico diferencial principal es con la AI asociada a anemia ferropénica, (anemia mixta [AM]), situación frecuente, ya que el tratamiento es diferente. Una ferritina < 30ng/dl señala ferropenia. Con ferritina normal o alta, el aumento del índice de receptor soluble de la transferrina (TFRs/log ferritina) indica ferropenia asociada. Los niveles normales o bajos de hepcidina en situación de inflamación podrían ser muestra de ferropenia asociada, pero su determinación está mal estandarizada en la actualidad. La concentración de hemoglobina reticulocitaria (CHr) parece ser un marcador precoz de ferropenia funcional.
Lectura rápida
El tratamiento debe ser el de la causa que lo origina.
Cuando no es posible, se puede emplear ferroterapia en la AM, preferiblemente intravenosa por su mejor respuesta, asociado o no a eritropoyetina (EPO) recombinante. No debe administrarse hierro en infección activa porque puede empeorar la morbimortalidad. También es capaz de aumentar la toxicidad en la inflamación al disminuir la respuesta inmunitaria y aumentar las especies reactivas de oxígeno.
Se ha comprobado una disminución importante de la vida media de los hematíes24. Los mecanismos pueden ser por diseritropoyesis, daño eritrocitario (hemólisis) e incremento de la eritrofagocitosis. El efecto mayor sobre estos componentes parece ser del TNF-α4.
En las infecciones el componente de hemólisis puede contribuir de forma principal a la anemia por diferentes mecanismos: parasitación y destrucción directa (malaria, babesiosis), toxina (Clostridium perfringens), defecto intrínseco eritrocitario (déficit de glucosa-6-fosfato deshidrogenasa), anemia hemolítica autoinmunitaria o síndrome hemolítico urémico (Escherichia coli)9.
Pérdida de hematíesContribuye a la anemia en algunos procesos inflamatorios (p. ej., la enfermedad inflamatoria intestinal) o infecciones (fiebres hemorrágicas virales, parasitaciones intestinales). Además, las infecciones pueden inducir un proceso de coagulación intravascular diseminada que favorece el sangrado9.
DiagnósticoGeneralmente, la AI es leve o moderada (Hb 7–12g/dl), normocrómica y normocítica, sin respuesta reticulocitaria, o normocítica e hipocroma (en infecciones9), aunque puede ser microcítica e hipocroma, especialmente en la AI de larga evolución en niños que necesitan hierro adicional para el crecimiento1.
Perfil bioquímico férricoEn la práctica clínica el diagnóstico de la AI se basa en el análisis bioquímico de los parámetros de hierro. La ferritina es normal o alta, y bajos el hierro, la TF, la capacidad sérica de unión al hierro y la saturación de TF1,2,9,23. La concentración de hemoglobina reticulocitaria (CHr) (<28pg) o el porcentaje de reticulocitos hipocrómicos (%Hypo) (> 5%) medidos por citometría de flujo son parámetros sensibles y útiles en la detección temprana de la deficiencia funcional de Fe antes de que se manifieste en la población total de hematíes. El %Hypo es un marcador del tiempo medio de eritropoyesis restrictiva en hierro, mientras que la CHr es un parámetro a tiempo real (48h, por lo que puede ser muy útil para valorar la respuesta terapéutica2,6,11. El hecho de que haya un aumento de %Hypo o disminución de la CHr indica que hay un relativo desequilibrio entre la liberación de hierro a los eritroblastos (vía hepcidina) y la estimulación por EPO, siendo mayor la restricción de hierro que la supresión de los precursores eritroides y la producción de EPO11.
El principal diagnóstico diferencial no es con la anemia ferropénica, ya que en esta la ferritina está baja y la transferrina alta, sino en la que, además de la AI coexiste una anemia carencial, situación frecuente. Unos niveles de ferritina <30ng/dl indican una anemia carencial6. La ferritina parece elevarse dependiendo de la situación clínica y de forma proporcional a los valores basales25.
Un parámetro que ha resultado ser útil para diferenciarlas es el receptor soluble de la transferrina (TFRs). El TFRs representa un fragmento truncado del receptor membranoso y es directamente proporcional a la cantidad total de receptores membranosos. Su nivel no se afecta por la inflamación ni la citólisis; aumenta cuando hay una carencia absoluta de Fe, mientras que en la Al, sus niveles son normales porque también se afecta su síntesis por las citocinas inflamatorias2,26,27. Por ello, la correlación del TFRs con el logaritmo de la ferritina (el llamado índice del TFRs) discrimina aún mejor la AI de la anemia carencial ya que aprovecha la relación recíproca entre dichas variables con el déficit de hierro: el aumento del TFRs y la disminución de la ferritina26. Sin embargo, también carece de sensibilidad y especificidad y debe ser corregido por los reactantes de fase aguda en el contexto de inflamación6,11. Además, los niveles de TFRs pueden aumentar también con el incremento de la eritropoyesis, aunque sea ineficaz y se correlacionan con los niveles de EPO11,27.
Parámetros de inflamación y hepcidinaLa determinación de los niveles de citocinas no es fácil en la práctica habitual. Lo que se suele realizar es la proteína C reactiva (PCR) y la velocidad de sedimentación globular como medidas inespecíficas de inflamación, a los que habría que añadir la α-1-glucoproteína ácida para descartar inflamación subclínica25.
La hepcidina está elevada y se puede medir en sangre y en orina y puede orientar hacia el origen de la anemia. Un hierro y hepcidina bajos orientan hacia una anemia carencial y no AI9. Aunque en la actualidad es difícil su estandarización y los resultados no son comparables entre sí28, su determinación podrá ser una herramienta útil para esta y otras anemias en donde está implicado el metabolismo del hierro y la respuesta al tratamiento29.
Niveles de eritropoyetinaLos niveles de EPO pueden ser útiles en anemias con Hb<10g/dl (por encima de esos niveles permanecen en rango normal), sobre todo en algunos casos de AI para valorar la posible respuesta al tratamiento con EPO-recombinante5. (véase la tabla 2).
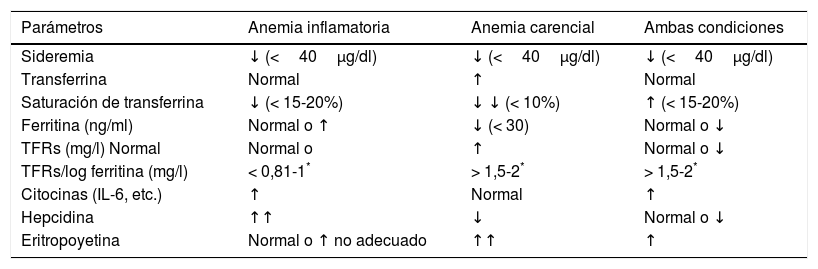
| Parámetros | Anemia inflamatoria | Anemia carencial | Ambas condiciones |
|---|---|---|---|
| Sideremia | ↓ (<40μg/dl) | ↓ (<40μg/dl) | ↓ (<40μg/dl) |
| Transferrina | Normal | ↑ | Normal |
| Saturación de transferrina | ↓ (< 15-20%) | ↓ ↓ (< 10%) | ↑ (< 15-20%) |
| Ferritina (ng/ml) | Normal o ↑ | ↓ (< 30) | Normal o ↓ |
| TFRs (mg/l) Normal | Normal o | ↑ | Normal o ↓ |
| TFRs/log ferritina (mg/l) | < 0,81-1* | > 1,5-2* | > 1,5-2* |
| Citocinas (IL-6, etc.) | ↑ | Normal | ↑ |
| Hepcidina | ↑↑ | ↓ | Normal o ↓ |
| Eritropoyetina | Normal o ↑ no adecuado | ↑↑ | ↑ |
TFRs: receptor soluble de la transferrina. Sus niveles normales tienen gran variabilidad interlaboratorios.
Lo fundamental en la AI es tratar la causa que lo origina, pero cuando esto no es posible, el tratamiento a emplear es controvertido. En la anemia por insuficiencia renal crónica (IRC) o por cáncer, la anemia se correlaciona con una mortalidad mayor, aunque podría estar relacionado con la severidad de la enfermedad6,23.
Opciones clásicasCuando la AI tenga un componente ferropénico, hay que administrar hierro. En la AI el hierro oral no se absorbe por el bloqueo duodenal producido por la hepcidina; la respuesta será algo mejor en las anemias mixtas. Los niveles de hepcidina podrían determinar qué pacientes son buenos candidatos para el hierro oral6. De forma práctica, si la anemia no es importante, se podría ver la respuesta a un ciclo de hierro oral.
Hierro por vía intravenosaEl objetivo es contrarrestar el bloqueo funcional del hierro. Se ha comprobado que el hierro parenteral incrementa la respuesta a la EPO recombinante en la IRC30, cáncer31 o enfermedad inflamatoria intestinal32, mejorando la calidad de vida. Inhibe la formación de TNF-α, disminuyendo la actividad inflamatoria de algunas enfermedades como la artritis crónica juvenil o la IRC5. Como contrapartida, el hierro es un nutriente esencial de microorganismos e inhibe la actividad del IFN-γ, comprometiendo la respuesta inmunitaria, además de aumentar las ROS que pueden causar daño tisular5,33,34. La respuesta a infecciones (TBC35, malaria36, infecciones intestinales37) puede empeorar con la sobrecarga de hierro y, en cambio, la ferropenia, puede conferir cierta resistencia a las mismas. Por eso estaría contraindicado el tratamiento durante la infección activa, a no ser que la anemia sea importante y se esté tratando la causa de la infección38. En las enfermedades inflamatorias la administración de hierro puede aumentar su toxicidad29 y es difícil de caracterizar por el aumento de ferritina como reactante, luego solo estaría indicado si existe además una ferropenia verdadera34.
Eritropoyetina recombinanteEl objetivo en este caso será contrarrestar la menor producción renal y respuesta del eritroblasto. El fracaso suele estar asociado a una escasa disponibilidad
Lectura rápida
El tratamiento con EPO recombinante permite contrarrestar la disminución de la producción renal y menor respuesta del eritroblasto mejorando la anemia y la calidad de vida. Una CHr baja indicaría la necesidad de ferroterapia por vía intravenosa asociada al tratamiento con EPO, aunque la EPO aislada puede liberar el hierro de los depósitos al inhibir la síntesis de hepcidina; además actúa como inmunomodulador. Sin embargo, su empleo solo está bien establecido en la insuficiencia renal crónica, puede ser perjudicial en algunas situaciones (infecciones, algunos tipos de cáncer, etc.), por lo que se necesitan más estudios en otras situaciones clínicas.
En el futuro se podrá actuar inhibiendo algunas vías metabólicas, como ya se ha realizado con éxito en la forma sistémica de la anemia crónica juvenil.
Sin embargo, esto puede no ser tan simple. En presencia de inflamación y déficit de hierro, los niveles de hepcidina responden más a la demanda eritropoyética de hierro, que a la inflamación6. El tratamiento con EPO disminuye la hepcidina y permite liberar el hierro de los depósitos8,39,40, y a la vez podría mejorar la absorción duodenal de hierro de forma independiente a la hepcidina41, por lo que podría darse de forma aislada y tendría menor toxicidad, siempre que hubiera unos mínimos depósitos de hierro40. Si hay ferropenia o con ferritina < 100ng/ml, se podría intentar dar hierro oral por el menor bloqueo de hierro a nivel duodenal, aunque la repuesta clínica es mejor cuando se añade hierro por vía intravenosa30–32.
Se han descrito receptores de EPO en células inmunitarias, con disminución de la actividad inflamatoria tras el tratamiento con EPO7 que podría tener un efecto beneficioso como agente inmunomodulador tanto en el cáncer23 como en las enfermedades inflamatorias o infecciones7. También se han encontrado receptores de EPO en múltiples líneas celulares malignas (mama, ovario, etc.) y hay resultados contradictorios sobre el posible papel de la EPO, que podría aumentar la actividad tumoral5,23 o perjudicar en algunas infecciones7. Por tanto, se necesitan más estudios controlados en las diferentes situaciones clínicas que valoren no solo la respuesta a la anemia, sino la morbilidad y supervivencia a largo plazo.
Posibilidades futurasLa resistencia al tratamiento con EPO puede estar producida por una respuesta inflamatoria severa, por lo que el empleo conjunto de fármacos con efecto antiinflamatorio podría ser eficaz. En este contexto, se ha empleado la pentoxifilina, que reduce la IL-623, o el empleo de estatinas, que disminuyen las citocinas proinflamatorias y la hepcidina en pacientes con IRC23,42,43.
Otra nueva estrategia de tratamiento es la administración de sustancias que contrarresten alguna vía metabólica:
Anti-IL-6 (tocilizumab): en la enfermedad de Castleman, o en la anemia crónica juvenil con altos niveles de IL-6, el empleo del anticuerpo monoclonal tocilizumab resuelve o mejora la anemia44,45.
Antihepcidina: en experimentación animal en un modelo con sobreexpresión de hepcidina humana e inflamación, el anticuerpo neutralizó la hepcidina normalizando los parámetros de hierro y la respuesta a dosis terapéuticas de EPO46.
Supresión de la señal BMP: se han empleado las moléculas dorsomorfina y LDN-19318923,29, que bloquean el receptor de la BMP reduciendo la respuesta inflamatoria. En ratas, la HJVs disminuye la expresión de hepcidina bloqueando su inducción por la IL-647.