Puntos clave
- •
La citometría de flujo en el campo de la medicina es una técnica diagnóstica de aplicación directa en el estudio de poblaciones celulares presentes en líquidos humanos
- •
La principal aplicación en hematooncología pediátrica es el diagnóstico del inmunofenotipo de las leucemias infantiles, donde la información que aporta tiene valor en el pronóstico y en el tratamiento
- •
La citometría de flujo se emplea en la cuantificación de los niveles de enfermedad mínima residual durante el tratamiento de las leucemias infantiles, y su información tiene valor pronóstico
- •
La citometría de flujo es diagnóstica en casos de inmunodeficiencias debidas a déficit de poblaciones linfocitarias
- •
La cuantificación del contenido de progenitores hematopoyéticos que contienen los productos de trasplante de sangre periférica movilizada se realiza rutinariamente mediante citometría de flujo
La citometría de flujo es una técnica de amplia utilización en investigación biomédica, pero que también tiene un uso importante en la práctica del diagnóstico clínico. Dado que la citometría está naturalmente preparada para estudiar partículas en suspensión en un medio líquido, tejidos humanos como la sangre, la médula ósea, el líquido cefalorraquídeo, o producidos en procesos patológicos (derrame pleural, derrame sinovial) o en el curso de técnicas diagnósticas (lavado broncoalveolar, por ejemplo), son muestras biológicas especialmente preparadas para la aplicación de técnicas de citometría de flujo. No es de extrañar pues que las especialidades de Hematología y de Inmunología sean las que han contemplado mayor aplicación de esta tecnología en sus actividades rutinarias de diagnóstico y seguimiento de los pacientes. En este artículo vamos a repasar someramente las aplicaciones principales de la citometría a la práctica de la pediatría, lógicamente a las enfermedades hematológicas e inmunitarias de los niños.
Principios de la citometría1,2Existen varios componentes básicos en cualquier citómetro de flujo. Una suspensión de células es inyectada en un líquido capaz de ordenar el flujo de células de manera individual y a gran velocidad. Dicho flujo pasa por un punto en el que incide la luz de al menos un láser, aunque los citómetros actuales cuentan generalmente con 2 o más fuentes de luz. Desde este punto, la luz incidente se transforma en emisiones a diferentes longitudes de onda (diferentes fluorescencias), algunas de las cuales son recogidas por detectores que amplifican las señales y las transforman a formato digital. Los citómetros actuales están preparados para manejar simultáneamente entre 6 y 10 detectores. Toda esta información es integrada en un ordenador, capaz de almacenarla para su análisis posterior.
La citometría puede estudiar partículas en suspensión, en nuestro caso, células. De cada una de ellas es capaz de identificar una serie parámetros intrínsecos, derivados del tamaño y la complejidad de la partícula (se refiere a características de su envuelta y de su contenido), y parámetros extrínsecos, derivados del marcaje de las partículas con sustancias que emiten fluorescencia. En el caso que nos ocupa, estas sustancias son anticuerpos que reconocen algún marcador y que están provistos de un fluoróforo, molécula capaz de absorber y emitir fluorescencia.
Dado que se pueden medir múltiples parámetros por cada célula (fig. 1), la población total estudiada puede dividirse en subgrupos cada vez menores, según las características de interés. La información que se genera en el análisis de los datos, bien de la población total o bien de las diferentes subpoblaciones, se presenta de manera estadística. Lo más frecuente es el porcentaje de células que cumplen algún criterio (p. ej., el porcentaje de linfocitos T, aquellos que son positivos para el marcador CD3). Este tipo de información se obtiene cuando dentro de la muestra existen células que son positivas para un marcador y células que son negativas para el mismo. Existe otra situación en la que lo que sucede es un cambio continuo en la expresión de un marcador, existen células que lo expresan con poca intensidad mientras otras lo hacen con intensidad elevada. En este caso se prefiere utilizar el parámetro que es la intensidad media de fluorescencia y se habla de poblaciones que son débilmente positivas o que son intensamente positivas.
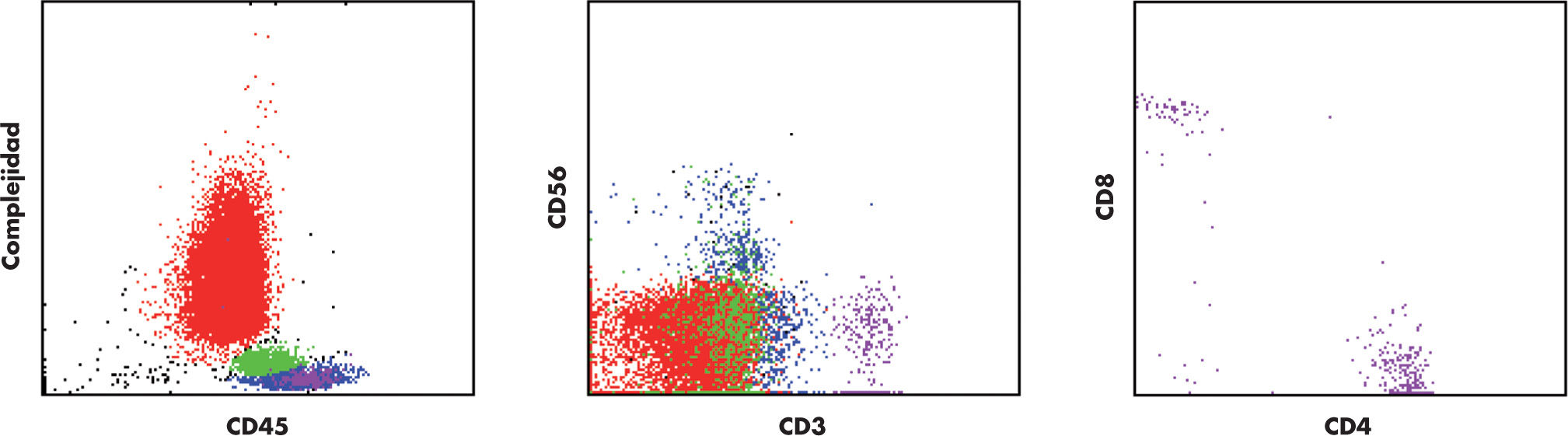
Imágenes de citometría de flujo de muestra de sangre periférica. A la izquierda se representa la gráfica de todas las células sanguíneas ordenadas según los niveles de expresión del marcador panleucocitario CD45 (eje horizontal) y la complejidad celular (eje vertical). Los granulocitos expresan niveles medios de CD45 y presentan gran complejidad celular (coloreados en rojo); los monocitos expresan mayores niveles de CD45 y tienen menor complejidad (coloreados en verde), mientras que los linfocitos son los leucocitos que expresan el marcador a mayor intensidad y presentan menor complejidad celular (coloreados en azul). En el medio se representa la gráfica de todas las células sanguíneas ordenadas según los niveles de expresión del marcador CD3 (eje horizontal) y el marcador CD56 (eje vertical). Ni los granulocitos (rojos) ni los monocitos (verdes) expresan estos marcadores. Una proporción de linfocitos (azules) tampoco los expresan, representando a los linfocitos B. Los linfocitos T expresan CD3 y no CD56, están coloreados en morado. Las células NK (natural killer) expresan CD56 y no CD3. Nótese las 2 subpoblaciones de células NK, unas expresan niveles bajos de CD56 (NKdim), mientras las demás expresan niveles altos de CD56 (NKbright). A la derecha se representa la gráfica de todos los linfocitos T ordenados según los niveles de expresión del marcador CD4 (eje horizontal) y el marcador CD8 (eje vertical).
El principal problema que requiere el apoyo de la citometría de flujo es, por su frecuencia, el diagnóstico de niños con leucemias agudas. Son la causa más frecuente de cáncer en la edad pediátrica, destacando las leucemias linfoblásticas agudas. En el momento del diagnóstico se realiza un aspirado de médula ósea, que se encuentra casi totalmente infiltrada por las células leucémicas. Esta muestra es procesada para el estudio, que consiste en la preparación de varios tubos que combinan un número amplio de anticuerpos que reconocen otros tantos marcadores específicos de los estadios madurativos de los linfocitos B o T, o de las células mieloides. De esta manera, se identifica el linaje de la leucemia y su estadio madurativo. Ambas informaciones tienen valor en el pronóstico y en el tratamiento de la enfermedad3.
Otra información muy importante que se obtiene en el momento del diagnóstico es la identificación de marcadores específicos de la leucemia, que permitirá reconocerla en muestras de médula ósea que se obtienen una vez que se ha iniciado el tratamiento. Todos los protocolos actuales requieren que se cuantifiquen los niveles de enfermedad mínima residual (EMR) en momentos concretos durante el tratamiento, cuando el niño está en situación de remisión completa. La importancia es tal que si dichos niveles son superiores a un umbral determinado, el paciente deber recibir un tratamiento más intenso o bien debe recibir un trasplante alogénico de progenitores hematopoyéticos, puesto que su riesgo de recaída es muy elevado en esa situación. La cuantificación de los niveles de EMR se realiza en muchos centros mediante citometría de flujo. Para ello, el hematólogo reconoce y cuantifica la presencia de células leucémicas buscando aquellos marcadores que identificó el día del diagnóstico y que diferencian las células malignas de las sanas3. En general, se aprovecha de alguna de estas características: aberración antigénica (expresión de un marcador que no corresponde al linaje de la leucemia), expresión asincrónica (expresión de un marcador que no corresponde al estadio madurativo), sobreexpresión antigénica (expresión de un marcador a una intensidad excepcionalmente elevada) o fenotipo ectópico (expresión de un marcador ausente en la hematopoyesis normal).
Una aplicación de la citometría de flujo que se está desarrollando en la actualidad en el campo de las leucemias es la detección de células leucémicas en el líquido cefalorraquídeo, para lo que presenta mayor sensibilidad que la citología convencional4.
Por último, la citometría de flujo puede identificar en muestras de médula ósea la presencia de células tumorales metastásicas, por ejemplo, células de neuroblastoma5. Estas células expresan marcadores distintos de los que expresan las células hematopoyéticas normales, por lo que son fácilmente identificables. Se puede aplicar en el momento del diagnóstico del tumor, para la estadificación de la enfermedad, y también para detectar la presencia de EMR durante el tratamiento.
Uso de la citometría en hematopatías no malignas6Las inmunodeficiencias son enfermedades de la edad pediátrica, para alguna de las cuales el citómetro de flujo es una herramienta diagnóstica. La ausencia de alguna población linfocitaria específica (linfocitos T, linfocitos B, células natural killer [NK]), bien de manera aislada o bien combinada, es fácilmente identificable en un análisis de una muestra de sangre periférica. En el caso de la inmunodeficiencia por déficit de HLA clase II, la ausencia de expresión de HLA-DR por parte de linfocitos y monocitos en una muestra de sangre se detecta fácilmente también por citometría. Otra enfermedad hematológica no maligna en la que la citometría apoya el diagnóstico es el síndrome linfoproliferativo autoinmunitario. En este caso, un porcentaje elevado de linfocitos T que no expresan ni CD4 ni CD8, linfocitos T dobles negativos, es un criterio diagnóstico.
La citometría de flujo en el diagnóstico de inmunodeficiencias no solo se utiliza para cuantificar poblaciones de células inmunitarias, sino que también se emplea en ensayos funcionales.
Uso de la citometría en el trasplante hematopoyéticoDesde hace más de una década, una de las fuentes de progenitores hematopoyéticos más empleadas es la sangre periférica movilizada. Siempre que se utiliza esta fuente, hay que conocer la cantidad total de células progenitoras presentes. El número absoluto de progenitores por kilo de peso del receptor debe alcanzar un nivel que garantice el injerto. Dicha cuantificación se realiza mediante citometría de flujo de manera rutinaria, evaluando el porcentaje de células que expresan el marcador CD34 en el producto de aféresis7.
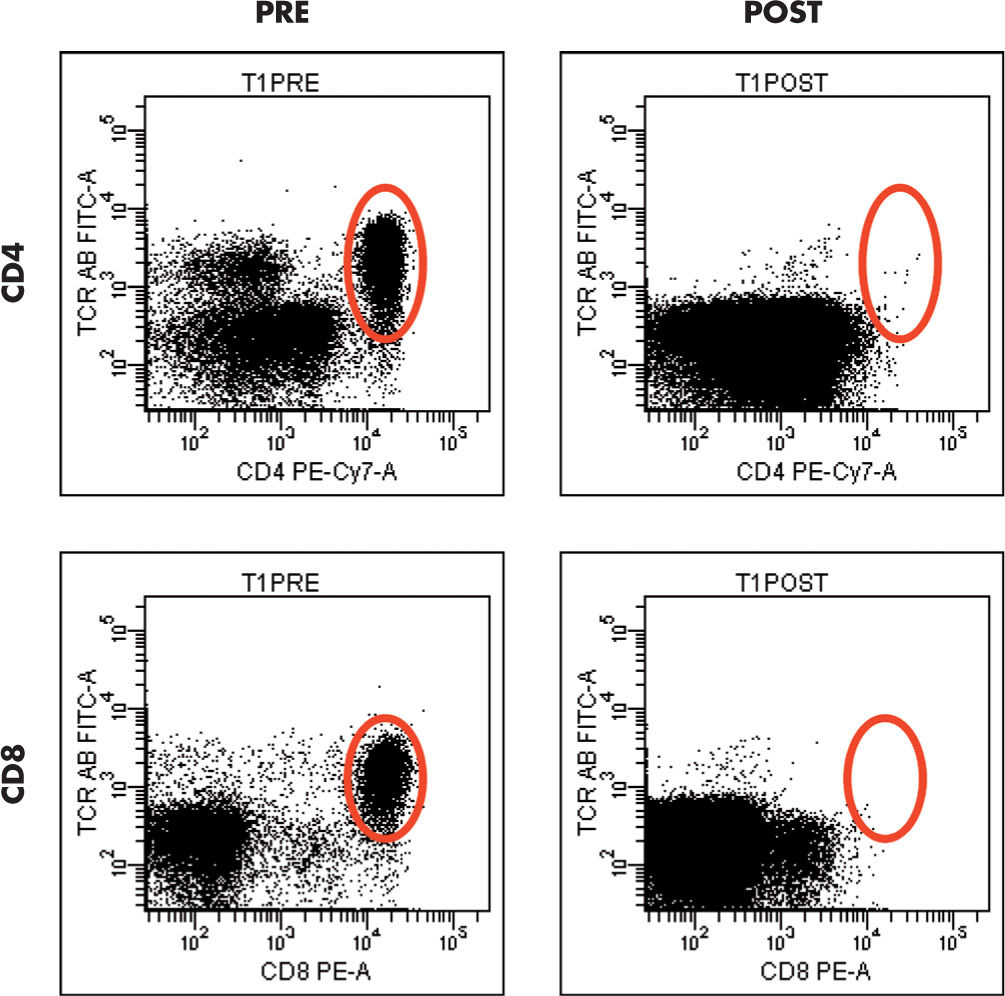
En algunos centros se realizan técnicas de manipulación celular en el inóculo antes del trasplante de donante alogénico o haploidéntico. El objetivo es eliminar los linfocitos maduros que pueden ocasionar una complicación muy temida, la enfermedad injerto contra huésped (EICH). Los métodos empleados consisten en la aplicación de técnicas inmunomagnéticas para purificar los progenitores (selección positiva) o para eliminar los linfocitos maduros (selección negativa). Al final del procedimiento y antes de infundir las células recuperadas, el médico necesita conocer la cantidad de progenitores y la cantidad de linfocitos contaminantes del inóculo. Esta información se consigue mediante citometría de flujo realizada sobre una muestra del producto que se trasplantará. Este estudio también sirve de control de calidad del procedimiento de manipulación realizado (fig. 2).
Análisis del resultado de un procedimiento de eliminación de linfocitos T en muestra de aféresis. A la izquierda se representa la muestra antes del procedimiento, y a la derecha después. En la parte superior se muestran los linfocitos T CD4 y en la inferior los T CD8. La cuantificación se realiza sobra la base de la cantidad de células contenidas en las áreas representadas en las elipses. Para identificar los linfocitos T se combinaron anticuerpos anti-CD4, anti-CD8 y anti-TCRαβ.
En el periodo después de realizar un trasplante hematopoyético, las células infundidas deben regenerar tanto la hematopoyesis como el sistema inmunitario. Esto sucede a lo largo del tiempo, y las interferencias con la recuperación normal aumentan el riesgo de infecciones. La cinética de reconstitución depende de muchos factores: tipo de acondicionamiento para el trasplante, fuente de células hematopoyéticas, tipo de inmunosupresión, compatibilidad donante-receptor8–10. Cuando el trasplante es alogénico o haploidéntico, la reconstitución inmunitaria puede acompañarse de EICH. La citometría de flujo puede ayudar a estudiar la cinética de la reconstitución inmunitaria postrasplante. Para ello es preciso analizar muestras de sangre del receptor a diferentes momentos postrasplante. Las primeras poblaciones en aparecer tras el periodo de aplasia son células mieloides (sobre todo granulocitos) y células NK. La detección de un porcentaje mayoritario de linfocitos T CD8 en los días periinjerto suele indicar el rechazo del trasplante y refleja la proliferación de los linfocitos citotóxicos del receptor frente a las células infundidas del donante. La recuperación de cifras normales de linfocitos B y T sucede de forma gradual durante el primer año postrasplante. La recuperación funcional, por ejemplo la producción de inmunoglobulinas, se retrasa respecto de la recuperación numérica. La citometría de flujo puede identificar en cada momento cómo se están regenerando las diferentes subpoblaciones de linfocitos T memoria, el número de linfocitos naïve circulantes, la ratio CD4:CD8 y otros muchos parámetros que pueden relacionarse con el estado clínico del paciente.