Puntos clave
- •
Existen 2 dispositivos de granulocitoféresis: Cellsorba® (fibras de poliéster no tejidas), que fija granulocitos y linfocitos, y Adacolumn® (acetato de celulosa) que fija selectivamente granulocitos y monocitos
- •
Además de retirar leucocitos activados, la aféresis produce incremento del número de granulocitos CD10-negativos (inmaduros), disminución de citocinas proinflamatorias (factor de necrosis tumoral alfa [TNF-α], interleucina [IL-6],IL-8 e IL-1β) e incremento de citocinas inhibitorias (IL-1, IL-10)
- •
La granulocitoféresis es un método razonablemente eficaz y seguro para obtener la remisión en niños con colitis ulcerosa corticodependiente o resistente, sobre todo en pacientes en el primer episodio, en enfermedad de corta evolución y en aquellos que no han recibido esteroides
- •
El procedimiento requiere 2 accesos venosos de buen flujo. La pauta más habitual de tratamiento consiste en 1–2 sesiones semanales de 60min a un flujo de 30ml/min, hasta un total de 5–10 sesiones
La colitis ulcerosa (CU) es una enfermedad crónica del colon que causa inflamación y ulceración del recto que se extiende de forma continua y con longitud variable en sentido proximal. La forma de afectación más frecuente en niños es la pancolitis. La historia natural se caracteriza por episodios de actividad inflamatoria más o menos frecuentes, graves y prolongados que alternan con periodos de remisión. En algunos casos, la actividad inflamatoria es continua, con gran afectación de la calidad de vida. Son frecuentes las manifestaciones extraintestinales. Se trata de un trastorno relativamente común, con una incidencia de 7–9/100.000 y una prevalencia de 200–250/100.000. La enfermedad se inicia en la edad pediátrica en un 15% de los casos y es frecuente la familiaridad. Se ha avanzado mucho en el conocimiento de la etiopatogenia de la enfermedad, pero la etiología exacta continúa siendo desconocida.
Tratamiento de la colitis ulcerosaEl arsenal terapéutico disponible para el manejo de la CU es muy amplio. Los derivados del ácido 5-aminosalicílico (5-ASA) y los corticoides son más efectivos que el placebo para inducir la remisión. Además, los 5-ASA y los inmunosupresores (azatioprina, mercaptopurina) reducen el riesgo de recaída en los pacientes con enfermedad quiescente. Sin embargo, una proporción considerable de pacientes no responden al tratamiento convencional o desarrollan una corticodependencia. En este tipo de pacientes pueden utilizarse los inmunosupresores de acción rápida (ciclosporina, tacrolimús) y la llamada terapia biológica (infliximab, adalimumab). Los pacientes refractarios al tratamiento médico pueden requerir una panproctocolectomía con anastomosis ileoanal. Esta cirugía tiene una baja mortalidad, pero una morbilidad elevada y la calidad de vida posquirúrgica es muy variable.
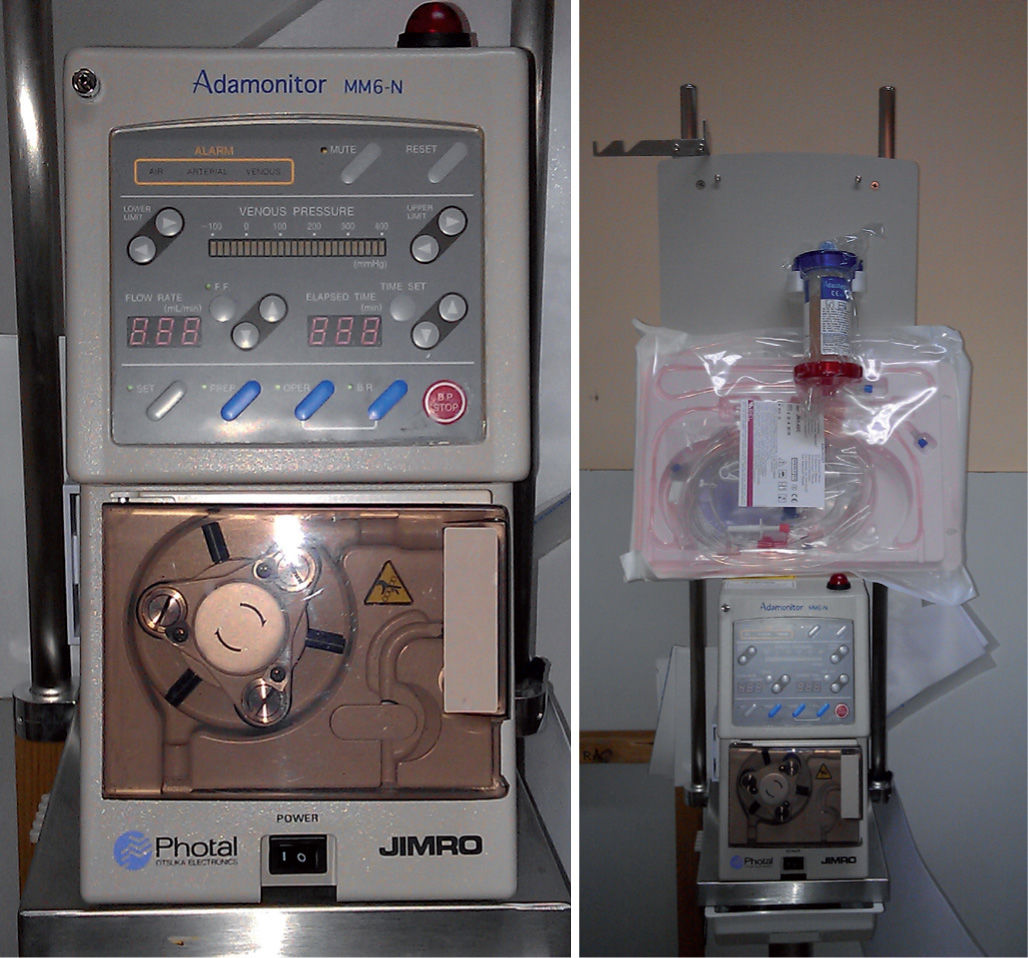
La causa exacta de la CU no es completamente conocida, pero muy probablemente incluye factores ambientales que desencadenan una respuesta anómala del sistema inmunitario del tracto digestivo en individuos genéticamente susceptibles. Los leucocitos (granulocitos y monocitos) son reclutados en la mucosa intestinal y tienen el potencial de iniciar y amplificar la inflamación con la liberación de una cascada de citocinas proinflamatorias. Estas observaciones han impulsado el desarrollo de técnicas de aféresis para retirar células blancas activadas de la sangre periférica. Existen 2 dispositivos de aféresis selectiva de leucocitos. La columna de leucocitoaféresis (LCA) Cellsorba® (Asahi Medical, Japón), que consiste en un cilindro de fibras de poliéster no tejidas que fijan granulocitos y linfocitos, y el dispositivo Adacolumn® (JIMRO Otsuka, Japón), constituido por 220g de gránulos de 2mm de diámetro de acetato de celulosa que fijan selectivamente granulocitos y monocitos (GMA) (fig. 1).
Mecanismos de acciónLa depleción del exceso de células inmunitarias activadas es una explicación obvia del beneficio terapéutico. Las comparaciones entre el flujo aferente y eferente de la columna de Adacolumn® indica que las esferas de acetato de celulosa absorben aproximadamente el 65% de los granulocitos, el 55% de los monocitos y solo un 2% de los linfocitos filtrados1,2. El recuento de linfocitos, eritrocitos y plaquetas no muestra cambios significativos después de la GMA. En contraste, el filtro de Cellsorba® fija el 90–100% de los granulocitos y monocitos, el 30–60% de los linfocitos y una cierta proporción de plaquetas1,2. Además de la retirada de células blancas activadas, la aféresis produce cambios en los perfiles de las poblaciones celulares con un incremento del número de granulocitos CD10-negativos (inmaduros) que pueden atenuar la respuesta inflamatoria, disminución en la liberación de citocinas proinflamatorias (TNF-α, IL-6, IL-8 e IL-1β), incremento en los niveles de citocinas inhibitorias (IL-1, IL-10), disminución de los niveles circulantes de L-selectina y otros efectos potenciales.
Modo de aplicaciónLa aféresis requiere 2 accesos venosos centrales o periféricos de buen flujo. La sangre es drenada hacia la columna y, una vez filtrada, retorna hacia el acceso venoso contralateral. Durante el procedimiento se administra heparina para evitar la coagulación en el sistema extracorpóreo. La velocidad de perfusión habitual es de 30ml/min y la duración de la sesión 60min, aunque se han referido mejores resultados con sesiones de 90min3. Dado el volumen de sangre que debe permanecer fuera del torrente circulatorio durante el procedimiento, se requiere un peso mínimo del paciente de 18–20kg. La pauta más utilizada es de una sesión semanal durante 5 semanas consecutivas4, pero se ha referido mayor eficacia, sin incremento de la incidencia de efectos secundarios, con la terapia intensiva de 2 sesiones semanales5. Los pacientes con buena respuesta pueden recibir una sesión semanal durante 5 semanas o pasar a terapia de mantenimiento con una sesión mensual hasta completar 10 sesiones en total.
Granulocitoféresis en el adultoSe ha utilizado la granulocitoféresis en pacientes con CU en diversas situaciones clínicas (libres de esteroides, corticorrefractarios, corticodependientes)1–6, proctitis ulcerosa refractaria7 y reservoritis8, obteniendo la remisión en el 60–85% de los casos. La respuesta es mejor en pacientes libres de esteroides, en el primer episodio de CU o en enfermedad de corta duración. Por el contrario, la enfermedad crónica y las úlceras colónicas profundas son predictores de mala respuesta3. El tratamiento con 5 sesiones de GMA disminuye significativamente la recurrencia en pacientes con alto riesgo de recaída (calprotectina fecal > 250μmg/g heces)9. La curación mucosa es uno de los objetivos fundamentales en el tratamiento de la CU. Se ha observado que los pacientes tratados con GMA que consiguen la curación mucosa (más frecuente cuando la lesión endoscópica es moderada) tienen menor riesgo de recaída10. Los estudios comparativos entre LCA y GMA muestran una eficacia similar con ambos dispositivos11. Todos los estudios confirman que se trata de un tratamiento seguro, con efectos secundarios escasos (5–6%) y leves (mareo, náuseas, fiebre, rubor, dolor abdominal)4, que raramente obligan a suspender el procedimiento.
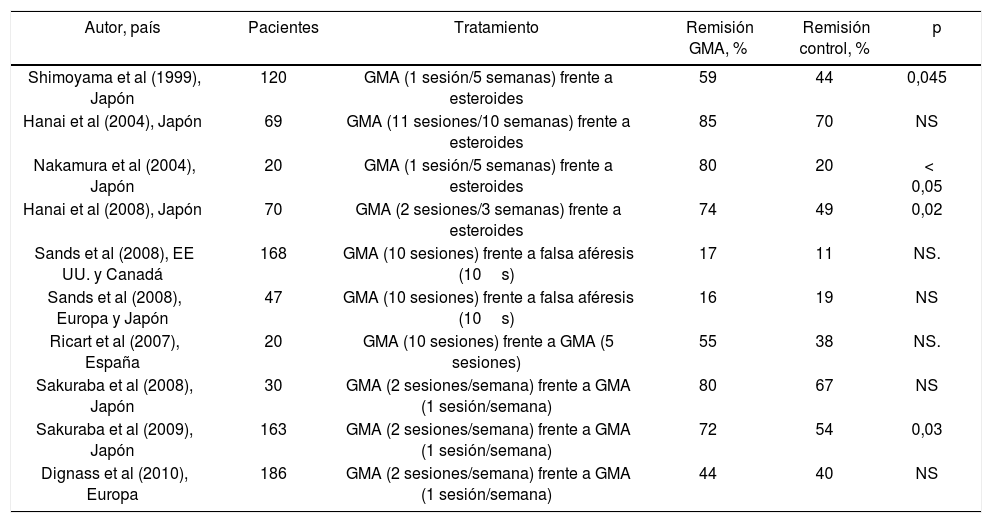
Una de las mayores dificultades para valorar la utilidad de la granulocitoféresis en el tratamiento de la CU es la escasez de estudios aleatorizados y controlados. La mayor parte de los estudios publicados son abiertos sobre series cortas de pacientes. Un reciente metanálisis revisa los resultados de 7 ensayos con GMA, que incluyen a 594 pacientes con CU activa, concluyendo que la GMA induce la remisión clínica en una mayor proporción de pacientes que la terapia convencional y que los efectos secundarios son mucho menos frecuentes que con esteroides12. Otro metanálisis más amplio revisa los resultados de 10 ensayos aleatorizados y controlados utilizando GMA13 (tabla 1). Cuatro ensayos comparan la GMA con esteroides y observan tasas de remisión mayores y efectos secundarios menos frecuentes en los pacientes que reciben GMA. Dos series comparan la GMA con falsa aféresis como placebo no demostrando diferencias entre ambas, aunque la GMA es significativamente superior al placebo en los pacientes con enfermedad activa confirmada endoscópicamente (p=0,03). Los otros 4 ensayos comparan la GMA intensiva (2 sesiones/semana) con la convencional (1 sesión/semana) observando mayores tasas de remisión con la terapia intensiva. Seis de los 10 ensayos revisados se desarrollaron en Japón, circunstancia que puede suponer una limitación de las conclusiones por las posibles diferencias clínicas, genéticas y ambientales respecto de los pacientes occidentales.
Características de ensayos aleatorizados y controlados de tratamiento con granulocitoféresis en adultos con colitis ulcerosa.
| Autor, país | Pacientes | Tratamiento | Remisión GMA, % | Remisión control, % | p |
|---|---|---|---|---|---|
| Shimoyama et al (1999), Japón | 120 | GMA (1 sesión/5 semanas) frente a esteroides | 59 | 44 | 0,045 |
| Hanai et al (2004), Japón | 69 | GMA (11 sesiones/10 semanas) frente a esteroides | 85 | 70 | NS |
| Nakamura et al (2004), Japón | 20 | GMA (1 sesión/5 semanas) frente a esteroides | 80 | 20 | < 0,05 |
| Hanai et al (2008), Japón | 70 | GMA (2 sesiones/3 semanas) frente a esteroides | 74 | 49 | 0,02 |
| Sands et al (2008), EE UU. y Canadá | 168 | GMA (10 sesiones) frente a falsa aféresis (10s) | 17 | 11 | NS. |
| Sands et al (2008), Europa y Japón | 47 | GMA (10 sesiones) frente a falsa aféresis (10s) | 16 | 19 | NS |
| Ricart et al (2007), España | 20 | GMA (10 sesiones) frente a GMA (5 sesiones) | 55 | 38 | NS. |
| Sakuraba et al (2008), Japón | 30 | GMA (2 sesiones/semana) frente a GMA (1 sesión/semana) | 80 | 67 | NS |
| Sakuraba et al (2009), Japón | 163 | GMA (2 sesiones/semana) frente a GMA (1 sesión/semana) | 72 | 54 | 0,03 |
| Dignass et al (2010), Europa | 186 | GMA (2 sesiones/semana) frente a GMA (1 sesión/semana) | 44 | 40 | NS |
La mayor parte de las referencias de tratamiento de CU con granulocitoféresis en el niño corresponde a casos aislados o series de muy pocos pacientes14–18. No existen estudios aleatorizados y controlados en niños. Los resultados referidos son muy similares a los obtenidos en el adulto en cuanto a eficacia y seguridad. El estudio retrospectivo más amplio de tratamiento con GMA incluye a 22 niños con CU corticodependiente o refractaria19. Se utilizó la pauta habitual de 5 sesiones de aféresis de 60min de duración con intervalo semanal a un flujo de 30ml/min. Se observó una disminución significativa del índice pediátrico de actividad de colitis ulcerosa (PUCAI) (p=0,0007), una reducción significativa de la dosis de esteroides (p=0,004) y una remisión mantenida a los 3 meses. Solo 2 pacientes presentaron recaída. El procedimiento fue bien tolerado y solo se observaron efectos secundarios leves (cefalea), que no obligaron a suspender el procedimiento.
Más recientemente, se ha publicado un estudio prospectivo abierto de tratamiento con LCA en niños con CU refractaria20. El estudio incluye 23 niños (19 con CU moderada y 4 grave) que reciben tratamiento con 2 columnas de LCA de diferentes volúmenes. Se observó una mejoría significativa de la frecuencia defecatoria, presencia de sangre en heces, dolor abdominal y fiebre junto a disminución significativa de la calprotectina fecal, mejoría de las alteraciones endoscópicas y disminución de la dosis de esteroides. No se observaron diferencias significativas en los resultados de los pacientes tratados con columnas de diferente volumen. Presentaron efectos secundarios leves el 61% de los pacientes. Los más frecuentes fueron disminución del hematocrito y de la concentración de hemoglobina.
En resumen, la granulocitoféresis es un método razonablemente eficaz y seguro para obtener la remisión en pacientes pediátricos con CU corticodependiente o resistente y en pacientes en el primer episodio o en enfermedad de corta evolución, sobre todo aquellos que no han recibido esteroides. La pauta más habitual incluye 1–2 sesiones semanales hasta un total de 5–10 sesiones de 60 min a un flujo de filtrado de 30ml/min.