La diabetes tipo 2 (DM2) es un trastorno metabólico multisistémico, de etiología heterogénea, en el que intervienen tanto factores genéticos como ambientales. Se caracteriza por la existencia de resistencia a la insulina (IR) junto con una disfunción en la secreción de ésta1.
La prevalencia de DM2 en niños y adolescentes se ha incrementado alarmantemente en la última década de forma paralela al aumento de obesidad2–6. Ésta constituye la causa más frecuente de IR en la infancia y adolescencia7. Asimismo, y también asociado al incremento de la obesidad, recientemente se ha descrito un aumento en la prevalencia de 2 condiciones metabólicas consideradas como prediabéticas: la alteración de la glucemia en ayunas (AGA) y la alteración de la tolerancia a la glucosa (ATG)3,6. Todas estas entidades se asocian a un incremento de la hipertensión arterial (HTA), perfil lipídico aterogénico y lesiones precoces de aterosclerosis, con el consiguiente incremento del riesgo cardiovascular.
Puntos clave
La verdadera prevalencia e incidencia de DM2 en la infancia permanece desconocida debido a la ausencia de cribado rutinario. No obstante, hay numerosos datos que confirman que la prevalencia de DM2 en niños y adolescente se ha incrementado significativamente en la última década, no sólo en Estados Unidos sino también en diversos países de Europa, Asia, África, Australia y América del sur4,8–11.
La DM2 no fue reconocida en al edad pediátrica hasta principio de los años setenta12. Aunque la DM1 sigue siendo la forma más frecuente de diabetes en esta edad, la DM2 ha llegado a ser más común que la DM1 en algunos países, como Japón y Taiwán13,14. En Europa su incidencia sigue siendo baja, del orden del 0,5-1%2,6,15. En España no hay datos publicados; en nuestra experiencia supone sólo el 1% de los pacientes diabéticos. En Estados Unidos la DM2 representa un 7-45% de los pacientes diagnosticados de diabetes2,6,16,17. Globalmente, ha habido un incremento importante de su incidencia en la última década8,13,14,18.
FisiopatologíaLa DM2 se caracteriza por grados variables tanto de IR, principalmente en músculo, tejido graso e hígado, como de disfunción de célula β. Ambos factores tienen origen mixto: genético y adquirido.
En situaciones de IR, inicialmente hay un aumento de actividad de la célula β. En esta adaptación están implicados: el incremento del metabolismo de la glucosa en dicha célula, la señalización por ácidos grasos libres (AGL) y la sensibilidad a las incretinas (GLP1, entre ellas) junto a una mayor actividad del sistema nervioso parasimpático en los islotes pancreáticos. Además, en las primeras fases, se produce una expansión de la masa celular. Estas adaptaciones pueden fallar por defectos genéticos o adquiridos.
El desarrollo de la hiperglucemia en la DM2 está precedido por una fase de hiperinsulinemia secundaria al aumento de la actividad de la célula β ante la IR. Ésta permite mantener, al menos durante un tiempo, la normoglucemia. Posteriormente, cuando se produce el fallo progresivo de la célula β, en el que desempeña un papel importante la hiperglucemia postingesta, se llega a una situación de desdiferenciación celular y pérdida de masa celular por apoptosis. La disfunción de la célula β parece tener un papel crítico en la patogenia de la DM2.
Tanto la IR como el declinar de la célula β son fenómenos precoces. Ya en las fases previas a la diabetes, como son la AGA y la ATG, hay IR y defectos secretorios de insulina, lo cual apoya la existencia de una base genética. Cuando aparece la hiperglucemia, aunque se evidencie una marcada hiperinsulinemia, hay un déficit relativo de ésta en relación con el valor de glucosa.
En la disfunción de la célula β intervienen: la glucotoxicidad, la lipotoxicidad y el acúmulo de sustancia amiloide, entre otros. Los mecanismos de actuación no son bien conocidos. Tras la fase inicial de hiperinsulinemia, se va progresivamente alterando la fase de secreción precoz de insulina, lo que lleva a hiperglucemia posprandial y, más tarde, hiperglucemia en ayunas. La hiperglucemia aumenta el estrés oxidativo y, con el tiempo, va ejerciendo un efecto tóxico sobre la célula β, creándose un círculo vicioso entre aumento de glucemia y deterioro de la función de la célula β.
En la DM2 se ha evidenciado también una alteración en el procesamiento de proinsulina a insulina que, a su vez, induce una disfunción de la célula β y un depósito de sustancia amiloide, disminuyendo la captación de glucosa e inhibiendo la secreción de insulina. Sin embargo, no está claro si este depósito es causa o consecuencia del defecto de secreción de insulina.
En la IR parecen intervenir varios mecanismos: incremento de las AGL, de las citocinas inflamatorias y de las adipocinas que modulan la acción de la insulina. El acúmulo de triglicéridos, especialmente en la grasa visceral, lleva a la formación de adipocitos grandes que son resistentes a la insulina para inhibir la lipólisis, por lo cual se incrementan los valores de AGL y glicerol que, a su vez, incrementan la IR en el músculo y en el hígado.
El tejido graso hipertrofiado libera además citocinas inflamatorias: factor de necrosis tumoral alfa (TNF)-α e interleucina 6, entre otros, que interfieren en la cascada de señalización de la insulina. Además, este tejido adiposo hipertrofiado produce una cantidad disminuida de adiponectina que tiene un efecto sensibilizador a la insulina en el músculo y en el hígado.
También parece desempeñar un papel significativo en la génesis de la DM2 la disfunción mitocondrial. Hoy se aboga que esta disfunción mitocondrial puede causar IR en tejidos periféricos y alteración de la secreción de insulina inducida por la glucosa en las células β, así como una reducción en la masa de dichas células.
Finalmente, la DM2 probablemente representa una interacción compleja entre distintos genes y factores ambientales. La importancia del factor genético, poligénico, se basa en la observación de que hijos de pacientes con DM2, delgados y normoglucémicos tienen un metabolismo oxidativo de la glucosa reducido, y una disminución de la síntesis del glucógeno muscular. Hasta la actualidad, sólo un pequeño número de genes se han podido implicar en su riesgo: el gen TCF7L2 (gen 2 del factor de trascripción 7), el gen de la calpaína 10, del canal de K dependiente de ATP (Kir 6.2), gen del factor hepatonuclear 4, del receptor activado por el perisoma gamma (PPARg), del sustrato 1 del receptor de la insulina, del gen WFS1, entre otros. Estos genes involucrados en el desarrollo de la célula β y en la síntesis de insulina, parecen contribuir sustancialmente al riesgo de DM219,20.
Lectura rápida
La diabetes tipo 2 (DM2) es un trastorno multisistémico de naturaleza heterogénea, en el que intervienen tanto factores genéticos (herencia poligénica) como ambientales. Su prevalencia en la edad pediátrica se ha incrementado alarmantemente en los últimos años, de forma paralela al aumento de la obesidad en el ámbito mundial.
Los factores de riesgo asociados al desarrollo de la DM2 en la edad pediátrica incluyen: el sobrepeso/obesidad, la historia familiar positiva, pertenecer a grupos étnicos específicos de riesgo, el sexo femenino y otras condiciones que cursan con IR (fenotipo de IR).
Sobrepeso. Según la definición del CDC (índice de masa corporal [IMC] > percentil 85), es el factor de riesgo más importante para el desarrollo de la DM2 y predispone al desarrollo de diabetes mediante el incremento de la resistencia a la insulina. La asociación entre sobrepeso y DM2 se ha puesto de manifiesto en numerosos estudios8,21–25.
Genética. La evidencia de un fuerte componente genético se basa en la observación de que el riesgo de DM2 se incrementa significativamente cuando hay familiares de primer grado afectados de ésta2. En un metaanálisis realizado por la American Diabetes Association (ADA) se objetivó que entre el 40 y el 80% de los niños y adolescentes con DM2 tenían al menos un padre afectado26.
Grupos étnicos. La DM2 es más común en determinados grupos étnicos, como los nativos americanos, afroamericanos, hispanos y asiáticos16. La incidencia más alta se ha descrito entre la población adolescente de indios Pima, en los que llega hasta el 51/1.000. También se ha visto que la DM2 afecta desproporcionadamente a los individuos de raza negra, y hay evidencias de que el factor de IR es mayor en la población de raza negra e hispana que en los niños de raza blanca27,28.
Sexo femenino. Las niñas tienen de 1,3 a 1,7 veces más probabilidades que los niños de desarrollar DM2 en la infancia8,16. Además, se sabe que la IR es un componente del síndrome del ovario poliquístico (SOP) y las niñas afectadas tienen un mayor riesgo de desarrollar DM2.
Otras condiciones. Dentro de las situaciones que cursan con IR (fenotipo de IR) y que pueden predisponer al desarrollo de la DM2 destacan: los factores responsables de cambios hormonales y metabólicos de la programación intraútero, como la desnutrición prenatal29 y la diabetes gestacional, la pubertad y la acantosis nigricans.
Durante la pubertad, en los estadios de Tanner II-IV, la sensibilidad a la insulina disminuye en torno a un 30%, en parte debido al incremento de la hormona de crecimiento (GH) y el factor de crecimiento de la insulina (IGF)30.
La acantosis nigricans se asocia estrechamente con la existencia de obesidad, IR e hiperinsulinismo. Está presente en el 90% de los niños y adolescentes con DM2 y su prevalencia es 25 veces mayor en los afroamericanos que en resto de poblaciones. No obstante, la adiposidad es mejor predictor de IR que la acantosis nigricans en diversos grupos raciales31.
ClínicaLa forma de presentación de la DM2 es muy variable, con un amplio espectro de severidad2,21. No obstante, la mayoría de los pacientes comparten una serie de características, como la obesidad, el inicio puberal, los antecedentes familiares de primer grado con DM2 y fenotipo de IR. Se pueden reconocer 3 grandes grupos en relación con su forma de presentación clínica: asintomático, sintomático y cetoacidosis (CA) o cetosis.
La gran mayoría de los pacientes con DM2 es asintomática al diagnóstico y se identifica mediante programas de cribado o de forma casual al detectar hiperglucemia o glucosuria en un análisis rutinario.
En el grupo de pacientes sintomáticos la clínica fundamental se debe a la hiperglucemia e incluye generalmente poliuria, polidipsia y nicturia, de forma similar a lo que ocurre en la DM1. La pérdida de peso no suele ser un hallazgo frecuente. En niñas adolescentes, la presencia de candidiasis vaginal puede ser el primer motivo de consulta médica.
La frecuencia de CA como forma de presentación de la DM2 se estima entre un 5 y un 25%2,32. Esta forma se conoce como forma “atípica” de DM233–35.
Lectura rápida
Desde el punto de vista fisiopatológico se caracteriza fundamentalmente por grados variables de resistencia a la insulina, especialmente en músculo, tejido graso e hígado, asociada a disfunción progresiva de la célula beta pancreática. Ambas alteraciones son fenómenos precoces, y se detectan anomalías en la secreción de insulina en fases previas al desarrollo de la diabetes.
El diagnóstico de DM2 en el niño y adolescente se basa en los criterios establecidos por la ADA y son los mismos que para la población adulta (tabla 1)36. Tanto la AGA como la ATG se han considerado oficialmente como situaciones prediabéticas (tabla 1).
Criterios diagnósticos de diabetes y prediabetes (ADA)39
Diabetes
Situaciones prediabéticas Alteración de la glucemia en ayunas
Alteración de la tolerancia a la glucosa
|
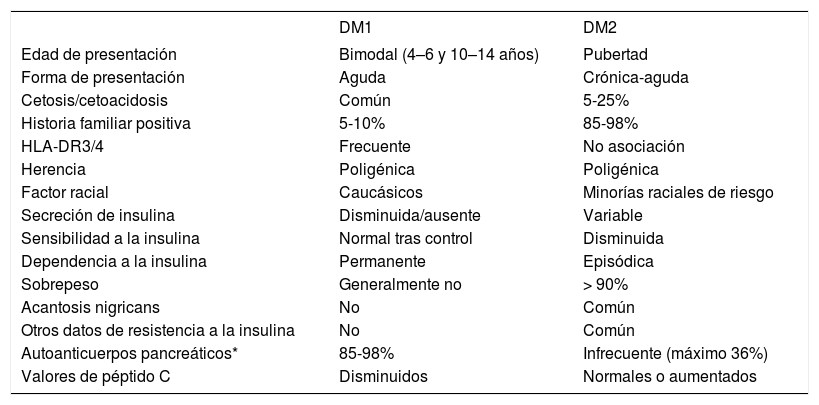
Una vez hecho el diagnóstico, hay que identificar el tipo de diabetes (DM1 frente a DM2) para optimizar el tratamiento, ya que su manejo difiere sustancialmente. En la mayoría de los casos la presentación clínica, junto con los datos de la historia y los hallazgos analíticos, permiten diferenciar bien ambos tipos de diabetes. No obstante, algún subgrupo de pacientes, sobre todo adolescentes con sobrepeso, comparten hallazgos clínicos y/o bioquímicos de ambos tipos, haciendo difícil e incluso a veces imposible un diagnóstico específico37. Las características diferenciales de ambos tipos de diabetes se reflejan en la tabla 237,38.
Características diferenciales de la DM1 y DM2
| DM1 | DM2 | |
|---|---|---|
| Edad de presentación | Bimodal (4–6 y 10–14 años) | Pubertad |
| Forma de presentación | Aguda | Crónica-aguda |
| Cetosis/cetoacidosis | Común | 5-25% |
| Historia familiar positiva | 5-10% | 85-98% |
| HLA-DR3/4 | Frecuente | No asociación |
| Herencia | Poligénica | Poligénica |
| Factor racial | Caucásicos | Minorías raciales de riesgo |
| Secreción de insulina | Disminuida/ausente | Variable |
| Sensibilidad a la insulina | Normal tras control | Disminuida |
| Dependencia a la insulina | Permanente | Episódica |
| Sobrepeso | Generalmente no | > 90% |
| Acantosis nigricans | No | Común |
| Otros datos de resistencia a la insulina | No | Común |
| Autoanticuerpos pancreáticos* | 85-98% | Infrecuente (máximo 36%) |
| Valores de péptido C | Disminuidos | Normales o aumentados |
Lectura rápida
Hay diversos factores de riesgo para el desarrollo de la DM2, entre los que destaca el sobrepeso (IMC > percentil 85). Otros factores de riesgo incluyen: pertenecer a grupos étnicos en los que se ha demostrado una mayor susceptibilidad para el desarrollo de la DM2, sexo femenino, historia familiar positiva y fenotipo de resistencia a la insulina (acantosis nigricans, síndrome de ovario poliquístico en las niñas y pubertad).
La mayoría de los grupos defienden la realización del cribado en grupos de población de riesgo39. La American Academy of Pediatrics (AAP) y la ADA recomiendan la realización del cribado cada 2 años, iniciándose a los 10 años o al inicio de la pubertad, siempre que haya sobrepeso (IMC > percentil 85) asociado a 2 o más de los siguientes factores de riesgo36,39: DM2 en un familiar de primer o segundo grado, pertenecer a un grupo étnico de riesgo (nativos americanos, hispánicos, raza negra no hispánica y asiáticos americanos), signos de IR (acantosis, dislipemia, hipertensión o SOP).
La ADA recomienda como método de elección para el cribado de DM2 y situaciones prediabéticas la determinación de glucosa en ayunas, a pesar de tener una menor sensibilidad, ya que se considera un método menos invasivo y de menor coste que la sobrecarga oral de glucosa (SOG)36,39.
Complicaciones y comorbilidadesComplicaciones agudasLa CA diabética (CAD) y el estado hiperglucémico hiperosmolar (EHH) pueden ser la forma de presentación de la DM2 o pueden desarrollarse como complicación aguda posterior, relacionada con un control inadecuado. Entre el 10 y el 25% de los adolescentes con DM2 se presenta con CAD40. Por otra parte, el EHH, considerado previamente complicación propia de los adultos con DM2, ha cobrado interés en los últimos años tras describirse varios casos en la edad pediátrica41.
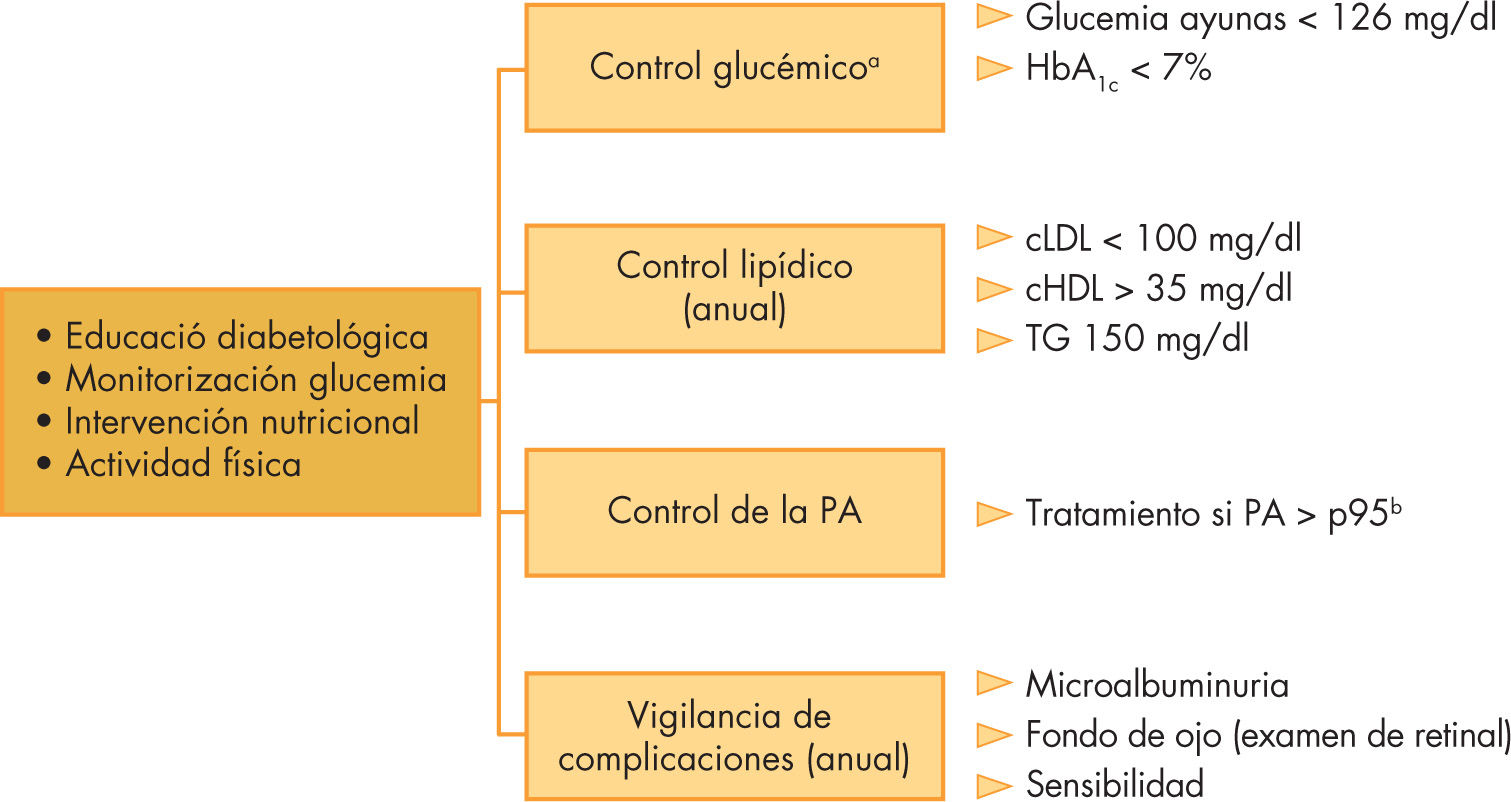
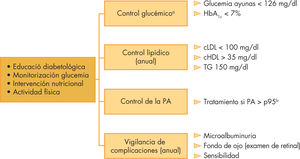
Comorbilidades y complicaciones crónicasLos niños y adolescente con DM2, asociada generalmente al sobrepeso, tienen un mayor riesgo de desarrollar HTA, dislipemia y hepatopatía grasa no alcohólica (HGNA) que la población no diabética, pudiendo estar presentes incluso antes del diagnóstico de diabetes40. Su control periódico constituye una parte esencial del manejo de los pacientes con DM2 (fig. 1).
Esquema de los aspectos fundamentales del manejo de la diabetes mellitus 2. cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HbA1c: hemoglobina glucosilada; PA:presión arterial. TG: triglicéridos. aCriterios según la American Diabetes Association. bPercentil según edad, sexo y altura.
La HTA primaria o esencial, que hasta hace unos años se consideró como infrecuente en la edad pediátrica, está aumentando de forma paralela al sobrepeso, y ha llegado a ser la causa más común de hipertensión en adolescentes con sobrepeso. En estudios en adolescentes con DM2 se encuentra HTA en un 17-32% de los pacientes40.
Dado que la HTA incrementa el riesgo de complicaciones vasculares, la presión arterial (PA) debe medirse de forma rutinaria en todos los pacientes con sobrepeso, independientemente de la presencia de DM2. Se considera PA normal (sistólica o diastólica —PAS y PAD, respectivamente—) < p90, prehipertensión (PAS o PAD en p90-p95), estadio 1 de HTA (PAS o PAD > p95) y estadio 2 de HTA (PAS o PAD > p95 + 5mmHg)42. Estos datos hay que normalizarlos en función de edad, sexo y talla.
La dislipemia en adolescentes con DM2 oscila entre un 4 y un 33%8,40,43. La ADA, la AAP y la American Heart Association han publicado diferentes recomendaciones y guías clínicas para el manejo de la dislipemia en niños y adolecentes44,45. Según la ADA, en el momento del diagnóstico y tras el control glucémico se debe realizar un perfil lipídico incluyendo colesterol unido a lipoproteínas de baja densidad (cLDL), colesterol unido a lipoproteínas de alta densidad (cHDL) y triglicéridos (TG). Los objetivos recomendados son: cLDL < 100mg/dl (2,6mmol/l); cHDL > 35mg/dl (0,9mmol/l); colesterol total < 200mg/dl (5,2mmol/l), y TG < 150mg/dl (1,7mmol/l).
La obesidad y la DM2 se asocian también con un amplio espectro de alteraciones hepáticas, conocidas como HGNA, y ésta es la causa más frecuente de alteración hepática en la infancia. El concepto de HGNA incluye alteraciones como la esteatosis hepática (incremento de la grasa hepática sin datos de inflamación) y la esteatohepatitis no alcohólica (incremento de la grasa hepática con inflamación). La esteatohepatitis puede conducir en último caso a fibrosis, cirrosis y fallo hepático. La alanina aminotransferasa está aumentada en más del doble de las cifras normales hasta en un 20% de los jóvenes con DM240.
Las complicaciones microvasculares incluyen la retinopatía, la nefropatía y la neuropatía. La nefropatía relacionada con la DM es una alteración progresiva del lecho microvascular renal, la microalbuminuria (excreción de albúmina urinaria entre 30 y 300mg/día o 20–200μg/min) se considera como el estadio más precoz de dicha alteración. La microalbuminuria está ya presente en el 14 y el 22% de los adolescentes con DM2 en el momento del inicio, y llega hasta el 60% durante los siguientes 10 años tras el diagnóstico, su incidencia es mucho mayor que en la DM1 durante los primeros 10 años de evolución. La ausencia de estudios adecuados en la población infantil hace que las indicaciones del cribado y tratamiento de la nefropatía sean las mismas que en la DM1 y en adultos con DM2 (fig. 1).
La prevalencia descrita de retinopatía es menor en la DM2 que en la DM1, quizás en relación con un seguimiento menos prolongado. Las pautas de seguimiento y diagnóstico de la retinopatía diabética derivan también de las utilizadas en adultos con DM2 o DM1 (fig. 1).
La prevalencia y riesgo de progresión de la neuropatía diabética en los adolescentes con DM2 no se ha estudiado de forma sistemática, por lo tanto, las estrategias de seguimiento y de control se basan en los criterios utilizados en adultos con DM2 (fig. 1).
Lectura rápida
La DM2, así como las situaciones prediabéticas (alteración de la glucemia en ayunas [AGA] y alteración de la tolerancia a la glucosa [ATG]) definidas por la American Diabetes Association (ADA), se asocian a hipertensión arterial, dislipemia e incremento del riesgo cardiovascular.
La forma de presentación de la DM2 es muy variable, con un amplio espectro de severidad, aunque la mayoría de los pacientes están asintomáticos en el momento del diagnóstico. En general, comparten una serie de características clínicas, como: sobrepeso, antecedentes familiares positivos, inicio puberal y fenotipo de resistencia a la insulina. La negatividad de marcadores de autoinmunidad frente a células pancreáticas así como valores de péptido C (normales o altos) pueden ayudar a su diagnóstico diferencial frente a la DM1.
La enfermedad cardiovascular aterosclerótica o complicación macrovascular es la causa fundamental de mortalidad y morbilidad en la población adulta con DM2. Diversos estudios observacionales han demostrado que el mal control glucémico incrementa el riesgo cardiovascular. Aunque hay escasos datos en la población infantil, se han descrito alteraciones cardiovasculares en adolescentes con DM2, como el incremento del grosor de la pared del ventrículo izquierdo así como el aumento de la rigidez arterial, datos que indican un envejecimiento prematuro del sistema cardiovascular40.
Lectura rápida
El diagnóstico se basa en los criterios establecidos por la ADA y son los mismos que para la población adulta.
Diabetes: glucemia basal plasmática > 126mg/dl (7,0mmol/l).
Prediabetes:
- –
AGA: glucemia basal plasmática > 126mg/dl (> 7,0mmol/l).
- –
ATG: glucosa plasmática a las 2h de la sobrecarga oral de glucosa: 140mg/d (7,8mmol/l)-199mg/d (11mmol/l).
Se debe realizar un cribado sistemático en las poblaciones con factores de riesgo asociado (sobrepeso, grupos raciales con aumento de suceptibilidad para la DM2, y situaciones que cursan con resistencia a la insulina). La ADA recomienda como método de elección para el cribado de la DM2 y situaciones prediabéticas la determinación de glucosa en ayunas, debido a su menor coste e invasividad que la sobrecarga oral de glucosa, a pesar de su menor sensibilidad.
El manejo y tratamiento óptimos de los niños y adolescentes con DM2 requiere un equipo multidisciplinario que incluya pediatra diabetólogo, educadora pediátrica, nutricionista y psicólogo36,46. La implicación de toda la familia es también un aspecto clave en el manejo de este grupo de pacientes, si se quieren conseguir y mantener los objetivos terapéuticos que incluyen: revertir las alteraciones metabólicas, conseguir y mantener unas cifras de glucemia próximas a la normalidad, mejorar la secreción y la sensibilidad a la insulina, promover hábitos de vida saludables (alimentación y ejercicio), mantener un peso corporal adecuado, realizar un cribado periódico y, si procede, tratamiento de las comorbilidades, y prevenir y tratar las complicaciones, tanto agudas como crónicas.
Los pacientes con DM2 y sus familiares deben recibir una adecuada educación diabetológica. La monitorización frecuente de la glucemia capilar, independientemente de que estén o no en terapia con insulina, es imprescindible. Dicho control deberá ser más frecuente en los períodos de ajuste de la terapia, cuando haya sintomatología de descompensación o durante los procesos intercurrentes. El autocontrol rutinario de la glucemia capilar deberá incluir tanto mediciones preprandiales como posprandiales. De forma similar a las recomendaciones para los pacientes con DM1, se aconseja realizar controles clínicos cada 3 meses, incluyendo la determinación de HbA1c y la vigilancia de posibles complicaciones.
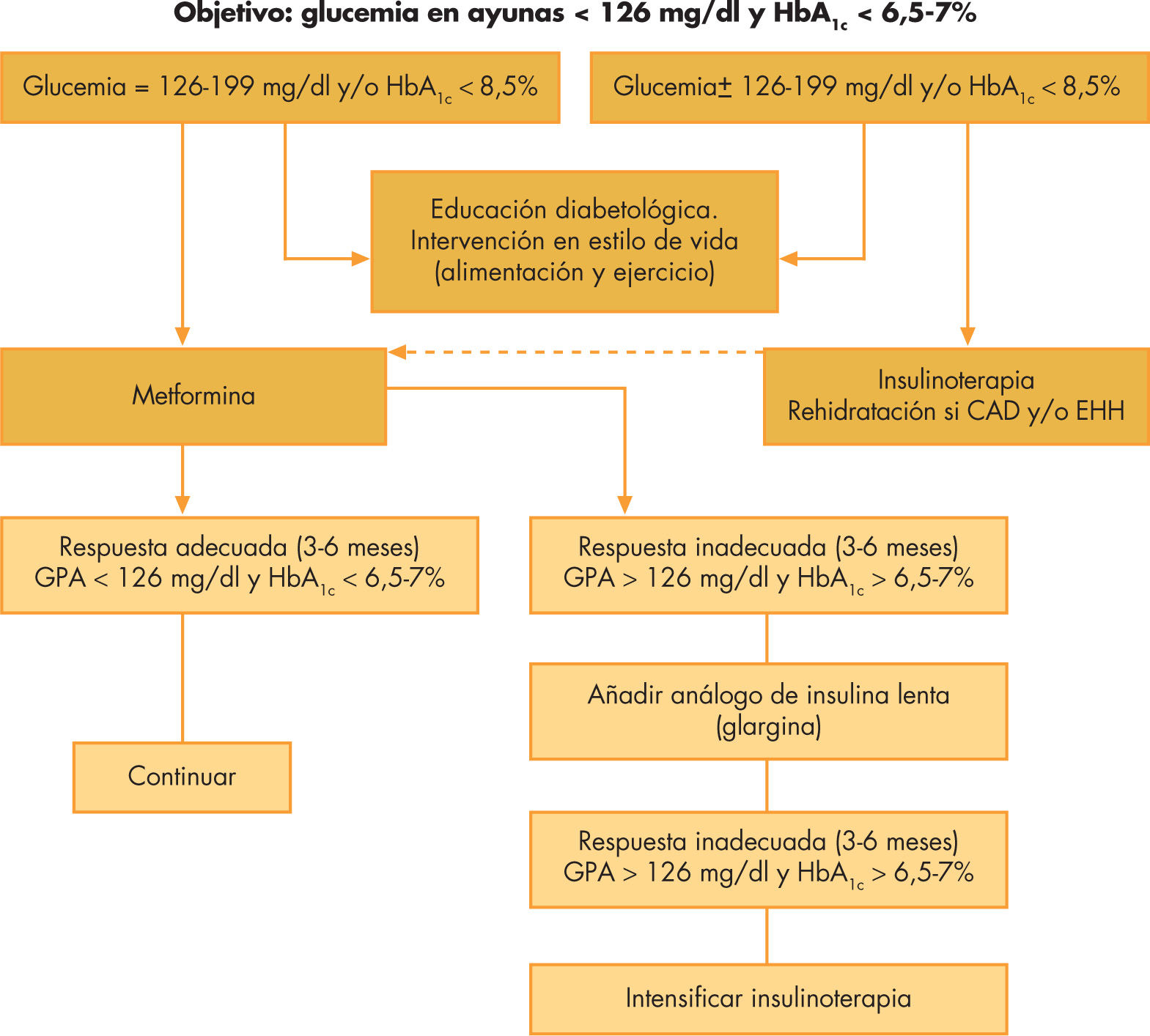
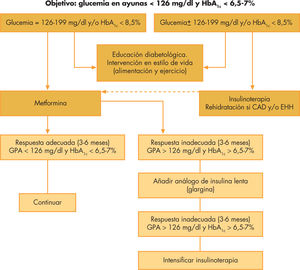
La ADA recomienda como objetivo terapéutico mantener unas cifras de glucemia en ayunas < 130mg/dl y una HbA1c < 7%36. Dado que no hay un valor mínimo de HbA1c en el cual no hayan las complicaciones propias de la diabetes, el American Collage of Endocrinology defiende unos criterios más estrictos, aconsejando cifras de glucemia de entre 70 y 126mg/dl y HbA1c < 6,5%47. La pauta general de tratamiento escalonado en los pacientes pediátricos con DM2 está reflejada en la figura 2.
La intervención en determinados hábitos de vida en población adulta con DM2, fundamentalmente nutricionales y ejercicio, ha demostrado ser eficaz en la prevención de la progresión de estados prediabéticos a diabéticos. Aunque estudios similares en pacientes pediátricos no han llegado a su fase final (www.todaystudy.org), la mayoría de los expertos recomiendan cambios en el estilo de vida en todos los niños que tienen factores de riesgo para DM2, situaciones prediabéticas o que hayan sido diagnosticados de DM2. Estos cambios incluirán pautas de alimentación adecuadas para cada edad, acompañadas de incremento en la actividad física.
Terapia nutricional. La terapia nutricional se debe equilibrar con el ejercicio físico. La dieta debe contemplar una reducción calórica, manteniendo una proporción adecuada de todos los nutrientes. Las tomas deben ser pequeñas y frecuentes para evitar oscilaciones amplias de la glucemia. En la edad pediátrica se acepta como objetivo inicial el mantenimiento del peso, con el fin de evitar la alteración en el crecimiento lineal. Una vez conseguido dicho objetivo, se puede indicar una intervención dietética más estricta para lograr una disminución progresiva del peso, hasta llegar a un IMC < percentil 85. La pérdida de peso recomendada debe ser de 0,5 a 1kg mensual en niños. En los adolescentes pospuberales se puede recomendar una pérdida de peso de 0,5 a 1kg semanal, de forma similar a las pautas aconsejadas en adultos.
Actividad física. La actividad física, independientemente de su impacto en el peso corporal, mejora la sensibilidad a la insulina, por lo que se debe recomendar especialmente en los pacientes con DM2.
Terapia farmacológicaSe deberá considerar la terapia farmacológica en los pacientes en los que después de 3 meses de medidas no farmacológicas no se consiga el adecuado control. Ésta se utilizará desde el inicio en pacientes sintomáticos, sobre todo cuando haya cetosis o CA.
La insulina y la metformina son los dos únicos agentes aprobados en Europa y en Estados Unidos, por la Food and Drug Administration, para el tratamiento de la DM2 en la edad pediátrica. Hay algunos estudios realizados con sulfonilureas, meglitinida y rosiglitazona2,48,49. En la actualidad está en marcha el estudio TODAY (Treatment Options for type 2 Diabetes in Adolescents and Youth) cuyo objetivo principal es comparar la eficacia sobre el control glucémico de las 3 opciones terapéuticas50: metformina, metformina más rosiglitazona y metformina más intervención intensiva sobre el estilo de vida. Los resultados definitivos arrojarán sin duda nuevos datos acerca del manejo de la DM2 en la edad pediátrica.
La terapia con insulina está indicada, de entrada, en los pacientes con hiperglucemia severa (> 200mg/dl), HbA1c > 8,5% o manifestaciones de marcada deficiencia insulínica (CA o cetosis). Tras rehidratación adecuada y una vez recuperados de la cetosis, se puede disminuir progresivamente las dosis de insulina e iniciar el tratamiento con metformina, siempre que se alcancen los objetivos glucémicos.
Estudios en adultos han demostrado que la introducción precoz del tratamiento con insulina puede revertir algunas de las disfunciones celulares, facilitando el control a largo plazo. Esto mismo se ha evidenciado en un estudio realizado en adolescentes con DM2 de reciente diagnóstico51.
La metformina se ha demostrado eficaz y segura en el tratamiento de la DM2 en la infancia y la adolescencia. Ésta tiene, además, el beneficio adicional de producir una modesta pérdida de peso o, al menos, estabilización de éste. Dentro de los efectos secundarios se incluyen: problemas digestivos como el dolor abdominal (hasta en un 25%), náuseas y vómitos (17%), diarrea y cefalea. En raras ocasiones se ha evidenciado acidosis láctica asociada a su uso. Los niños y adolescentes que presentan una hiperglucemia moderada (glucemia en ayunas de entre 126 y 199mg/dl y una HbA1c < 8,5%) pueden tratarse inicialmente con metformina asociada a las medidas no farmacológicas. La pauta habitual consiste en administrar inicialmente dosis bajas (500mg 2 veces al día, a mitad de la ingesta) que se van incrementando progresivamente según la tolerancia y los efectos obtenidos hasta un máximo de 2.000mg/día, para alcanzar los objetivos glucémicos. Los pacientes que reciban tratamiento con metformina deberán tomar un complejo vitamínico ya que puede disminuir la absorción de vitamina B12 y/o ácido fólico.
Lectura rápida
Los pacientes con DM2 y sus familiares deben recibir una adecuada educación diabetológica, siendo imprescindible la monitorización frecuente de la glucemia capilar. La estrecha vigilancia de posibles complicaciones, tanto agudas como crónicas (cetoacidosis y estado hiperglucémico hiperosmolar), junto con el control de la morbilidad asociada (hipertensión, dislipemia y hepatopatía grasa no alcohólica) constituyen una parte esencial del manejo de estos pacientes.
El tratamiento debe incluir tanto medidas no farmacológicas (cambios en el estilo de vida, intervención dietética e incremento del ejercicio) como terapia farmacológica. Los objetivos terapéuticos consisten en mantener unas cifras de glucemia en ayunas < 126–130mg/dl y una HbA1c < 6,5-7%.
La insulina y la metformina son los 2 únicos agentes aprobados en Europa y en Estados Unidos por la Food and Drug Administration para el tratamiento de la DM2 en la edad pediátrica.
La metfomina no debe administrarse cuando haya cetosis, insuficiencia renal, alteraciones hepáticas, insuficiencia cardíaca o cuando se ha recibido contrastes iodados.
Manejo de las complicacionesAgudasLas complicaciones agudas de la DM2 incluyen la CAD diabética y el coma hiperosmolar, los cuales puedes se pueden observars simultáneamente en el mismo paciente. Dichos pacientes deben ser manejados por un equipo experto mediante rehidratación adecuada, como mínimo en 48h, insulinoterapia intravenosa, corrección de los desequilibrios electrolíticos y monitorización continua del estado mental y neurológico junto con el mantenimiento de la vía aérea.
CrónicasEl primer escalón de actuación de la HTA es la terapia no farmacológica (dieta saludable baja en sal, ejercicio diario y pérdida de peso). En caso de no haber respuesta adecuada a las medidas previas se considerará el tratamiento farmacológico, siempre que haya un estadio 2 de HTA.
La primera opción terapéutica son los inhibidores de la enzima de conversión de la angiotensina o los bloqueadores de la angiotensina II, basándose en su efecto beneficioso sobre el desarrollo de daño renal42. En caso de no ser bien tolerados o estar contraindicados, se considerarán otras opciones terapéuticas como los diuréticos tiazídicos, los inhibidores del canal del calcio y/o los bloqueadores beta.
DislipemiaEl objetivo del tratamiento de la hipercolesterolemia, siguiendo los criterios más exigentes recomendados por la ADA, es mantener unos valores séricos de cLDL < 100mg/dl. Los pacientes con valores de cLDL entre 100 y 130mg/dl se deberán manejar con mediadas no farmacológicas43,44. Los cambios en las pautas de alimentación así como el incremento de la actividad física siguen siendo el primer escalón de actuación.
Los inhibidores de la HMG-CoA reductasa (estatinas) son los fármacos de primera línea más ampliamente utilizados en la edad pediátrica44. Es importante tener presente su potencial teratógeno en las adolescentes con riesgo de posible embarazo.
La terapia farmacológica deberá considerarse en todo niño mayor de 10 años cuando, tras 6 meses de cambios en los hábitos de vida, el perfil lipídico permanece con los siguientes valores: cLDL > 160mg/dl (4,14mmol/l) o cLDL = 130–159mg/dl (3,36-4,14mmol/l), siempre que hayan otros factores de riesgo cardiovascular asociados.
En cuanto al control de las cifras de TG, la ADA recomienda que los pacientes con cifras > 150mg/dl (1,69mmol/l) deberán ser manejados mediante optimización del control glucémico, junto con la pérdida de peso. En los casos excepcionales con cifras de TG > 1.000mg/dl (11,3mmol/l) se sugiere la utilización de fibratos por el alto riesgo de pancreatitis.
Alteraciones hepáticasActualmente, el manejo más ampliamente aceptado de las alteraciones hepáticas asociadas a la obesidad y a la DM2, está basado en la pérdida gradual y progresiva de peso, la mejoría de la IR así como el mantenimiento de un adecuado control glucémico. El consumo de alcohol está contraindicado. Es importante destacar que una pérdida de peso demasiado brusca puede predisponer a la fibrosis hepática.
Debido a que los estudios de tratamiento con metformina en pacientes pediátricos con HGNA son escasos, no hay un consenso acerca de su utilización en esta patología.