La enfermedad pulmonar crónica del prematuro o displasia broncopulmonar (DBP) fue descrita en 1967 por Northway1 en un grupo de niños pretérmino que desarrollaron una enfermedad respiratoria crónica y unas alteraciones características en la radiografía de tórax después de haber tenido ventilación mecánica prolongada. El daño pulmonar fue atribuido al uso de ventilación mecánica agresiva y a las elevadas concentraciones de oxígeno inspirado. En los últimos años, tras la amplia introducción de esteroides prenatales, el uso de surfactante y la ventilación mecánica menos agresiva, esta forma clásica de DBP es infrecuente; pero la mayor supervivencia de niños nacidos muy pretérmino ha condicionado que aparezcan nuevas formas DBP debidas sobre todo a la gran inmadurez de los pulmones. Estos cambios han condicionado alguna confusión tanto en la definición, como en los criterios diagnósticos.
Puntos clave
La DBP es la causa más frecuente de morbilidad respiratoria en niños pretérmino que sobreviven al período neonatal. En los primeros 2 años son frecuentes las hospitalizaciones por causa respiratoria, y aunque la morbilidad respiratoria va disminuyendo con la edad, estos niños pueden presentar síntomas respiratorios y alteraciones de la función pulmonar más allá de la edad escolar, e incluso de la adolescencia.
El seguimiento adecuado tras el alta de la unidad neonatal es fundamental para mejorar su calidad de vida.
Concepto y definición de displasia broncopulmonarDebido a los cambios en los cuidados neonatales y a la mayor supervivencia de niños de muy bajo peso y edad gestacional, las características de la DBP han ido cambiando en los últimos años y han ido apareciendo distintas definiciones y criterios para el diagnóstico de la enfermedad.
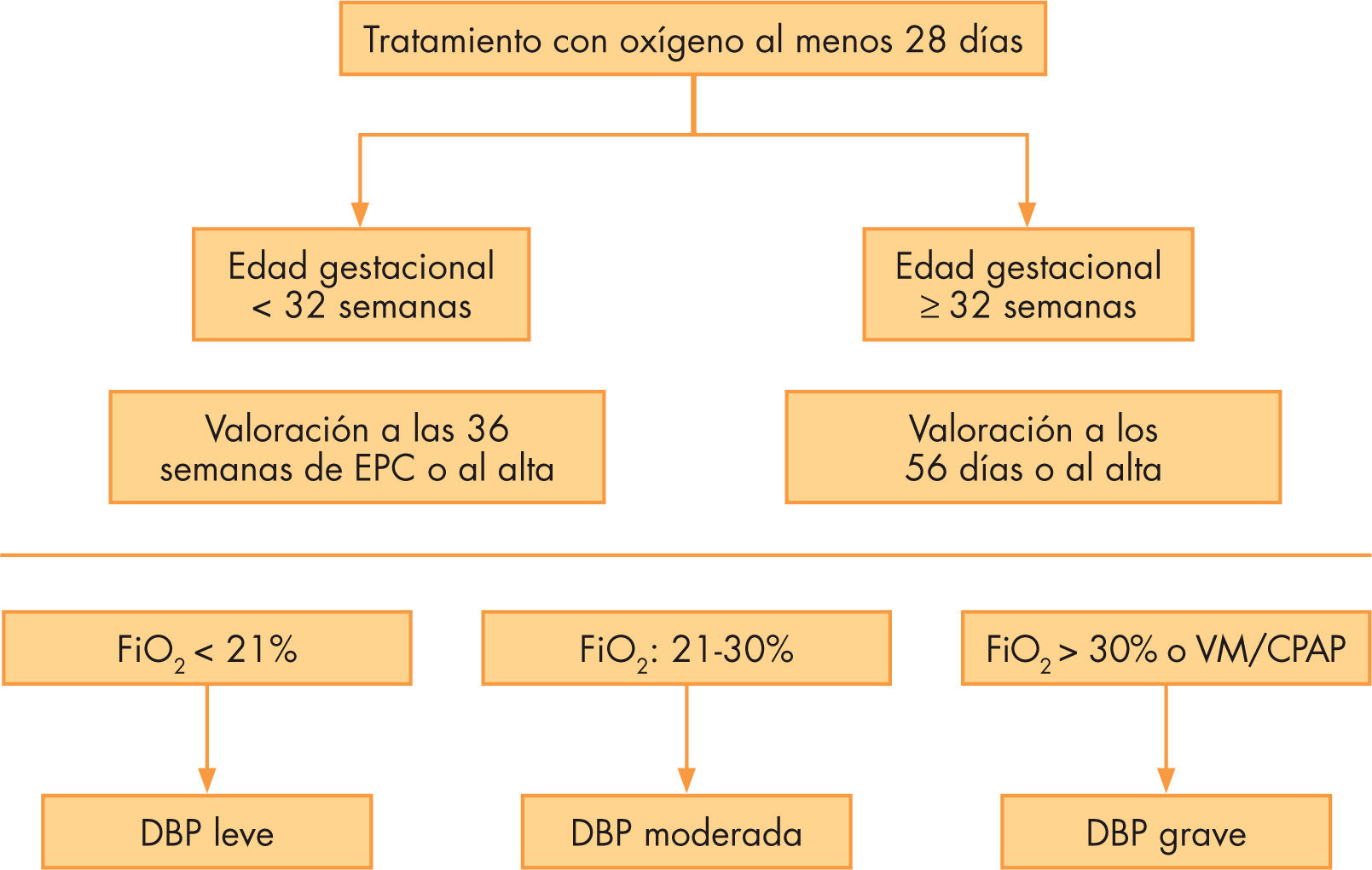
Aunque con muchas limitaciones, tras una conferencia de consenso en el año 2001, se aceptó el término de DBP para definir la necesidad de suplemento de oxígeno al menos 28 días después del nacimiento, y la severidad de la enfermedad dependerá del grado de soporte respiratorio requerido a las 36 semanas de edad posconcepcional (fig. 1)2.
Definición de displasia broncopulmonar (DBP). CPAP:presión positiva continua en la vía aérea; EPC: enfermedad pulmonar crónica; FiO2: fracción inspiratoria de oxígeno; VM: ventilación mecánica. De Jobe y Bancalari2.
La incidencia real de la DBP es muy variable debido a los distintos criterios diagnósticos utilizados y a que las indicaciones para el suplemento de oxígeno son distintas entre unos centros y otros. En la actualidad es muy infrecuente en niños > 1.500g y gestación superior a 30 semanas y su incidencia es inversamente proporcional a la edad gestacional y al peso del recién nacido, y varía desde un 7% en niños con peso entre 1.251 y 1.500g hasta un 52% en niños con peso entre 501 y 750 g3.
Lectura rápida
La displasia broncopulmonar (DBP) es la causa más frecuente de morbilidad respiratoria en el prematuro que sobrevive a los 28 días de vida. Su incidencia no ha disminuido en los últimos años, debido a la mayor supervivencia de niños cada vez más inmaduros donde la enfermedad es más frecuente.
ConceptoActualmente se acepta que un niño nacido pretérmino tiene DBP cuando ha requerido suplemento de oxígeno al menos 28 días; la gravedad de la enfermedad dependerá del grado de soporte respiratorio requerido a las 36 semanas de edad posconcepcional.
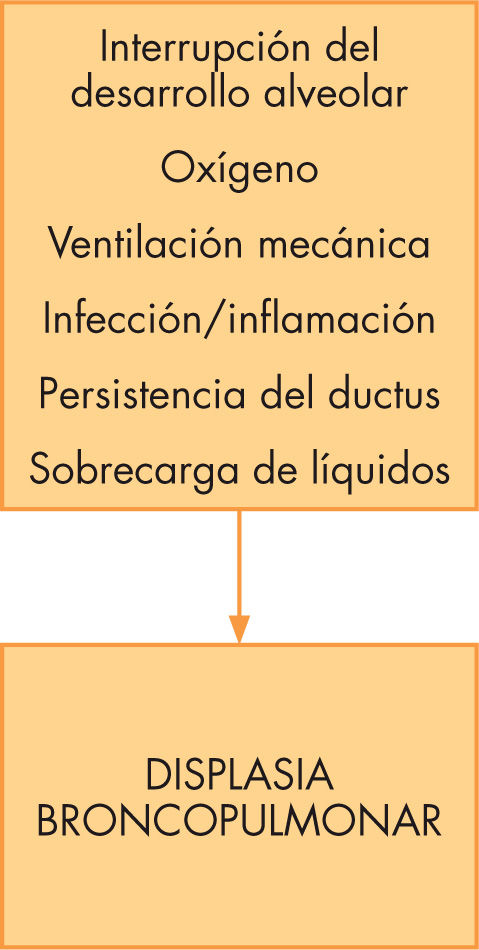
La DBP es una enfermedad de origen multifactorial4 (fig. 2). El primer factor que se ha considerado clásicamente responsable de la DBP ha sido el oxígeno, debido a la acción de los radicales libres, que pueden dañar la membrana celular y provocar alteraciones en el tejido pulmonar. El niño prematuro tiene poco desarrollados los sistemas antioxidantes ya que las enzimas antioxidantes tienden a incrementarse en el último trimestre de la gestación. A medida que el grado de inmadurez aumenta, el daño pulmonar se producirá con cantidades más bajas de oxígeno. La ventilación mecánica (VM), utilizada clásicamente para el tratamiento de la enfermedad de membrana hialina, o el síndrome de distrés respiratorio (SDR) se consideran otros factores importantes para el desarrollo de la DBP, sobre todo por las lesiones secundarias a las presiones y los volúmenes (barotrauma y volutrauma). Las presiones requeridas para reclutar alvéolos y prevenir atelectasias pueden causar daño en el pulmón inmaduro y poner en marcha la cascada inflamatoria, otro de los factores implicados en la patogenia de la DBP. La persistencia del ductus arteriovenoso (PDA) y la sepsis, especialmente si coinciden en el tiempo, aumentan el riesgo de DBP. Todos estos factores provocan una respuesta inflamatoria del huésped que persiste durante las primeras semanas de vida en los niños que van a desarrollar DBP. Dicha respuesta inflamatoria está caracterizada por una acumulación de neutrófilos y macrófagos en las vías aéreas y en el tejido pulmonar, además de una gran cantidad de mediadores proinflamatorios que afectarán a la unidad alveolocapilar y a la integridad tisular. También existen estudios que revelan la implicación de factores genéticos en el desarrollo de DBP.
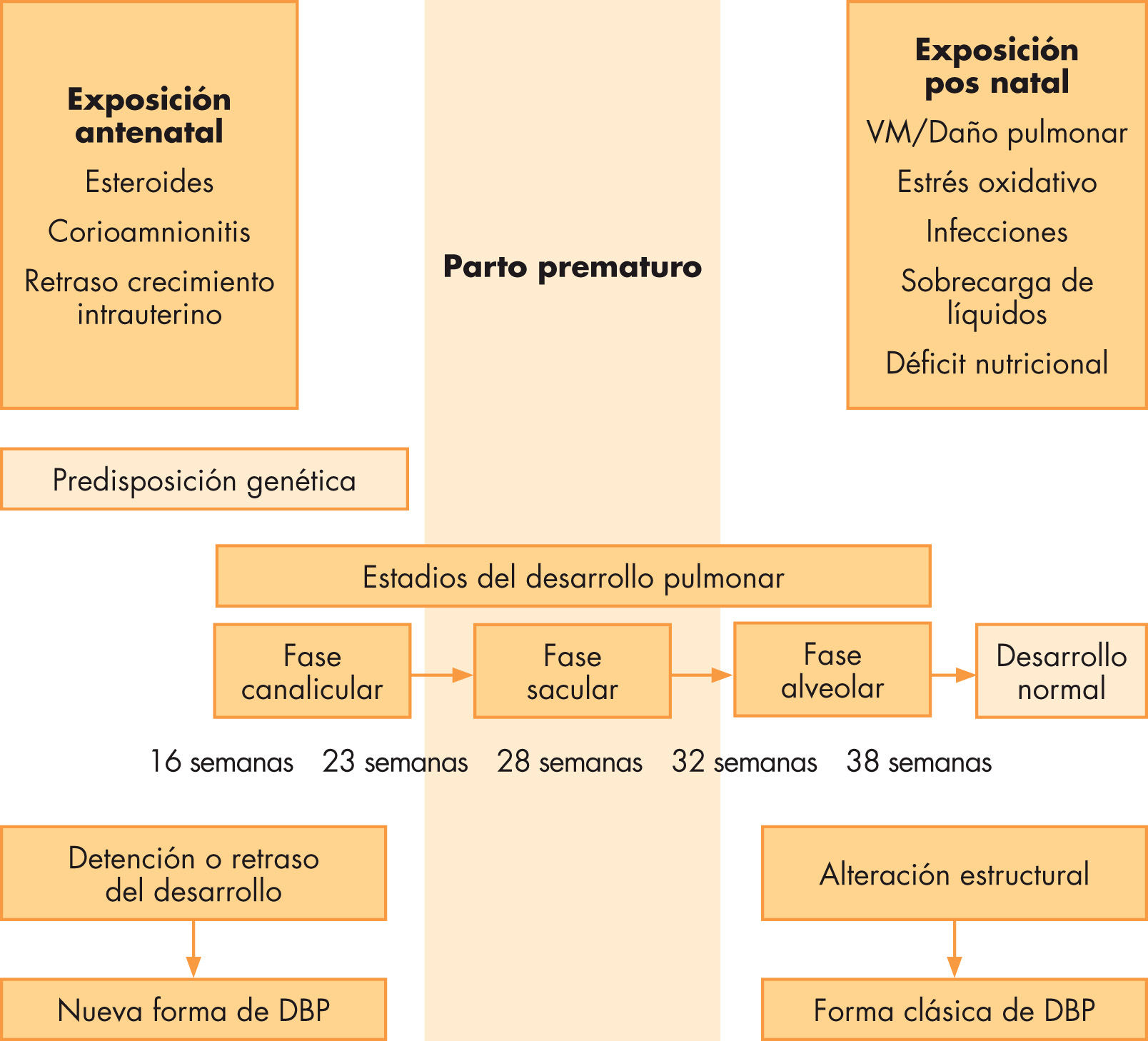
Estos y otros factores tendrán distintas consecuencias según el momento de la gestación en el que actúen (fig. 3)5; cuando ocurren en una fase muy precoz de la gestación (24–28 semanas de gestación) en la que está teniendo lugar el desarrollo alveolar y vascular distal, se interrumpirá la alveolarización y el desarrollo vascular, causando las formas «nuevas» de DBP. En modelos animales se ha demostrado no sólo reducción en el número de alvéolos sino también aumento de los espacios aéreos, con disminución de la superficie alveolar y, por tanto, alteración del recambio gaseoso. Las formas «clásicas», por el contrario, ocurrían en niños de más edad gestacional (fase sacular del desarrollo) y se caracterizaban por la presencia de inflamación en la vía aérea, hipertrofia del músculo liso y fibrosis del parénquima pulmonar. En esta forma de DBP habrá afectación grave de la vía aérea con zonas de atelectasia que se alternan con enfisema (tabla 1).
Fases del desarrollo pulmonar, daños potenciales y tipos de alteración pulmonar. DBP: displasia broncopulmonar; VM: ventilación mecánica. De Baraldi y Filippone5.
Diferencias histopatológicas entre las formas nuevas y las clásicas de displasia broncopulmonar
| Forma clásica | Forma nueva |
|---|---|
| Afectación de la vía aérea | Interrupción del desarrollo alveolar |
| Hipertrofia del músculo liso | Alvéolos escasos y grandes |
| Metaplasia escamosa | Menos alteración epitelial en la vía aérea |
| Pérdida del epitelio ciliado | Menos alteración epitelial en la vía aérea |
| Hipertrofia de glándulas mucosas | Menos fibrosis intersticial |
| Afectación alveolar | Menos hipertrofia del músculo liso |
| Fibrosis intersticial | Disminución en el desarrollo vascular |
Lectura rápida
La incidencia es muy variable debido a los distintos criterios utilizados para definir la DBP, pero todos coinciden en que es inversamente proporcional a la edad gestacional y al peso al nacer. Se estima alrededor del 30% en los nacidos con menos de 1.000g. En la actualidad es muy infrecuente en niños con peso superior a 1.500g y gestación superior a 30 semanas.
Debido a las alteraciones del pulmón y de la vía aérea, los niños con DBP van a tener una morbilidad respiratoria importante, sobre todo durante los primeros 2 años de vida. Existe un mayor riesgo de sibilancias recurrentes, así como mayor susceptibilidad a las infecciones respiratorias de vías bajas, sobre todo víricas. La rehospitalización por enfermedad respiratoria es común entre los niños con DBP menores de 2 años. Incluso los que aparentemente se recuperan bien de la misma tienen un alto riesgo de ingresos hospitalarios por enfermedades intercurrentes en esos 2 años de vida. En 98 niños con DBP seguidos desde el nacimiento hasta los 2 años de edad, se comprobó que el 50% reingresó durante el primer año de vida y el 37% durante el segundo año. Los episodios de sibilancias, las neumonías y las infecciones por virus respiratorio sincital (VRS) fueron las responsables del 65% de los ingresos en el primer año, y del 81% en el segundo año. La severidad de la DBP estuvo asociada con la mayor estancia hospitalaria6. En general, se estima que el 80% tendrá alguna infección de vías respiratorias bajas en el primer año de vida y alrededor de un 50 % requerirá ingreso hospitalario7,8. El riesgo de hospitalización por infección respiratoria por VRS antes de la utilización de palivizumab, se encontraba entre el 11 y el 13% en los pretérminos < 32 semanas9 aumentando a medida que disminuían el peso al nacer y la edad gestacional, y sobre todo si existía DBP10. La gravedad de la infección está relacionada con la menor edad gestacional y por supuesto con la existencia o no de DBP. La utilización de palivizumab para la profilaxis de la infección por VRS ha supuesto un importante avance en el descenso de la infección por este virus, con la consiguiente reducción en el número de hospitalizaciones11,12.
Lectura rápida
La patogenia de la DBP es multifactorial, siendo la exposición prolongada a altas concentraciones de oxígeno y la ventilación mecánica junto con la sepsis y la sobrecarga de líquidos los factores más importantes, que al actuar en un pulmón muy inmaduro provocan alteraciones bioquímicas, microscópicas y anatómicas en el mismo. Las «nuevas formas» de DBP ocurren en niños que nacen pretérmino en la fase canalicular tardía o sacular precoz del desarrollo pulmonar. La agresión pulmonar durante la vida fetal y la neonatal altera el programa morfogénico del desarrollo pulmonar con reducción en el número de alvéolos condicionando una disminución de la superficie alveolar y del recambio gaseoso.
A partir de los 3–4 años de vida las hospitalizaciones por problemas respiratorios decrecen13, sin embargo pueden persistir algunos síntomas de disfunción respiratoria. En nuestra experiencia, tras un seguimiento longitudinal durante 2 años en niños ≤ 32 semanas con y sin DBP comparándolos con un grupo control de niños nacidos a término pudimos comprobar una mayor morbilidad durante los primeros 2 años en los niños prematuros, y especialmente en los afectados de DBP (fig. 4)14. A partir de los 2 años de edad disminuyeron el número de hospitalizaciones, los episodios de sibilancias y la necesidad de broncodilatadores, pero no llegaron a desaparecer por completo. A los 4 años, un porcentaje no despreciable de niños seguía teniendo síntomas respiratorios. Igualmente, un tercio de los niños pretérmino con y sin DBP estudiados por Vrijlandt15 entre los 3 y 5 años tenía síntomas como sibilancias o disnea y casi la mitad de ellos había usado betaadrenérgicos en el último año.
Morbilidad respiratoria en niños pretérmino ≤ 32 semanas. DBP: displasia broncopulmonar. De Pérez Pérez et al14.
En los niños mayores y adolescentes, en general, hay una tendencia hacia la mejoría clínica16. Los síntomas respiratorios van disminuyendo de manera progresiva a medida que pasan los años y la mayoría de los sujetos nacidos pretérmino pueden hacer aparentemente una vida normal. No obstante, la tos y las sibilancias serán algo más frecuentes que en la población general, así como los síntomas tras el ejercicio físico. En un estudio realizado en adolescentes, los que tenían antecedentes de prematuridad con o sin DBP habían presentado más enfermedades respiratorias en los últimos años que los nacidos a término17. En otra serie de 508 adultos de 19 años nacidos prematuramente, se constató que un porcentaje elevado tenía síntomas respiratorios equivalentes al asma18. Hay autores19 que aunque no encuentran diferencias significativas en la situación respiratoria a la edad de 14 años entre prematuros y nacidos a término, al realizarles pruebas de función pulmonar observan que los parámetros relacionados con el flujo aéreo (FEV1 y FEF25-75) son menores en el grupo DBP que en los prematuros sin DBP, y éstos a su vez tienen valores más bajos que los controles nacidos a término.
Función pulmonarLos prematuros y niños de bajo peso al nacer, y especialmente los niños con DBP, suelen tener alteraciones en su función pulmonar que pueden persistir hasta la adolescencia e incluso hasta la edad adulta. Durante los primeros años de vida, estos niños tienen menores volúmenes pulmonares, escasa distensibilidad pulmonar, menor capacidad residual funcional (FRC) y aumento de las resistencias pulmonares con obstrucción al flujo aéreo20,21. Aunque muchas de estas anormalidades se van resolviendo con la edad, la obstrucción de la vía aérea y el atrapamiento aéreo pueden persistir hasta la infancia tardía y la adolescencia en casi la mitad de los niños22–24. Numerosos estudios han demostrado que incluso con espirometrías normales estos niños pueden tener menor capacidad para el ejercicio físico25,26, cierto grado de intolerancia al mismo y disminución de los flujos espiratorios cuando se les realiza una prueba de esfuerzo.
Aunque no existen estudios relevantes sobre las implicaciones que la prematuridad y la DBP puedan tener en la edad adulta tardía, se especula que la alteración de la función pulmonar que se observa en la infancia y adolescencia pueda tener consecuencias posteriores, facilitando enfermedades respiratorias obstructivas como la EPOC5,17. Por otro lado, se estima que la reducción en la función respiratoria de los fumadores que han nacido pretérmino es varias veces mayor que la de fumadores nacidos a término, por lo que el tabaquismo puede tener serias consecuencias en los jóvenes y adultos con antecedentes de DBP27.
Lectura rápida
Existe un mayor riesgo de sibilancias recurrentes, así como mayor susceptibilidad a las infecciones respiratorias de vías bajas, sobre todo víricas. Los ingresos hospitalarios por enfermedad respiratoria son frecuentes entre los niños con DBP menores de 2 años. Los síntomas van mejorando con la edad, si bien en algunos niños persisten alteraciones respiratorias más allá de la edad pediátrica. La administración de palivizumab para la profilaxis de la infección por virus respiratorio sincitial (VRS) ha supuesto un importante avance en el descenso de la infección por este virus, así como en el número de hospitalizaciones.
No existe un tratamiento específico para la DBP una vez establecida, por lo que el tratamiento farmacológico va a ir dirigido a corregir los síntomas respiratorios, valorando individualmene la situación de cada niño28. Entre los medicamentos más utilizados destacamos los que se exponen seguidamente.
DiuréticosSon medicamentos que se han usado desde décadas para el tratamiento de la DBP ya que mejoran la resistencia de la vía aérea y la distensibilidad del pulmón, a la vez que ayudan a prevenir el edema pulmonar; además, por su efecto diurético nos van a permitir aportar más cantidad de volumen, y así poder administrar las calorías necesarias. El más utilizado es la furosemida en dosis entre 0,5-2mg/kg/día, pero no hay evidencias suficientes para recomendar su uso de forma prolongada29, ya que tiene riesgos potenciales como son desequilibrio electrolítico, ototoxicidad, nefrocalcinosis y osteopenia que obligan a ser cautos en su utilización. De hecho, la forma más utilizada es la administración a días alternos durante cortos períodos de tiempo para disminuir las alteraciones metabólicas. En niños pretérmino con DBP establecida o en desarrollo se ha utilizado la furosemida en aerosol para intentar minimizar los efectos secundarios, y se ha podido comprobar que una sola dosis de 1mg/kg de furosemida aerosolizada aumenta más la distensibilidad pulmonar a las 1–2h que la furosemida intravenosa o el placebo. Pero no se ha comprobado la mejoría pulmonar de forma significativa cuando se administra de forma crónica. En los casos en que se precise un tratamiento prolongado con diuréticos, la asociación tiazida-espironolactona puede ser una alternativa razonable para minimizar los efectos secundarios. Excepcionalmente el niño afectado de DBP requerirá tratamiento con diuréticos cuando se marcha de alta. En esos casos, los controles y monitorización electrolítica deberán ser muy estrictos30.
Broncodilatadores inhaladosLos broncodilatadores forman parte del tratamiento habitual de los niños con DBP, ya que se ha demostrado mejoría de la función pulmonar tras su administración, como hemos comentado anteriormente. Los beta-2-agonistas administrados en aerosol pueden incrementar la conductancia específica, disminuir la resistencia de la vía aérea y aumentar los flujos espiratorios. Pero estos resultados sólo se han comprobado a corto plazo, sin que se disponga de estudios suficientes que valoren sus efectos a largo plazo31. La administración se hará mediante nebulización o con sistema MDIespaciador, siendo ambas formas igualmente efectivas en mejorar la mecánica pulmonar, si bien la relación coste-efectividad parece mejor con el sistema MDI; en la actualidad, sólo se aconseja su uso cuando se sospeche obstrucción de la vía aérea y siempre que la respuesta sea favorable28. El más utilizado es el salbutamol.
Lectura rápida
La oxigenoterapia es uno de los pilares fundamentales en el tratamiento de la DBP. El objetivo de la misma es múltiple: ayudar al crecimiento y reparación del pulmón en desarrollo, garantizar una tolerancia adecuada al ejercicio y disminuir la hipertensión pulmonar y la sobrecarga del ventrículo derecho. Esto se conseguirá manteniendo niveles de saturación de oxígeno entre el 94-95% en todos los momentos (reposo, sueño, alimentación).
Teniendo en cuenta el papel de la inflamación en la patogenia de la DBP, los glucocorticoides sistémicos son eficaces en el tratamiento de la DBP. Mejoran la función pulmonar y, sobre todo, facilitan el destete del respirador. El que más se ha empleado es la dexametasona; pero, además de los efectos secundarios a corto plazo (hiperglucemia, perforación intestinal) se ha observado que a largo plazo aumentan el riesgo de parálisis cerebral, por lo que únicamente se usarán como último recurso terapéutico cuando falle el destete del respirador y el niño lleve más de 7 días con ventilación mecánica y necesitando concentraciones elevadas de oxígeno32,33. No se contempla el uso de glucocorticoides sistémicos tras el alta de la unidad neonatal.
Glucocorticoides inhaladosCada vez se utilizan más en el tratamiento de la DBP debido a su actividad antiinflamatoria y a sus menores efectos secundarios, si bien no se han hallado importantes beneficios con los mismos34–36. Tras el alta hospitalaria, pueden ser útiles para prevenir los episodios recidivantes de sibilancias y se pueden utilizar con los mismos criterios que se siguen en el asma, aunque no parece que el mecanismo fisiopatológico sea el mismo en estas 2 enfermedades37–39.
Otros fármacosEl mejor conocimiento de la patogenia de la DBP ha dado lugar a nuevas opciones terapéuticas, que están ensayándose con más o menos éxito: inositol, vitamina A, cafeína, tiroxina, antioxidantes (superóxido dismutasa, N-acetil cisteína, vitamina E, etc.), macrólidos, antiproteasas, pentoxifilina. Pero no hay suficientes estudios controlados para poder recomendar su uso de forma sistemática28–30.
Tratamiento tras el altaLa mejora de los cuidados perinatales y la situación sociosanitaria, así como el conocimiento que existe del impacto negativo de la hospitalización prolongada en el desarrollo del pretérmino, ha influido en el planteamiento de altas cada vez más precoces. Está documentado que el alta precoz de la unidad neonatal con un seguimiento adecuado no sólo es menos costosa, sino que también es segura y beneficiosa para el niño y su familia, incluso en el caso de niños que requieren cuidados más complejos (oxigenoterapia, aerosolterapia, etc.).
Las condiciones para el alta hospitalaria de la unidad neonatal se exponían en la tabla 2. Una vez decidida el alta y de acuerdo con los padres o cuidadores, es fundamental asegurarse un seguimiento adecuado por parte de los distintos especialistas (neumólogos, neurólogos especialistas en atención temprana, oftalmólogos, etc.), estableciendo un plan de visitas con una frecuencia variable según la situación del niño.
Condiciones para el alta de la unidad neonatal
| Estabilidad fisiológica, sin ninguna enfermedad aguda en los días previos |
| Capacidad para mantener una Sat O2 adecuada (94-95%) y estable en todos los momentos del día |
| Ausencia de agudizaciones respiratorias y/o episodios de apnea en las últimas 2 semanas |
| Ganancia ponderal adecuada |
| Capacidad de los padres o cuidadores para el manejo adecuado del niño |
| Sin cambios en el tratamiento en las últimas 2 semanas |
En el seguimiento y control de la enfermedad respiratoria incluiremos la evaluación clínica, funcional y radiológica, haciendo con especial énfasis en:
- 1.
Información exhaustiva a los padres o cuidadores sobre las características de la enfermedad, la evolución natural de la misma y su pronóstico a corto y largo plazo. Es muy importante para reducir la angustia familiar que los padres sean conscientes de los problemas que pueden presentarse, que conozcan cuáles son los signos de descompensación respiratoria y qué medidas pueden tomar, facilitándoles el contacto inmediato con el médico especialista. Son fundamentales las condiciones higiénico-ambientales del domicilio, por lo que se insistirá en la necesidad de evitar el humo del tabaco y cualquier otro irritante ambiental.
- 2.
Cómo prevenir las enfermedades respiratorias:
- —
Aconsejar lavado de manos de las personas que cuidan al niño.
- —
Evitar el contacto con personas afectadas de infecciones respiratorias.
- —
Demorar en lo posible la asistencia a guarderías.
- —
Programar o continuar la profilaxis frente a la infección por VRS con anticuerpos monoclonales.
- —
Recomendar vacunación antigripal en el niño a partir del sexto mes de vida, así como en los familiares que conviven con él.
- —
Evitar en lo posible ingresos hospitalarios reglados para cirugía reparadora, sobre todo en los meses de otoño-invierno.
- —
- 3.
Oxigenoterapia domiciliaria: los objetivos de la oxigenoterapia en el niño con DBP establecida son múltiples: ayudar al crecimiento y reparación del pulmón en desarrollo, garantizar una tolerancia adecuada al ejercicio y evitar la hipertensión pulmonar y la sobrecarga del ventrículo derecho. Los niños hipoxémicos tienen falta de energía para comer y estar alerta, y observaciones a largo plazo han demostrado un mejor estado general y nutricional en los niños bien oxigenados. También el mantenimiento de saturaciones adecuadas de oxígeno reducirá la frecuencia de apneas y el riesgo de episodios aparentemente letales40.
El oxígeno se administrará siempre bajo monitorización y dosificado de forma estricta. No hay acuerdo unánime sobre cuál es el nivel más bajo tolerable de saturación de oxígeno (SatO2) en los niños con DBP establecida y el rango en el que debe estar la misma, aunque de forma orientativa y coincidiendo con la mayoría de autores41–44, el oxígeno domiciliario debería indicarse cuando la SatO2 sea < 93% y una vez iniciado debe mantenerse para conseguir SatO2 entre 94-95%. La administración de oxígeno domiciliario se hace habitualmente mediante el uso de cánulas nasales (flujos entre 0,25l/m y 3l/m). El oxígeno líquido es el sistema más conveniente para uso domiciliario, precisándose válvulas reguladoras de bajo flujo y un cilindro portátil; en pacientes que requieran más de 1l/m se utilizan concentradores de oxígeno. Es importante que el paciente disponga en su domicilio de un monitor de SatO2.
Lectura rápida
Debido a las alteraciones persistentes de la función pulmonar y la menor capacidad para el ejercicio físico, consideramos de gran valor el seguimiento a largo plazo de estos niños, ya que pueden constituir un sustrato importante para el desarrollo de enfermedades tardías como la pulmonar obstructiva crónica (EPOC), sobre todo si se asocian otros factores como el tabaquismo.
La decisión de iniciar la retirada de oxígeno se hará evaluando la situación clínica y la monitorización de la saturación en su domicilio, y si no es posible, durante las visitas. La monitorización previa a la retirada definitiva se aconseja que se realice en períodos largos de varias horas, y mucho mejor si se puede hacer durante el sueño. Se realizará la retirada de forma gradual y será definitiva cuando la SatO2 sea ≥ 95% durante la alimentación, la actividad y el sueño. La retirada se hará de forma discontinua durante el día manteniendo la oxigenoterapia durante la noche hasta retirarla definitivamente. La familia debe estar informada de la posibilidad de requerir mayores necesidades de oxígeno cuando el niño tenga una infección respiratoria.
Seguimiento nutricionalOptimizar el crecimiento y el desarrollo constituyen el principal objetivo del soporte nutricional en los niños con DBP35. Estos niños tienen aumentadas las demandas metabólicas y requerimientos calóricos y requerirán mayor aporte energético que los niños sanos de su misma edad. Se debe prestar especial atención para detectar trastornos en la coordinación deglutoria y reflujo gastroesofágico y restricción de líquidos, sobre todo en los niños en los que la terapia diurética es insuficiente para evitar el edema pulmonar.
Las técnicas de alimentación y la composición de las fórmulas enterales son aún objeto de discusión. Para administrar las calorías adecuadas es conveniente recurrir a fórmulas especiales para prematuros, sobre todo durante los primeros meses, y en ocasiones será necesario suplementar con hidratos de carbono o grasas, aunque este aspecto es aún motivo de discusión. Habrá que prestar atención a los suplementos minerales y vitamínicos, necesarios en todos los prematuros. La monitorización sistemática de las medidas antropométricas de longitud, peso y perímetro cefálico ajustados a la edad gestacional nos serán de gran información para valorar el estado nutricional, si bien en ocasiones habrá que recurrir a estudios y valoraciones más complejos realizados por especialistas en nutrición.
Seguimiento cardiovascularDebido a la hipertensión pulmonar y cor pulmonale que pueden presentar los niños con DBP grave, será conveniente realizar periódicamente ecocardiografías.
Seguimiento auditivo, oftalmológico y del neurodesarrolloFormarán parte del manejo habitual de los prematuros con DBP.
Controles y visitas de seguimientoTras lo expuesto anteriormente podemos deducir que estos niños van a requerir una serie de cuidados y controles muy rigurosos para evitar que se produzca su empeoramiento o deterioro a lo largo de los primeros años de vida45,46.
Por esta razón, siguiendo entre otras las recomendaciones elaboradas por el Grupo de Trabajo de Displasia Broncopulmonar de la Sociedad Española de Neumología Pediátrica47 se deberán llevar a cabo una serie de visitas programadas, en las que se incluirá la realización de controles clínicos, analíticos, radiológicos y funcionales que exponemos (tabla 3).
Controles clínicos y seguimiento
| Generales | Primera visita a las 2-4 semanas tras el alta |
| Cada 3-4 meses el primer año | |
| Cada 6 meses entre el primer y segundo años | |
| Una vez al año hasta los 6 años (opcional) | |
| Primera visita | Situación clínica/respiratoria del niño |
| Alimentación (técnica, cantidad, etc.) | |
| Normas higiénico-ambientales a la familia | |
| Asegurar una adecuada actitud de los cuidadores ante la situación | |
| Contactar con el pediatra de atención primaria | |
| Programar o iniciar profilaxis frente a infecciones respiratorias por VRS | |
| Recomendar vacunación antigripal a partir del sexto mes de vida | |
| Visitas posteriores | Situación respiratoria: clínica, funcional, radiológica |
| Curva de crecimiento (valoración nutricional) | |
| Calendario vacunal obligatorio | |
| Exámenes complementarios (según sintomatología) | |
| Pruebas complementarias | 6–12 meses Radiografía de tórax. Valora TCAR (si la sintomatología es grave) Analítica sanguínea (si toma diuréticos) Ecocardiografía (si hay signos de hipertensión pulmonar) Función pulmonar (según medios técnicos) |
| 3 años TCAR opcional (si la sintomatología es grave) Espirometría Estudio inmunoalérgico según sintomatología | |
| ≥ 6 años (según sintomatología) Función pulmonar Espirometría Prueba de esfuerzo Prueba de broncodilatación Estudio inmunoalérgico según sintomatología TCAR en inspiración y espiración para valorar posibles secuela |
TCAR: tomografía computarizada de alta resolución; VRS: virus respiratorio sincitial. De Pérez Pérez et al47.
Existe una mejoría evidente a medida que el niño va creciendo. A partir del segundo año los episodios de sibilancias se reducen, así como los ingresos por agudizaciones respiratorias y pocos pacientes necesitarán oxígeno suplementario a partir de esa edad. Sin embargo, las anomalías en la función pulmonar permanecerán durante la edad escolar y la adolescencia, incluso en niños nacidos pretérmino que no han tenido DBP. Numerosos estudios han demostrado una disminución en los flujos aéreos espiratorios e hiperrespuesta bronquial, lo que limitará su actividad física39. Algunos investigadores sospechan mayor susceptibilidad de estos pacientes a padecer enfermedad pulmonar obstructiva crónica (EPOC) en la edad adulta, sobre todo si se asocia a tabaquismo5.