Puntos clave
Lectura rápida
Los hemangiomas infantiles son los tumores benignos más frecuentes en la infancia. La mayoría de ellos no requieren tratamiento, ya que, durante años, se ha observado que la tendencia natural de los mismos es la involución espontánea. Sin embargo, alrededor del 20% precisan tratamiento, bien por generar gran deformidad o desfiguración, bien por afectar a funciones vitales que amenazan el correcto desarrollo del niño.
TratamientoEl tratamiento de elección han sido los corticoides administrados por vía oral, hasta el año 2008, cuando se publicó la drástica respuesta de estos tumores al tratamiento con propranolol.
El propranolol es un β-bloqueante no cardioselectivo, cuya acción sobre los hemangiomas no está bien descrita en la actualidad. Las 3 acciones fundamentales que se han descrito como inductoras a la involución de estos tumores son: vasoconstricción, inhibición de la expresión de los factores de crecimiento del endotelio vascular (VEGF) y de los fibroblastos (bFGF) e inducción de la apoptosis de las células endoteliales.
No existe un protocolo de actuación estandarizado para la administración de este medicamento. La mayoría de los autores coinciden en la realización de una exploración general y estudio cardiológico previos al inicio de la toma del fármaco.
Los hemangiomas infantiles son los tumores benignos más frecuentes1,2 en recién nacidos y lactantes. Aunque la incidencia real es desconocida3, se estima que afectan a 1 de cada 10 niños, más o menos entre el 2 y el 12%4 de los niños de raza blanca nacidos a término. Este porcentaje aumenta hasta el 23% cuando los recién nacidos son prematuros con un peso inferior a 1.200 g1,5. Las niñas están afectadas con más frecuencia, con una relación 3:11.La localización más frecuente es el tercio superior del cuerpo, fundamentalmente cara y cuello (60%), tronco (25%) y extremidades (15%), aunque pueden asentar en cualquier región corporal6. Alrededor del 80% se presentan como un tumor solitario, aunque el 20% de los pacientes tienen más de una lesión.
La etiopatogenia es desconocida, pero se postula un desequilibrio entre los factores de crecimiento y los factores apoptóticos en el tejido afectado que serían responsables del crecimiento anómalo del tejido vascular4.
Historia naturalLa mayoría de los hemangiomas infantiles tienen una historia natural característica, que cursa en 3 etapas:
- —
Fase proliferativa: dura desde los primeros días de vida hasta los 9 meses aproximadamente. Por lo general, se aprecia una mácula eritematosa tenue o una mancha hipovascularizada con telangiectasias en el momento del nacimiento, que experimenta un crecimiento rápido, multiplicando su tamaño en pocos días. En este período de crecimiento, el hemangioma puede ulcerarse, con o sin sobreinfección, limitar actividades vitales para el desarrollo del bebé como la visión cuando asientan en párpado o, incluso, limitar la función respiratoria si asientan en la vía respiratoria.
La histología en esta fase muestra células endoteliales hipertróficas, con abundantes mitosis, elevado número de mastocitos y membranas basales multilaminadas. Asimismo, las células endoteliales expresan positividad para la tinción inmunohistoquímica, los marcadores GLUT-1 (transportador de glucosa expresado en la placenta y otras zonas de intercambio), FcγRII, antígeno Y de Lewis, merosina, factor de crecimiento del endotelio vascular (VEGF) y factor de crecimiento básico de fibroblastos (bFGF)7.
- —
Fase de estabilización: tras la fase proliferativa, el hemangioma entra en un período de estabilización, en el que no experimenta crecimiento ni se observa regresión.
- —
Fase de regresión: a partir de los 10–15 meses el hemangioma comienza a regresar. Adquiere tonalidades blanco-grisáceas en algunas zonas, que de manera progresiva sustituyen a la coloración eritematosa o violácea y disminuyen su tamaño. El hemangioma puede regresar total o parcialmente, y se observan cambios de coloración, telangiectasias residuales en el seno del hemangioma o piel redundante.
La histología en esta fase muestra apoptosis, células endoteliales planas, aparentemente inactivas en una matriz de tejido fibroadiposo. El marcador GLUT-1 se mantiene positivo a lo largo de toda la historia natural del hemangioma.
ClasificaciónSegún la presentación clínica, los hemangiomas se pueden dividir en:
- —
Superficiales: el componente tumoral afecta sobre todo a la dermis y a la epidermis. Clínicamente es una masa carnosa, exuberante, de coloración rojo brillante.
- —
Profundos o subcutáneos: el componente tumoral se extiende a planos profundos, conformando una tumoración subcutánea, de consistencia blanda y tonalidad violácea que se aprecia a través de la piel que lo cubre, la cual tiene una tonalidad normal o levemente hiperpigmentada.
- —
Mixtos: combinación de los dos anteriores.
Otros autores prefieren clasificarlos6 según el número de lesiones en:
- —
Hemangiomas localizados o segmentales: asientan sobre una región focal definida o sobre un área de mayor tamaño sin aparente distribución lineal ni afectación del desarrollo morfológico normal.
- —
Hemangiomas indeterminados: no cumplen características ni de hemangiomas localizados o segmentales, ni de hemangiomas multifocales.
- —
Hemangiomas multifocales: se presentan, al menos, con 10 lesiones cutáneas.
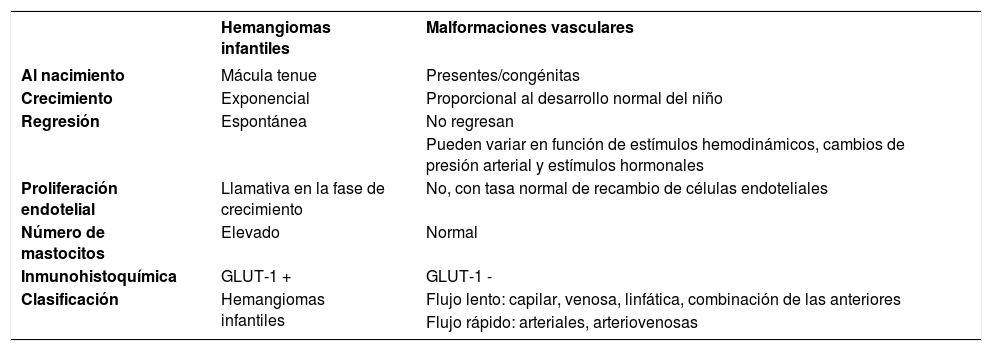
El diagnóstico diferencial fundamental se debe establecer con las malformaciones vasculares, que son verdaderas anomalías estructurales y morfológicas debidas a errores durante la embriogénesis (tabla 1).
Diagnóstico diferencial de los hemangiomas y las malformaciones vasculares
| Hemangiomas infantiles | Malformaciones vasculares | |
|---|---|---|
| Al nacimiento | Mácula tenue | Presentes/congénitas |
| Crecimiento | Exponencial | Proporcional al desarrollo normal del niño |
| Regresión | Espontánea | No regresan |
| Pueden variar en función de estímulos hemodinámicos, cambios de presión arterial y estímulos hormonales | ||
| Proliferación endotelial | Llamativa en la fase de crecimiento | No, con tasa normal de recambio de células endoteliales |
| Número de mastocitos | Elevado | Normal |
| Inmunohistoquímica | GLUT-1 + | GLUT-1 - |
| Clasificación | Hemangiomas infantiles | Flujo lento: capilar, venosa, linfática, combinación de las anteriores |
| Flujo rápido: arteriales, arteriovenosas |
Lectura rápida
La dosis administrada oscila entre 2–3mg/kg/día, dividiendo la dosis total en 2 o 3 tomas al día. Se ha descrito tanto la escalada de dosis como el inicio del tratamiento con dosis plenas.
Los autores coinciden en la vigilancia de los efectos secundarios más frecuentes como la hipoglucemia, la hipotensión y la bradicardia. Inicialmente, la toma de constantes se realiza tras las primeras administraciones del fármaco y en régimen de hospitalización. Posteriormente, el control se realiza de forma ambulatoria y más espaciado en el tiempo.
Hasta ahora se han descrito efectos secundarios graves como hipoglucemia y bradicardia. No se ha descrito ningún episodio de desenlace fatal.
Se ha descrito recrecimiento de tumores tras la suspensión del tratamiento, fundamentalmente si se hallaban en fase de crecimiento.
En la actualidad sólo se han publicado series de casos. No existen ensayos clínicos que avalen la seguridad de este medicamento para esta indicación. Por ello, su administración se realiza a través de petición de fármaco de uso compasivo.
En la mayoría de los hemangiomas infantiles es adecuado mantener una actitud expectante, ya que hasta el 50% han regresado a los 5 años, el 70% a los 7 años y el 90% a los 9 años. Sin embargo, el 20% de los hemangiomas presentan complicaciones durante la fase de crecimiento8, y precisan tratamiento1. Incluyen fundamentalmente los que asientan en área periorbital, área centrofacial, vía aérea, pliegues, región anogenital y regiones con alto riesgo de ulceración, disfunción o desfiguración6. La ulceración es la complicación que se produce con mayor frecuencia9.
La primera línea de tratamiento6,10 utilizada en los últimos años han sido los corticoides2 administrados por vía sistémica, en dosis iniciales de 3–4mg/kg/día, y después reduciendo dicha dosis durante períodos de al menos 6 meses de duración. La respuesta clínica de los hemangiomas ha sido aceptable, con una buena respuesta en el 50% de ellos aproximadamente. Se han registrado numerosos efectos secundarios con la administración a largo plazo de tratamiento corticoide oral.
Las alternativas terapéuticas10 farmacológicas como vincristina o interferón α11,12 son más tóxicas y se utilizan en casos seleccionados. La radioterapia está actualmente contraindicada. La cirugía clásica es muy útil en casos sin respuesta a tratamiento médico, en lesiones fácilmente accesibles, en hemangiomas de la punta de la nariz y en párpados. El uso del láser es controvertido, aunque parece existir consenso en que es eficaz en la reducción del dolor en los hemangiomas ulcerados. En series de casos limitadas de pequeños hemangiomas no complicados se usó la administración tópica de imiquimod crema al 5%, con resultados satisfactorios sólo para los hemangiomas superficiales de pequeño tamaño13. Asimismo, se ha publicado un artículo en el que tratan a 6 pacientes con hemangiomas superficiales, mediante la aplicación diaria, cada 12h, de timolol al 0,5% en forma de gel con respuesta satisfactoria14. Estos tratamientos nuevos están limitados tanto por la escasa casuística como por la involución espontánea. Recientemente se ha introducido el propranolol, un bloqueante β no cardioselectivo, para el tratamiento de los hemangiomas infantiles. Actualmente no se han publicado resultados de ensayos clínicos que avalen su uso15 y dado que aún no está aprobada su indicación en ficha técnica, continúa siendo un medicamento de uso compasivo. Se desconoce su mecanismo de acción exacto, pero hasta ahora sabemos que interfiere con las células endoteliales vasculares, regula el tono vascular, la angiogénesis y la apoptosis7,16. Los efectos del propranolol sobre el tejido tumoral se dividen en 3 etapas, en función de la diana molecular sobre la que actúen. Los efectos inmediatos son cambios de color y tamaño que se han apreciado a las 24h de iniciarse el tratamiento y se atribuyen a la vasoconstricción mediada por la disminución del óxido nítrico (NO). Los efectos a medio plazo, como la reducción del volumen tumoral4,7, se deben al bloqueo de señales proangiogénicas como el VEFG. Los efectos a largo plazo, que se caracterizan por la inducción de apoptosis de las células endoteliales proliferantes, se traducen clínicamente en regresión tumoral17.
La farmacocinética del propranolol se conoce en los pacientes adultos, siendo la vida media entre 3,5 y 6h, con un pico de absorción entre 1 y 3h después de la toma11. Sin embargo, no existen datos suficientes en los pacientes menores de un año11. Los principales efectos adversos18 del tratamiento con propranolol son bradicardia, hipotensión11,18, hipoglucemia, broncospasmo, alteraciones gastrointestinales y alteraciones del sueño. El uso de este fármaco puede enmascarar signos clínicos de insuficiencia cardíaca como la taquipnea o la hipersudoración.
Los principales datos clínicos que alertan frente a los efectos adversos son letargia, dificultad para conciliar el sueño, dificultad respiratoria, sudoración fría, retraso en el relleno capilar y anorexia. Sin embargo, se han publicado casos de efectos adversos que no presentaban sintomatología11. Es por ello que se establece la toma de constantes (frecuencia cardíaca, presión arterial y glucemia) durante la toma de las primeras dosis, ya que la susceptibilidad al fármaco es muy variable.
Las variables que se deben tener en cuenta antes de iniciar el tratamiento incluyen la edad del paciente, historia de prematuridad, tipo de hemangioma, comorbilidad asociada, entendimiento y compromiso parental4. Los datos publicados hasta el momento recomiendan una evaluación cardiológica completa, incluyendo realización de un electrocardiograma (ECG) y una ecocardiografía electiva18 previa al inicio del tratamiento11,19,20.
Las dosis indicadas oscilan entre 2 y 3mg/ kg/día1,7,16, divididas en 2 o 3 tomas. Algunos autores avalan la instauración gradual del fármaco para el mejor control de los efectos adversos. La escalada se realizaría del siguiente modo11,21:
- —
Se inicia con 0,17mg/kg/dosis, realizando una toma cada 8 h18. Control de constantes 1h después de cada toma.
- —
Si hay buena tolerancia, se dobla la dosis (0,33mg/kg/dosis y 0,67mg/kg/dosis) cada 2 tomas bien toleradas18.
- —
Si el paciente es menor de 3 meses, se utiliza la misma pauta de escalada, pero doblando la dosis cada 3 días de toma con controles bien tolerados.
- —
Asimismo, se recomienda la retirada gradual del fármaco durante 2 semanas, a mitad de dosis cada semana, por riesgo de crisis hipertensiva.
Se recomienda la determinación diaria de constantes (presión arterial, frecuencia cardíaca y glucemia) los primeros 15 días de tratamiento. Posteriormente, se indica un control cada 15 días durante los 2 meses posteriores y evaluación cardiológica periódica durante el tratamiento1,20,22. Se recomienda iniciar tratamiento a dosis plenas con control hospitalario18. Se realizará control de tolerancia al fármaco durante al menos 48 h18. Posteriormente, el seguimiento será ambulatorio y la toma de constantes se espaciará de forma progresiva a semanal, quincenal y mensual. La retirada del fármaco debe plantearse tras la fase proliferativa, es decir, tras al menos 5–9 meses desde el inicio del crecimiento20. No hay consenso en la literatura médica respecto a si la retirada debe ser progresiva o brusca. No se han publicado complicaciones en ninguna de las dos conductas adoptadas. Algunos autores sugieren reducir la dosis durante 2–3 semanas2 y seguir la evolución clínica, valorando el recrecimiento de la lesión23.
Las principales contraindicaciones incluyen1:
- —
Insuficiencia cardíaca no controlada.
- —
Bloqueo auriculoventricular de segundo o tercer grado.
- —
Bloqueo sinusal.
- —
Asma no controlada.
- —
Arteriopatía periférica.
- —
Alteración de la glucemia.
- —
Síndrome PHACE: malformaciones cerebrales de la fosa posterior, hemangiomas, coartación de la aorta y alteraciones cardíacas oculares (eye).