Puntos clave
La infección primaria prenatal ocasiona la enfermedad congénita, se adquiere por vía transplacentaria, siendo su gravedad proporcional a la carga viral recibida
La infección posnatal se puede adquirir por vía respiratoria o digestiva y por transfusiones sanguíneas (leucocitos con virus latente)
En la gestante seronegativa deben extremarse las medidas profilácticas para evitar la primoinfección (lavado de manos tras cambiar pañales, evitar besos en la boca, no compartir comidas, bebidas y vasos)
La avidez de la IgG anticitomegalovirus es la prueba más fiable para el diagnóstico de la infección primaria en gestantes
El diagnóstico posnatal se basa en el análisis del ADN mediante reacción en cadena de la polimerasa en orina, líquido cefalorraquídeo o sangre
El tratamiento con ganciclovir durante 6 semanas esta indicado en la infección congénita sintomática, con afectación neurológica, trombopenia o alta carga viral. No se considera indicado en la infección asintomática y en cuadros clínicos irreversibles
El citomegalovirus (CMV) es un herpes virus, miembro de la familia de Herpesviridae, del que existen varios serotipos. A semejanza de otros virus de la familia Herpes, tiene la capacidad de permanecer en estado latente y reactivarse1,2. Cuando infecta a una célula humana condiciona que aumente su tamaño y aparezcan cuerpos de inclusión intranucleares e intracitoplasmáticos. La infección por CMV aparecerá en el 0,3–2,2% de los recién nacidos (RN) vivos3,4. La prevalencia de la infección congénita en países industrializados es alrededor del 0,63–0,7%5
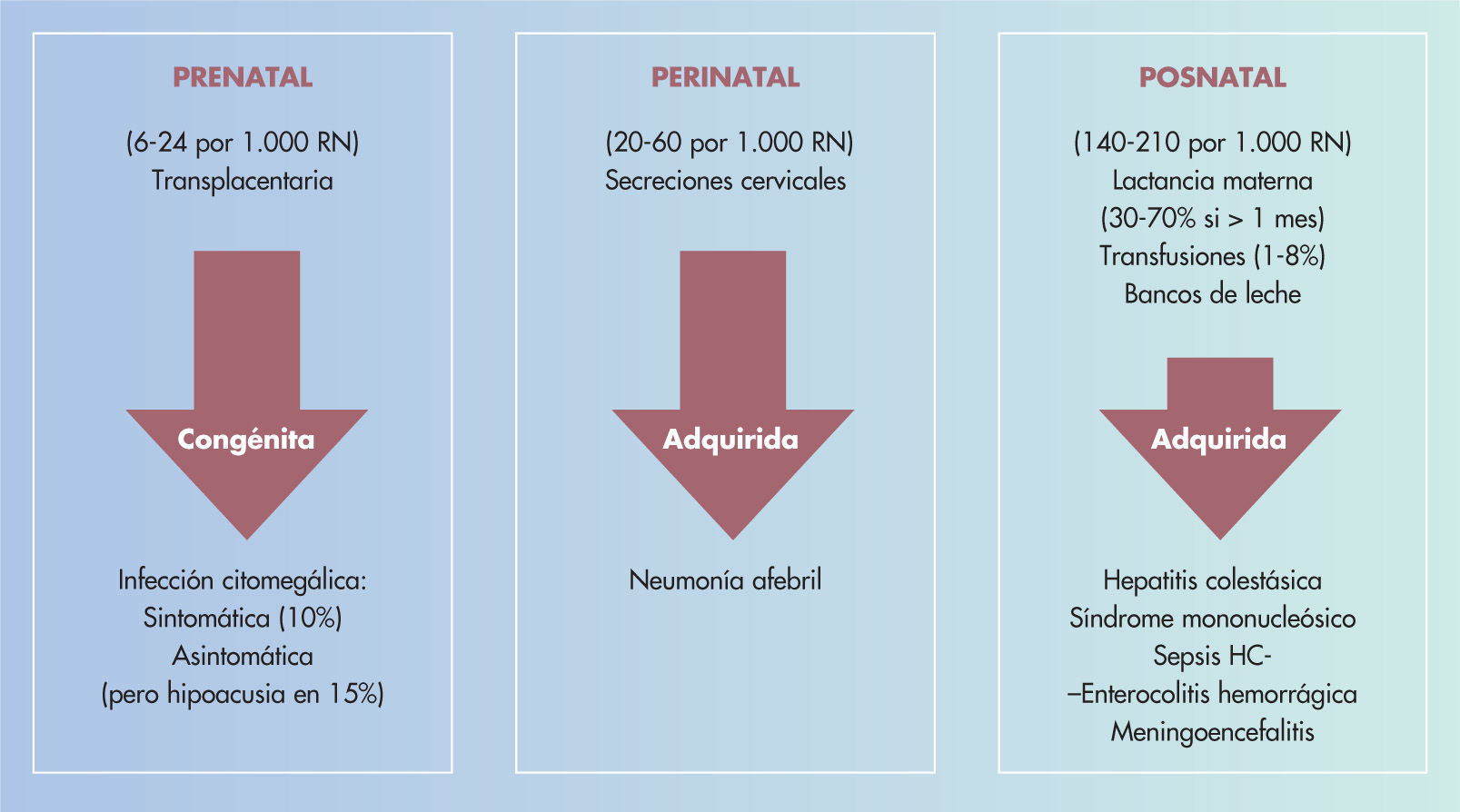
Infección por citomegalovirus en la gestante y el fetoLa infección por CMV se considera la infección viral más frecuente en la gestante, el feto y el RN6. La infección en la gestante puede ser primaria, por reinfección o por reactivación del virus7. La infección del feto o RN será prenatal, intranatal o posnatal (fig. 1)
La infección primaria prenatal condiciona la enfermedad congénita, y se adquiere por vía transplacentaria a partir de la viremia materna, siendo su gravedad proporcional al momento en que se infecta y a la carga viral recibida. La infección intranatal es transmitida en el momento del nacimiento, a partir de secreciones cervicales contaminadas, y ya se puede considerar una forma adquirida. La infección posnatal será siempre adquirida, por vía respiratoria o digestiva, aunque también puede tener su origen en transfusiones sanguíneas (leucocitos que contienen el virus en estado latente), leche materna (reactivación del CMV en las madres seropositivas, apareciendo en la leche a los primeros días y alcanzando el máximo número de copias virales a las 43–6 semanas), contacto venéreo por la gran riqueza de virus en las secreciones cervicovaginales o trasplantes de órganos. En el 40% de las embarazadas afectadas de una infección por CMV adquirida se produce paso del virus al feto a través de la placenta, en la que también aparecen alteraciones citomegálicas. Aunque se produce en la madre una inmunidad humoral duradera, los hijos siguientes pueden, en ocasiones, resultar afectados nuevamente, bien por un defecto de la inmunidad celular exclusivo ante este virus o por reactivaciones o por reinfecciones o por otras causas
Un organismo seropositivo a CMV puede estar expuesto por vía endógena o exógena a la infección8,9. La exposición exógena a un CMV de diferente tipo antigénico da lugar a la reinfección; también puede ocasionar reinfección una dosis infectante de virus en un niño seropositivo con respuesta inmunológica alterada. La exposición endógena por reactivación de una infección por CMV latente puede ocurrir en circunstancias fisiológicas, patológicas o iatrogénicas, como ocurre en el embarazo, enfermedades debilitantes, intervenciones quirúrgicas, administración de inmunosupresores o trasplantes de órgano. La infección por CMV congénita por reactivación suele ser asintomática
El virus se disemina por vía hematógena, afectando primero al epitelio tubular renal donde se replica y es excretado por la orina al líquido amniótico. Su ingesta por el feto va seguida de una replicación en la orofaringe y una nueva diseminación hematógena, afectándose sobre todo el sistema nervioso central (SNC), ojos, pulmón e hígado, produciéndose la forma clínica más grave. En el caso de contagio intranatal o posnatal por leche materna, la puerta de entrada suele ser la orofaringe y la replicación del virus tiene lugar en la mucosa del tracto respiratorio o digestivo, con una diseminación hematógena
Lectura rápida
La infección primaria prenatal causa la enfermedad congénita, se adquiere por vía transplacentaria y su gravedad es proporcional a la carga viral recibida. La infección intranatal es transmitida en el momento del nacimiento, a partir de secreciones cervicales contaminadas y se considera una forma adquirida. La infección posnatal será siempre adquirida por vía respiratoria o digestiva (saliva, leche materna, secreciones cérvico vaginales), aunque también puede tener su origen en transfusiones sanguíneas (leucocitos que contienen el virus) o trasplantes de órganos
La exposición a un virus de diferente tipo antigénico da lugar a la reinfección La exposición endógena por reactivación de un virus latente se puede dar en el embarazo, intervenciones quirúrgicas, administración de inmunosupresores o trasplantes de órgano
La gestante seronegativa tiene una probabilidad entre el 13–4%, de presentar una primoinfección; en este caso, la infección fetal será del 40% y la enfermedad fetal sintomática del 103–15% de los infectados. Por lo tanto, la probabilidad de que el feto adquiera una infección sintomática será baja, del 43–6%
La gestante seronegativa para el CMV puede presentar una primoinfección con una probabilidad entre el 13–4%, si bien en este caso la infección fetal será del 40% y la enfermedad fetal sintomática del 103–15% de los infectados. Por lo tanto, la probabilidad de que el feto adquiera una infección sintomática será baja, del 43–6%
En esta circunstancia es cuando deben extremarse las medidas profilácticas para evitar la primoinfección en la gestante Debería evitarse el contacto con pacientes excretores, medida que es difícil de realizar porque son asintomáticos. Se consideran mujeres de riesgo alto a las que trabajan en guarderías infantiles, las cuales deberían efectuar un buen lavado de manos tras cambiar los pañales (habiendo usado también guantes), evitar besos en la boca y no compartir comidas, bebidas y vasos. Se debe recordar la posible transmisión venérea del CMV. Al no disponer de un tratamiento efectivo para el feto, no se recomienda el diagnóstico serológico sistemático de las gestantes. Las indicaciones de estudio de las gestantes se resumen en la tabla 1
Indicaciones de estudio de gestante
| Clínica compatible con primoinfección por CMV |
| Infección por VIH, inmunosupresión |
| Gestante seronegativa en contacto con lactantes o niños que van a guardería |
| CIR en el primer trimestre + ventriculomegalia |
| Hallazgos indicativos en ecografías fetales |
| Hidropesía, ascitis, cardiomegalia, hepatoesplenomegalia |
| Polioligohidramnios, hiperecogenicidad intestina Microcefalia, ventriculomegalia, atrofia cortica Pliegue nucal aumentado con cariotipo norma Calcificaciones hepáticas o intracraneales |
CIR: crecimiento intrauterino retardado; CMV: citomegalovirus; VIH: virus de la inmunodeficiencia humana
La gestantes seropositivas son más prevalentes (60% entre 153–24 años y hasta 95% después de los 36 años), en especial en caso de bajo nivel socioeconómico o si tienen hijos en edad preescolar (que actúan como reservorios humanos del CMV)10. En este caso, pueden presentar infecciones recurrentes o reactivaciones del CMV, en especial en la vagina y la glándula mamaria, las cuales solo dan lugar a infección fetal en el 0,153–1% de los casos y enfermedad fetal sintomática en el 03–1% de los infectados
Evidencia de una primoinfección por citomegalovirus durante la gestaciónLa infección materna suele ser asintomática o confundirse con un cuadro gripal, por lo que el diagnóstico debe hacerse con pruebas de laboratorio (fig. 2). Mediante técnicas de ELISA se puede determinar específicamente la IgG y la IgM, pero con una amplia variabilidad en la fiabilidad del diagnóstico. La presencia de IgM anti-CMV es un buen indicador de infección reciente, pero pueden concurrir otras circunstancias. La gestante puede producir IgM por reactivaciones o reinfección y en algunos casos se pueden detectar IgM anti-CMV hasta 63–9 meses después de una infección primaria. Los falsos positivos son frecuentes y pueden aparecer tras otras infecciones virales (B19, virus de Epstein-Barr, etc.)11. La avidez de la IgG anti-CMV es la prueba más fiable para el diagnóstico de la infección primaria en gestantes12,13. Una avidez baja de la IgG indica que los anticuerpos se han producido por una infección reciente primaria, mientras que una avidez alta indica lo contrario. Se recomienda su determinación cuando la IgM es positiva14-16, especialmente antes de las 163–18 semanas (sensibilidad 100%), pues después de las 20 semanas se reduce. Si la avidez es alta en las primeras 12 a 16 semanas de gestación, se puede descartar una infección reciente.
El diagnóstico de infección fetal se puede hacer evidenciando la presencia del virus en líquido amniótico mediante técnicas de reacción en cadena de la polimerasa (PCR), con una alta sensibilidad y especificidad (del 90 al 98% y del 92 al 98%, respectivamente)17. El líquido amniótico es el producto de elección y evita la cordocentesis18. La muestra de líquido amniótico debe obtenerse después de la semana 21 y por lo menos de 6 a 9 semanas después de la infección materna para que el virus se excrete en cantidad suficiente por la orina fetal. El valor predictivo negativo es 100%19
La enfermedad fetal puede comportar hallazgos en la ecografía o la resonancia magnética (RM), si bien son inespecíficos. Las alteraciones morfológicas del SNC se acompañan siempre de secuelas. Además, debe buscarse restricción de crecimiento fetal, hepatoesplenomegalia, hiperecogenicidad intestinal, calcificaciones hepáticas o craneales, o ascitis. Muchas de estas alteraciones no pueden verse antes de la semana 26. La RM puede proporcionar mayor información del desarrollo cortical neuronal y de la sustancia blanca alrededor de 323–34 semanas203–24
Si se demuestra infección fetal, y en especial cuando la ecografía fetal muestre detención del crecimiento o alteraciones cerebrales, se informará a la familia que puede considerar la interrupción legal del embarazo. En la actualidad no se dispone de ningún tratamiento para la infección por CMV del feto, si bien se ha ensayado la administración a la gestante de inmunoglobulina específica anti-CMV (100U/kg/mes para prevenir la infección fetal y el doble para intentar tratarla), con una aparente reducción de la probabilidad de infección congénita por CMV y su gravedad25,26. Tiene un alto costo. También se ensaya la utilización de ganciclovir, que atraviesa la placenta y parece bien tolerado por el feto, y la administración de una vacuna con glucoproteína B de CMV (3 dosis tras el parto)27. Por la relativa baja incidencia y la poca gravedad de la enfermedad adquirida intraparto, no está justificada la práctica de cesárea ante la sospecha de citomegalovirosis genital. Tampoco se suprimirá la lactancia materna, si bien puede ser peligrosa la leche de banco no pasteurizada ni congelada.
Lectura rápida
Las gestantes seropositivas son más prevalentes (60% entre 153–24 años), pueden presentar reinfecciones o reactivaciones del citomegalovirus (CMV), en especial en la vagina y la glándula mamaria, las cuales solo dan lugar a infección fetal en el 0,153–1% de los casos y enfermedad fetal sintomática en el 0-1% de los infectados
La infección materna suele ser asintomática. La presencia de IgM anti-CMV es un buen indicador de infección reciente. La gestante puede producir IgM por reactivaciones o reinfección. Los falsos positivos son frecuentes y pueden aparecer tras otras infecciones. La avidez de la IgG anti-CMV es la prueba más fiable, una avidez baja indica una infección reciente primaria
El diagnóstico de infección fetal se puede hacer evidenciando la presencia del virus en líquido amniótico mediante técnicas de reacción en cadena de la polimerasa (PCR), con una alta sensibilidad y especificidad (del 90 al 98% y del 92 al 98%, respectivamente)
Lectura rápida
Si se demuestra infección fetal, y en especial cuando la ecografía fetal muestre restricción del crecimiento o alteraciones cerebrales, los padres pueden considerar la interrupción legal del embarazo. En la actualidad no se dispone de ningún tratamiento para el feto
La infección congénita sintomática grave suele presentarse en prematuros (34%) y recién nacidos de bajo peso (50%) que muestran ictericia (67%), hepatoesplenomegalia (60%) y lesiones cutáneas purpúricas o petequiales (76%), hepatitis y trombopenia y síntomas de afectación neurológica. Mediante técnicas de imagen se pueden ver quistes periventriculares, calcificaciones cerebrales periventriculares, ventriculomegalia, hidranencefalia y alteraciones de migración neuronal. El fondo de ojo puede mostrar coriorretinitis (103–15%) y atrofia óptica, y los potenciales auditivos de tronco cerebral una hipoacusia neurosensorial
Suele ser consecuencia de una infección primaria prenatal con paso del virus por vía transplacentaria. Como ya se ha indicado, los RN pueden no presentar sintomatología clínica aparente de enfermedad (853–90% de los casos), presentarla con manifestaciones aisladas o bien ofrecer un cuadro clínico grave y de sintomatología florida, Cuanto más precozmente sucede la infección primaria durante la gestación, peor es el pronóstico28, si bien la infección en el tercer trimestre también puede condicionar sordera29–32
Citomegalovirosis congénita sintomática graveSuele presentarse en prematuros (34%) y RN de bajo peso (50%) que, al cabo de pocas horas o días del nacimiento, muestran ictericia (67%), hepatoesplenomegalia (60%) y lesiones cutáneas purpúricas o petequiales (76%), expresión de una hepatitis y trombopenia infecciosa, a las que se pueden añadir síntomas de afectación neurológica (hipotonía, letargia, convulsiones, por meningoencefalitis), digestiva (vómitos, diarrea, por gastroenteritis), pulmonar (disnea, taquipnea, por neumonitis intersticial o consumo de surfactante), cardíaca (signos de insuficiencia cardíaca por miocarditis), cutánea (nódulos violáceos constituidos por focos de eritropoyesis extramedular) o renal. El laboratorio mostrará anemia con eritroblastosis, neu-trofilia, hiperbilirrubinemia (bilirrubina directa > 2mg/dl), aumento de enzimas hepáticas (AST>80U/l), trombocitopenia (< 100.000/mm3) y, en el líquido cefalorraquídeo (LCR), pleocitosis y aumento de proteínas; en ocasiones puede aparecer un síndrome de coagulación intravascular diseminada. En la exploración radiográfica se visualizan bandas en las metáfisis de los huesos largos. Las alteraciones que se pueden encontrar en el sistema nervioso mediante técnicas de imagen (tomografía computarizada o RM) son quistes periventriculares, calcificaciones cerebrales periventriculares, ventriculomegalia, hidranencefalia y alteraciones de migración neuronal. El fondo de ojo puede mostrar coriorretinitis (103–15%) y atrofia óptica, y los potenciales auditivos de tronco cerebral una hipoacusia neurosensorial. La evolución es rápidamente mortal en el curso de unos días hasta en un 30% de los pacientes
Infección congénita atenuada, paucisintomática o asintomáticaPueden aparecer solo hepatoesplenomegalia, trombocitopenia o coriorretinitis, aunque son posibles trastornos neurológicos posteriores. En el grupo más frecuente con infección asintomática se ha señalado también la posibilidad de secuelas neurológicas en el 53–15%, en especial pérdida de audición y retraso mental discreto, que se pondrá de manifiesto de forma tardía
Infección adquiridaSuele adquirirse durante el nacimiento a partir de secreciones cervicales contaminadas y corresponde al 303–50% de las infecciones perinatales por CMV. Suele ser asintomática o a las pocas semanas de vida puede cursar con un cuadro respiratorio con tos, taquipnea, dificultad respiratoria y sibilancias; radiológicamente se aprecian signos de neumonitis e hiperventilación, pudiéndose aislar el CMV de faringe y orina o mediante lavado broncoalveolar. La infección por leche materna contaminada es frecuente; la transmisión ocurre en el 303–70% de las casos tras una incubación media de 42 días o más breve en RN pretérmino y, aunque suele ser asintomática, puede dar una grave morbilidad33, inclusive con un cuadro séptico34 en los prematuros. En ocasiones, puede aparecer una hepatoesplenomegalia con alteración de las enzimas hepáticas35 y un cuadro de seudomononucleosis. La infección por CMV ha sido asociada con diarreas hemorrágicas36, meningitis aséptica o un cuadro encefalítico similar al producido por el virus herpético
La gravedad de la infección por CMV adquirida en el RN va ligada a un origen no materno de la infección, sea por transfusión o por administración de leche de banco contaminada; si la madre es la fuente de la infección, el RN dispondrá de una inmunidad transplacentaria que evitará formas graves, excepto en el prematuro
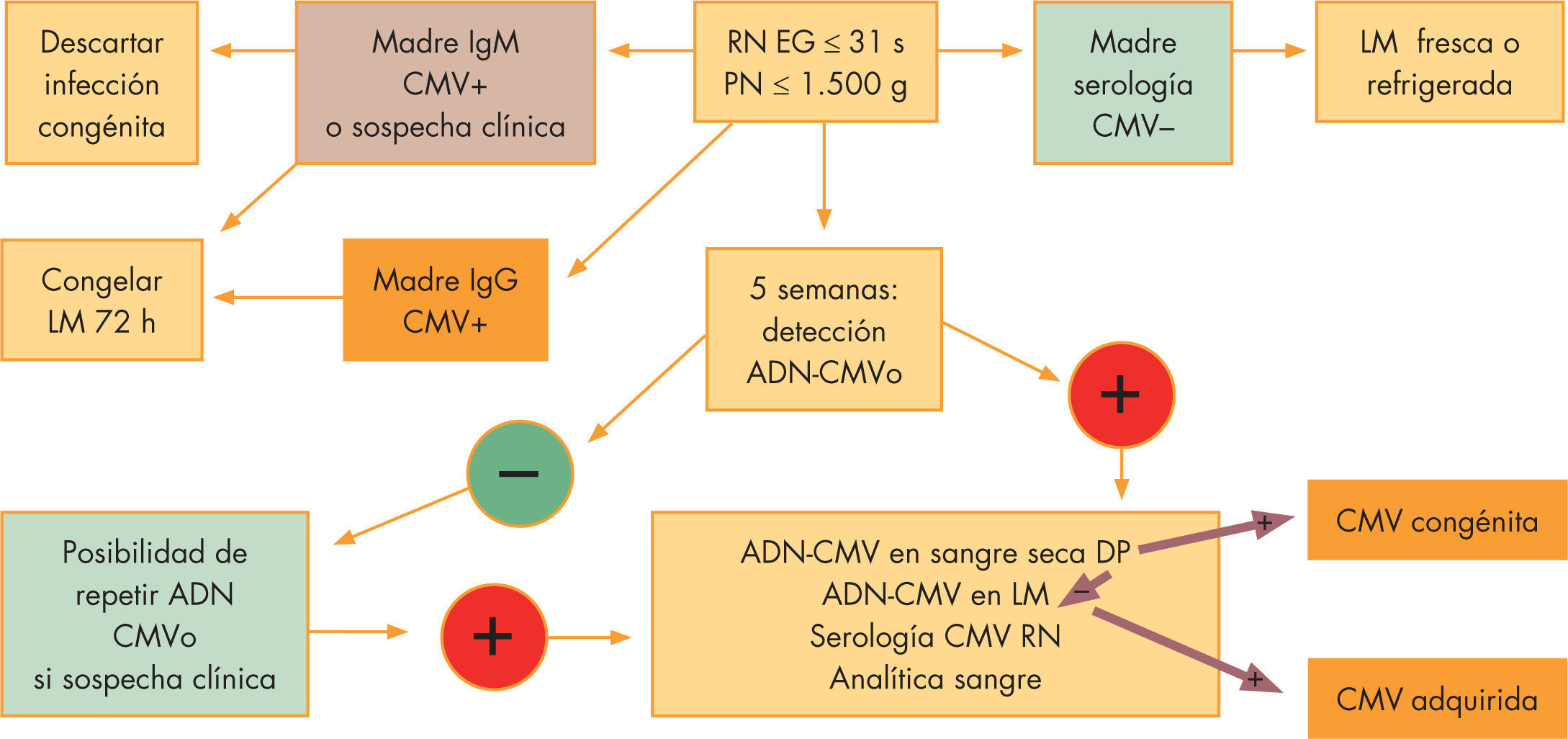
DiagnósticoLas indicaciones de estudio posnatal de CMV se resumen en la figura 3. Cabe destacar el cribado sistemático de todos los prematuros extremos a partir de las 43–6 semanas de vida, momento en que se puede detectar si ha existido una infección por CMV, bien congénita o adquirida (fig. 4)
El diagnóstico posnatal se fundamenta en:
- –
Histología: se pueden hallar células con cuerpos de inclusión intranucleares e intracitoplasmáticos en el tejido hepático y el pulmonar procedentes de biopsia (células en «ojos de búho o lechuza»), o en las células de sedimento de orina, en saliva y en LCR
- –
Virología: el cultivo de virus es el método más específico para el diagnóstico. Las muestras más utilizadas son orina, saliva, LCR y tejidos procedentes de biopsia
- –
Serología: la mayor sensibilidad la presentan las técnicas de hemaglutinación, inmunofluorescencia indirecta y enzimoinmunoensayo, todas las cuales miden anticuerpos IgG. La existencia de anticuerpos IgM para CMV en el feto (tras cordocentesis) o en el RN confirma una infección congénita, si bien solo se encuentra en el 70% de los infectados
- –
Análisis del ADN mediante PCR: permite un diagnóstico más rápido en orina, LCR o sangre y tiene gran utilidad para los estudios epidemiológicos y para el análisis del líquido amniótico. Su positividad en las 3 primeras semanas de vida indica infección congénita, mientras que posteriormente la presencia de virus puede ser por infección adquirida. Una PCR para CMV positiva en líquido amnióti
Lectura rápida
La infección congénita asintomática puede cursar con hepatoesplenomegalia, trombocitopenia o coriorretinitis. Existe la posibilidad de secuelas neurológicas en el 53–15%, en especial pérdida de audición y retraso mental discreto
El diagnóstico posnatal se fundamenta en el análisis del ADN mediante PCR que permite un diagnóstico más rápido en orina, líquido cefalorraquídeo o sangre y tiene gran utilidad para los estudios epidemiológicos y para el análisis del líquido amniótico.
co con menos de 1.000 copias de genoma de CMV/ml se acompaña de cultivos negativos y neonatos asintomáticos. La presencia de 1.000 o más copias/ml predice la infección fetal con un 100% de probabilidad, y si la cifra asciende a 100.000 o más copias/ml, la infección neonatal será sintomática. La determinación de CMV por PCR en muestras de sangre seca obtenidas para el cribado de enfermedades endocrinometabólicas es sensible y específica para el diagnóstico de infección congénita373–39. Más recientemente se han utilizado muestras líquidas o secas de saliva obtenida a los 3 días de vida40, con mayor grado de sensibilidadLectura rápida
El tratamiento se considera indicado en la infección congénita sintomática (afectación neurológica, trombopenia o alta carga viral). No se considera indicado en caso de CMV asintomática, a pesar de una alta carga viral, y en cuadros clínicos irreversibles. Se fundamenta en la administración de ganciclovir por vía intravenosa y se puede seguir con valganciclovir por vía oral
Profilaxis de la infección por lactancia materna El poder contagiante de la leche materna dependerá de la carga viral que contenga y puede ser anulada mediante pasteurización o reducida por congelación a −20 °C durante 72h
Se considera indicado en la infección por CMV congénita sintomática, en especial si hay afectación del SNC, trombopenia o alta carga viral. También en la infección por CMV adquirida sintomática en inmunode-primidos. No se considera recomendable en caso de CMV asintomática, a pesar de una alta carga viral, y en cuadros clínicos ya irreversibles con sordera bilateral profunda, insuficiencia renal (creatinemia > 1,5mg/dl) o neuroimagen muy alterada.
Se fundamenta en la administración de antivirales
GanciclovirEs el quimioterápico anti-CMV más utilizado. Es virostático, ya que el CMV disminuye o desaparece durante su administración, pero reaparece cuando se suspende la medicación. La duración mínima del tratamiento EV será de 6 semanas (2 semanas en la infección por CMV adquirida), a la dosis de 6mg/kg 2 veces al día. Posteriormente, se puede seguir con valganciclovir, una forma oral de ganciclovir que facilita su administración, a 16mg/kg/dosis, cada 12h, hasta 6 meses (un mes en infección por CMV adquirida) e incluso durante más tiempo41. La neutropenia es la complicación más frecuente, aunque también puede producir anemia, trombopenia, toxicidad renal y hepática, fiebre y exantemas42-46. En animales se ha referido infertilidad y riesgo de mutagenicidad. Por ello, los padres deben ser convenientemente informados y dar su consentimiento
FoscarnetActúa inhibiendo la ADN-polimerasa del virus. Está especialmente indicado en la resistencia al ganciclovir y en niños con sida y afectación neurológica por su amplia difusión a nivel cerebral, por una cierta actividad antirretroviral y por su escaso efecto mie-lotóxico, si bien su nefrotoxicidad limita la administración
Otros recursos terapéuticosEl tratamiento con inmunoglobulina hiperinmune a la dosis de 400mg/kg los días 0, 4, 8 y 200mg/kg los días 12 y 16 tendría indicación en los pacientes afectados de inmunodeficiencias, al igual que los anticuerpos monoclonales anti-CMV
PronósticoSi el RN sobrevive, aparecerán secuelas en el 503–70%. Los síntomas cutáneos y la ictericia desaparecen pronto, pero la hepatoesplenomegalia persiste durante algunas semanas. La afectación neurológica dará lugar en un 90% de los casos a secuelas moderadas o graves, en especial de tipo neurológico (microcefalia, displasias corticales, calcificaciones, retraso mental, parálisis cerebral y síndrome convulsivo), sensorial (defectos visuales, sordera neurosensorial) y defectos dentales. La hipoacusia neurosensorial (70%) suele ser progresiva y fluctuante, agravando el retraso psicomotor. La probabilidad de que aparezca hipoacusia dependerá de la carga viral, siendo poco probable si en plasma se detecta < 1×104copias/ml o si en orina < 5×103copias/ml, mientras que si en plasma se obtiene > 2,5×104copias/ml, la probabilidad de hipoacusia será del 40%47,48
Son factores de mal pronóstico la primoinfección precoz durante el embarazo con alta carga viral, presencia de sintomatología al nacimiento, aparición de microcefalia o calcificaciones intracraneales y la elevación de IgM o de IgM específica en el periodo neonatal. Las infecciones asintomáticas pueden desarrollar sordera progresiva y trastornos cognitivos1. Cuando el contagio es intranatal, la aparición de secuelas parece depender del peso al nacimiento y en los niños que pesan menos de 2.000g el porcentaje de secuelas es mayor. Los RN a término con CMV perinatal no suelen presentar secuelas. Los trastornos encefalopáticos menores afectan al 70% de los lactantes o niños sintomáticos (23–7% de los asintomáticos), a lo que se debe añadir un 20% de inadaptación escolar (4% en asintomáticos), un 50% de hipoacusia (10% de asintomáticos) y un 14% de ambliopía (1% en asintomáticos). Si al año de vida no se constatan secuelas, es poco probable que aparezcan.
ProfilaxisPrevención de la enfermedad adquirida por transfusiónEs por ahora un problema de difícil solución: entre un 503–90% de los donantes son seropositivos y no existe método para determinar los que pueden transmitir el virus. Se ha aconsejado el uso de sangre congelada desglicerolizada o conservada durante 48h en lugar de fresca, ya que difícilmente transmite el CMV, o bien la utilización de filtros de leucocitos en todas las transfusiones de sangre o plaquetas (medida obligada), o la utilización exclusiva de sangre que no contenga anticuerpos anti-CMV, indicada para la transfusión de sangre a los prematuros o para exanguinotransfusión
Prevención de la enfermedad adquirida por lactancia maternaLa reactivación del CMV en la glándula mamaria es frecuente en las gestantes seropositivas y no comporta riesgo en el RN a término, ya que este ha recibido anticuerpos anti-CMV procedentes de la madre por vía transplacentaria en el último trimestre de la gestación. Esto ocurre en menor grado en el prematuro, el cual por ello tendría un cierto grado de inmu-nosupresión. El poder contagiante de la lactancia materna dependerá de la carga viral que contenga y esta puede ser anulada mediante una correcta pasteurización de la leche de banco o de donante o bien reducida si se somete a congelación a −20 °C durante 72h49,50
VacunaciónLas primeras investigaciones han estado encaminadas a obtener una vacuna de virus vivo atenuado (cepas Ad 169 y Towne 125). El efecto inmunizante es fugaz y plantea el peligro de una posible reactivación al poder actuar el virus de la vacuna como virus latente, que en ciertas circunstancias (embarazo, tratamiento con inmunosupresores) se reactivaría y provocaría una CMV congénita o adquirida. Los ensayos más recientes se realizan con vacunas recombinantes y de subunidades
Gammaglobulina hiperinmune y otras medidasPreviene la infección por CMV en la población de riesgo seronegativa, en especial, los receptores de un trasplante. En el trasplante de médula ósea se ha utilizado profilácticamente aciclovir a altas dosis (1.500mg/m2/día) y el foscarnet