Puntos clave
- •
El estudio del líquido cefalorraquídeo (LCR) sigue siendo de gran utilidad en el diagnóstico de enfermedades infecciosas, neurológicas y oncológicas. Su extracción también sirve como medida terapéutica (administración de medicamentos, disminución de la presión intracraneal, etc.).
- •
Varios de los componentes del líquido cefalorraquídeo son similares a los de la sangre, por lo que es recomendable comparar los valores obtenidos con los de una muestra de sangre obtenida de forma simultánea.
- •
Los valores normales de proteínas, glucosa y células van a depender de la edad del paciente.
- •
Existen distintas pruebas de laboratorio para la identificación de agentes microbiológicos, unas de detección rápida (tinción de Gram) útiles para un diagnóstico inicial y otras más tardías (cultivo, estudios con reacción en cadena de la polimerasa) para un diagnóstico definitivo.
- •
Combinando los hallazgos del LCR, hemograma y situación clínica se pueden diferenciar las meningitis víricas de las bacterianas y decidir si se precisa tratamiento antibiótico o no. Para ello se sigue utilizando el score de Boyer.
El líquido cefalorraquídeo (LCR) es una solución compleja que se forma principalmente en los plexos coroideos y ventrículos laterales. Las 3 cuartas partes se localizan en el espacio subaracnoideo y el resto en los ventrículos1. En el adulto, el volumen total es variable, oscilando entre 90 y 150ml2. En el recién nacido, oscila entre 10 y 60ml, pudiéndose duplicar en niños mayores1,2.
La obtención del LCR se realiza mediante una sencilla técnica que se denomina punción lumbar. Se realiza introduciendo un catéter en el espacio subaracnoideo espinal en la zona lumbar, a nivel de L3–4 o L4–51,3. La punción lumbar, aunque no está exenta de riesgos, realizada por manos expertas presenta una incidencia de complicaciones mínima3. El LCR puede ser extraído con fines diagnósticos y terapéuticos (administrar medicamentos, reducir presión intracraneal), administrar contrastes radioopacos o medir presión intracraneal4,5.
La cantidad de líquido que se extrae va a depender de la edad del paciente y, sobre todo, del tipo de estudio que se vaya a realizar1 (tabla 1).
Recogida de líquido cefalorraquídeo para las pruebas más frecuentes.
| Bioquímica general (volumen 0,5–1ml) |
| Glucosa, proteínas, albúmina |
| Inmunoquímica (volumen > 2ml) |
| Cuantificación de inmunoglobulinas totales |
| Perfil electroforético de proteínas |
| Bandas oligoclonales |
| Inmunofijación |
| Microbiología (volumen > 2ml) |
| Tinción rápida: Gram, tinta china, bacilos acidorresistentes |
| Aglutinación látex: análisis de bacterias corrientes |
| Cultivos: bacterias (anaeróbico, aeróbico), virus, micobacterias, hongos |
| Reacción en cadena de la polimerasa: algunos organismos virales (virus herpes simple), tuberculosis |
| VDRL: sífilis |
| Hematología (volumen 0,5–1ml) |
| Recuentos celulares |
| Evaluación leucemia, linfoma |
| Citopatología (volumen 2–4ml) |
| Evaluación de células malignas |
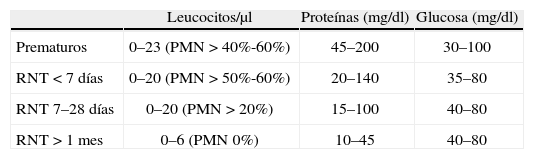
El LCR es incoloro e inodoro, transparente, similar al agua destilada1. Muchos de los constituyentes del LCR son similares a los de la sangre, por lo que es recomendable comparar los valores del LCR con los de una muestra de sangre obtenida de forma simultánea. Los valores normales del LCR6 se reflejan en la tabla 2.
Valores normales en el líquido cefalorraquídeo según la edad.
| Leucocitos/μl | Proteínas (mg/dl) | Glucosa (mg/dl) | |
| Prematuros | 0–23 (PMN > 40%-60%) | 45–200 | 30–100 |
| RNT < 7 días | 0–20 (PMN > 50%-60%) | 20–140 | 35–80 |
| RNT 7–28 días | 0–20 (PMN > 20%) | 15–100 | 40–80 |
| RNT > 1 mes | 0–6 (PMN 0%) | 10–45 | 40–80 |
Valores normales de glucosa: 2 tercios de la glucemia obtenida en el mismo momento.
PMN: polimorfonucleares; RNT: recién nacido a término.
La presión normal del LCR en los niños oscila entre 5 y 18mmHg siendo algo inferior en neonatos7–9. Consideramos que la presión está elevada cuando de forma mantenida se encuentra por encima 18mmHg.
En condiciones normales, la concentración de proteínas en plasma es 200 veces superior a la del LCR7. El 80% deriva de la sangre y la albúmina es la que se encuentra en mayor concentración. Otras proteínas que se pueden encontrar en el LCR son prealbúmina, alfa-2-macroglobulina, fibrinógeno, transferrina y ceruloplasmina7.
La concentración de glucosa en el LCR es un reflejo de la concentración en suero, siendo aproximadamente un 50–75% de la concentración en suero1,6,7. Un descenso en los niveles de glucosa puede aparecer en meningitis bacterianas, hemorragia subaracnoidea y procesos neoplásicos.
Los valores normales en el recuento celular del LCR van a depender de la edad del paciente y han sido reflejadas en la tabla 2.
Estudio del líquido cefalorraquídeo e interpretaciónAparienciaEl aspecto del LCR tras realizar una punción lumbar nos puede dar una idea inicial diagnóstica. Un aspecto turbio, poco transparente, nos indica la presencia de células y/o bacterias, lo que nos hace pensar en un proceso infeccioso bacteriano.
Un LCR hemorrágico puede ser debido a punción traumática o a una hemorragia subaracnoidea. Para distinguir ambas situaciones, nos valemos de cómo se modifica el aspecto del LCR a medida que se realiza la punción lumbar. Un líquido hemorrágico que se va aclarando a medida que fluye nos hace pensar en una punción traumática. Si el líquido no se aclara, habrá que pensar en una hemorragia subaracnoidea.
Un LCR xantocrómico (color amarillo-anaranjado) lo encontramos en un paciente con una hemorragia subaracnoidea evolucionada1.
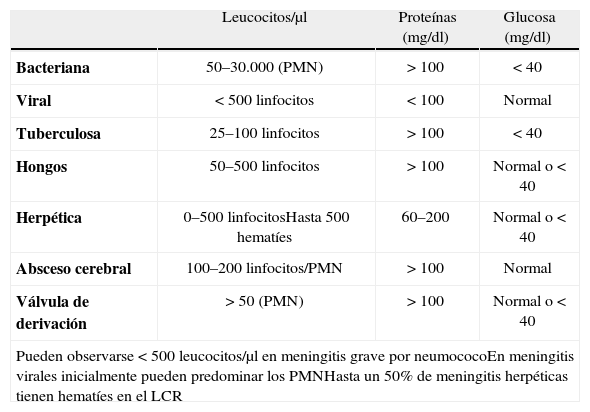
Estudio bioquímicoEl estudio bioquímico del LCR, principalmente de la glucosa y proteínas, también es de gran utilidad en el diagnóstico de distintas enfermedades. En la tabla 3 se reflejan las alteraciones en los valores de glucosa y proteínas en el LCR que aparecen en los procesos infecciosos más frecuentes6.
Interpretación de los hallazgos del líquido cefalorraquídeo.
| Leucocitos/μl | Proteínas (mg/dl) | Glucosa (mg/dl) | |
| Bacteriana | 50–30.000 (PMN) | > 100 | < 40 |
| Viral | < 500 linfocitos | < 100 | Normal |
| Tuberculosa | 25–100 linfocitos | > 100 | < 40 |
| Hongos | 50–500 linfocitos | > 100 | Normal o < 40 |
| Herpética | 0–500 linfocitosHasta 500 hematíes | 60–200 | Normal o < 40 |
| Absceso cerebral | 100–200 linfocitos/PMN | > 100 | Normal |
| Válvula de derivación | > 50 (PMN) | > 100 | Normal o < 40 |
| Pueden observarse < 500 leucocitos/μl en meningitis grave por neumococoEn meningitis virales inicialmente pueden predominar los PMNHasta un 50% de meningitis herpéticas tienen hematíes en el LCR | |||
LCR: líquido cefalorraquídeo; PMN: polimorfonucleares.
Un aumento de la albúmina en LCR (Q albúmina LCR/albúmina suero > 8×10−3) es indicativo de disfunción en la barrera hematoencefálica y, por lo tanto, compatible con enfermedades como meningitis bacteriana o síndrome de Guillain-Barré8.
La presencia de hiperproteinorraquia > 550mg/dl sin pleiocitosis (< 10 mononucleares /mm3) es muy indicativa, aunque no diagnóstica, de síndrome de Guillain-Barré10.
La electroforesis de proteínas permite la evaluación de las proteínas que se encuentran en concentraciones elevadas7. La presencia de bandas oligoclonales es típica de la esclerosis múltiple; un pico monoclonal se relaciona con gammapatía monoclonal.
La elevación del lactato en LCR se origina en meningitis bacterianas y es independiente del valor en sangre.
Actualmente, están en estudio otros marcadores para el diagnóstico de enfermedades, como son la proteína-beta-traza o la cistatina C, que estarían elevadas en las meningitis bacterianas11, o la elevación de adenosina deaminasa (ADA) en las meningitis por varicela zóster12.
Estudio citológicoAl igual que el estudio bioquímico, el estudio citológico es otro pilar en el diagnóstico. Se valoran leucocitos, hematíes y otras células, como pueden ser tumorales en el caso de leucemias y linfomas con extensión al sistema nervioso central. En la tabla 3 aparecen las alteraciones citológicas más frecuentes.
Un problema que puede surgir en la interpretación del LCR se produce cuando una punción lumbar es traumática. En estos casos la valoración directa de la citología no es correcta y hay que hacer corrección del número de leucocitos obtenidos en el LCR6,13. Esta corrección se hace de 2 maneras, dependiendo del resultado del hemograma:
- –
Si el recuento de hematíes y leucocitos en sangre es normal, se descuenta un leucocito en LCR por cada 700 hematíes en LCR.
- –
Si el recuento es anormal: leuc reales en LCR = leuc LCR
- –
(hematíes LCR/hematíes sangre).
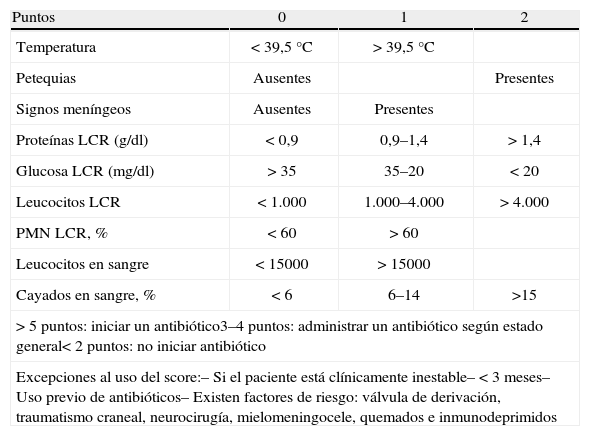
Combinando los hallazgos del LCR, el hemograma y la situación clínica, se pueden diferenciar las meningitis víricas de las bacterianas y decidir si se precisa tratamiento antibiótico o no. Para ello, se sigue utilizando el score de Boyer6 (tabla 4) que, según la puntuación que dé, se indicará una observación clínica con o sin antibióticos.
Score de Boyer.
| Puntos | 0 | 1 | 2 |
| Temperatura | < 39,5°C | > 39,5°C | |
| Petequias | Ausentes | Presentes | |
| Signos meníngeos | Ausentes | Presentes | |
| Proteínas LCR (g/dl) | < 0,9 | 0,9–1,4 | > 1,4 |
| Glucosa LCR (mg/dl) | > 35 | 35–20 | < 20 |
| Leucocitos LCR | < 1.000 | 1.000–4.000 | > 4.000 |
| PMN LCR, % | < 60 | > 60 | |
| Leucocitos en sangre | < 15000 | > 15000 | |
| Cayados en sangre, % | < 6 | 6–14 | >15 |
| > 5 puntos: iniciar un antibiótico3–4 puntos: administrar un antibiótico según estado general< 2 puntos: no iniciar antibiótico | |||
| Excepciones al uso del score:– Si el paciente está clínicamente inestable– < 3 meses– Uso previo de antibióticos– Existen factores de riesgo: válvula de derivación, traumatismo craneal, neurocirugía, mielomeningocele, quemados e inmunodeprimidos | |||
LCR: líquido cefalorraquídeo; PMN: polimorfonucleares.
Por último, el estudio de la celularidad en el LCR nos puede ayudar al diagnóstico de enfermedades neoplásicas, como tumores del sistema nervioso central o extensión meníngea de leucemias y linfomas.
Estudio microbiológicoExisten distintas pruebas de laboratorio para la identificación de agentes microbiológicos, unas de detección rápida14 útiles para un diagnóstico inicial y otras más tardías para un diagnóstico definitivo. Sin lugar a dudas, de todas las pruebas que se pueden realizar en el LCR, las microbiológicas son las que tienen mayor importancia.
- –
Tinción de Gram: es una técnica de identificación rápida que bien realizada es positiva en el 75–90 % de los casos. Según la morfología y el resultado de la tinción, se puede identificar al agente etiológico15. Podemos encontrar cocos gramnegativos (meningococo), cocos grampositivos (neumococo y estafilococo), bacilos gramnegativos (Haemophilus influenzae), bacilos grampositivos (Listeria), etc.
- –
Otras tinciones: tinta china para la infección por criptococo, tinción de Ziehl-Neelsen para micobacterias.
- –
Cultivo: la muestra de LCR se debe cultivar durante al menos 72h a 35°C para obtener un resultado adecuado. La positividad del cultivo nos da el diagnóstico etiológico definitivo.
- –
Determinación de antígenos bacterianos: técnicas rápidas de coaglutinación o aglutinación de látex. Estas técnicas permiten la detección de antígenos bacterianos solubles en el LCR. No son diagnósticas y tienen un alto coste por lo que es dudosa la relación coste-beneficio.
- –
Estudios con reacción en cadena de la polimerasa (PCR): útiles para infecciones víricas16 (enterovirus, virus grupo herpes, arbovirus, etc.), tuberculosis1, etc. Máxima rentabilidad en las infecciones por virus herpes simple. La PCR cuantitativa en LCR sirve en las infecciones por virus herpes simple como marcador pronóstico. La presencia de más de 100cps/mm3 se asocia a mayor gravedad2.
- –
Serologías: estudio de anticuerpos en el LCR como en la infección por Borrelia y VDRL para el diagnóstico de sífilis (pero puede ser negativa hasta en el 50 % de los casos1).
A pesar de la creciente disponibilidad de pruebas diagnósticas de imagen, el estudio de los distintos componentes del LCR sigue siendo de gran utilidad en el diagnóstico de enfermedades neurológicas. Su utilidad es máxima en procesos infecciosos, pero no por ello deja de ser fundamental en otras afecciones del sistema nervioso central, procesos oncológicos y como medida terapéutica.
El autor declara no tener ningún conflicto de intereses.