Puntos clave
- •
Proporciona una mejor adaptación entre la demanda de flujo inspiratorio del paciente y el flujo de gas entregado por el dispositivo.
- •
Efecto de presión positiva en la vía aérea generado por el alto flujo que suministra un cierto nivel de presión de distensión pulmonar y reclutamiento alveolar. Este efecto ha sido documentado en voluntarios sanos y en pacientes que se recuperan de cirugía cardíaca.
- •
Realiza un lavado del espacio muerto nasofaríngeo, contribuyendo así a mejorar el intercambio de los gases alveolares.
- •
Mayor comodidad para el paciente lo que puede contribuir a los resultados beneficiosos obtenidos con oxigenoterapia de alto flujo (OAF).
- •
La constatación de una taquipnea mantenida sin mejoría en la oxigenación y en la sincronía toracoabdominal son signos evidentes de que la OAF no está funcionando.
Lectura rápida
El oxígeno constituye el tratamiento de primera línea en los pacientes con insuficiencia respiratoria aguda, habitualmente realizado a través de gafas nasales o una mascarilla (con o sin reservorio) con flujos inferiores a 15l/m. Los nuevos dispositivos disponibles en la actualidad ofrecen hasta 60l/m de flujo de oxigeno humidificado y calentado a través de una cánula nasal.
El concepto de oxigenoterapia de alto flujo consiste en aportar un flujo de oxígeno solo o mezclado con aire por encima del flujo pico inspiratorio del paciente, a través de una cánula nasal. El gas se humidifica y se calienta.
La OAF produce un lavado del espacio muerto nasofaríngeo, disminuye la resistencia inspiratoria, mejora la compliancia y elasticidad pulmonar, reduce el trabajo metabólico y aporta cierto grado de presión de distensión para el reclutamiento alveolar. La oxigenoterapia de alto flujo (OAF) mejora el patrón ventilatorio disminuyendo la frecuencia respiratoria (FR), la frecuencia cardiaca y las necesidades de O2, pero generalmente no influye en la paCO2 ni en el pH. Existen varios sistemas de administración de OAF. Requieren una fuente de gas (aire y O2), un humidificador calentador, un circuito y unas cánulas nasales cortas. Algunos disponen de una válvula de presión. Se pueden administrar en todos los grupos de edad.
Es útil en pacientes con hipoxemia sin hipercapnia que precisan FiO2 > 0,4 en mascarilla facial (fracaso respiratorio tipo 1).
Se recomienda empezar con flujos bajos e ir incrementando lentamente hasta conseguir el efecto deseado. Una vez la FR se normaliza y la oxigenación mejora se puede iniciar el destete.
La OAF se puede utilizar eficazmente para tratar a pacientes con niveles moderados de insuficiencia respiratoria hipoxémica.
La constatación de taquipnea mantenida sin mejoría en la oxigenación y en la sincronía torácicoabdominal son signos evidentes de que la OAF no está funcionando.
El oxígeno constituye el tratamiento de primera línea en pacientes con insuficiencia respiratoria aguda1. Habitualmente, se realiza a través de gafas nasales o de una mascarilla (con o sin reservorio). El flujo de oxígeno a través de estos dispositivos es limitado y no suele ser mayor de 15l/min. Habitualmente, este oxígeno no está calentado y la humedad alcanzada no es la adecuada. Con estos flujos de oxígeno se produce cierto nivel de dilución del mismo (el oxígeno suministrado se diluye con el aire ambiente), debido a la diferencia entre el flujo de oxígeno suministrado por el dispositivo y el flujo inspiratorio del paciente2. Por esta razón, cuanto mayor sea el flujo inspiratorio, mayor será la dilución del gas. Este fenómeno no afecta demasiado a los pacientes con hipoxemia leve, pero la situación puede ser diferente en pacientes con insuficiencia respiratoria moderada-grave, teniendo en cuenta que las tasas de flujo inspiratorio pueden variar entre 30 y hasta más de 120l/min3. Los nuevos dispositivos ahora actualmente disponibles ofrecen hasta 60l/min de flujo de oxígeno humidificado y calentado a través de una cánula nasal.
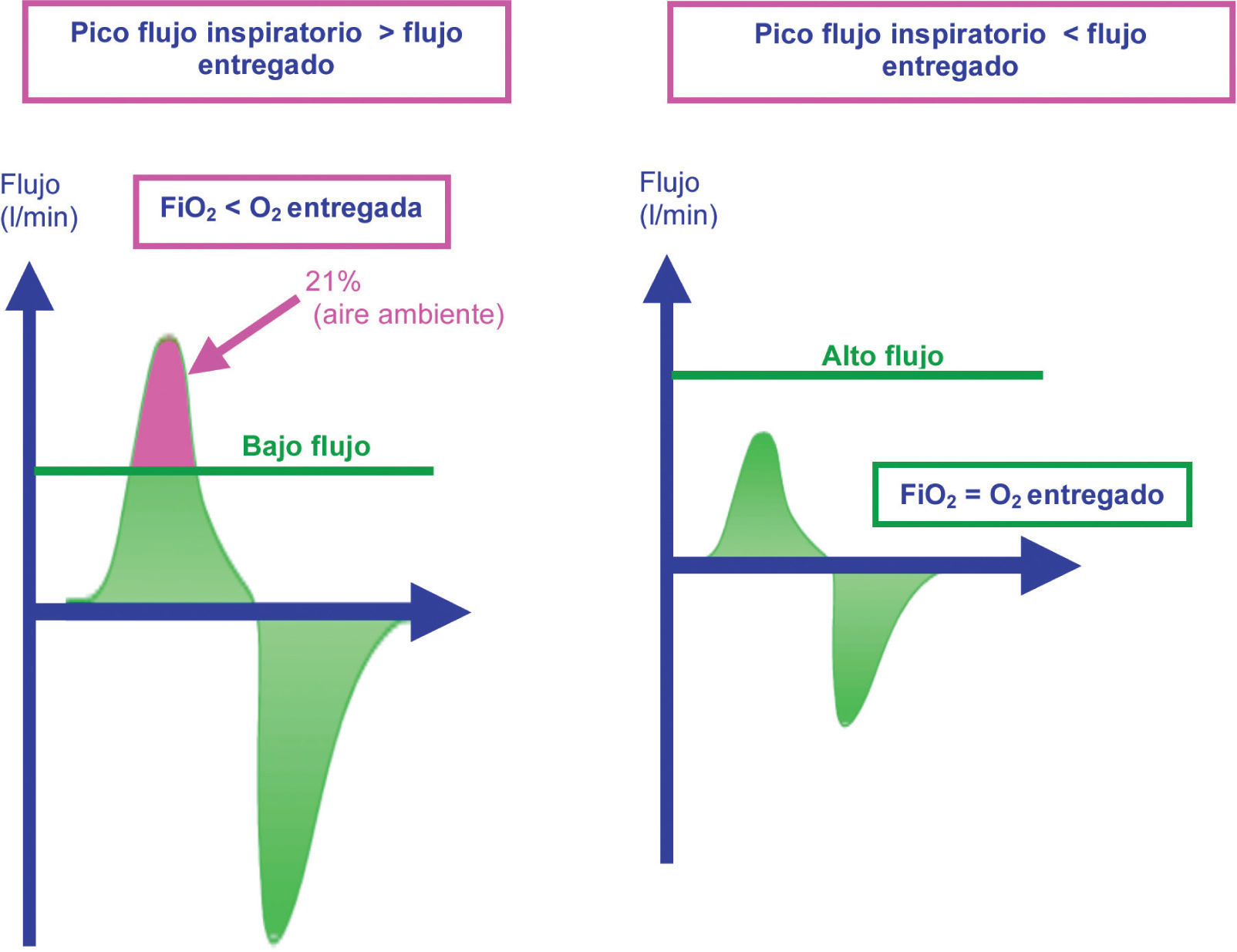
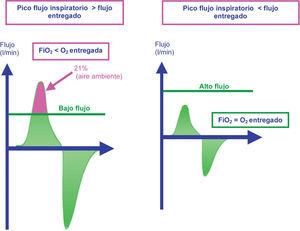
Concepto de oxigenoterapia de alto flujoLa oxigenoterapia de alto flujo (OAF) consiste en aportar un flujo de oxígeno, solo o mezclado con aire, por encima del flujo pico inspiratorio del paciente, a través de una cánula nasal. El gas se humidifica (humedad relativa del 95-100%) y se calienta hasta un valor cercano a la temperatura corporal (34-40°C). En la figura 1 se expone el mecanismo por el que el alto flujo obtiene mejores concentraciones de O2, en comparación con sistemas de bajo flujo.
Mecanismo por el que el alto flujo obtiene mejores concentraciones de oxígeno en relación con los sistemas de bajo flujo. Figura de la izquierda con bajo flujo: el paciente obtiene aire ambiente para conseguir su pico flujo, la FiO2 obtenida es el resultado de la mezcla de aire con el oxígeno administrado. Figura de la derecha: el paciente recibe todo el aire del alto flujo, la FiO2 obtenida es igual a la entregada por el sistema de oxigenoterapia de alto flujo.
Aunque no se ha definido que es alto flujo, en neonatos se considera un flujo > 1-2lpm, en niños > 4lpm y en adultos > 6lpm.
Mecanismo de acción (tabla 1)- –
Lavado del espacio muerto nasofaríngeo4. En este aspecto, la OAF puede mejorar la eficiencia respiratoria al inundar el espacio anatómico nasofaríngeo con gas limpio y contribuir a disminuir el trabajo respiratorio. Como en el caso de cualquier reducción del espacio muerto anatómico o fisiológico, este tratamiento contribuye a establecer mejores fracciones de gases alveolares, facilitando la oxigenación y pudiendo mejorar teóricamente la eliminación de CO2.
- –
Debido a que la OAF proporciona suficiente flujo como para igualar o exceder el flujo inspiratorio del paciente, lo más probable es que disminuya la resistencia inspiratoria relacionada con el paso de aire por la nasofaringe. Esto se traduce en un cambio en el trabajo de la respiración.
- –
El calentamiento adecuado y la humidificación de las vías aéreas están asociados con una mejor compliancia y elasticidad pulmonar en comparación con el gas seco y frío. Asimismo, los receptores de la mucosa nasal responden al gas frío y seco provocando una respuesta broncoconstrictora de protección en sujetos normales y asmáticos. El aire calentado y humidificado genera un efecto beneficioso, independiente de la concentración de oxígeno, sobre el movimiento ciliar y el aclaramiento de secreciones.
- –
Reduce el trabajo metabólico necesario para calentar y humidificar el aire externo, más frío y seco que la temperatura y humedad corporal.
- –
Aporta cierto grado de presión de distensión para el reclutamiento alveolar.
Resumen de los mecanismos que determinan los efectos terapéuticos de la oxigenoterapia de alto flujo.
| Aumento de FIO2 |
| El flujo de gas elevado por encima del flujo pico del paciente evita el arrastre secundario de aire ambiente |
| Proporciona depósitos anatómicos de oxígeno utilizando nasofaringe y orofaringe Lavado del espacio muerto de la vía aérea |
| Efecto CPAP |
| Disminuye las atelectasias y mejora la relación ventilación-perfusión pulmonar |
| En los adultos mejora la disminución de la compliancia y en los recién nacidos con déficit de surfactante trata las atelectasias |
| Estimula el centro respiratorio en niños prematuros reduciendo la apnea de la prematuridad |
| Disminuye el trabajo respiratorio: contrarrestando la PEEP intrínseca |
| Mayor comodidad |
| El oxígeno nasal calentado y humidificado se tolera mejor, especialmente cuando los flujos son > 6l/min |
PEEP: presión positiva telespiratoria. CPAP: presión positiva continua en la vía aérea.
A pesar de las diferentes teorías que existen en la literatura sobre los mecanismos de acción de la OAF, parece haber acuerdo en que origina cierta presión positiva en la vía aérea5. Esta presión es variable (desde escasa a excesiva), relativamente impredecible, no regulable, relacionada con el tamaño de las gafas, del paciente (fugas, boca abierta) y de la efectividad de la humedad y del calor. Se considera suficiente como para producir efectos clínicos y/o cambios en la función pulmonar.
Una de las diferencias fundamentales entre la OAF y la ventilación no invasiva (VNI) es que los primeros mantienen un flujo fijo y generan presiones variables, mientras que los sistemas de VNI utilizan flujos variables para obtener una presión fija.
Groves y Tobin6, en adultos, utilizan OAF entre 10 y 60l/min y miden las presiones alcanzadas con la boca cerrada y abierta. Con la boca cerrada, las presiones a nivel faríngeo aumentaron linealmente de 3,7 a 7,2 y 8,7cm de H2O con flujos de 20, 40 y 60l/min, respectivamente. Con la boca abierta, la presión alcanzada se redujo a 1,4, 2,2, y 2,7cm de H2O con el mismo flujo.
La OAF mejora el patrón ventilatorio, disminuyendo la frecuencia respiratoria, la frecuencia cardíaca y las necesidades de oxígeno, pero generalmente no influye ni en la paCO2 ni en el pH7.
Los dispositivos son fácilmente aplicables, permiten comer, hablar y movilizar a los niños. La tendencia a usar OAF se debe en parte a una percepción de mayor facilidad para su empleo además de una mejor tolerancia por parte del paciente consiguiendo así mayores beneficios5,8.
Métodos de administraciónExisten varios sistemas de administración de OAF. No hay estudios que demuestren la superioridad de un sistema sobre otro9. Se pueden utilizar en todos los grupos de edad (neonatos, lactantes, niños mayores y adultos)10,11. Requieren de una fuente de gas (aire y oxígeno), un humidificador calentador, un circuito que impide la condensación de agua y unas gafas-cánulas nasales cortas. Algunos disponen de una válvula de liberación de presión.
Las cánulas nasales son de diferente tamaño según los flujos empleados, deberían tener un diámetro externo menor al interno de la nariz para no ocluir completamente esta y prevenir excesos de presión y úlceras por decúbito.
Habitualmente, se utilizan flujos de oxígeno mezclados con aire, aunque también se ha empleado para administrar gases medicinales (p. ej., heliox 70/30, óxido nítrico [NO])12 y fármacos en aerosol. En la actualidad, y a la espera de estudios que confirmen su utilidad, no se recomienda la administración de estos fármacos por estos sistemas10.
IndicacionesEs útil en pacientes con hipoxemia pero sin hipercapnia que precisan FiO2 > 0,4 en mascarilla facial (fracaso respiratorio tipo I). No se considera útil en el fracaso respiratorio tipo II, ya que no reduce los niveles de PaCO2 y no está indicado en retenedores de CO2 porque reduce el estímulo respiratorio desencadenado por la hipoxia que se produce en la hipoventilación.
En pediatría, no hay indicaciones establecidas pero son similares a las de adultos13,14 (tabla 2). La mayoría de los estudios publicados en niños demostrando su seguridad y eficacia son estudios en lactantes con bronquiolitis15-17. Schibler et al7 encontraron, con el empleo de la OAF, que la necesidad general de intubación se redujo del 37 al 7% en los niños con bronquiolitis viral durante un período de 5 años. Esta tendencia no se encontró en niños con otras afecciones11. No se ha demostrado su eficacia en el asma y en la neumonía. Los efectos clínicos beneficiosos de la OAF (aumento de SatO2, disminución de las necesidades de O2, de frecuencia respiratoria [FR], frecuencia cardiaca [FC] y mejoría de signos de dificultad respiratoria), deberían ser observados en las primeros 60-90min desde su inicio, si no es así, debe considerarse otro soporte ventilatorio más agresivo. Schibler et al7 demostraron que los lactantes con OAF que tenían una disminución de más del 20% en la FR y FC sobre la inicial no requerían una escalada en el apoyo respiratorio. Si no se observa una mejoría después de 90min de apoyo con OAF, es imprescindible evaluar la necesidad de una intensificación de la asistencia respiratoria.
Indicaciones de oxigenoterapia.
| Indicaciones de oxigenoterapia (adultos y niños) |
| Emergencias médicas que requieren siempre altas concentraciones de oxígeno |
| Shock, sepsis, politrauma. Parada cardiaca. |
| Anafilaxia. Intoxicación por CO y cianuro |
| Emergencias médicas necesitando bajas o altas concentraciones de oxigeno (Sat objetivo 94-98%) |
| Bronquiolitis, neumonía, asma, insuficiencia cardiaca, tromboembolismo pulmonar, pausas de apnea, laringitis, retirada de la ventilación mecánica o de ventilación no invasiva |
| Emergencias médicas con control de nivel de oxigenación (Sat objetivo 88-92%) |
| Exacerbaciones agudas de patologías respiratorias crónicas con retención de CO2 (EPOC, DBP, FQP, neuromusculares) |
| Recién nacido prematuro o a término |
| Profilaxis o tratamiento del SDR como alternativa a la ventilación mecánica; tras extubación, tratamiento de la apnea del prematuro |
CO: monóxido de carbono; CO2: anhídrido carbónico; DBP: displasia broncopulmonar; EPOC: enfermedad pulmonar obstructiva crónica; FQP: fibrosis quística del páncreas; Sat: saturación; SDR: síndrome de distrés respiratorio.
Nuestra tendencia actual en el manejo del fallo respiratorio hipoxémico es usar la OAF entre la oxigenoterapia convencional y la VNI.
Otras aplicaciones de la OAF son su utilidad en la broncoscopia18 y en pacientes con orden de no intubar como alternativa a la VNI19.
No se considera el empleo de OAF en los pacientes con bradicardia extrema, inestabilidad hemodinámica grave, coma, fracturas de base de cráneo o fallo de la bomba respiratoria.
Modo de empleoInicioEn la actualidad, no hay pautas establecidas y/o guías clínicas en adultos ni en niños, para orientar el uso del tratamiento con OAF.
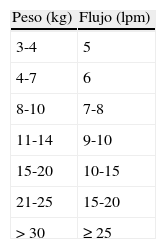
Algunos autores empiezan ajustando el flujo a 8 a 10 veces el volumen minuto del paciente aproximadamente de 8 a 12lpm en lactantes y 20 a 30lpm en niños5. Se recomienda empezar con flujo bajos (tabla 3):
- –
5-8lpm en lactantes y 10-20lpm niños.
- –
20lpm en adultos.
- –
Neonatos: flujo (lpm)=0,92 + (0,68 × peso,kg).
e ir incrementando lentamente hasta conseguir los efectos deseados. Algunos mejoran con flujos bajos y otros necesitan incrementar hasta 40-50lpm. Flujos máximos orientativos son 12lpm en menores de un año, 30lpm en niños y 60lpm en adultos.
DesteteUna vez que la frecuencia respiratoria se normaliza y la oxigenación mejora se puede iniciar el destete. Se empieza reduciendo la concentración de oxígeno hasta una FiO2 < 50% y después se reduce el flujo entre 5-10lpm cada 1-2h hasta el nivel de inicio. A partir de ahí, ponemos mascarilla de oxígeno o gafas nasales y valoramos las respuesta.
En ocasiones, existen pacientes que no mejoran su hipoxemia con OAF y no toleran presión positiva continua en la vía aérea (CPAP) continua; en estos casos, se puede emplear CPAP alternando con OAF.
Ventajas e inconvenientesLos inconvenientes son escasos, dada la buena tolerancia de este sistema (tabla 4). Se ha observado en algunos casos distensión abdominal por meteorismo. Puede ocurrir condensación en la cánula nasal a flujos bajos. Existe el riesgo potencial de síndrome de escape aéreo aunque no hay casos descritos en la literatura.
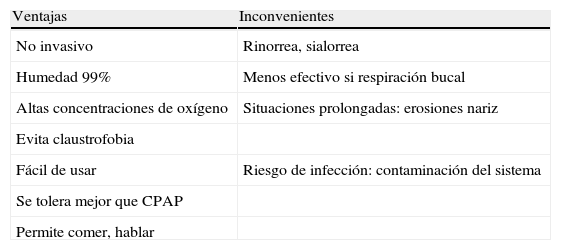
Ventajas e inconvenientes.
| Ventajas | Inconvenientes |
| No invasivo | Rinorrea, sialorrea |
| Humedad 99% | Menos efectivo si respiración bucal |
| Altas concentraciones de oxígeno | Situaciones prolongadas: erosiones nariz |
| Evita claustrofobia | |
| Fácil de usar | Riesgo de infección: contaminación del sistema |
| Se tolera mejor que CPAP | |
| Permite comer, hablar |
La OAF se puede utilizar eficazmente para tratar a los pacientes con niveles moderados de insuficiencia respiratoria hipoxémica. Podría ser considerada como un técnica inicial en ciertos entornos (p. ej., urgencias), ya que el flujo se puede ajustar en base a la respuesta entre un rango amplio sin tener que cambiar a otros dispositivos. También se podría considerar como una interfase de administración alternativa para situaciones en las que la hipoxemia o disnea no se corrigió después de un ensayo con cánula de bajo flujo y/o mascarilla con FIO2 de 0,4. Hay que estar pendientes además de la gasometría, de los resultados del examen físico y de la SpO2. La constatación de una taquipnea mantenida sin mejoría en la oxigenación y en la sincronía toracoabdominal (60-90min) son signos evidentes de que la OAF no esta funcionando17. En adultos, una FiO2 > 0,5 con 30lpm es una indicación de ingreso en intensivos20.
Se pueden lograr con OAF presiones de distensión de las vías respiratorias similares a la CPAP, pero son difíciles de medir y no predecibles5.
La OAF no es un modo de soporte respiratorio diseñado para dar CPAP. No está demostrada su superioridad sobre otros métodos de soporte respiratorio. Su uso continúa aumentando debido a su facilidad de uso, a la buena tolerancia y a sus teóricos beneficios clínicos. La OAF no debería usarse de rutina en neonatos prematuros hasta que haya una mayor evidencia sobre su seguridad y eficacia21.
Es de esperar que futuras investigaciones aclaren mejor su papel en el tratamiento de la insuficiencia respiratoria y que flujos son los más seguros y eficaces.
La aplicación de OAF puede ser percibida como un dispositivo que se asocia con una baja severidad de la enfermedad, pero en realidad algunos pacientes pueden estar recibiendo flujos de oxigeno de hasta 50lpm con una FiO2 de 1.
Los autores declaran no tener ningún conflicto de intereses.