El registro de la actividad eléctrica cerebral mediante electroencefalografía es una herramienta útil que ofrece información sobre el estado funcional y metabólico del cerebro, y la detección de actividad epiléptica. Sin embargo, el electroencefalograma (EEG) tiene una serie de limitaciones para su uso sistemático en las unidades de neonatología, como son la dificultad en el mantenimiento de una monitorización prolongada con una impedancia adecuada, el excesivo número de electrodos necesario y la dificultad para interpretar los registros por personal no experto en neurofisiología. La electroencefalografía integrada de amplitud (EEGa) es un método de monitorización continua de la función cerebral, diseñado para analizar cambios y tendencias en la actividad eléctrica cerebral, así como detectar actividad paroxística1. El uso de la EEGa en el paciente neonatal ha tenido relevancia clínica en la mejora del diagnóstico y el tratamiento de las crisis epilépticas, y en la ayuda para establecer el grado de gravedad de la encefalopatía en fase aguda, así como el establecimiento del pronóstico neurológico en una fase temprana.
Puntos clave
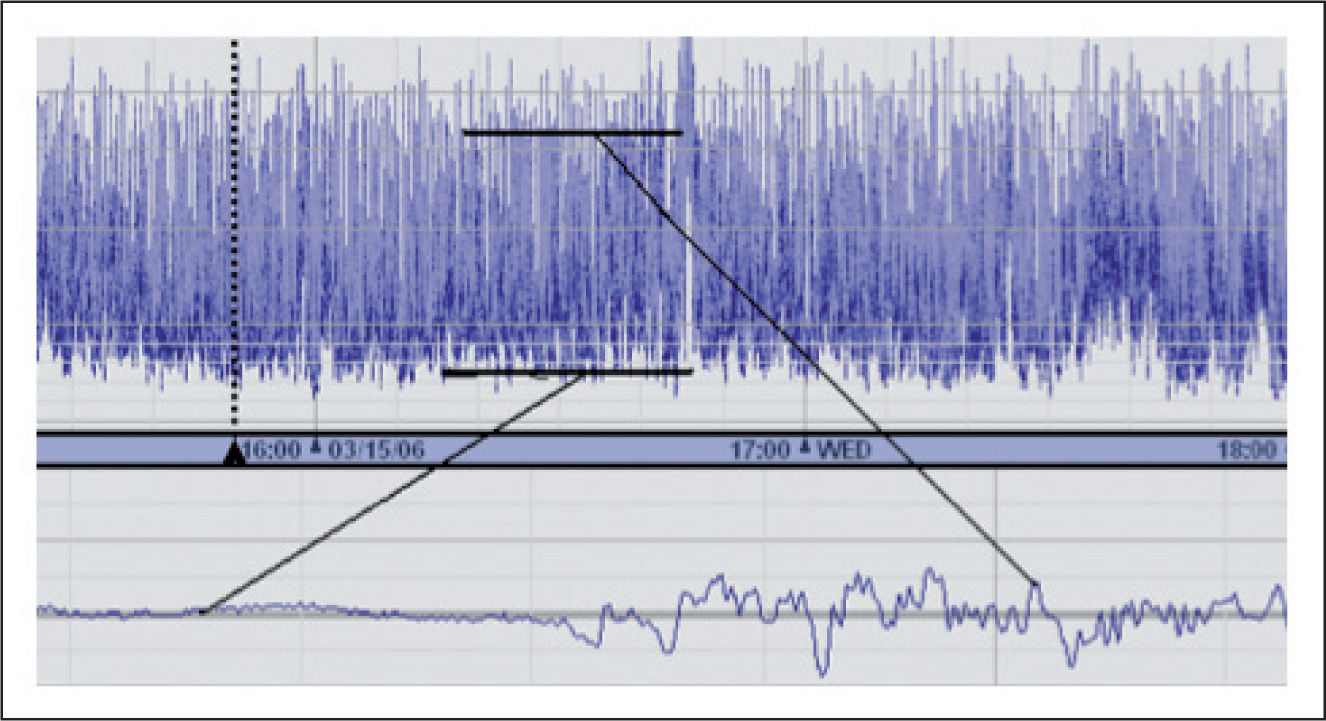
El método se basa en un análisis de la amplitud pico a pico de la señal eléctrica cerebral. El procesamiento de la señal incluye: a) el paso a través de un filtro que atenúa la actividad por debajo de 2Hz y por encima de 15Hz; b) la visualización de los valores de amplitud en escala semilogarítmica (linear de 0–10, logarítmica de 10–100μV), y c) la rectificación y la compresión en el tiempo (habitualmente 6cm/h). El trazado obtenido se visualiza como una banda que refleja la actividad eléctrica cerebral global, y muestra las variaciones en la amplitud máxima y mínima del registro (fig. 1). Mientras la atenuación de frecuencias minimiza artefactos producidos por interferencias procedentes de equipos electrónicos, o de la propia actividad biológica del paciente, la visualización semilogarítmica acentúa la identificación de cambios en el rango de voltaje bajo y evita la sobrecarga con amplitudes elevadas2. En la actualidad, los equipos para realizar la monitorización de la función eléctrica cerebral disponibles utilizan tecnología digital y, además de mostrar las tendencias de EEGa, incorporan la visualización de la señal electroencefalográfica sin procesar. Esto último facilita el reconocimiento de artefactos y la detección de crisis, y hace que estos monitores sean de fácil aplicabilidad e interpretación, ya que ofrecen información directa en tiempo real sobre la función cerebral. Además, hay una buena correlación entre la EEGa y el EEG convencional3.
LIMITACIONES DE LA TÉCNICAEs importante tener presente una serie de características de la técnica de EEGa a la hora de interpretar los trazados. La señal eléctrica deriva de un número de canales reducido, por lo que se pierde información detallada de la actividad eléctrica cortical. Además, el registro puede estar artefactado por la propia actividad biológica del paciente o equipos electrónicos, y mostrar una elevación transitoria en los márgenes superior e inferior del trazado, que puede confundirse con actividad epiléptica. Por otra parte, la administración de medicación sedante y antiepiléptica puede disminuir de forma transitoria el voltaje del registro, de ahí que deba quedar registrada su administración durante la monitorización para facilitar su interpretación. Esta depresión de la actividad eléctrica cerebral se ve más acentuada en el paciente prematuro y en los pacientes con pérdida de la integridad funcional cerebral, de ahí que, a la hora de interpretar los trazados, es necesario conocer la administración previa o no de estas medicaciones. Por tanto, es recomendable obtener un EEG convencional en todo paciente monitorizado con EEGa en el que se detecten anomalías en el registro.
TIPOS DE ELECTRODOS Y MÉTODO DE COLOCACIÓNLos electrodos más utilizados son los de aguja y los de hidrogel. Para monitorizaciones prolongadas con el objeto de minimizar interferencias, disminuir la impedancia y obtener una mejor calidad de registro, se recomienda utilizar electrodos de aguja, y también son válidos los electrodos de hidrogel para monitorizaciones breves. En nuestra experiencia, los electrodos de aguja son mínimamente invasivos y no hemos encontrado problemas en relación con infecciones y/o hemorragia.
La localización de los electrodos sigue las recomendaciones del sistema 10–20 internacional. Para los registros de un canal único, la localización preferible es biparietal P3-P4, para registros de 2 canales C3-P3 y C4-P4. La función del electrodo neutral es disminuir las interferencias. Hay que evitar zonas de edema y fontanela, ya que ello conllevaría una disminución del voltaje. La impedancia se define como la resistencia que se ofrece al flujo de la corriente eléctrica, entre la superficie cortical y el electrodo. A menor impedancia, se obtiene una calidad mejor de la señal.
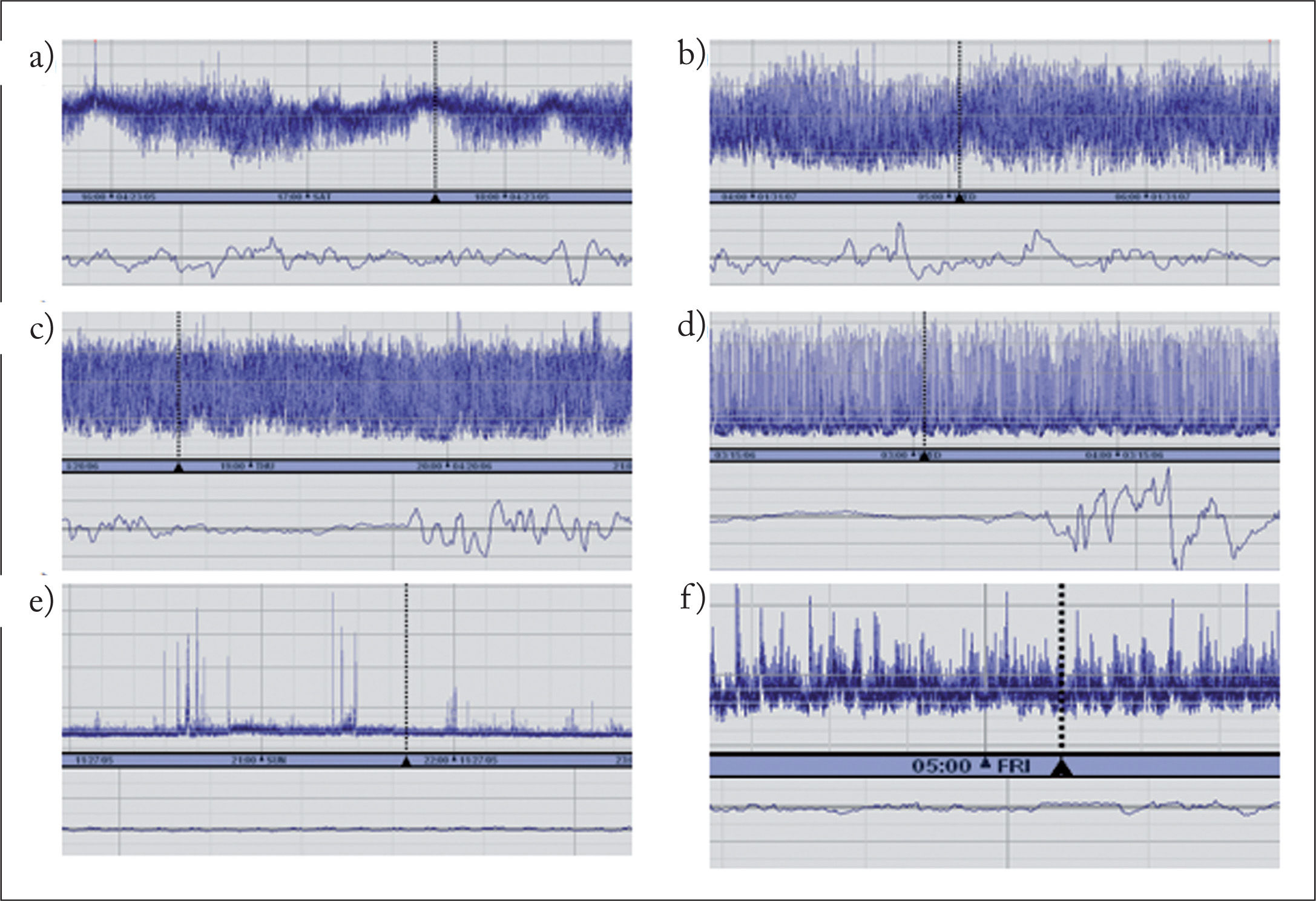
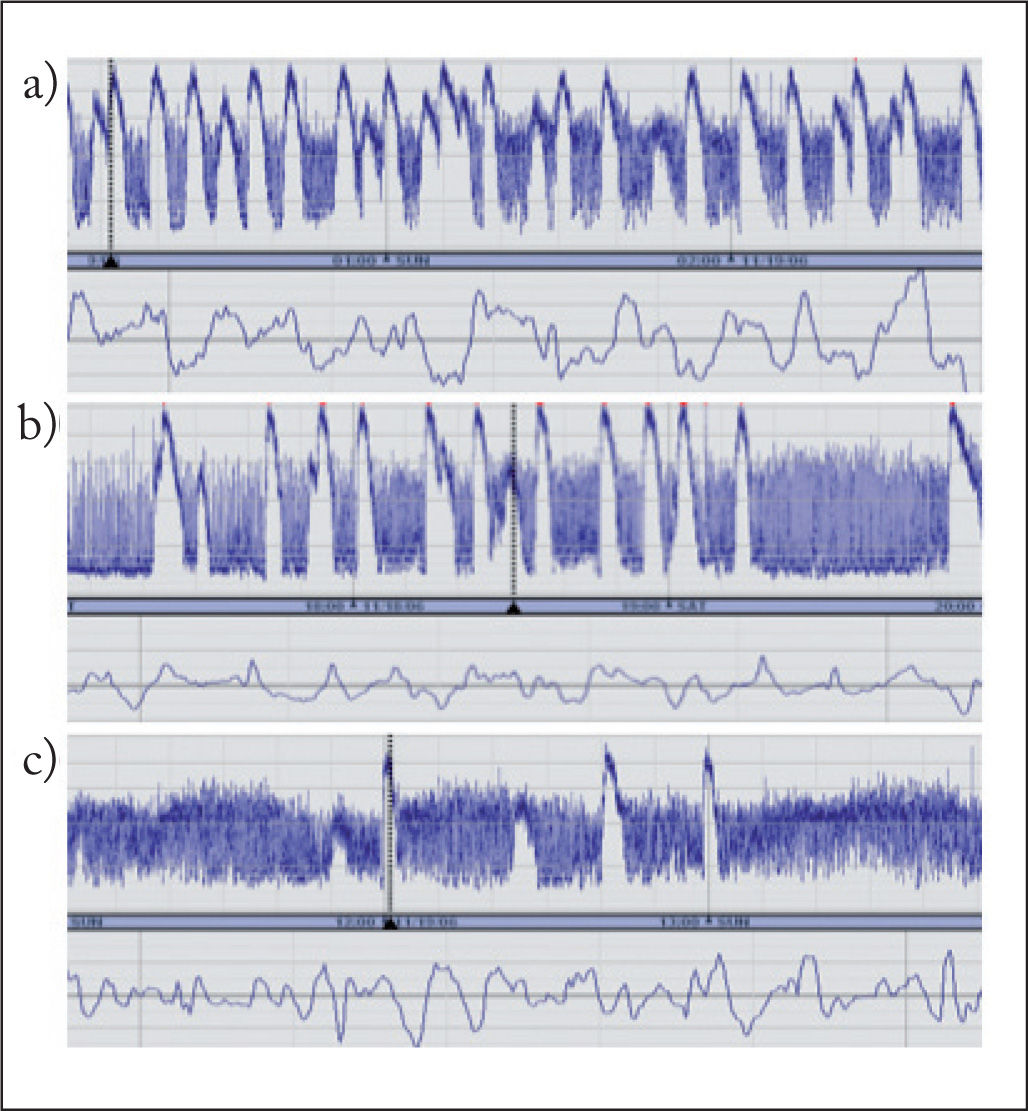
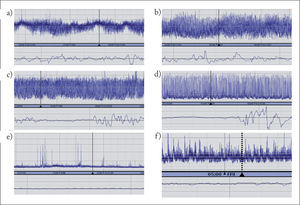
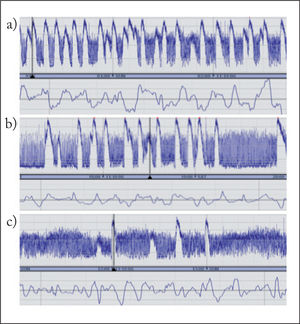
INTERPRETACIÓN Y CLASIFICACIÓN DE REGISTROS DE ELECTROENCEFALOGRAFÍA INTEGRADA DE AMPLITUDSe han propuesto diferentes clasificaciones de patrones de EEGa basadas unas en el reconocimiento visual de patrones3, y otras en la amplitud del trazado (normal: margen superior > 10μV, margen inferior > 5μV; moderadamente alterada: margen superior > 10μV, margen inferior < 5μV, y suprimida: margen superior < 10μV, margen inferior < 5μV)4. Recientemente, se ha propuesto una nueva clasificación basada en la terminología del EEG, que es válida tanto para el neonato a término como prematuro5 (tabla 1). Esta nueva clasificación incluye la descripción de los trazados de base, ciclos vigilia-sueño y actividad paroxística ictal. Los trazados de base se describen según la actividad electrocortical predominante en el registro. No obstante, los valores normativos de amplitud máxima y mínima establecidos previamente son de gran ayuda en evaluar los registros. Así, la amplitud mínima durante el sueño tranquilo guarda correlación positiva con la edad gestacional en el neonato prematuro. También permite diferenciar un trazado discontinuo con un margen inferior variable entre 0 y 6μV de un trazado brote-supresión, en el cual el margen inferior es rectilíneo entre 0 y 1μV. Los ciclos vigilia-sueño se visualizan en el registro como variaciones sinusoidales en la banda, en el que la banda más estrecha corresponde al trazado continuo durante la vigilia y sueño activo, y la banda ancha, al trazado discontinuo durante el sueño tranquilo. Es importante reconocerlos porque son un indicador de la integridad de la función cerebral y de maduración del sistema nervioso central. La actividad paroxística se reconoce en el registro como una elevación abrupta en la amplitud mínima, con frecuencia acompañada de una elevación en la amplitud máxima. En las figuras 2 y 3 se muestra el reconocimiento de diferentes tipos de patrones de EEGa.
Clasificación de trazados de electroencefalografía integrada de amplitud (EEGa) en el recién nacido a término y pretérmino
| Trazado de base |
| Describe el tipo dominante de actividad electrocortical en el trazado de EEGa |
| Continuo: actividad continua con amplitud mínima entre 5 y 10μV y máxima entre 10–25 (−50) μV |
| Discontinuo: trazado discontinuo con amplitud mínima variable, pero < 5μV, y amplitud máxima > 10μV |
| Brote-supresión: trazado discontinuo con amplitud mínima sin variabilidad entre 0–1 (2) μV y brotes con amplitud > 25μV. BS +: densidad brotes ≥ 100 brotes/h; BS -: densidad de brotes < 100 brotes/h |
| Voltaje bajo: trazado de base continuo de voltaje muy bajo (≤ 5μV); amplitud máxima < 10μς |
| Inactivo, plano: trazado isoeléctrico por debajo de 5μV. |
| Ciclos VS |
| Los ciclos VS en la EEGa se caracterizan por variaciones sinusoidales suaves, principalmente en la amplitud mínima. La banda más ancha representa la actividad discontinua durante el sueño tranquilo, y la más estrecha corresponde a la actividad continua durante la vigilia o el sueño activo |
| No ciclos VS: no variaciones cíclicas en la EEGa |
| Ciclos VS inmaduro: algunas variaciones cíclicas de la amplitud mínima, pero no ampliamente desarrolladas |
| Presencia ciclos VS: identificación de variaciones sinusoidales entre actividad continua y discontinua, con duración de los ciclos ≥ 20min |
| Convulsiones |
| La actividad convulsiva epiléptica en la EEGa se visualiza generalmente como una elevación abrupta en la amplitud mínima y una elevación simultánea en la amplitud máxima. La línea de EEG debería mostrar actividad epiléptica simultánea |
| Crisis aislada |
| Crisis repetidas: crisis que aparecen con frecuencia superior a una por cada 30min de intervalo |
| Estado epiléptico: actividad epiléptica continua durante > 30min |
BS: brote-supresión; VS: vigilia-sueño. Tomada de Helltrom-Westas et al6.
Clasificación de trazados de base de electroencefalografía integrada de amplitud. a) Continuo con ciclos de vigilia-sueño maduros en niño a término. b) Continuo alternando con discontinuo con ciclos de vigilia-sueño inmaduros en niño prematuro. c) Discontinuo. d) Brote-supresión. e) Inactivo. f) Hipovoltado.
Los estudios realizados con EEGa en recién nacidos a término, con asfixia perinatal y clínica de encefalopatía hipoxicoisquémica, en las primeras 6–12h de vida, han mostrado su validez para establecer la gravedad de la encefalopatía, y para ayudar a establecer de forma temprana el pronóstico neurológico4–8. En estos estudios, los niños con trazado continuo o discontinuo de voltaje normal tuvieron un desarrollo neurológico favorable, mientras que aquellos con un trazado anómalo (brote-supresión, voltaje bajo, inactivo) evolucionaron a muerte o secuelas neurológicas graves. El análisis del curso evolutivo de los patrones de EEGa, durante las primeras 48h tras la lesión hipoxicoisquémica, también ayuda a clarificar el pronóstico. Así, una mejoría en las características del trazado9,10 y la aparición de los ciclos vigilia-sueño antes de las 36h de vida determinan un pronóstico favorable11. Las indicaciones para iniciar una monitorización electroencefalográfica continua serían los neonatos con acidosis perinatal significativa (pH < 7,0 o EB ≥ 16) y test de Apgar < 5 a los 5min, o si no restringirla a los pacientes con antecedentes de asfixia perinatal que presentan clínica neurológica anómala tras el nacimiento. En estos pacientes, el reconocimiento de anomalías en el trazado de base durante las primeras 6h de vida ayuda a establecer la presencia y la gravedad de la encefalopatía hipóxico-isquémica. Esta información temprana se está utilizando para incluir a estos pacientes en estrategias de neuroprotección. Además, el registro durante las primeras 72h permite detectar el perfil temporal de cambios y examinar la recuperación de los ciclos vigilia-sueño, información también relevante para el pronóstico.
MONITORIZACIÓN CON EEGa EN EL NEONATO PREMATUROLa interpretación de los trazados electroencefalográficos en el período neonatal requiere el conocimiento del desarrollo normal del EEG desde estadios tempranos en el niño prematuro, hasta alcanzar el período postérmino, así como reconocer las características del trazado durante los diferentes estados de vigilia-sueño. Diversos estudios ofrecen información sobre el desarrollo del EEG en el grupo de recién nacidos inmaduros12–14. Estos estudios coinciden en que el trazado de base del niño prematuro es discontinuo, que se caracteriza por períodos de brotes de voltaje elevado intercalados con períodos de amplitud baja. La maduración del EEG en función de la edad gestacional se caracteriza por la aparición de un porcentaje de continuidad mayor, con una disminución del intervalo entre los brotes de actividad y mayor amplitud durante el intervalo interbrote. Por tanto, es importante conocer la edad gestacional y posmenstrual para la correcta interpretación de los trazados electroencefalográficos. La duración del intervalo interbrote y el número de brotes/hora se han utilizado para valorar el grado de madurez de los trazados de EEG/EEGa13,15. Estos cambios madurativos en la actividad eléctrica cerebral también se reflejan en los registros de EEGa16. Por otra parte, los estados cíclicos de vigilia-sueño son claramente reconocibles a partir de la 30 semanas de edad gestacional, pero pueden estar ya presentes a las 25–26 semanas en niños estables, aunque se trata de patrones de sueño rudimentarios17.
La electroencefalografía también se ha utilizado en el niño prematuro para realizar el seguimiento de la actividad eléctrica cerebral, y evaluar el efecto que diversas medicaciones y cuidados sistemáticos tienen en ella16,18–20. Está aún por determinar el papel que tiene este tipo de registros en la evaluación del daño cerebral y en la determinación del pronóstico neurológico en niños prematuros21. Las anomalías del trazado de base electrocortical son comunes en niños prematuros con hemorragia de matriz germinal e intraventricular, y pueden preceder a las anomalías ultrasonográficas. Los cambios tempranos en fase aguda, cuando se está produciendo la hemorragia, son cambios inespecíficos caracterizados por una depresión de la amplitud del trazado de base, aumento de la discontinuidad y por la presencia de actividad epiléptica hasta en un 75% de los pacientes18,22, 23. Además, el grado de depresión de la actividad eléctrica cerebral está en relación con la gravedad de la hemorragia. Los hallazgos electroencefalográficos, cuando se está produciendo la lesión de sustancia blanca, también son inespecíficos, y se encuentra una depresión de la actividad y la presencia de actividad epiléptica. En cuanto a la capacidad pronóstica neuroevolutiva de la EEGa, ésta es aún incierta en el niño prematuro, dado que el pronóstico puede estar influido por otros problemas relacionados con la prematuridad.
EEGa EN EL NEONATO CON CONVULSIONESLas convulsiones son un signo clínico neurológico frecuente en el período neonatal. su diagnóstico se basa habitualmente en criterios clínicos; sin embargo, en estudios con videoelectroencefalografía se ha observado que tan sólo el 20% de las neonatales eléctricas provocan signos clínicos24. Además, es frecuente que tras administrar el primer fármaco antiepiléptico, se produzca disociación electroclínica, por lo que la clínica desaparece y el fenómeno eléctrico persiste. El seguimiento electroencefalográfico prolongado con videoelectroencefalografía ha permitido detectar la presencia de crisis epilépticas convulsivas, y determinar su duración y distribución espacial25. Los estudios sobre eficacia de tratamiento son escasos, pero muestran una respuesta pobre de las crisis al tratamiento médico convencional26. La EEGa desempeña un papel importante en la detección de crisis subclínicas, permite controlar la duración de éstas y la respuesta al tratamiento anticonvulsivo, y ayuda a diferenciar entre el origen epiléptico o no de fenómenos motores paroxísticos frecuentes en el recién nacido. Hay que tener presente que, al tratarse de un registro obtenido de uno o 2 canales, y estar comprimido en el tiempo, crisis focales, de corta duración y/o voltaje bajo, pueden pasar inadvertidas. Las interferencias producidas por equipos electrónicos, la actividad muscular y ECG pueden producir también elevaciones en el margen superior e inferior y confundirse con actividad epiléptica.
Todo esto se compensa por la contribución que el seguimiento continuo electroencefalográfico supone en la mejora del diagnóstico y el tratamiento de las crisis convulsivas epilépticas en el período neonatal.