Puntos clave
- •
El nódulo tiroideo es toda masa palpable de consistencia distinta a la glándula normal.
- •
El nódulo tiroideo en la infancia requiere una evaluación completa ya que con más frecuencia que en el adulto puede encontrarse un carcinoma tiroideo.
- •
La ecografía es la prueba de imagen clave en el estudio del nódulo tiroideo que con ayuda de la punción aspiración con aguja fina sirve para conducir el manejo terapéutico, que en el niño es más complicado que en el adulto.
- •
Las causas más frecuentes de nódulo tiroideo son el adenoma generalmente folicular, el carcinoma tiroideo y el quiste tiroideo.
- •
El tratamiento del nódulo tiroideo es generalmente quirúrgico y debe ser realizado por un cirujano experto.
- •
En caso de absoluta certeza diagnóstica de nódulo tiroideo benigno, se podría controlar de forma clínica mediante ecografías, realizando una punción aspiración con aguja fina si no regresa o, sobre todo, si crece o surgen signos sospechosos.
Lectura rápida
Los nódulos tiroideos son masas palpables que se distinguen en la glándula tiroidea por su distinta consistencia en la palpación y también son diferentes del resto de parénquima tiroideo cuando se realiza una ecografía.
Los nódulos no palpables detectados solamente en ecografía se denominan incidentalomas. Los nódulos palpables tienen el mismo riesgo de malignizarse que los nódulos no palpables del mismo tamaño.
En general, solo se evalúan los nódulos tiroideos mayores de 1cm, ya que tienen más riesgo de ser malignos. Pero si se encuentran rasgos radiológicos sospechosos en nódulos menores de 1cm, asociados a linfadenopatías, historia familiar de cáncer en familiares de primer grado o historia de radiación de cabeza o cuello, también deberán ser evaluados.
La incidencia de nódulos tiroideos aumenta con la edad, siendo mayor en mujeres que en hombres y también es superior en sujetos que viven en zonas deficientes en yodo o en personas que hayan sido expuestas a radiación.
Aunque los nódulos tiroideos son menos frecuentes en la población pediátrica, son sin embargo con más frecuencia (25%) malignos, especialmente en el sexo masculino y por debajo de los 10 años de edad.
Los factores de riesgo asociados con la posibilidad de que un nódulo tiroideo sea maligno son: a) historia familiar de cáncer de tiroides; b) historia familiar de neoplasia endocrina múltiple; c) historia familiar de otros tipos de cáncer, d) historia familiar de enfermedad tiroidea, y e) historia de exposición previa a radiación de cabeza, cuello y tórax tras tratamientos radioterápicos para los linfomas de Hodgkin y previo trasplante de médula ósea en leucemias (factor más importante de riesgo de carcinoma diferenciado de tiroides).
Generalmente, los nódulos de crecimiento rápido y consistencia dura, y fijos suelen ser malignos. La presencia de adenopatías asociadas también aumenta el riesgo de malignidad.
Se debe de realizar determinación de hormona tiroestimulante (TSH), T4 libre, con el fin determinar si el paciente está eutiroideo, hipo o hipertiroideo. La determinación de tiroglobulina puede estar alta en la mayor parte de las alteraciones tiroideas, por lo que no resulta muy útil en el estudio de la malignidad de un nódulo tiroideo. No sucede lo mismo con la determinación de calcitonina, que sí resulta útil para detectar hiperplasia de células C y carcinoma medular de tiroides. La ecografía constituye el método de elección no invasivo para valorar un nódulo tiroideo.
La ecografía proporciona información sobre el tamaño, la forma, la localización (intra o extratiroidea y composición de los nódulos tiroideos).
En la ecografía, también hay que valorar el lóbulo tiroideo contralateral en búsqueda de otros nódulos que no hayan sido detectados en la palpación y también permite valorar las cadenas ganglionares cervicales en búsqueda de adenopatías cervicales sospechosas de malignidad.
La gammagrafía permite valorar la actividad funcional de nódulos superiores a 1cm. Generalmente, se realiza cuando se detecta una TSH baja, con el fin de investigar si los nódulos son hiperfuncionantes (calientes), isofuncionantes o hipofuncionantes (fríos).
La punción aspiración con aguja fina (PAAF) no está indicada realizarla de rutina en nódulos menores de 1cm, a no ser que se encuentren microcalcificaciones en un nódulo sólido hipoecoico.
Los nódulos tiroideos son masas palpables que se distinguen en la glándula tiroidea por su diferente consistencia en la palpación y también son diferentes del resto de parénquima tiroideo cuando se realiza una ecografía. Generalmente, son nódulos benignos. La prevalencia descrita de nódulos tiroideos depende de la población que se analice y de los métodos utilizados para detectar los nódulos como son la palpación y la ultrasonografía.
Los nódulos no palpables detectados solamente en ecografía se denominan incidentalomas. Los nódulos palpables tienen el mismo riesgo de malignizarse que los nódulos no palpables del mismo tamaño1. En general, solo se evalúan los nódulos tiroideos mayores de 1cm ya que tienen más riesgo de ser malignos. Pero si se encuentran rasgos radiológicos sospechosos en nódulos menores de 1cm, asociados a linfadenopatías, historia familiar de cáncer en familiares de primer grado o historia de radiación de cabeza o cuello, también está indicada su evaluación. Aproximadamente, el 1–2% de los pacientes que son sometidos a la realización de una 2-deoxy-2-18-fluoro-D-glucosa tomografía por emisión de positrones (PET) presentan nódulos tiroideos; el riesgo de malignidad en estos pacientes es del 33%, aunque generalmente cuando se evalúan son debidos a tiroiditis autoinmune2.
La incidencia de nódulos tiroideos aumenta con la edad, siendo mayor en mujeres que en hombres y también es superior en sujetos que viven en zonas deficientes en yodo o en personas que hayan sido expuestas a radiación3. En sujetos menores de 21 años la prevalencia de nódulos palpables es de 0,5–1,8%4,5. El porcentaje aumenta al 3% si se realiza la detección por métodos ecográficos. Sin embargo, la verdadera incidencia de nódulos incidentales puede llegar a ser superior al 13% en niños y adolescentes en estudios de autopsias.
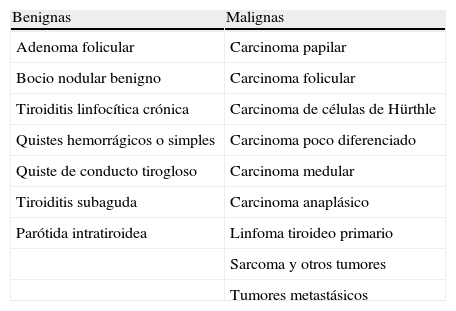
Aunque los nódulos tiroideos son menos frecuentes en la población pediátrica, son sin embargo con más frecuencia (25%) malignos, especialmente en el sexo masculino y por debajo de los 10 años de edad (tabla 1). Por este motivo requieren ser bien evaluados, mediante datos clínicos, analíticos y estudios de imagen e histológicos, para poder realizar un tratamiento adecuado tan pronto como sea posible6.
Etiología de los nódulos tiroideos.
| Benignas | Malignas |
| Adenoma folicular | Carcinoma papilar |
| Bocio nodular benigno | Carcinoma folicular |
| Tiroiditis linfocítica crónica | Carcinoma de células de Hürthle |
| Quistes hemorrágicos o simples | Carcinoma poco diferenciado |
| Quiste de conducto tirogloso | Carcinoma medular |
| Tiroiditis subaguda | Carcinoma anaplásico |
| Parótida intratiroidea | Linfoma tiroideo primario |
| Sarcoma y otros tumores | |
| Tumores metastásicos |
Los factores de riesgo asociados a la posibilidad de que un nódulo tiroideo sea maligno son: a) historia familiar de cáncer de tiroides; b) historia familiar de neoplasia endocrina múltiple; c) historia familiar de otros tipos de cáncer; d) historia familiar de enfermedad tiroidea, y e) historia de exposición previa a radiación de cabeza, cuello y tórax tras tratamientos radioterápicos para los linfomas de Hodgkin y previo transplante de médula ósea.
El carcinoma diferenciado de tiroides supone el 3–8% de todos los tumores malignos en la infancia4,7. La mayor parte de los pacientes son adolescentes entre 15 y 19 años, y solo un 5% de los casos son menores de 10 años.
Evaluación clínicaHistoria clínicaAnamnesisEn la realización de la historia clínica de un paciente pediátrico afectado de nódulos tiroideos es importante preguntar sobre los antecedentes familiares de enfermedad tiroidea, tanto en forma de hipotiroidismo como hipertiroidismo. No hay que olvidar que el factor de riesgo más importante de carcinoma diferenciado de tiroides es la radiación recibida en cabeza, cuello y tórax como parte de tratamiento de tumores, como son principalmente los linfomas y leucemias. También hay que considerar la radiación externa por accidentes, como fueron el de Chernobyl en 1986 y el de Japón en 2011. Otro factor de riesgo importante de cáncer de tiroides en pacientes pediátricos es la historia familiar de carcinoma medular de tiroides o de síndromes relacionados con cáncer tiroideo (p. ej., neoplasia endocrina múltiple [MEN2], el síndrome de Cowden, la poliposis familiar, el complejo Carney, el síndrome de Wermer) presentes en un familiar de primer grado.
Conviene preguntar desde cuándo presenta el nódulo, así como su velocidad de crecimiento, y si presenta signos o síntomas acompañantes como son eritema, inflamación o dolor. Si el nódulo tiroideo cambia de tamaño puede estar relacionado con un quiste y si drena o se ha infectado habrá que sospechar un quiste del conducto tirogloso.
También hay que indagar sobre la presencia de síntomas de compresión, como son disfagia, disfonía y tos, ya que en ocasiones el nódulo tiroideo puede ir acompañado de aumento del tamaño global de la glándula tiroidea.
Es también necesario preguntar sobre síntomas tanto de hipertiroidismo (pérdida de peso, temblor, palpitaciones, nerviosismo, astenia, falta de concentración e irregularidades del ciclo menstrual), como de hipotiroidismo (estreñimiento, piel seca, astenia y aumento de peso). También hay que preguntar sobre el consumo de alimentos ricos en yodo y la utilización de sal yodada.
Exploración clínicaHay que realizar una exploración del área del cuello, examinando la presencia de bocio, nódulos y adenopatías. Se realiza mediante palpación e inspección visual con el cuello en posición normal e hiperextendido. Es importante tratar de describir el nódulo, blando, duro, móvil o fijo, así como si es doloroso a la palpación. Generalmente, los nódulos de crecimiento rápido, consistencia dura y fijos suelen ser malignos. La presencia de adenopatías asociadas también aumenta el riesgo de malignidad.
En los pacientes con historia familiar de neoplasia endocrina múltiple hay que explorar la presencia de hábito marfanoide, neuromas mucosos, pectus excavatum y lesiones en la piel.
Conviene recordar la escala para valorar el grado de bocio según la clasificación de la Organización Mundial de la Salud (OMS) (tabla 2), ya que en ocasiones los nódulos tiroideos se pueden asociar a bocio. El bocio es un aumento de tamaño de la glándula tiroidea que da lugar a un abultamiento en la región anterior del cuello. La OMS lo define como un agrandamiento de los lóbulos laterales del tiroides hasta un tamaño superior a la falange distal del dedo pulgar del paciente, lo que supone un aumento de tamaño de 4 a 5 veces el tamaño normal de la glándula o también durante la infancia tiroides palpable.
Clasificación del bocio según la Organización Mundial de la Salud.
| Grado 0: no hay bocio |
| Grado I: tiroides palpable |
| Grado Ia: bocio palpable pero no visible |
| Grado Ib: bocio palpable y visible con el cuello extendido, pero no visible con el cuello en posición normal. Se incluyen los nódulos tiroideos |
| Grado II: bocio palpable y fácilmente visible con el cuello en posición normal |
| Grado III: bocio voluminoso reconocible a distancia |
Se debe realizar determinación de TSH, T4 libre y anticuerpos antitiroglobulina, con el fin de determinar sí el paciente está eutiroideo, hipo o hipertiroideo. La determinación de tiroglobulina puede estar alta en la mayor parte de las alteraciones tiroideas, por lo que no resulta muy útil en el estudio de la malignidad de un nódulo tiroideo; no sucede lo mismo con la determinación de calcitonina, que sí resulta útil para detectar hiperplasia de células C y carcinoma medular de tiroides. El test de estimulación de la calcitonina con pentagastrina eleva la sensibilidad de la prueba; si el nivel es superior a 100pg/ml, es muy probable el diagnóstico de carcinoma medular. En estos pacientes también se incluirá: calcio, CEA y metanefrina o normetanefrina en plasma y orina para excluir feocromocitoma asociado a la MEN2.
Ecografía tiroideaConstituye el método de elección no invasivo para valorar un nódulo tiroideo. La ecografía proporciona información sobre el tamaño, la forma, la localización (intra o extratiroidea y composición de los nódulos tiroideos). Los nódulos pueden ser sólidos, quísticos o mixtos. Permite visualizar nódulos de 1mm de diámetro. También hay que valorar el lóbulo tiroideo contralateral en búsqueda de otros nódulos que no hayan sido detectados en la palpación y también permite valorar las cadenas ganglionares cervicales en búsqueda de adenopatías cervicales sospechosas de malignidad.
Además, si las características del nódulo tiroideo son sospechosas de malignidad, se puede realizar una punción aspiración con aguja fina (PAAF).
Las características ecográficas de un nódulo no son totalmente fiables para predecir benignidad o malignidad, pero la combinación de algunos rasgos ecográficos pueden tener un valor predictivo, como son los nódulos hipoecoicos de bordes irregulares y microcalcificaciones8. Así mismo, el aumento de vascularización intranodular, ausencia de halo y una morfología del nódulo más alta que ancha (medido en la dimensión transversa) son rasgos de malignidad. Sin embargo, los nódulos tiroideos de bordes regulares, composición quística, iso o hiperecoicos y sin microcalcificaciones pueden predecir benignidad siempre que no haya historia de radiación o cáncer tiroideo9,10. La elastografía es una técnica ecográfica que puede ser útil en el estudio del nódulo tiroideo, pero requiere validación mediante estudios prospectivos11.
La presencia de un nódulo hipervascularizado en un niño con un perfil de hormonas tiroideas de hipertiroidismo es compatible con un nódulo tóxico. Si se observan hipervascularización difusa y nódulos hipoecoicos en un paciente con hipertiroidismo en los resultados de su perfil tiroideo, es compatible con enfermedad de Graves. Si se observan nódulos múltiples en un paciente hipertiroideo, sugiere un bocio tóxico multinodular.
La ecografía es, por tanto, una herramienta muy útil en el estudio de los nódulos tiroideos y debe, por tanto, utilizarse de rutina12.
Gammagrafía tiroideaLa gammagrafía permite valorar la actividad funcional de nódulos superiores a 1cm. Generalmente, se realiza cuando se detecta una hormona tiroestimulante (TSH) baja, con el fin de investigar si los nódulos son hiperfuncionantes (calientes), isofuncionantes o hipofuncionantes (fríos). Tiene las desventajas de su imprecisión y de que somete al niño a radiación, por lo que se utiliza en muy pocas ocasiones. En los niños se prefiere el I123 al I131, ya que es 100 veces menos radiactivo. Si los nódulos son calientes, como raramente son malignos, no se suele realizar estudios citológicos.
Punción aspiración con aguja fina y citologíaLa citología por PAAF realizada con ayuda de la ecografía es el mejor método para determinar la benignidad o malignidad de los nódulos tiroideos. Fue introducida en los años cincuenta. La sensibilidad y la especificidad son altas, aunque difieren según los estudios. La precisión de la prueba depende de la habilidad del ecografista y del patólogo. Aunque depende del centro en que se realice, puede tener una sensibilidad del 90–98%13. Estudios retrospectivos describen baja frecuencia de citologías no diagnósticas o falsos negativos tras PAAF guiada mediante ecografía14,15. Por lo tanto, incluso en nódulos con muchas posibilidades de que la citología no sea diagnóstica (con un porcentaje quístico superior al 25–50%) se prefiere realizar una PAAF guiada con ecografía. Los resultados de la citología se dividen en seis categorías: a) no diagnóstica; b) maligna (riesgo de confirmación de citología maligna tras cirugía de más de un 95%); c) sospechosa de malignidad (riesgo de confirmación de citología maligna del 50–75%); d) lesión folicular de significado incierto (riesgo de confirmación de citología maligna del 5–10%); e) indeterminada o sospechosa de neoplasia, y f) benigna.
No está indicado realizar una PAAF de rutina en nódulos menores de 1cm, a no ser que se encuentren microcalcificaciones en un nódulo sólido hipoecoico. En un nódulo menor de 1cm con apariencia ecográfica maligna, hay que intentar localizar adenopatías cervicales y, si se encuentran, está indicado realizar PAAF. Así mismo, también habría que realizar PAAF si la historia clínica es indicativa de sospecha de malignidad, como puede ser en pacientes con historia familiar de carcinoma papilar de tiroides, antecedentes de radioterapia en cabeza, cuello o tórax, historia de exposición a radiaciones ionizantes en la infancia o adolescencia, antecedente de hemitiroidectomía con diagnóstico de cáncer y 18 FDG-PET positivo para nódulos tiroideos.
Los nódulos mixtos (sólidos-quísticos) con más del 50% de componente quístico también son indicación de realizar PAAF, con realización de drenaje del contenido quístico, especialmente si el paciente está asintomático. Generalmente, se recomienda realizar la punción guiada por ecografía si tras una biopsia inicial el diagnóstico citológico no es preciso. Aun así, un 7% de los nódulos continúan presentando citologías no diagnósticas, tras biopsias repetidas y pueden presentar resultados citológicos malignos tras la cirugía.
Manejo, tratamiento y seguimientoA pesar de que el ritmo de crecimiento no es patognomónico de malignidad, sí que el crecimiento de un nódulo es indicación de repetir la biopsia. Para los nódulos de composición mixta sólido-quística, la indicación de la biopsia se basa en el crecimiento del componente sólido.
Los nódulos benignos también requieren seguimiento ecográfico. No existe consenso sobre qué ritmo de crecimiento del nódulo debe ser indicación de realización de biopsia. Generalmente, se considera que ha crecido si aumenta un 50% de su volumen16 o si aumenta un 20% en 2 de sus dimensiones en los nódulos quísticos o en el componente sólido de los nódulos mixtos.
Se recomienda que todos los nódulos benignos sean controlados con seguimiento ecográfico cada 6–18 meses tras las primera PAAF. Si no se observa crecimiento, se puede realizar la siguiente ecografía cada 3–5 años. Si se observa un crecimiento significativo, ya sea mediante palpación o por medio de ecografía (cambio de volumen superior al 50% o aumento de un 20% en 2 de sus dimensiones, con un mínimo incremento de 22mm en los nódulos sólidos o en la parte sólida de los nódulos mixtos), habrá que repetir la PAAF.
En los nódulos quísticos con citología benigna también conviene realizar un seguimiento para valorar la acumulación de líquido. Si son recurrentes conviene, realizar una hemitiroidectomía o inyecciones percutáneas de alcohol, especialmente si provocan sintomatología compresiva.
En cuanto al tratamiento médico con hormona tiroidea de los nódulos tiroideos, solo un 17–25% de nódulos tiroideos con niveles de TSH elevada, pueden reducirse con administración de levotiroxina17,18, por lo que no se puede realizar como tratamiento de rutina en nódulos tiroideos benignos.
Si la citología es sospechosa de carcinoma papilar de tiroides se recomienda cirugía. En un 15–30% de las muestras de PAAF se puede encontrar citología indeterminada (carcinoma folicular o neoplasia de células de Hürthle)19, que tiene un 20–30% de riesgo de malignidad20.
Existen algunos marcadores comercializados, como son la galectina-3, la citoqueratina y BRAF, que han sido evaluados para mejorar la precisión diagnóstica de nódulos indeterminados21,22. Del mismo modo, también se ha valorado en algunos estudios prospectivos la capacidad de algunos marcadores genéticos (BRAF, Ras, RET/PTC) para aumentar la precisión diagnóstica23.
Si la citología es compatible con neoplasia folicular, se debe considerar la realización de una gammagrafía tiroidea, si es que no ha sido previamente realizada por haber encontrado una TSH baja. Si no se observa un nódulo autónomo concordante, se puede realizar una lobectomía o tiroidectomía total24.
Si la citología es de sospecha de carcinoma papilar o neoplasia de células de Hürthle, no es necesario realizar una gammagrafía y se practica lobectomía o tiroidectomía total, dependiendo del tamaño de la lesión y de otros factores de riesgo. En nódulos superiores a 4cm con marcada atipia en la biopsia, con sospecha de carcinoma papilar en pacientes con historia familiar de carcinoma tiroideo o antecedentes de exposición a radiación, está indicada la realización de una tiroidectomía total debido al elevado riesgo de malignidad. En la mayor parte de los casos de carcinoma papilar hay que realizar ablación con yodo radiactivo24.
Si la citología es indeterminada (neoplasia folicular o de células de Hürthle), el riesgo de malignidad es del 20%25. El riesgo es mayor si el nódulo es mayor de 4cm y especialmente si se observa pleomorfismo celular, si hay historia familiar de cáncer tiroideo o en pacientes con antecedentes de exposición a radiación. El riesgo de malignidad para nódulos con citologías repetidas no diagnósticas es desconocido pero probablemente sea cercano al 5–10%. La cirugía inicial recomendada es la lobectomía y posteriormente según los resultados anatomopatológicos se puede realizar la tiroidectomía total si está indicado. En nódulos con citología indeterminada con enfermedad bilateral o los que prefieren no ser sometidos a una segunda intervención también está indicado una tiroidectomía total o casi total24.
En el carcinoma medular de tiroides, que constituye solo un 5% de los tumores tiroideos en los niños, la tiroidectomía total es el tratamiento de elección en cuanto se conozcan los antecedentes familiares y se haya realizado el estudio genético.
Si la citología es benigna no se precisan más estudios diagnósticos ni tratamiento.
Los pacientes con múltiples nódulos tiroideos con o sin bocio tienen el mismo riesgo de malignidad que los que presentan nódulos solitarios. Se puede considerar la realización de una gammagrafía y practicar una PAAF de los nódulos hipofuncionantes. Si hay uno o más nódulos superiores a 1cm, hay que aspirar el que tenga más características de malignidad. Si ninguno de los nódulos tiene características de malignidad se puede aspirar solamente el más grande y realizar seguimiento ecográfico del resto.
Si los niveles de TSH son bajos sugieren la presencia de un nódulo autónomo. Se debe de realizar una gammagrafía y considerar la realización de PAAF en los isofuncionantes o no funcionantes.
En la mayor parte de los casos, tras la cirugía es necesario instaurar tratamiento con L-tiroxina. Tras la cirugía, que en la mayor parte de los casos suele ser la tiroidectomía total, habrá que realizar tratamiento con dosis ablativas de yodo radiactivo. La monitorización de los niveles de tiroglobulina y los rastreos periódicos con yodo radioactivos se utilizan para control de las recidivas.
ConclusionesEl estudio de los nódulos tiroideos en la población pediátrica requiere una cuidadosa y paciente investigación, reuniendo toda la información posible a través de la historia clínica, exploración física, pruebas de imagen que reúnan toda la información posible para poder indicar la necesidad de cirugía. La incidencia de enfermedad maligna en pacientes pediátricos con nódulos tiroideos es elevada, por ello es difícil establecer un algoritmo diagnóstico generalizado y hay que individualizar el tratamiento en cada paciente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.