Actualmente para el diagnóstico de certeza de la enfermedad tuberculosa es necesaria la obtención de un cultivo positivo para Mycobacterium tuberculosis complex (M. tuberculosis complex), la demostración del bacilo de Koch en la baciloscopia o la detección de ácido desoxirribonucleico (ADN) mediante técnicas de diagnóstico molecular tipo reacción en cadena de la polimerasa (PCR). Dado que no existe ninguna prueba considerada de referencia para la detección de tuberculosis latente, la prueba de la tuberculina con derivado proteico purificado (PPD) ha sido la más utilizada durante más de 100 años. A pesar de su elevado número de limitaciones, (por ejemplo, en inmunodeprimidos, niños y pacientes con la vacuna de bacilo de Calmette-Guérin (BCG), la PT sigue siendo de elección por ser una técnica sencilla, económica, universal y de fácil acceso (tabla 1). Dadas estas limitaciones, desde finales de la década de 1990 se está investigando sobre nuevas técnicas in vitro, que por su mayor sensibilidad y especificidad, ayudan al diagnóstico tanto de la infección latente como de la enfermedad tuberculosa, y han sido aceptadas por la Food and Drug Administration (FDA) y los Centers for Disease Control and Prevention (CDC) desde el año 2005.
Limitaciones de la prueba de la tuberculina (falsos positivos y falsos negativos)
| Falsos positivos |
|---|
| Individuos vacunados con bacilo de Calmette-Guérin (BCG) |
| Infección por otras micobacterias no tuberculosas o atípicas |
| Rotura de vaso o infección en la zona de inyección |
| Error en la lectura |
| Falsos negativos | |
|---|---|
| Factores en relación a la persona | Factores en relación con la técnica |
| Período ventana (entre exposición y positivización: 4–12 semanas) | Inyección demasiado profunda |
| Efecto booster | Inyección cantidad insuficiente |
| Tuberculosis diseminadas o con afectación de las serosas (miliar, meningitis, pleural, etc.) | Almacenamiento y conservación inadecuada |
| Coinfección con virus de la inmunodeficiencia humana (VIH) | Exposición a la luz y al calor |
| Infecciones virales: sarampión, parotiditis, varicela y gripe | Antígeno caducado o contaminación |
| Infecciones bacterianas: fiebre tifoidea, brucelosis, tifus, lepra, tos ferina | Diluciones incorrectas |
| Infecciones parasitarias intestinales en los 2 meses previos | Lectura errónea (subjetiva) |
| Vacunas virus vivos atenuados los 2 meses previos: sarampión, rubéola, parotiditis, polio oral, varicela y fiebre amarilla. Vacuna tifoidea oral | Permanencia > 30min en la jeringa |
| Inmunodeficiencias congénitas | |
| Terapia inmunosupresora: corticoides, terapias biológicas, quimioterapia, etc. | |
| Enfermedades neoplásicas de órganos linfoides | |
| Insuficiencia renal crónica | |
| Sarcoidosis | |
| Malnutrición, depleción proteica grave | |
| Edad: neonatos, ancianos | |
Puntos clave
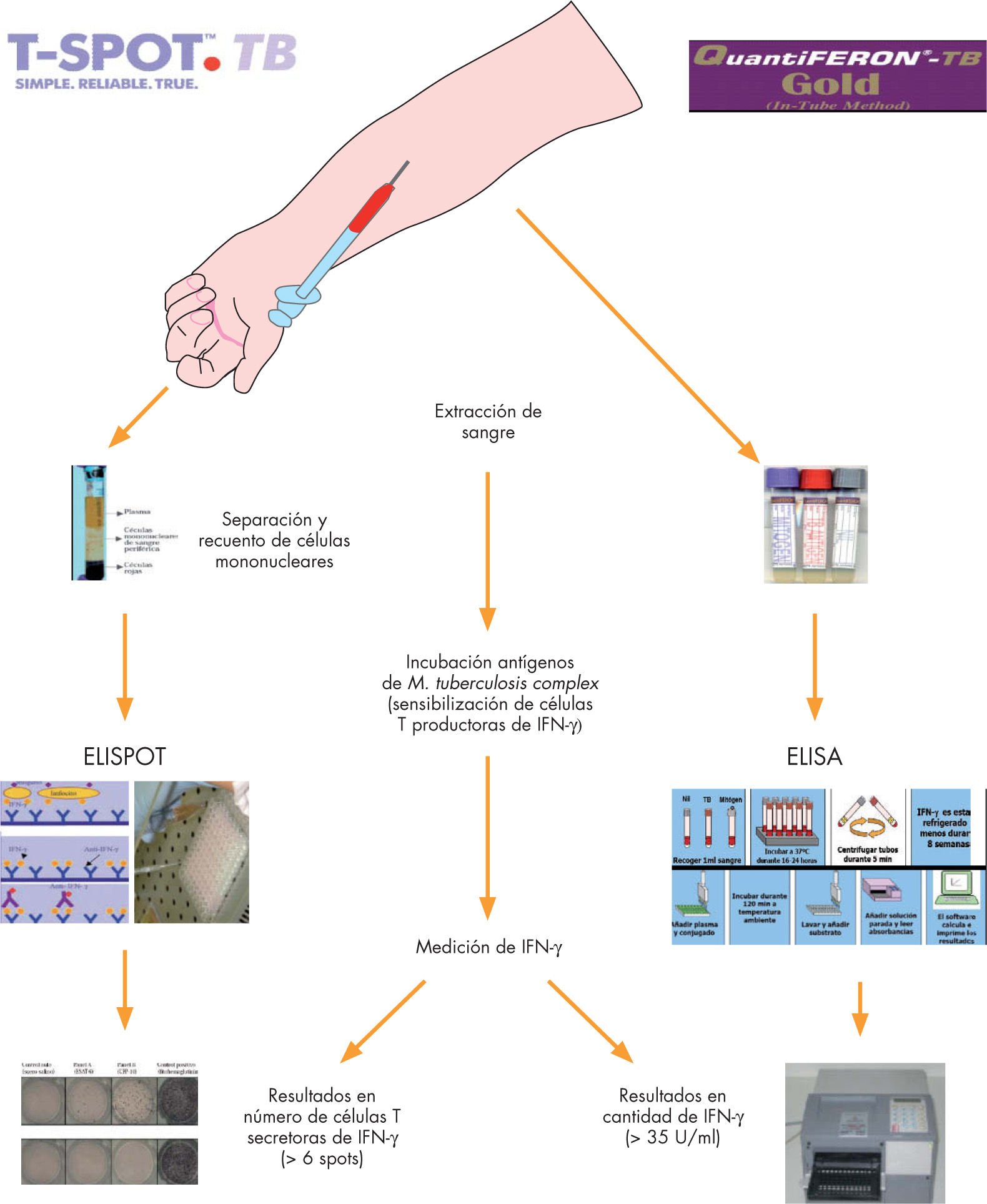
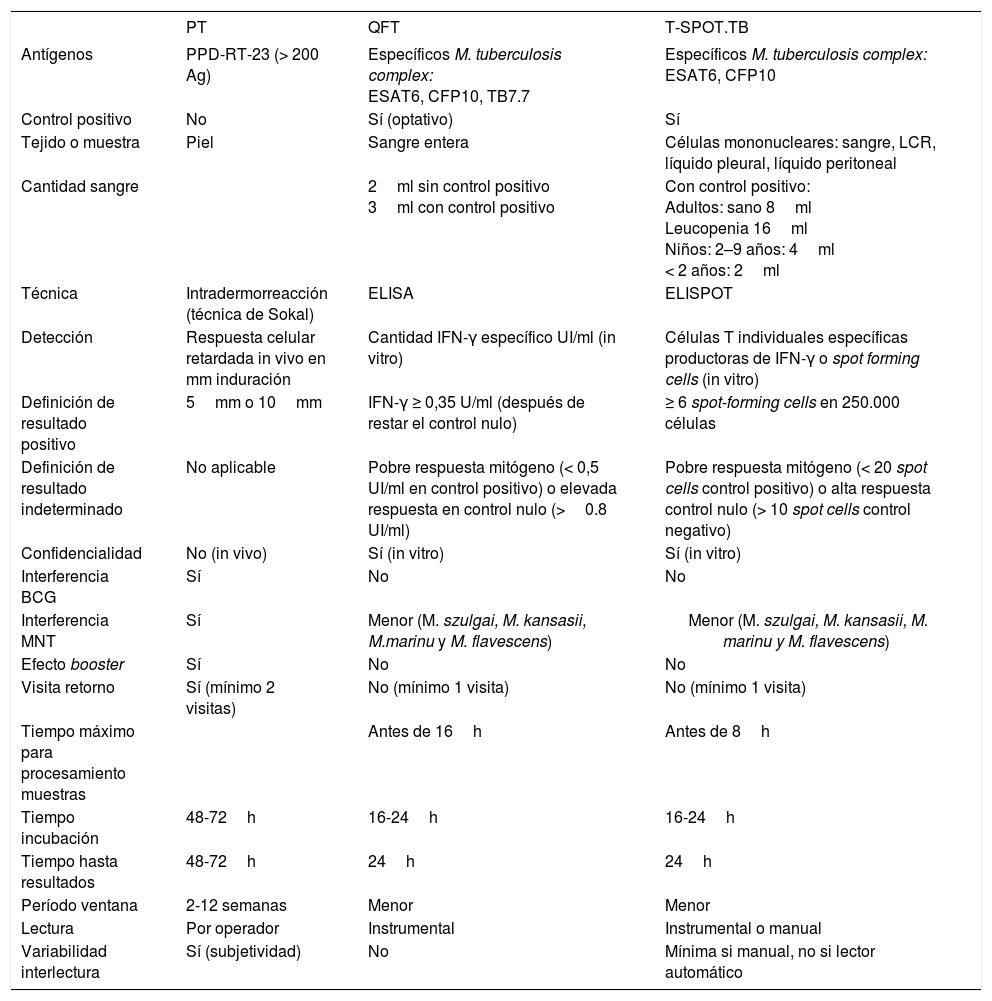
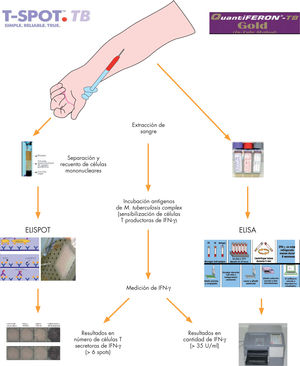
Una respuesta inmune celular efectiva en un paciente infectado por M. tuberculosis complex (M. tuberculosis, M. bovis, M. africanum), comprende la activación de linfocitos T CD4+ y CD8+ específicos para sus antígenos y la liberación de citocinas como el interferón gamma (IFN-γ) y el factor de necrosis tumoral alfa (TNF-α). Las técnicas denominadas genéricamente en la literatura anglosajona con el acrónimo de IGRA (interferon-gamma release assays) se basan, al igual que la PT, en la respuesta celular de hipersensibilidad retardada del individuo frente a determinados antígenos específicos de M. tuberculosis complex. A diferencia de la PT, que mide la respuesta in vivo mediante la lectura de la intradermorreacción de Mantoux, los IGRA miden la respuesta mediante la cuantificación in vitro por técnica inmunológica del IFN-γ (citocina efectora clave en el control de la infección tuberculosa), o de las células T productoras del mismo1. Los antígenos utilizados para su estímulo en sangre total son la proteína secretada de 6 kD (ESAT6), la proteína presente en los filtrados de cultivo (CFP10) y la proteína TB7.7(p4). Dichos antígenos se encuentran codificados en la región RD-1 del gen cromosómico de M. tuberculosis complex y están ausentes en todas las variedades de la vacuna BCG y en la mayoría de las micobacterias no tuberculosas ambientales (MNT), excepto en M. szulgai, M. kansasii, M. marinum y M. flavescens2, por lo que personas sanas o vacunadas no deberían responder. En el mercado actualmente existen dos técnicas IGRA, el Kit QuantiFERON®-TB-GOLD in tube (Cellestis Limited, Australia; QFT) basado en la técnica de ELISA (técnica de inmunoabsorción ligada a enzimas) y el T-SPOT.TB® (Oxford Immunotec, Reino Unido; ELISPOT) basado en la técnica de inmunospot (ensayo de inmunospot ligado a enzimas), con detección de la cantidad de IFN-γ o el número de células T productoras de IFN-γ respectivamente (fig. 1). Ambas técnicas utilizan un control negativo que analiza la cantidad total de IFN-γ del paciente a pesar de no exponerse a estos antígenos, descartando otras causas o enfermedades, evitando falsos positivos y asegurando una correcta realización del test; y un control positivo (mitógeno fitohemaglutinina) que evalúa la viabilidad y capacidad de linfoproliferación de los linfocitos, que pone de manifiesto el estado inmunológico del paciente y evita así los falsos negativos. En la tabla 2 se muestran las principales diferencias entre la PT, el QFT y el ELISPOT y en la tabla 3 las principales ventajas y limitaciones de los IGRA en comparación con la PT.
Descripción de las técnicas: QuantiFERON®-TB-Gold in tube y T-SPOT.TB®.
T-SPOT.TB®:1) Extracción entre 2–8ml de sangre total (tubo citrato sódico). 2) Separación manual o automática de un número determinado de células mononucleares. 3) Incubación directamente en placas o pocillos con antígenos específicos, control positivo y negativo. 4) Realización de la técnica ELISPOT. 5) Recuento manual o lector automatizado de manchas (spot forming cells = un linfocito T sensibilizado productor de IFN-γ).
QuantiFERON® -TB-Gold in tube: 1) Extracción 3ml de sangre total. 2) Incubación con los antígenos, control positivo y negativo, antes de 16h, a 37°C y durante 16–24h. 3) Centrifugación, obtención sobrenadante (material estable 8 semanas en nevera y meses si congelación). 4) Técnica ELISA, mediante un material estandarizado de forma manual o automatizada. 5) Análisis de resultados por lector automatizado y un software específico.
ELISA: técnica de inmunoabsorción ligada a enzimas; ELISPOT: ensayo de inmunospot ligado a enzimas; IFN-γ: interferón gamma.
Características de ambas técnicas IGRA en comparación con la prueba de la tuberculina
| PT | QFT | T-SPOT.TB | |
|---|---|---|---|
| Antígenos | PPD-RT-23 (> 200 Ag) | Específicos M. tuberculosis complex: ESAT6, CFP10, TB7.7 | Específicos M. tuberculosis complex: ESAT6, CFP10 |
| Control positivo | No | Sí (optativo) | Sí |
| Tejido o muestra | Piel | Sangre entera | Células mononucleares: sangre, LCR, líquido pleural, líquido peritoneal |
| Cantidad sangre | 2ml sin control positivo 3ml con control positivo | Con control positivo: Adultos: sano 8ml Leucopenia 16ml Niños: 2–9 años: 4ml < 2 años: 2ml | |
| Técnica | Intradermorreacción (técnica de Sokal) | ELISA | ELISPOT |
| Detección | Respuesta celular retardada in vivo en mm induración | Cantidad IFN-γ específico UI/ml (in vitro) | Células T individuales específicas productoras de IFN-γ o spot forming cells (in vitro) |
| Definición de resultado positivo | 5mm o 10mm | IFN-γ ≥ 0,35 U/ml (después de restar el control nulo) | ≥ 6 spot-forming cells en 250.000 células |
| Definición de resultado indeterminado | No aplicable | Pobre respuesta mitógeno (< 0,5 UI/ml en control positivo) o elevada respuesta en control nulo (>0.8 UI/ml) | Pobre respuesta mitógeno (< 20 spot cells control positivo) o alta respuesta control nulo (> 10 spot cells control negativo) |
| Confidencialidad | No (in vivo) | Sí (in vitro) | Sí (in vitro) |
| Interferencia BCG | Sí | No | No |
| Interferencia MNT | Sí | Menor (M. szulgai, M. kansasii, M.marinu y M. flavescens) | Menor (M. szulgai, M. kansasii, M. marinu y M. flavescens) |
| Efecto booster | Sí | No | No |
| Visita retorno | Sí (mínimo 2 visitas) | No (mínimo 1 visita) | No (mínimo 1 visita) |
| Tiempo máximo para procesamiento muestras | Antes de 16h | Antes de 8h | |
| Tiempo incubación | 48-72h | 16-24h | 16-24h |
| Tiempo hasta resultados | 48-72h | 24h | 24h |
| Período ventana | 2-12 semanas | Menor | Menor |
| Lectura | Por operador | Instrumental | Instrumental o manual |
| Variabilidad interlectura | Sí (subjetividad) | No | Mínima si manual, no si lector automático |
Ag: antígeno; BCG: vacuna de Calmette-Guérin; CFP10: proteína presente en los filtrados de cultivo; ELISA: técnica de enzimoinmunoabsorción ligada a enzimas; ELISPOT: ensayo de inmunospot ligado a enzimas; ESAT6: proteína secretada de 6kD; IFN-γ: interferón gamma; IGRA: Interferon Gamma Release Assays (técnicas de diagnóstico in vitro); LCR: líquido cefalorraquídeo; M. tuberculosis complex: Mycobacterium tuberculosis complex; MNT: micobacterias no tuberculosas; PT: prueba de la tuberculina; QFT: Técnica QuantiFERON®-TB-Gold in tube; spot forming cells: células formadoras de mancha; TB7.7: proteína TB7.7(p4); T-SPOT.TB: técnica T-SPOT.TB®.
Ventajas y limitaciones de las técnicas IGRA en comparación con la prueba de la tuberculina
| Ventajas de los IGRA |
|---|
| La vacuna BCG y la mayor parte de las MNT no interfieren en su resultado (evitan falsos positivos de la PT) |
| Mayor sensibilidad que la PT (evitan falsos negativos, pe. inmunodeprimidos, niños pequeños, infección activa) |
| Mayor especificidad que la PT, pudiendo reducir tratamientos innecesarios y sus efectos secundarios |
| Utilización de control negativo y positivo, detectando posible inmunodeficiencia o error en la realización de la prueba |
| Unica visita para la extracción de sangre, lo cual mejora la adherencia |
| Resultados en 24h y diagnóstico más precoz en casos graves |
| Examen in vitro, aportando confidencialidad |
| No presencia de efecto booster, su repetición no altera los resultados |
| Ausencia de errores de administración o lectura |
| Técnica reproducible (mínima variabilidad interlectura) |
| Aparente fácil realización en laboratorios entrenados |
| Uso en muestras diferentes a sangre (líquido cefalorraquídeo, pleural, peritoneal) |
| Desventajas o limitaciones de los IGRA |
| Ausencia de diferenciación entre infección activa y latente al igual que la PT, requiriendo la realización de otras exploraciones complementarias para excluir una enfermedad tuberculosa |
| Disponibilidad limitada actualmente en los diferentes centros sanitarios y países (por ejemplo, países en vías de desarrollo) |
| Aparente mayor coste económico (reactivos y personal). |
| Necesidad de procesar las muestras en un tiempo limitado (8–16h), impidiendo la derivación de las muestras con facilidad a centros de referencia |
| Posible reacción cruzada con la infección de cuatro MNT (M. szulgai, M. kansasii, M.marinum y M. flavescens). |
| Mayor complejidad técnica y necesidad de entrenamiento. |
| Requerimiento de un volumen considerable de sangre para un niño |
| Posibilidad de extracciones dificultosas en edad pediátrica |
BCG: Vacuna de Calmette-Guérin; IGRA: técnicas de diagnóstico in vitro (interferon gamma release assays); MNT: micobacterias no tuberculosas; PT: prueba de la tuberculina.
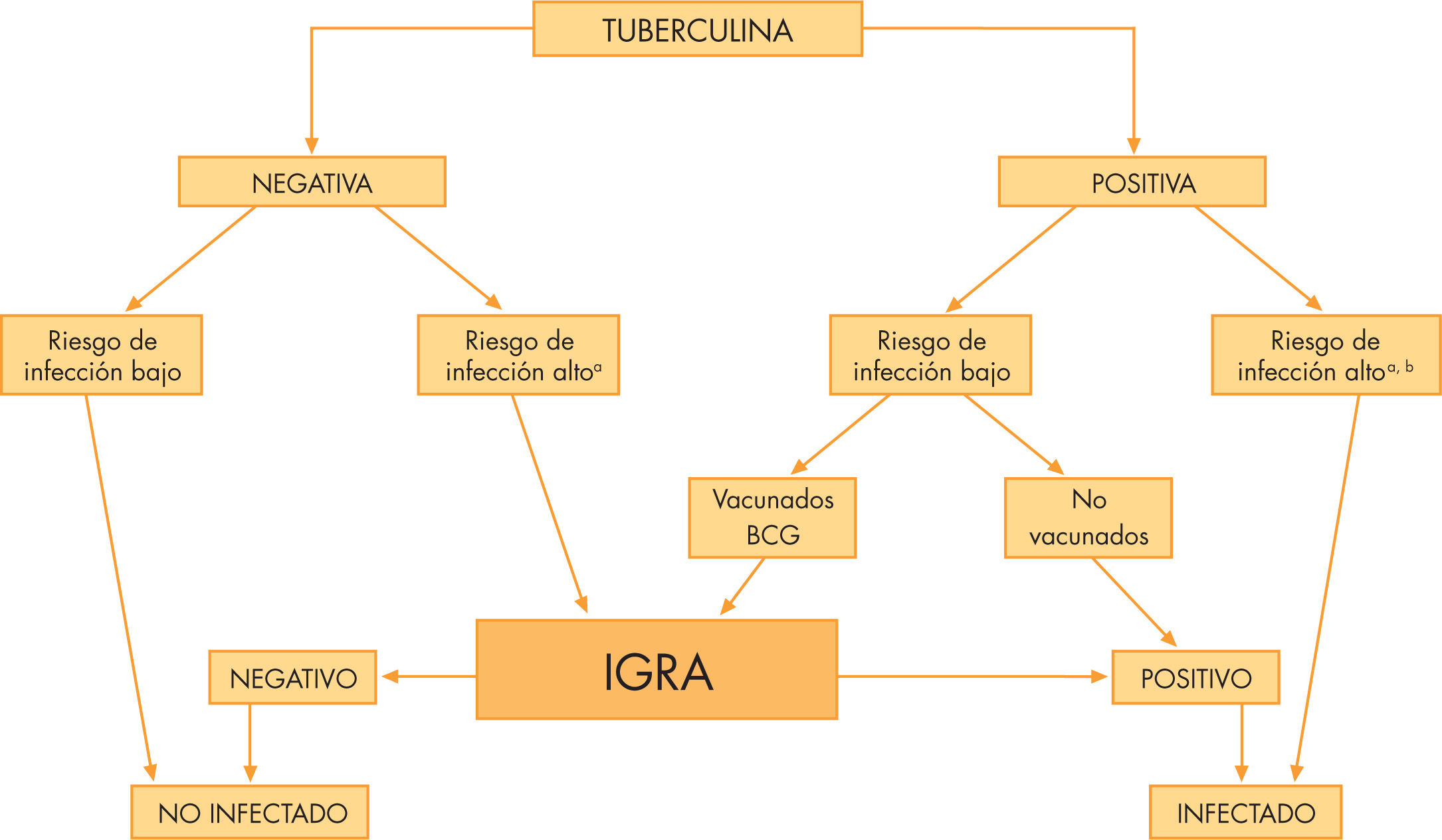
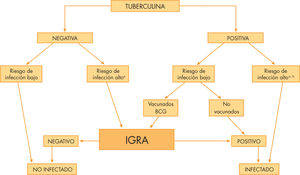
En los últimos años, con el aumento creciente de publicaciones, se ha ido demostrando la utilidad de los IGRA en distintas situaciones y poblaciones (por ejemplo, diagnóstico de infección latente o enfermedad activa en autóctonos, inmigrantes o adoptados, en cribado de pacientes con factores de riesgo o estudios de contactos), tanto en adultos como niños ya sean sanos o inmunodeprimidos8–10. Existen normativas sobre su uso en aproximadamente unos 16 países desarrollados, no todas ellas oficiales ni incluyendo niños. La mayoría se basan en la literatura y la opinión de expertos, con escasas revisiones sistemáticas y metaanálisis y sin basarse en grados de evidencia científica. Existen 3 tipos de estrategias para su utilización: reemplazar la PT por los IGRA, utilizar IGRA o PT indistintamente o utilizar la PT y seguidamente un IGRA en 2 pasos escalonados (two-step). El two-step parece ser la estrategia más utilizada en España, sobre todo en el estudio de contactos y en vacunados con BCG. Las principales guías en el momento actual son: Guía CDC de EE.UU11, publicada en el 2005, que recomienda el uso de los IGRA tanto en infección latente como en la enfermedad activa, incluso como sustituto de la PT en algunos tipos de poblaciones (exceptuando niños y inmunodeprimidos), y la Guía NICE12 de Reino Unido en 2008 (National Institute for Health and Clinical Excellence), que realizan una estrategia diferente siendo más restrictivos y basándose en la prevalencia: primero la PT, si es positivo o los resultados no son muy fiables, se realizará el IGRA. En el año 2007 se aprobó el uso del QuantiFERON®-TB-Gold in tube, una versión del anterior que simplifica el procesamiento de las muestras e incluye el antígeno TB7.7. La Sociedad Española de Neumología y Cirugía Torácica (SEPAR) en 2008 y la Sociedad Española de Infectología Pediátrica junto a la Sociedad Española de Neumología Pediátrica en 2010 han publicado la actualización de la normativa y un consenso, respectivamente, sobre el diagnóstico de la tuberculosis en edad pediátrica, incluyendo ambas la utilización de los IGRA (fig. 2).13,14
Algoritmo diagnóstico de la infección tuberculosa mediante la utilización conjunta de la PT y los IGRA.
aContactos con alta prioridad, incluyendo inmunodeprimidos, niños y contactos íntimos con enfermos bacilíferos. bCon independencia del estado de vacunación con BCG.
BCG: vacuna de bacilo de Calmette-Guérin; IGRA: técnica de diagnóstico in vitro (interferon-gamma release assays); PT:prueba de la tuberculina.
Las recomendaciones actuales indican la realización de los IGRA dentro del estudio de contactos siguiendo la estrategia en 2 pasos o escalonada (two step) y en función del riesgo de infección y/o inmunosupresión (fig. 2). En algunas poblaciones o situaciones clínicas se puede realizar el IGRA de forma paralela y complementaria a la PT. Algunas de ellas son:
- —
Diagnóstico de casos difíciles con sospecha de enfermedad activa, teniendo en cuenta las dificultades diagnósticas en niños por clínica inespecífica, ausencia de pacientes bacilíferos y dificultades en la toma de muestras para realización de cultivos.
- —
Estudio de infección latente/enfermedad activa en niños vacunados con BCG si la PT ha sido positiva, identificando posibles reacciones vacunales15.
- —
Estudio de infección latente/enfermedad activa en niños con posible inmunodeficiencia (por ejemplo, neonatos16 y lactantes pequeños menores de 2 años, malnutridos, inmunodeficiencias primarias o secundarias (virus de la inmunodeficiencia humana [VIH]17, corticoterapia, anti-TNF-α, quimioterapia), parasitosis, etc.)18.
- —
Diagnóstico diferencial de la linfadenitis u otras enfermedades por MNT19.
- —
Diagnóstico de enfermedad tuberculosa extrapulmonar (por ejemplo, meningitis, tuberculosis miliar, adenitis tuberculosa, tuberculosis osteoarticular, etc.).
- —
Diagnóstico de la tuberculosis congénita y en el seguimiento de los lactantes hijos de madre con tuberculosis.
Ambos métodos IGRA no pueden distinguir entre infección latente y enfermedad y todavía se desconoce si serán buenos predictores de la probabilidad de progresión de una a otra, por lo que los resultados deben de ser interpretados conjuntamente a los datos epidemiológicos de riesgo, resultado de la PT, exploraciones complementarias (principalmente radiografía de tórax), exploración física y otros resultados microbiológicos. Pueden presentar 3 tipos de resultados finales:
- —
Positivo: infección tuberculosa probable por respuesta presente tras el estímulo con antígenos.
- —
Negativo: improbable infección por la ausencia de respuesta tras el estímulo con los antígenos.
- —
Indeterminado: el diagnóstico de infección tuberculosa no se puede determinar.
Un resultado indeterminado indica que el estado de infección de un individuo por M. tuberculosis complex no se puede determinar, pero nos aporta una información importante sobre el estado inmunológico del paciente. Generalmente es consecuencia de un estado inmunológico defectuoso o fallo del control positivo, pero también puede significar una realización de la prueba incorrecta. Aun así, muchos individuos con inmunosupresión e infección tuberculosa pueden tener un IGRA positivo. El porcentaje de resultados indeterminados de las diferentes poblaciones estudiadas parece ser mayor con el test QFT que con el ELISPOT, generalmente asociados a inmunosupresión, edad avanzada, edad inferior a 3–5 años y PT negativa10,20.
La mayor parte de las diferencias en las series descritas en la literatura médica en cuanto al número de indeterminados se deben a la utilización de diferentes metodologías, en las que las poblaciones seleccionadas varían (grupos de riesgo, diferentes edades, con o sin inmunodeprimidos, diferentes laboratorios, rutina frente a condiciones controladas, etc.), pudiendo también utilizar diferentes definiciones de indeterminado y diferentes IGRA y generaciones de las técnicas15,20,21. Tras un resultado indeterminado del QFT secundario a un fallo en el control positivo y posible inmunodepresión, algunos autores recomiendan la realización posterior del ELISPOT22.
En la tabla 2 se muestran los valores de corte utilizados para cada una de las técnicas, bien de la cantidad de IFN-γ (QFT) o de las células T específicas productoras de IFN-γ o spot forming cells (ELISPOT).
SENSIBILIDAD Y ESPECIFICIDAD DE LOS IGRANumerosos artículos han mostrado la utilidad de ambas técnicas en el diagnóstico de la enfermedad latente y la enfermedad tuberculosa activa dada su elevada sensibilidad y especificidad tanto en adultos como en niños3,4. El cálculo de las mismas en ocasiones es dificultoso dada la ausencia de una prueba de referencia confirmatoria, sobre todo en la infección latente y en la enfermedad con cultivos negativos. En los 2 metanálisis existentes, se estima que ambas técnicas IGRA tienen en comparación con la PT una mayor sensibilidad (PT 70%, QFT 76%, ELISPOT 88%) y una mayor especificidad en población sana de bajo riesgo (PT 66%, QFT 97% y ELISPOT 92%)5,6. Su mayor especificidad permitiría seleccionar mejor a los posibles falsos positivos de la PT, evitando tratamientos profilácticos y curativos innecesarios y posibles efectos secundarios. La mayor sensibilidad permitiría detectar un mayor número de pacientes con infección latente o casos con enfermedad activa, pudiendo iniciar tratamientos de forma precoz y evitar así la transmisión de la infección. La sensibilidad del IGRA es mayor que la PT en pacientes inmunodeprimidos, malnutridos, en contactos recientes con pacientes bacilíferos, en la enfermedad activa y en niños. El ELISPOT presenta una aparente mayor sensibilidad y especificidad que la PT y el QFT, con menor número de resultados indeterminados, pero se trata de una técnica más compleja en su realización (requiere mayor cantidad de sangre, separación de las células mononucleares y con ello un mayor tiempo de realización), con menor aceptabilidad y accesibilidad en el momento actual7.
CONCORDANCIA ENTRE PT E IGRALa concordancia global entre la PT y los IGRA generalmente es buena, pero a pesar de ello, en algunos trabajos se describen ciertas discordancias dada la existencia de posibles factores de confusión. Algunos de ellos son: la vacunación con BCG, la exposición repetida a M. tuberculosis complex y a diferentes tipos de MNT (sobre todo países con alta prevalencia de infección), el tratarse de infecciones recientes o antiguas, el haber recibido tratamiento antituberculoso o quimioprofilaxis previas, el encontrarse en diferentes grupos de riesgo y condiciones clínicas, los posibles sesgos y limitaciones en la lectura de la PT (por ejemplo, diferentes puntos de corte) 23. Las discordancias deben ser interpretadas de forma cautelosa en función del tipo de población en la que se aplique el IGRA:
Sospecha de enfermedad activa- —
PT - y IGRA +: posible falso negativo de la PT. El IGRA detecta infecciones más recientes por su mayor sensibilidad y menor período ventana, viéndose menos influenciado por la inmunosupresión intrínseca de la enfermedad activa.
- —
PT + e IGRA -: posible falso positivo de la PT (por ejemplo, MNT o vacunación BCG). Probablemente no se trate de un falso negativo del IGRA dado que este último es más sensible y específico.
- —
PT - y IGRA +: posible falso negativo de la PT. Deben ser valorados en función del riesgo a la hora de iniciar tratamiento o bien ser seguidos en el tiempo para ver evolución clínica (poco probable que se trate de un falso positivo del IGRA).
- —
PT + e IGRA -: posible falso positivo de la PT, sobre todo por posible reacción por vacuna BCG si existe vacunación previa.
- —
PT - y IGRA +: posible falso negativo de la PT. Podría ser que el IGRA detectara infecciones más recientes por su mayor sensibilidad.
- —
PT + y IGRA -: posible falso positivo de la PT, en caso de vacunados o infecciones por MNT. Raramente se tratará de un posible falso negativo del IGRA.
Hay trabajos que muestran una posible base inmunológica de algunas de estas discordancias: la PT detecta células efectoras y de memoria (infección actual y antigua) y en cambio los IGRA sólo las efectoras (infección actual o reciente), dada su corta incubación (entre 16–24h) y por tanto ausencia de estimulación de las células de memoria específicas24.
FUTURO DE LOS IGRAA pesar de la creciente bibliografía, queda pendiente de demostrar o resolver ciertas cuestiones en relación a los IGRA, con escasos trabajos hasta el momento sobre, por ejemplo, variabilidad en los resultados inter o intralaboratorio; si llegarán a permitir la diferenciación entre infección latente y activa o permitirán confirmar o excluir la enfermedad; estudios costeefectividad y aplicabilidad en todo tipo de poblaciones con diferentes grados de endemia; si un resultado de un IGRA positivo tendrá valor pronóstico de una posible progresión a enfermedad activa; utilidad en otros tipos de muestras diferentes a sangre (líquido cefalorraquídeo, pleural, peritoneal, etc.). A pesar de un mayor coste económico, existen trabajos recientes que demuestran que en términos globales de coste-efectividad su uso podría suponer un menor coste para los sistemas de salud25. Recientemente, algunos autores hablan de la utilidad de los IGRA en la monitorización del tratamiento tanto de la infección latente como activa26. Por todo ello, se requieren más estudios de seguimiento longitudinal que muestren la evolución de los pacientes con resultados discordantes, significado de la conversión de un IGRA positivo a negativo y estudios de coste-efectividad que permitan la implementación sistemática de los IGRA dentro de los protocolos diagnóstico-terapéuticos tanto en la edad adulta como pediátrica.
COMENTARIOS FINALESLas nuevas técnicas de diagnóstico in vitro de la tuberculosis podrían mejorar la eficiencia en el diagnóstico de pacientes con sospecha de enfermedad activa, estudio de contactos y cribado de infección latente en poblaciones de riesgo. Permiten resolver muchas de las limitaciones de la PT, siendo más sensibles y específicas y, por lo tanto, permitiendo una mejor selección de los pacientes infectados que deben recibir tratamiento. De esta forma se evitaría la diseminación de la infección, el riesgo de secuelas con elevada morbilidad y mortalidad, los tratamientos innecesarios y costosos y el aumento de los gérmenes multirresistentes.