Puntos clave
Es fundamental clasificar correctamente todo niño (expuesto, infectado o enfermo). Cada estadio conlleva una actitud terapéutica distinta.
Debemos tener especial cuidado con los menores de 5 años por presentar mayor riesgo de evolucionar a enfermedad tuberculosa (ETB) y de desarrollar formas graves.
La ausencia de aislamiento de Mycobacterium tuberculosis, de identificación de caso índice y/o un resultado negativo de prueba de la tuberculina/interferon-gamma release assays no excluye el diagnóstico en casos sospechosos.
En las formas ganglionares, debemos realizar el diagnóstico diferencial con infecciones por otras micobacterias, ya que el tratamiento es radicalmente distinto.
El tratamiento de la ETB requiere regímenes en politerapia, de duración mínima de 6 meses. Las formas extrapulmonares, resistentes y los inmunodeprimidos requieren regímenes muy prolongados, con monitorización estrecha de toxicidad y del cumplimiento terapéutico.
Hasta conocer la sensibilidad de la cepa, se debe iniciar tratamiento con 4 fármacos en regiones con resistencia a isoniacida superiores al 4%.
La tuberculosis en niños es un fiel marcador de la situación epidemiológica de una comunidad, e indica una transmisión reciente de Mycobacterium tuberculosis (MTB), generalmente desde un familiar próximo1.
Realizar un diagnóstico precoz de la primoinfección es muy importante, ya que permite instaurar una quimioprofilaxis que evite la progresión a enfermedad tuberculosa (ETB) y detectar el foco de contagio. Por ello, la actuación de los pediatras es clave en el control de la enfermedad.
El diagnóstico de la ETB es una tarea compleja, ya que en un porcentaje elevado de casos no se consigue confirmación microbiológica2. En estos, debemos establecer el diagnóstico basándonos en datos clínicos y epidemiológicos. Sin embargo, la presentación de la ETB en pediatría muestra gran variabilidad, que en ocasiones comienza con formas oligosintomáticas.
Por ello concluimos que, a pesar de la importancia de establecer un diagnóstico precoz, los pediatras nos seguimos encontrando múltiples dificultades a la hora de realizar esta tarea.
EpidemiologíaLa tasa de nuevos casos de tuberculosis (TB) ha disminuido en la última década, aunque en 2012 todavía se diagnosticaron 8,6 millones nuevos de casos, falleciendo 1,3 millones de personas por esta enfermedad. En niños, en 2012 se diagnosticaron 530.000 nuevos casos, falleciendo 74.0003.
Un tema preocupante es la creciente aparición de formas multirresistentes (MR), diagnosticándose 450.000 nuevos casos de ETB-MR en 2012 en todo el mundo3.
En España, los últimos datos de incidencia son de 14 casos/100.000 habitantes, diagnosticándose el 8% de estos en menores de 14 años4.
En la última década se han observado en nuestro país, porcentajes de resistencias a isoniacida (H) en población pediátrica superiores al 4 %5, siendo este porcentaje aún superior en población inmigrante5. Los niños de mayor riesgo son aquellos que provienen de zonas endémicas, los que están infectados por el virus de la inmunodeficiencia humana (VIH) y los que conviven en condiciones precarias sociosanitarias con poblaciones de riesgo. En ellos debe realizarse periódicamente una prueba de tuberculina (PT), permitiéndonos detectar precozmente la infección y buscar posibles fuentes de contagio6.
Además, los niños menores de 5 años representan una población especialmente susceptible por asociar mayor riesgo de evolucionar de infectado a enfermo y de desarrollar formas graves, como la tuberculosis miliar o la meningoencefalitis. Se estima que hasta el 50% de los menores de un año desarrollan enfermedad tras la primoinfección7. Por ello, la TB continúa siendo hoy en día un importante problema de salud pública.
Conceptos generales y recuerdo fisiopatológicoLa TB es una enfermedad infecciosa producida por MTB. Esta micobacteria presenta una pared celular rica en lípidos, resistente a la decoloración tras la tinción con colorantes, lo que le otorga el calificativo de bacilo ácido-alcohol resistente (BAAR). A diferencia de otras micobacterias, se transmite exclusivamente por contacto persona-persona8. Los enfermos bacilíferos eliminan la micobacteria a través de las secreciones respiratorias, siendo el foco de transmisión8. Cuando un niño se expone a un enfermo bacilífero, puede adquirir o no la infección. La adquisición de la infección precisa una convivencia estrecha y mantenida para su transmisión, habitualmente más de 4h diarias en ambiente cerrado.
El MTB es un patógeno intracelular y, por tanto, la inmunidad celular tiene un papel fundamental. Por ello, los niños con defectos de inmunidad celular (VIH, inmunodeficiencias congénitas, tratamiento corticoideo o con terapias biológicas…) tienen un riesgo aumentado de desarrollar tuberculosis8.
Tras la primoinfección, el MTB llega a los alvéolos, donde se produce la fagocitosis del mismo por los macrófagos. Los macrófagos infectados son transportados hasta los ganglios hiliares y mediastínicos. En la mayor parte de los casos, la infección se controla. Sin embargo, en algunos casos, especialmente en niños pequeños e inmunodeprimidos, la infección progresa dando lugar a la enfermedad pulmonar o diseminándose produciendo enfermedad extrapulmonar9,10. Otra vía de infección es la transplacentaria (desde la madre con TB aguda al feto) dando lugar a la TB congénita8.
Lectura rápida
En la última década, se ha observado en nuestro país una disminución de casos de enfermedad tuberculosa (ETB) en niños, pero el porcentaje de resistencias a isoniazida (H) ha aumentado por encima del 4%, sobre todo en inmigrantes.
La tuberculosis (TB) se transmite por contacto persona-persona. Los pacientes eliminan la bacteria a través de las secreciones respiratorias. Otra vía de infección es la transplacentaria, que da lugar a la TB congénita. La TB pulmonar en niños es paucibacilar, eliminando escasos bacilos a través de secreciones, siendo los niños poco contagiosos.
Debemos clasificar a cada niño como expuesto, infectado o enfermo. Para ello tendremos en cuenta la presencia de síntomas, el resultado de la prueba de la tuberculina (PT) o del interferon-gamma release assay (IGRA) y la radiografía de tórax.
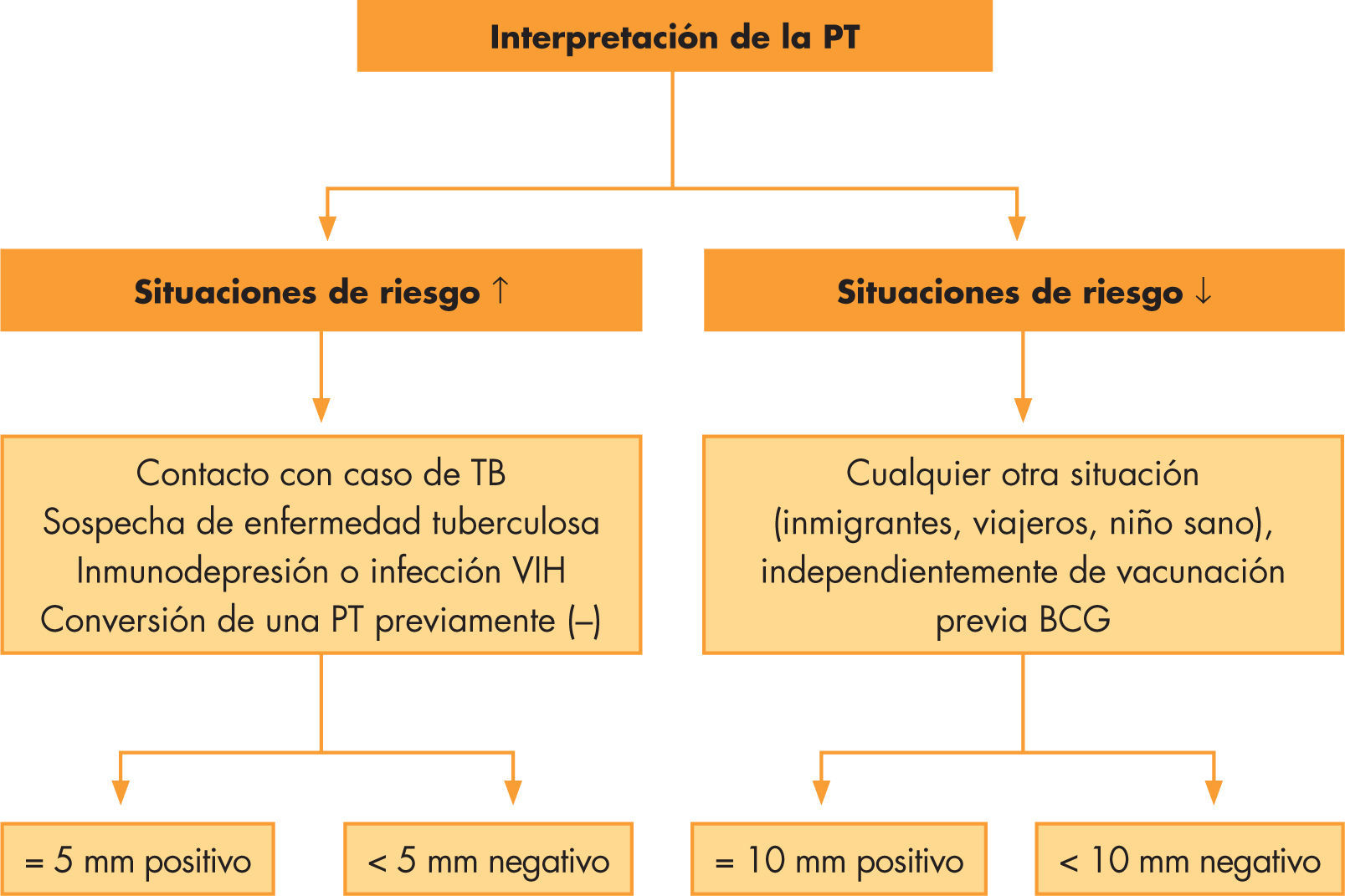
La positividad de la PT solo indica infección, siendo necesaria la realización de otras pruebas para descartar enfermedad. En situaciones de riesgo, se considerarán positivas induraciones mayores o iguales a 5mm. En cualquier otra situación, se considerarán positivas induraciones superiores o iguales a 10mm. Pueden presentar falsos negativos en determinadas situaciones y falsos positivos por vacunación con BCG o infección por otras micobacterias no tuberculosas. Los IGRA se proponen como prueba complementaria en casos de sospecha de enfermedad con PT negativa, o niños con PT positiva sin factores de riesgo en los que se sospecha un falso positivo por BCG.
Todo niño que ha tenido contacto reciente con adulto enfermo, presente PT/IGRA negativo y esté asintomático, con prueba de imagen normal, se considera expuesto y debe recibir 2 meses de isoniacida (H) para evitar el contagio, repitiendo PT/IGRA antes de suspender H. Si estas pruebas se positivizan, el paciente se ha infectado y habrá que descartar enfermedad activa.
Se considera infección tuberculosa latente (ITBL) la presencia de PT/IGRA positiva y una prueba de imagen normal en niños asintomáticos. Deben recibir 6 meses de H para evitar la progresión a ETB. Los menores de 5 años asocian un mayor riesgo de evolucionar a ETB activa tras la primoinfección y de desarrollar formas graves.
Diagnosticaremos ETB cuando aparezcan clínica compatible y hallazgos radiológicos, analíticos, anatomopatológicos y/o microbiológicos sugestivos. La presentación clínica es muy variable, desde formas oligosintomáticas hasta graves. La TB pulmonar es la forma mas frecuente. La forma grave más frecuente en niños es la meningoencefalitis. Las formas ganglionares suponen un reto diagnóstico, debiendo realizar el diagnóstico diferencial con infecciones por otras micobacterias, ya que el enfoque terapéutico es distinto.
El diagnóstico de certeza es obtener un cultivo o reacción en cadena de la polimerasa (PCR) positiva para Mycobacterium tuberculosis (MTB) en esputo, aspirado gástrico, líquido cefalorraquídeo (LCR), líquido pleural, articular o biopsia. En los niños, que no expectoran, se obtiene cultivo de aspirado gástrico y/o de esputo inducido. Cuando el aislamiento de MTB no es posible, estableceremos el diagnóstico basándonos en datos clínicos y epidemiológicos. La ausencia de confirmación microbiológica, una PT negativa y/o la ausencia de identificación del caso índice no excluye el diagnostico en casos sospechosos.
La radiografía de tórax tiene una rentabilidad diagnóstica del 75%. La tomografía computarizada torácica está indicada en casos de alto riesgo a pesar de radiografía normal o dudas diagnósticas, sobre todo en menores de 2–3 años.
La detección de MTB por PCR ofrece alta especificidad y algo mayor sensibilidad que los cultivos, permite resultados rápidos e incluso detección resistencias, aunque no esta disponible en todos los centros.
Los niños con ETB deben ser remitidos a una unidad de referencia para su tratamiento, dada la complejidad del mismo, la necesidad de asegurar el cumplimiento terapéutico y evitar la diseminación de las cepas a la comunidad, y controlar la toxicidad farmacológica. La duración del tratamiento dependerá de la forma clínica, siendo las ETB pulmonares no complicadas y las ganglionares las que requieren menor duración, nunca inferior a 6 meses. Las extrapulmonares y las ETB en inmunodeprimidos y con infección por virus de la inmunodeficiencia humana requieren regímenes prolongados.
Hasta conocer la sensibilidad de la cepa, se debe iniciar tratamiento con 4 fármacos en regiones con resistencia a H superiores al 4%. El tratamiento de la ETB resistente y multirresistente es complejo, precisa seguimiento estrecho, terapia directamente observada, y puede asociar toxicidad farmacológica, debiendo realizarse siempre en unidades de referencia con experiencia.
Tras la primoinfección inicial, los niños eliminan escasos bacilos a través de secreciones respiratorias, siendo muy excepcionalmente bacilíferos y, por tanto, poco contagiosos. Sin embargo, las reactivaciones tuberculosas en adolescentes y adultos jóvenes que se infectaron en la primera infancia, especialmente si presentan formas pulmonares cavitadas, suelen ser formas bacilíferas y, por tanto, altamente contagiosas8.
ClasificaciónTodos los niños en contacto con el bacilo tuberculoso deberán ser estudiados y clasificados en expuestos, infectados o enfermos11 (tabla 1). Es necesario clasificar al paciente en uno de estos estadios de la enfermedad, ya que comportan una actitud terapéutica diferente.
Clasificación y estadios de la tuberculosis11
| Exposición a TB sin infección |
| 1. Contacto reciente y estrecho con adulto enfermo de TB |
| 2. PT/IGRA negativo |
| 3. Asintomático con radiografía de tórax normal |
| ITBL |
| 1. PT/IGRA positivo |
| 2. Asintomático con radiografía de tórax normal |
| * Aunque no documentemos la existencia de un contacto con TB |
| * Antes de confirmar ITBL, es obligado descartar enfermedad y realizar una radiografía de tórax |
| Enfermedad tuberculosa |
| 1. Diagnóstico de certeza: cultivo o PCR positiva para MTB |
| 2. Diagnóstico de sospecha: clínica compatible y hallazgos indicativos radiográficos, analíticos y/o anatomopatológicos |
| * En niños es difícil obtener cultivos o PCR (+) y se realiza habitualmente diagnóstico de sospecha |
| * El Mantoux suele ser (+), aunque en formas iniciales o diseminadas puede ser (−) |
| En caso de sospecha clínica debemos tratar siempre, a pesar de Mantoux (−) |
ITBL: infección por TB latente; MTB: Mycobacterium tuberculosis; PCR: reacción en cadena de la polimerasa; TB: tuberculosis; PT/IGRA: prueba de la tuberculina/interferon-gamma release assays.
Algunos pacientes expuestos no se infectan. De aquellos que se infectan, algunos presentarán infección latente asintomática, otros desarrollaran enfermedad oligosintomática, tuberculosis con afectación moderada y algunos, enfermedad grave y diseminada11.
La probabilidad de infección después de la exposición dependerá de la intimidad del contacto, la duración de la exposición o de la cantidad de bacilos de la fuente. Una vez infectado, el desarrollo de formas clínicas sintomáticas y/o graves estará en relación con múltiples factores: edad, estado nutricional, inmunodepresión, carga bacilar, etc. Como ya hemos comentado, el riesgo de desarrollar enfermedad activa y la severidad de la misma son inversamente proporcionales a la edad. Por ello, los menores de 5 años, y en especial los lactantes, son los que mayor probabilidad tienen de desarrollar enfermedad y de presentar formas graves de la misma11.
Prueba de tuberculina y nuevos test de inmunodiagnósticoLa PT consiste en la inyección intradérmica de componentes antigénicos del bacilo (derivado proteico purificado [PPD]). Si el niño ha tenido contacto previo con el bacilo, se producirá induración que se conoce como la intradermorreacción de Mantoux12. Su positividad solo indica infección, siendo necesaria la realización de pruebas complementarias para descartar enfermedad activa.
Se administra mediante inyección intradérmica 0,1ml del PPD-RT23, en la cara anterior de antebrazo y la introducción del líquido debe producir una pápula detectable13.
Debe leerse a las 72h cuando se consigue la máxima induración, aunque es valorable entre las 48 y las 96h. Se debe leer solo el diámetro máximo transversal al eje mayor del brazo, anotándose siempre en milímetros con la fecha de lectura13.
La prueba puede presentar resultados falsos negativos13: periodo ventana, ETB diseminada, neonatos y lactantes, VIH, inmunodeficiencias, tratamientos inmunosupresores, infecciones virales, bacterianas o parasitarias activas, vacunas de virus vivos atenuados los 2 meses previos, malnutrición, enfermedades crónicas y neoplasias, factores relacionados con la técnica de administración, la conservación del producto o con la lectura errónea.
También asocia falsos positivos, por infecciones por micobacterias atípicas y tras vacunación con BCG, al existir reacción cruzada con el PPD13.
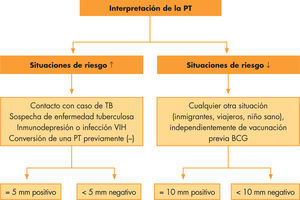
El dintel para la positividad es distinto en función de la situación clínica y epidemiológica del niño14. En situaciones de riesgo, se considerarán positivas induraciones mayores o iguales a 5mm. En cualquier otra situación, induraciones superiores o iguales a 10mm14 (fig. 1). Induraciones superiores a 15mm son infrecuentemente resultados falsos positivos.
Algoritmo para la interpretación de la prueba de tuberculina en niños. PT: prueba de la tuberculina; TB: tuberculosis; VIH: virus de la inmunodeficiencia humana.
Recientemente, se han desarrollado unas nuevas pruebas diagnósticas denominadas interferon-gamma release assays (IGRA), basadas en la detección de la secreción de interferón-γ por parte de células T al entrar en contacto con antígenos específicos de MTB15,16.
Dichos antígenos también están presentes en algunas micobacterias (M. kansasii, M. marinum, M. szulgai, M. flavescens), pero no en BCG, ni en M. avium, que es la micobacteria atípica más frecuente en nuestro medio. Por ello, no presentan falsos positivos por vacunación previa BCG y por infección por las micobacterias atípicas más frecuentes15,16. También presentan falsos negativos, como la PT. Requieren de personal especializado y su coste es superior. Se propone su uso como prueba complementaria a la PT en casos de alta sospecha de ETB con PT negativa, o en niños con PT positiva sin factores de riesgo en lo que se sospecha un falso positivo de la PT14.
Clasificación. Formas clínicasPara clasificar a los pacientes tendremos en cuenta la presencia o no de síntomas y los resultados de la PT o del IGRA (tabla 1).
Se considera expuesto a todo niño que ha tenido contacto reciente y sustancial, más de 4h diarias, en espacio cerrado, con adulto enfermo o sospechoso de TB, presentar una PT o un IGRA negativo y está asintomático, con prueba de imagen normal (radiografía y/o tomografía computarizada [TC] de tórax)6,12.
Se consideran en situación de infección por TB latente (ITBL), los niños asintomáticos que presenten PT/IGRA positivo, y una prueba de imagen normal6,12.
La ETB tiene una presentación clínica muy variable, desde formas oligosintomáticas con síntomas inespecíficos hasta síntomas de afectación grave, por lo que muchos autores la denominan «la gran simuladora».
Diagnosticaremos ETB cuando aparezcan clínica compatible y hallazgos radiológicos, analíticos, anatomopatológicos y/o microbiológicos indicativos12,13. El diagnóstico de certeza lo proporcionan un cultivo o una reacción en cadena de la polimerasa (PCR) positiva para MTB. Pero con frecuencia en algunos casos no obtenemos confirmación microbiológica. En ellos realizaremos el diagnóstico basándonos en la sospecha clínica, apoyándonos en otras pruebas complementarias (radiología, citoquímico del líquido cefalorraquídeo [LCR], pleural o articular, biopsia con granulomas, y PT o IGRA habitualmente positiva, aunque pueden ser negativos en enfermos graves o inmunodeprimidos12,14). Suele existir el antecedente epidemiológico, pero no es obligado. La ausencia de confirmación microbiológica, de identificación del caso índice o un resultado negativo de PT/IGRA no excluye el diagnostico, y en casos de alta sospecha debemos igualmente instaurar un tratamiento empírico12,14.
La forma clínica más frecuente en niños es la pulmonar8. Suele presentarse con sintomatología anodina (tos persistente, febrícula, astenia, falta de apetito…). A veces comienza con disnea, compromiso respiratorio y derrame pleural. En ocasiones, su diagnóstico es casual, en niños que consultan por contacto con ETB. Existen formas parenquimatosas (neumonía, caverna…), ganglionares (ganglios mediastínicos que pueden comprimir bronquio y producir atelectasias), formas mixtas (afectación parenquimatosa y ganglionar), derrames pleurales y formas miliares8.
Un 10% de los niños pueden comenzar con formas extratorácicas, secundarias a la diseminación hematógena del MTB11,12. La forma miliar por diseminación hematógena del MTB se manifiesta a los 2–6 meses de la primoinfección. Más frecuente en lactantes e inmunodeprimidos, tiene un comienzo insidioso que evoluciona a fiebre persistente, adenopatías generalizadas y hepatoesplenomegalia, que puede evolucionar a afectación multiorgánica que comporta una situación de extrema gravedad. Se asocia a disnea, hipoxemia, estertores o sibilancias, en ocasiones neumotórax o neumomediastino. El 20–40% asocia meningitis o peritonitis11,12.
La forma grave más frecuente en niños es la meningoencefalitis y tiene una mayor incidencia en menores de 3 años. Solo el 50% de los casos asocian una radiografía de tórax patológica y una PT positiva. Se produce por localización del exudado inflamatorio tuberculoso en la base del sistema nervioso central (SNC), bloqueando el flujo del LCR, produciendo dilatación ventricular con hidrocefalia11,12. El comienzo es insidioso de cefalea, irritabilidad y vómitos, con posterior afectación de pares craneales (III, VI, VII) y de la consciencia. Algunos niños no tienen meningismo y comienzan con desorientación, trastornos del movimiento y del lenguaje11,12. En el lactante, el cuadro es más agudo y puede presentar desde el comienzo signos meníngeos, letargia y convulsiones. El LCR presenta pleocitosis linfocitaria, hipoglucorraquia e hiperproteinorraquia marcada, y el aislamiento de MTB ocurre en menos del 60% de los casos11,12. Las pruebas de imagen mostrarán tuberculomas, aracnoiditis en la base del cráneo y dilatación ventricular. La hidrocefalia es la complicación más frecuente y devastadora.
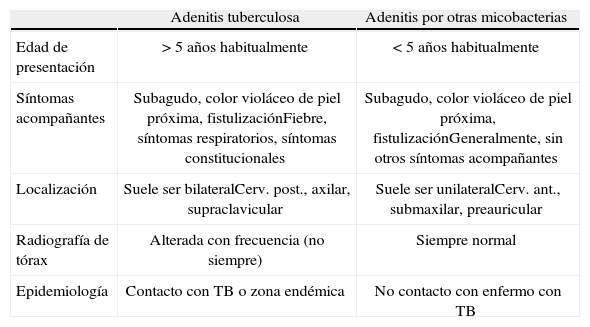
Las formas ganglionares de ETB suponen un reto diagnóstico, debiendo hacer el diagnóstico diferencial con las adenitis por micobacterias ambientales, siendo el enfoque terapéutico radicalmente distinto. La edad del niño, la localización de la adenitis, los antecedentes epidemiológicos y la presencia de síntomas constitucionales ayudan a diferenciarlas (tabla 2)11. En las adenitis por micobacterias atípicas la radiografía de tórax nunca debe presentar alteraciones y pueden presentar PT positiva.
Diagnóstico diferencial en las adenitis por micobacterias.
| Adenitis tuberculosa | Adenitis por otras micobacterias | |
| Edad de presentación | > 5 años habitualmente | < 5 años habitualmente |
| Síntomas acompañantes | Subagudo, color violáceo de piel próxima, fistulizaciónFiebre, síntomas respiratorios, síntomas constitucionales | Subagudo, color violáceo de piel próxima, fistulizaciónGeneralmente, sin otros síntomas acompañantes |
| Localización | Suele ser bilateralCerv. post., axilar, supraclavicular | Suele ser unilateralCerv. ant., submaxilar, preauricular |
| Radiografía de tórax | Alterada con frecuencia (no siempre) | Siempre normal |
| Epidemiología | Contacto con TB o zona endémica | No contacto con enfermo con TB |
TB: tuberculosis.
Las osteomielitis/artritis tuberculosas cursan con dolor, impotencia o inflamación de localización muy insidiosa y prolongada. Suele afectar a grandes huesos y vértebras. En la espondilitis tuberculosa (enfermedad de Pott), la destrucción de los cuerpos vertebrales da lugar a cifosis.
Dada la variabilidad de presentaciones clínicas, es fundamental para sospechar la ETB la realización de una adecuada historia clínica, que pondrá de manifiesto antecedentes epidemiológicos que serán la verdadera señal de alarma para pensar en la enfermedad.
Estudios complementarios- –
Estudio epidemiológico11–13: es muy importante investigar la existencia de contacto con inmigrantes, viaje a áreas endémicas y convivencia con poblaciones de riesgo. Si existe contacto con enfermo, detallar el tiempo de exposición y averiguar la situación del caso índice, el tratamiento recibido, el cumplimiento y, sobre todo, la sensibilidad de la cepa. Igualmente, debemos documentar la existencia de vacunación previa BCG (fecha, número de dosis, cicatriz posvacunal) y, en caso de realización previa de PT, su fecha y resultado.
- –
Técnicas de imagen11–13: la radiografía de tórax aislada tiene una rentabilidad diagnóstica elevada. La TC torácica es más sensible, pero está indicada solo en casos de alto riesgo a pesar de estudio radiológico normal o dudas diagnósticas, sobre todo en niños menores de 2–3 años17. La evolución radiológica es mucho más lenta que la clínica, observándose en ocasiones empeoramiento radiológico al iniciar el tratamiento y pudiendo quedar lesiones residuales después de completarlo. En casos de TB del SNC es indispensable una TC cerebral, con contraste y en muchos casos resonancia magnética. En adenitis cervical es útil la ecografía y en casos de TB osteoarticular se emplearán resonancia y estudios isotópicos.
- –
Anatomía patológica11–13: el estudio histológico mostrará la presencia de granulomas caseificantes y necrosantes, con células gigantes, debiendo hacer el diagnóstico diferencial con enfermedades que desarrollen granulomas (micobacterias atípicas, Bartonella, sarcoidosis…). Se puede realizar en biopsias de ganglios, sinovial, pleural, pericárdica…
- –
Determinación de adenosindeaminasa11–13: su elevación es orientativa de TB, aunque no específica. Su estudio se realiza en líquidos orgánicos: LCR (normal 1–4U/l) y líquido pleural (normal < 40U/l).
- –
Estudios microbiológicos11–13: el diagnóstico de certeza de enfermedad TB consiste en el aislamiento mediante cultivo o PCR del MTB en muestra de esputo, aspirado gástrico, LCR, líquido pleural o articular o material de biopsia. En el niño, dada la dificultad para expectorar, se realiza estudio en jugo gástrico, recogiendo 3 muestras en días consecutivos mediante sonda nasogástrica, estando el paciente en ayunas. Tras la obtención del jugo se inyectan 3 cc de agua estéril y se aspira de nuevo. Una nueva técnica es el esputo inducido2,18. Se realiza inhalando salbutamol y posteriormente ClNa nebulizado 15min. El suero salino por efecto osmótico atrae líquido intersticial a la luz de las vías respiratorias, aumentando las secreciones, y provoca expectoración espontánea. En niños que no hayan expectorado, se aspiran las secreciones de nasofaringe a través de un catéter estéril. Presenta ventajas frente al aspirado gástrico, como no requerir el ingreso del niño, ser menos invasiva y de más fácil realización, y es especialmente útil en pacientes que no expectoran2,18. Tiene el inconveniente de un mayor riesgo de contagio, dado que con el esputo inducido se generan gotitas de «flugge». El riesgo en niños es bajo debido a la naturaleza paucibacilar de la ETB, pero se recomienda realizar la técnica en una habitación con ventilación con presión negativa, o al menos con adecuada ventilación2,18. Se deben adoptar medidas de protección personal.
- 1.
Baciloscopia y cultivo11–13: en todas las muestras obtenidas, se realizará baciloscopia o visión directa de BAAR, mediante fluorescencia con auramina o tinción de Ziehl-Neelsen. El cultivo de MTB se realizará en medios sólidos (tipo Lowenstein, 4–6 semanas) o líquidos (tipo Middlebrook, 15 días-1 mes). Es obligado realizar un estudio de sensibilidad a fármacos en el cultivo.
- 2.
PCR11–13: es una técnica novedosa, no disponible de forma universal y que, en manos expertas, es rápida y segura para diagnóstico de MTB, presentando alta especificidad y algo mayor sensibilidad que cultivos. Permite resultados en poco tiempo. Se puede realizar en líquidos orgánicos y muestras de tejidos. Desde 2010, se dispone de una técnica de PCR que permite la detección en tan solo 2h de material genético de MTB y de resistencias a rifampicina (Xpert® MTB/RIF assay)19. Esta técnica es mucho más sensible que la baciloscopia y más rápida que las técnicas convencionales de cultivo19. Se recomienda en sospechas de TB resistente, en pacientes infectados por el VIH y en casos con alta sospecha y baciloscopia negativa19.
En todo niño expuesto a enfermo bacilífero debemos descartar la infección/enfermedad, realizando una PT o un IGRA y una radiografía de tórax. Si estas pruebas descartan infección y enfermedad, instauraremos una profilaxis primaria para evitar el contagio que todavía no se ha infectado, con H 2 meses a 5–10mg/kg/día (máx. 300mg/día). Si la exposición fue a cepa resistente a H, rifampicina (R) 10mg/kg/día (máx. 600mg/día) 2 meses11–13. Terminada la profilaxis, deberemos repetir la PT. Si es negativa, suspenderemos la profilaxis. Si es positiva, el paciente se ha infectado, debiendo realizar una nueva radiografía. Si esta es normal y el paciente está asintomático, completaremos profilaxis hasta 6–9 meses11–13.
Si el niño expuesto presenta PT/IGRA positivo y radiografía de tórax normal estando asintomático, diagnosticaremos una ITBL, debiendo iniciar tratamiento con H 5–10mg/kg/día, 6–9 meses (12 meses en inmunodeprimidos) para evitar que el niño desarrolle la enfermedad11–13. En situaciones en las cuales sea difícil asegurar un cumplimiento adecuado durante 6 meses, se puede utilizar H 5–10mg/kg/día con R 10mg/kg/día durante 3 meses11–13. En casos de intolerancia a H o exposición a TB resistente a H, se utilizará R 10mg/kg/día, 6–9 meses11–13.
No existe consenso sobre la profilaxis primaria y el tratamiento de ITBL en niños expuestos a cepas multirresistentes, recomendándose remitir siempre al niño a una unidad especializada.
Tratamiento de la enfermedad tuberculosaEl tratamiento de la TB consta de una fase de inducción o bactericida, con rápida disminución del número de bacilos, mejoría clínica y disminución de la capacidad de contagio (2 meses), y una fase de mantenimiento, para eliminar los bacilos quiescentes (duración mínima 4 meses)20,21.
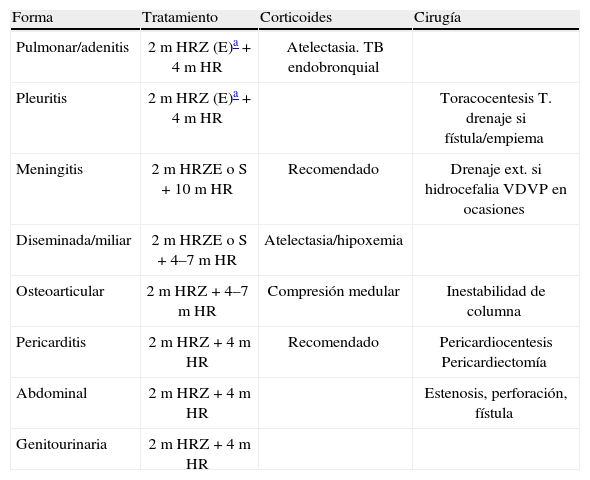
En la tabla 3 se recogen las principales recomendaciones para el tratamiento farmacológico y quirúrgico de las diversas formas de ETB20–22. Los corticoides pueden ser beneficiosos y están indicados en algunas formas de ETB13,22,23, generalmente durante las fases iniciales (tabla 3).
Pautas de tratamiento en tuberculosis.
| Forma | Tratamiento | Corticoides | Cirugía |
| Pulmonar/adenitis | 2m HRZ (E)a + 4m HR | Atelectasia. TB endobronquial | |
| Pleuritis | 2m HRZ (E)a + 4m HR | Toracocentesis T. drenaje si fístula/empiema | |
| Meningitis | 2m HRZE o S + 10m HR | Recomendado | Drenaje ext. si hidrocefalia VDVP en ocasiones |
| Diseminada/miliar | 2m HRZE o S + 4–7m HR | Atelectasia/hipoxemia | |
| Osteoarticular | 2m HRZ + 4–7m HR | Compresión medular | Inestabilidad de columna |
| Pericarditis | 2m HRZ + 4m HR | Recomendado | Pericardiocentesis Pericardiectomía |
| Abdominal | 2m HRZ + 4m HR | Estenosis, perforación, fístula | |
| Genitourinaria | 2m HRZ + 4m HR |
E: etambutol; H: isoniacida; R: rifampicina; VDVP: válvula de derivación ventrículo peritoneal; Z: pirazinamida.
En pacientes inmunodeprimidos y en infectados por el VIH, debemos realizar tratamientos prolongados, nunca inferiores a 9 meses. Debemos recordar que la R interacciona con algunos antirretrovirales, disminuyendo sus niveles y aumentando la toxicidad de la R12.
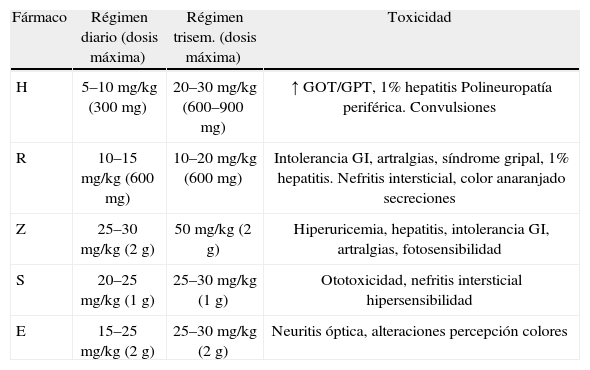
En niños, la toxicidad de los fármacos usados es escasa y puede solventarse con pequeñas modificaciones13,20,21. El efecto adverso más importante es la toxicidad hepática, principalmente por H. No es necesaria la realización rutinaria de analítica, salvo sospecha clínica. Si hay hepatotoxicidad leve, se debe ajustar la dosis de H a 5mg/kg/día o instaurar pauta intermitente. Si el paciente presenta sintomatología con cifras de transaminasas superiores a 3 veces el límite de la normalidad o 5 veces el límite, aunque no tenga síntomas debemos suspender el fármaco y valorar cambio a otro no hepatotóxico, principalmente etambutol (E) o estreptomicina (S), alargando el tiempo de tratamiento. Es importante considerar la posibilidad de rash y reacción de hipersensibilidad a estos compuestos y deberá intentarse, cuando la situación no sea de gravedad, una desensibilización, para utilizar prioritariamente fármacos de primera línea (tabla 4).
Presentación y dosis de los fármacos antituberculosos de primera línea.
| Fármaco | Régimen diario (dosis máxima) | Régimen trisem. (dosis máxima) | Toxicidad |
| H | 5–10mg/kg (300mg) | 20–30mg/kg (600–900mg) | ↑ GOT/GPT, 1% hepatitis Polineuropatía periférica. Convulsiones |
| R | 10–15mg/kg (600mg) | 10–20mg/kg (600mg) | Intolerancia GI, artralgias, síndrome gripal, 1% hepatitis. Nefritis intersticial, color anaranjado secreciones |
| Z | 25–30mg/kg (2g) | 50mg/kg (2g) | Hiperuricemia, hepatitis, intolerancia GI, artralgias, fotosensibilidad |
| S | 20–25mg/kg (1g) | 25–30mg/kg (1g) | Ototoxicidad, nefritis intersticial hipersensibilidad |
| E | 15–25mg/kg (2g) | 25–30mg/kg (2g) | Neuritis óptica, alteraciones percepción colores |
E: etambutol; GI: gastrointestinal; GOT: transaminasa glutámico oxalacética; GPT: transaminasa glutámico-pirúvica; H: isoniazida; R: rifampicina; S: estreptomicina; Z: pirazinamida.
Actitud ante cepas de MBT resistentes a fármacos: en países con tasas de resistencia primera a H superiores al 4%, se iniciará tratamiento con 4 fármacos hasta conocer la sensibilidad de la cepa20,21,23. Estudios epidemiológicos recientes en nuestro país descubren tasas de resistencia a H en niños superiores al 4%, sobre todo en hijos de inmigrantes procedentes de zonas de alta endemia5. Por ello, en estos niños se debe iniciar 4 fármacos hasta conocer la sensibilidad de la cepa5. Todo caso de ETB-MR (al menos H y R) debe ser derivado a una unidad de referencia, dadas la complejidad de su tratamiento y la necesidad de seguimiento estrecho23,24.
Seguimiento y pronósticoEn niños con ETB es recomendable el ingreso hospitalario y el seguimiento por una unidad de referencia especializada. El ingreso nos permite obtener muestras para baciloscopia y cultivo, mediante esputo directo, esputo inducido o aspirado gástrico, y vigilar la tolerancia inicial al tratamiento20,21. Se recomienda aislamiento en habitación individual y uso de mascarillas en familiares y personal sanitario.
Se recomienda un estrecho seguimiento para asegurar el cumplimiento y evitar la diseminación de las cepas a la comunidad, siendo obligado realizar terapia directamente observada en casos de TB resistente25. Tras el alta, se debe realizar una valoración clínica mensual para detectar precozmente la aparición de efectos secundarios y comprobar la eficacia y la adherencia al tratamiento20,21. Se recomienda la realizar radiografía de tórax al diagnóstico, al mes y cada 3 meses hasta finalizar el tratamiento. Más de la mitad de los pacientes pueden no haber normalizado la radiografía de tórax al finalizar el tratamiento, sin que esto signifique una mala respuesta. Se recomienda realizar control analítico trimestral en caso de empleo de fármacos de segunda línea debido a su toxicidad20,21,25. Estos fármacos generalmente son mejor tolerados en niños que en adultos. Los efectos secundarios más frecuentes son gastrointestinales, seguidos a distancia por los hepáticos, articulares, psiquiátricos y endocrinológicos20,21,25. Si se emplea E, deben realizarse controles oftalmológicos cada 2–3 meses. La administración prolongada de fluoroquinolonas requiere controlar la aparición de tendinitis o artropatía. Si se emplean aminoglucósidos, se deberá realizar cribado vestibular y auditivo20,21,25.
Deben ingresarse siempre las formas pulmonares graves (derrames pleurales, atelectasias importantes…), toda forma grave o diseminada, formas extrapulmonares, salvo formas ganglionares aisladas, sospecha de ETB resistente a fármacos, fracasos terapéuticos tras al menos 2 meses del mismo y sospechas de incumplimiento13.
Los autores declaran no tener ningún conflicto de intereses.