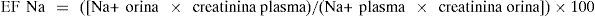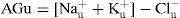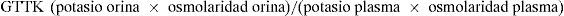Puntos clave
- •
La excreción de electrolitos en orina debe ser interpretada en el contexto clínico y bioquímico del paciente, ya que cifras consideradas como normales pueden no serlo al relacionarlas con su concentración plasmática.
- •
La tasa de eliminación urinaria de sodio nos permite evaluar el estado de la volemia, realizar el diagnóstico del tipo de insuficiencia renal y de la hiponatremia.
- •
La excreción urinaria de cloro puede ser útil en el diagnóstico de alcalosis metabólica y en acidosis metabólica con anión gap normal.
- •
La medición de la excreción urinaria de potasio puede ayudar en el diagnóstico de la hipopotasemia inexplicable. Para el estudio de hipo o hiperpotasemia está indicado medir el gradiente transtubular de potasio.
- •
La medición de la tasa de eliminación de calcio en orina es fundamental para detectar hipercalciuria que es la causa metabólica más frecuente de cálculos renales.
La evaluación de la concentración urinaria de electrolitos es una herramienta muy útil para el diagnóstico y el manejo de los trastornos nefrológicos y del medio interno. Nos centraremos en los parámetros que aportan mayor información y en su interpretación. Son pruebas fáciles de realizar. Solo es necesario una muestra de orina aislada y otra simultánea de sangre. El riñón varía su tasa de excreción según los aportes en la dieta y la producción endógena, por lo que no hay cifras normales fijas, dependiendo de la situación clínica y bioquímica sanguínea del paciente. De tal forma que cifras consideradas como normales pueden no serlo al relacionarlas con su concentración plasmática, por lo que se debe calcular los cocientes urinarios, la excreción fraccional, o índices de excreción (tablas 1–3). Cualquier valor anómalo obtenido en una muestra aislada debe ser confirmado recogiendo orina de 24h. A continuación, se detallará cómo valorar la eliminación de los solutos más importantes.
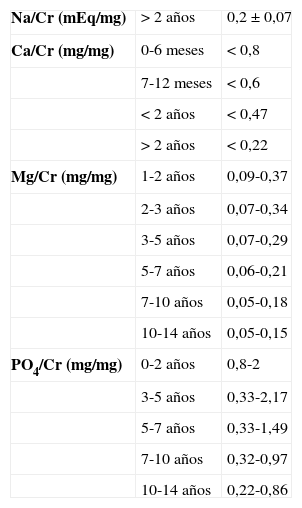
Cifras de cocientes urinarios en pediatría.
| Na/Cr (mEq/mg) | > 2 años | 0,2±0,07 |
| Ca/Cr (mg/mg) | 0-6 meses | < 0,8 |
| 7-12 meses | < 0,6 | |
| < 2 años | < 0,47 | |
| > 2 años | < 0,22 | |
| Mg/Cr (mg/mg) | 1-2 años | 0,09-0,37 |
| 2-3 años | 0,07-0,34 | |
| 3-5 años | 0,07-0,29 | |
| 5-7 años | 0,06-0,21 | |
| 7-10 años | 0,05-0,18 | |
| 10-14 años | 0,05-0,15 | |
| PO4/Cr (mg/mg) | 0-2 años | 0,8-2 |
| 3-5 años | 0,33-2,17 | |
| 5-7 años | 0,33-1,49 | |
| 7-10 años | 0,32-0,97 | |
| 10-14 años | 0,22-0,86 |
La tasa de excreción urinaria de sodio (UNa+) depende de la ingesta diaria. Sus cifras normales en orina de 24h son 3,87 ± 1,3mEq/kg/día (tabla 1). El riñón, a través de varios factores neurohormonales, modifica la UNa+ para mantener la volemia efectiva.
Ante una alteración de la natremia, nos preguntaremos cuál es el estado del volumen de líquido extracelular para un correcto diagnóstico diferencial1:
- 1.
Hiponatremia hipovolémica: se produce en enfermedades con pérdidas gastrointestinales, renales o por piel de Na+. Si las pérdidas son extrarrenales, hay oliguria, los túbulos renales responden con avidez por el Na+ y la UNa+ es < 20mEq/l. Si las pérdidas son renales la UNa+, puede ser muy alta a pesar de la disminución de la volemia.
El síndrome pierde sal acontece en enfermedad neuroquirúrgica. Puede ser debida a secreción inapropiada de la hormona natriurética o del péptido natriurético cerebral. Se produce poliuria, UNa+ > 120mEq/l, ADH alta y balance negativo de sodio2,3.
- 2.
Hiponatremia hipervolémica: se da en pacientes con aumento de los niveles de sodio corporal total y defecto en la excreción de agua, de tal manera que se retiene más agua que sodio (p. ej., insuficiencia renal aguda o crónica, insuficiencia cardiaca y síndrome nefrótico). Hay una distribución inadecuada del volumen extracelular, con predominio intersticial, por lo que el volumen efectivo está disminuido. Se produce retención de agua y UNa+ baja por el hiperaldosteronismo que acompaña la disminución de perfusión renal.
- 3.
Síndrome de secreción inadecuada de hormona antidiurética: aparece, fundamentalmente, en trastornos neurológicos y enfermedades torácicas. Se produce hiponatremia, orina concentrada, volumen extracelular normal o ligeramente aumentado, natriuresis > 60mEq/l y secreción de vasopresina4–6.
Con la UNa+ podemos estimar la volemia del paciente; si es < 20mEq/l, es generalmente indicativa de hipovolemia. En la insuficiencia renal aguda prerrenal, la UNa+ será < 20mEq/l, mientras que en la necrosis tubular aguda la UNa+ es > 40mEq/l, por el daño tubular asociado y la incapacidad para reabsorber Na+7,8.
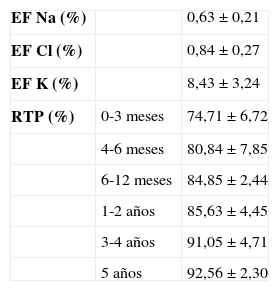
La excreción fraccional de sodio (EF Na) (tabla 2) que mide la fracción de sodio filtrado que es excretado tiene mejor sensibilidad para estudiar la reabsorción tubular (tabla 2). Está indicada para realizar el diagnóstico diferencial de hiponatremia renal o extrarrenal y oliguria por nefropatía funcional o parenquimatosa9:
El valor normal es < 1%. Si es > 1%, indica pérdida renal de sodio. En oliguria, valores inferiores indican origen prerrenal y superiores, insuficiencia renal. En glomerulonefritis y uropatías obstructivas, la EF Na es < 1%10-12.
CloroEl cloro se reabsorbe junto con el sodio, por lo que la tasa de excreción de estos iones es generalmente similar y la medición de la concentración urinaria de cloro (UCl–) añade poca información13,14.
Según la UCl–, clasificamos las alcalosis metabólicas en clorurosensibles (UCl– < 10mmol/l) y clorurorresistentes (UCl– > 20mmol/l).
La clorurosensible es la más frecuente, se relaciona con pérdidas extrarrenales de ácido (gástricas, tiazidas, diuréticos del asa, fibrosis quística con pérdidas aumentadas por piel de cloro) y posthipercapnea. Estos pacientes presentan déficit de Cl– con depleción de volumen e hipopotasemia con disminución en la filtración glomerular y/o aumento en la reabsorción proximal de bicarbonato. Esto produce un hiperaldosteronismo hiperreninémico y estimula la secreción de H+ en el tubo colector. Responde a la administración de NaCl15.
La clorurorresistente se asocia a exceso de mineralocorticoides e hipopotasemia y no responde al tratamiento con NaCl. La UCl– puede ser útil en pacientes con acidosis metabólica con anión gap normal o hiperclorémica16. Esto indica que el bicarbonato disminuyó y fue eficazmente reemplazado por cloro, resultando en hipercloremia (p. ej., en diarrea o pérdida aumentada de HCO3– como en la acidosis tubular de tipo proximal; también en fallo de la acidificación renal como la acidosis tubular distal). El GAP de aniones urinarios (AGu) es un cálculo matemático que nos ofrece un método indirecto de estimar la excreción de amonio urinario, permitiéndonos diferenciar si la acidosis es de origen renal o extrarrenal. En la acidosis de origen renal, el AGu es positivo, pues no aumenta la excreción de amonio a pesar de la acidosis (acidosis tubular distal). En la extrarrenal con acidosis crónica, aumenta la producción tubular y excreción urinaria de cloruro de amonio y el AGu será negativo, pues la UCl es mayor que la UNa17-19:
PotasioLa excreción urinaria de potasio (UK+) varía con la ingesta, una respuesta que está mediada principalmente por la aldosterona y en relación directa con la concentración de K+ en plasma. Sus cifras normales en orina de 24h son 1,73±0,7mEq/kg/día (tabla 1).
La medición de la UK+ puede ayudar en el diagnóstico de la hipopotasemia inexplicable. Un valor < 20mEq/l indica pérdidas extrarrenales (digestivas) o uso de diuréticos. La UK+ > 40mEq/l indica un componente de pérdida renal7.
La medición de la excreción de K+ es menos útil en pacientes con hiperpotasemia. La UK+ será baja en la hiperpotasemia crónica si está asociada a un defecto en la excreción urinaria de K+ (insuficiencia renal o hipoaldosteronismo), ya que la función renal normal eliminaría el exceso de K+ en este contexto.
La interpretación de la excreción fraccional de potasio es complicada porque depende de la carga distal de sodio y de la diuresis. Por eso se mide el gradiente transtubular de potasio (GTTK), que da idea del gradiente de potasio dependiente del flujo urinario y de la aldosterona, y antes del efecto de la ADH. Está indicado para el estudio de hipo o hiperpotasemia (renal, primaria o secundaria a déficit de aldosterona)12,13:
Los valores correspondientes a los percentiles 3 y 97 del GTTK son, en los lactantes, 4,9 y 15,5, y en los niños mayores de 1 año, 4,1 y 10,5. La disminución del GTTK en un niño afectado de hiperpotasemia crónica de origen renal indica la presencia de un estado de hipo o seudohipoaldosteronismo.
CalcioLa excreción urinaria de calcio (UCa2+) no depende tanto de la ingesta, ya que su absorción intestinal es muy variable y su excreción se ve favorecida por la ingesta de sodio. La reabsorción de Ca2+ en el túbulo proximal aumenta en estados de hipocalcemia, depleción de volumen y viceversa. Un 20% del Ca2+ filtrado se reabsorbe en el asa de Henle; así la furosemida disminuye su absorción si no hay depleción de volumen; un 10% se reabsorbe en el túbulo contorneado distal donde las tiazidas y la parathormona aumentan su reabsorción; un 10% se reabsorbe en el túbulo colector y será mayor en estados de depleción de volumen extracelular20,21.
La medición de la UCa2+ es fundamental para detectar hipercalciuria, causa metabólica más frecuente de cálculos renales en la infancia. La UCa2+ en los niños se puede evaluar en orina de 24h, existiendo buena correlación de esta con el cociente calcio/creatinina (mg/mg) en una micción aislada (tabla 3). Se define hipercalciuria con una UCa2+ > 4mg/kg/día y un cociente calcio/creatinina > 0,20. En caso de que se constate la alteración del cociente calcio/creatinina, conviene confirmar el hallazgo en orina de 24h.
MagnesioTiene efecto protector frente a la precipitación de cristales. Su valor normal en orina de 24h es de 2,10±1,1mg/kg/día y un cociente urinario Mg/Cr (mg/mg) de 0,1±0,06 (tabla 3). Puesto que la excreción fraccional de magnesio (EF Mg) puede reflejar la función tubular, la EF Mg se podría utilizar como un marcador para detectar las primeras etapas de la lesión renal crónica22.
FosfatoEn condiciones normales, la excreción urinaria de fosfato (UP–) depende fundamentalmente de la ingesta y de la acción de la parathormona. La UP– normal oscila entre 15-25mg/kg/día. Si las concentraciones de fosfato plasmático están dentro del rango normal, una UP– elevada refleja una dieta rica en fósforo o un hiperparatiroidismo primario o secundario, por ejemplo, a insuficiencia renal crónica donde se mantienen los valores de fosfato circulante normales a expensas de un aumento de la fosfaturia. Una reabsorción tubular proximal de fosfato (RTP) disminuida nos hará sospechar un hiperparatiroidismo (tabla 2):
Los autores declaran no tener ningún conflicto de intereses.