Puntos clave
El uso juicioso de antibióticos se refiere a su prescripción sólo cuando están indicados y que el elegido tenga el espectro más corto necesario para ser efectivo. Un uso apropiado de antibióticos significa la elección no sólo del correcto, sino también en la dosis y duración adecuadas para no promover el desarrollo de resistencias. Es incuestionable que el uso de antibióticos a cualquier edad, esté o no médicamente justificado, contribuye al desarrollo de bacterias resistentes como por ejemplo la colonización nasofaríngea por neumococos resistentes o infecciones urinarias por Escherichia coli resistentes. También hay riesgo de contraer una enfermedad invasiva por microorganismos resistentes con la dificultad consiguiente de su tratamiento1,2. La decisión de prescribir un antibiótico puede afectar desfavorablemente a otros niños y este hecho también faculta a los médicos porque significa que por cada antibiótico no prescrito varios niños están protegidos de potenciales consecuencias.
Elección óptima de un antibióticoEl contacto de los niños con los antibióticos es alto, y se estima que casi el 70% de los lactantes menores de 7 meses de edad han estado expuestos a los antibióticos. Son prescripciones de los médicos que, partícipes del riesgo que supone su utilización excesiva, deben decidir entre un número creciente de posibles opciones antimicrobianas. En general, existe por parte de los facultativos un relativo buen conocimiento de los antibióticos disponibles. Encuestas realizadas a pediatras y médicos generales destacan como criterios preferentes de elección y de mayor a menor importancia: eficacia clínica, efectos secundarios, comodidad posológica, espectro antibacteriano, precio y resistencias3.
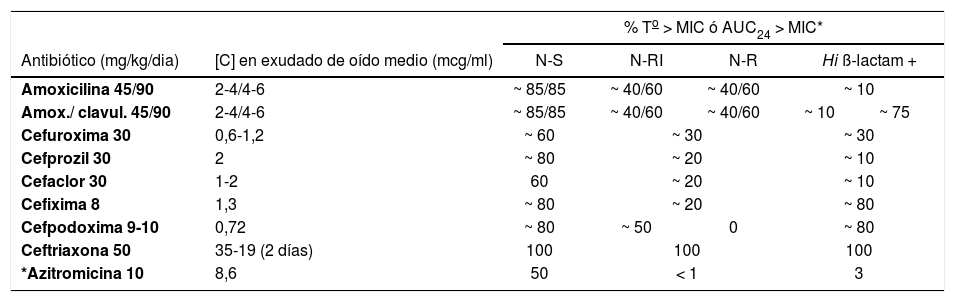
Con antibióticos tan utilizados como los betalactámicos y macrólidos, la consideración de ciertos parámetros farmacocinético-farmacodinámicos (índices terapéuticos) permite optimizar el tratamiento de las infecciones más comunes y proporcionar una base para una dosificación más racional. Existe una relación entre cura bacteriológica y el porcentaje de tiempo (T) en suero o lugar de infección que un betalactámico permanece por encima de la concentración mínima inhibitoria (CIM) para la bacteria causal (T > CIM). Concentraciones del antibiótico que exceden un 40-50% el intervalo de la dosis son curativas, lo cual permite, por ejemplo, que en la faringoamigdalitis estreptocócica y en la otitis media aguda, amoxicilina se pueda administrar cada 12h en lugar de cada 8. El número de dosis diarias atañe directamente al cumplimiento del régimen antibiótico previsto. Otro parámetro farmacocinético-farmacodinámico es la actividad del antibiótico dependiente de la concentración (AUC24/CIM) en la que una relación > 10 predice una buena eficacia4–6 (tabla 1). Para un tratamiento antibiótico más racional, habitualmente empírico, de las infecciones comunes diagnosticadas principalmente en atención primaria, deben tenerse en cuenta ciertos principios básicos:
- —
Identificación por una sintomatología indicativa de origen bacteriano y, si es factible, con el apoyo selectivo de pruebas de diagnóstico rápido u otros recursos.
- —
Consideración de los microorganismos más probables de cada infección con información sobre posibles resistencias.
- —
Toxicidad comparativa de los antibióticos disponibles.
- —
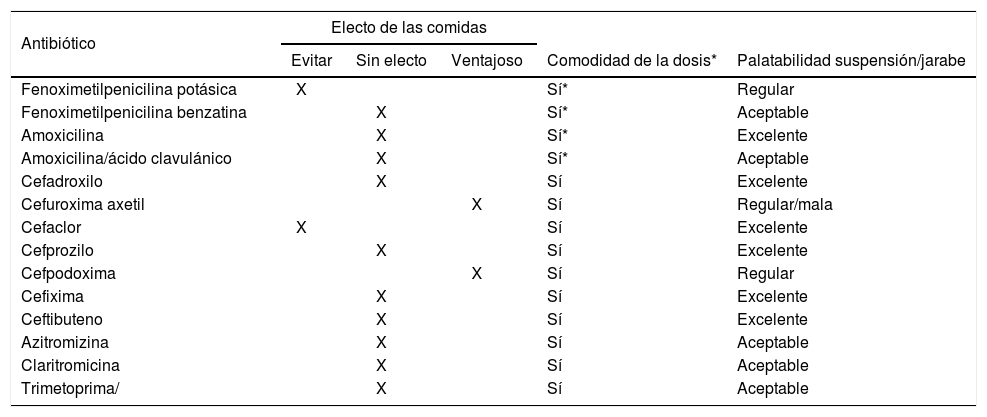
Asegurar el cumplimiento del tratamiento mediante una dosificación conveniente, palatabilidad y una duración idónea7 (tabla 2).
Tabla 2.Antibióticos de uso más frecuente en infecciones comunes: efecto de las comidas, comodidad de las dosis y palatabilidad
Antibiótico Electo de las comidas Comodidad de la dosis* Palatabilidad suspensión/jarabe Evitar Sin electo Ventajoso Fenoximetilpenicilina potásica X Sí* Regular Fenoximetilpenicilina benzatina X Sí* Aceptable Amoxicilina X Sí* Excelente Amoxicilina/ácido clavulánico X Sí* Aceptable Cefadroxilo X Sí Excelente Cefuroxima axetil X Sí Regular/mala Cefaclor X Sí Excelente Cefprozilo X Sí Excelente Cefpodoxima X Sí Regular Cefixima X Sí Excelente Ceftibuteno X Sí Excelente Azitromizina X Sí Aceptable Claritromicina X Sí Aceptable Trimetoprima/ X Sí Aceptable
Parámetros farmacocinéticos/farmacodinámicos (índices terapéuticos) de algunos antibióticos en el tratamiento de la otitis media aguda
| Antibiótico (mg/kg/dia) | [C] en exudado de oído medio (mcg/ml) | % To > MIC ó AUC24 > MIC* | ||||
|---|---|---|---|---|---|---|
| N-S | N-RI | N-R | Hi ß-lactam + | |||
| Amoxicilina 45/90 | 2-4/4-6 | ~ 85/85 | ~ 40/60 | ~ 40/60 | ~ 10 | |
| Amox./ clavul. 45/90 | 2-4/4-6 | ~ 85/85 | ~ 40/60 | ~ 40/60 | ~ 10 | ~ 75 |
| Cefuroxima 30 | 0,6-1,2 | ~ 60 | ~ 30 | ~ 30 | ||
| Cefprozil 30 | 2 | ~ 80 | ~ 20 | ~ 10 | ||
| Cefaclor 30 | 1-2 | 60 | ~ 20 | ~ 10 | ||
| Cefixima 8 | 1,3 | ~ 80 | ~ 20 | ~ 80 | ||
| Cefpodoxima 9-10 | 0,72 | ~ 80 | ~ 50 | 0 | ~ 80 | |
| Ceftriaxona 50 | 35-19 (2 días) | 100 | 100 | 100 | ||
| *Azitromicina 10 | 8,6 | 50 | < 1 | 3 | ||
To > CIM: antibiótico con actividad dependiente del tiempo; óptima si > 40-50%; AUC24/CIM: antibiótico con actividad dependiente de la concentración; óptima si > 10; N-R: neumococo con resistencia alta a la penicilina; N-S: neumococo sensible a la penicilina; Hi ß-lactam +: Haemophilus influenzae productor de betalactamasas.
Números en sombreado: antibióticos con mejores índices terapéuticos.
Lectura rápida
Encuestas a pediatras y médicos de familia destacan los siguientes factores preferentes al elegir un antibiótico: eficacia, efectos secundarios, comodidad posológica, espectro antibacteriano, precio y resistencias.
Conocer ciertos parámetros farmacocinético-farmacodinámicos de los antibióticos más utilizados mejora el tratamiento y justifica una dosificación más racional. Existe una relación entre cura bacteriológica y el porcentaje de tiempo en suero o lugar de infección que el antibiótico permanece por encima de la concentración inhibitoria mínima (CIM) para la bacteria causal. Las concentraciones que exceden el 40-50% del intervalo de la dosis son curativas, lo cual permite, por ejemplo, que en la faringoamigdalitis estreptocócica y en la OMA la amoxicilina se pueda administrar cada 12h.
La exploración clínica sola no permite diferenciar entre una faringoamigdalitis de origen viral y la causada por estreptococo betahemolítico del grupo A (EbhGA) y esta bacteria es la única en la que el tratamiento antibiótico está definitivamente indicado8. La presencia de rinorrea, afonía, tos, conjuntivitis, diarrea y aftas debe disuadir al médico de que la infección sea estreptocócica. Sin estos síntomas virales si un paciente mayor de 3 años presenta fiebre superior a 38°C, inflamación y exudado amigdalar, y adenopatía cervical anterior, la sensibilidad diagnóstica de una faringoamigdalitis por EbhGA es muy alta y usando estos criterios alrededor del 60% de niños serían considerados de bajo riesgo sin necesidad de tratamiento antibiótico9. Las faringoamigdalitis estreptocócicas son muy raras en niños menores de 2 años e insólitas en los menores de 18 meses. La mejor estrategia de actuación es identificar a los pacientes según la información epidemiológica y clínica más precisa y confirmar la infección estreptocócica mediante pruebas antigénicas rápidas y/o cultivo10.
Bacterias causantesPrincipalmente estreptococo betahemolítico del grupo A o Streptococcus pyogenes. Otras bacterias son menos frecuentes y con menor repercusión clínica (tabla 3).
Etiología bacteriana más frecuente de las infecciones comunes, susceptible de tratamiento antibiótico
| Faringoamigdalitis aguda | Estreptococos betahemolíticos del grupo A o Streptococcus pyogenes Otras bacterias con menor interés clínico: Estreptococos betahemolíticos grupos C y G, Arcanobacterium haemoliticum, Mycoplasma pneumoniae |
| Otitis media aguda | Streptocococcus pneumoniae, serotipos más comunes: 19F, 23F, 14, 6B, 9V,19A Haemophilus influenzae no tipificable: 30-50% de cepas producen betalactamasas Menor protagonismo: Moraxella catarrhalis (más de 80% producen betalactamasas) S. pyogenes, aislamiento ocasional |
| Sinusitis aguda | Similar a la otitis media aguda |
| Neumonía | S. pneumoniae a todas las edades Mycoplasma pneumoniae y Chlamydophila pneumoniae, sobre todo en mayores de 5 años y adolescentes |
| Infección urinaria | Escherichia coli en el 70-80% de casos Menos frecuentes: Proteus, Klebsiella, Serratia, Enterobacter y Pseudomonas |
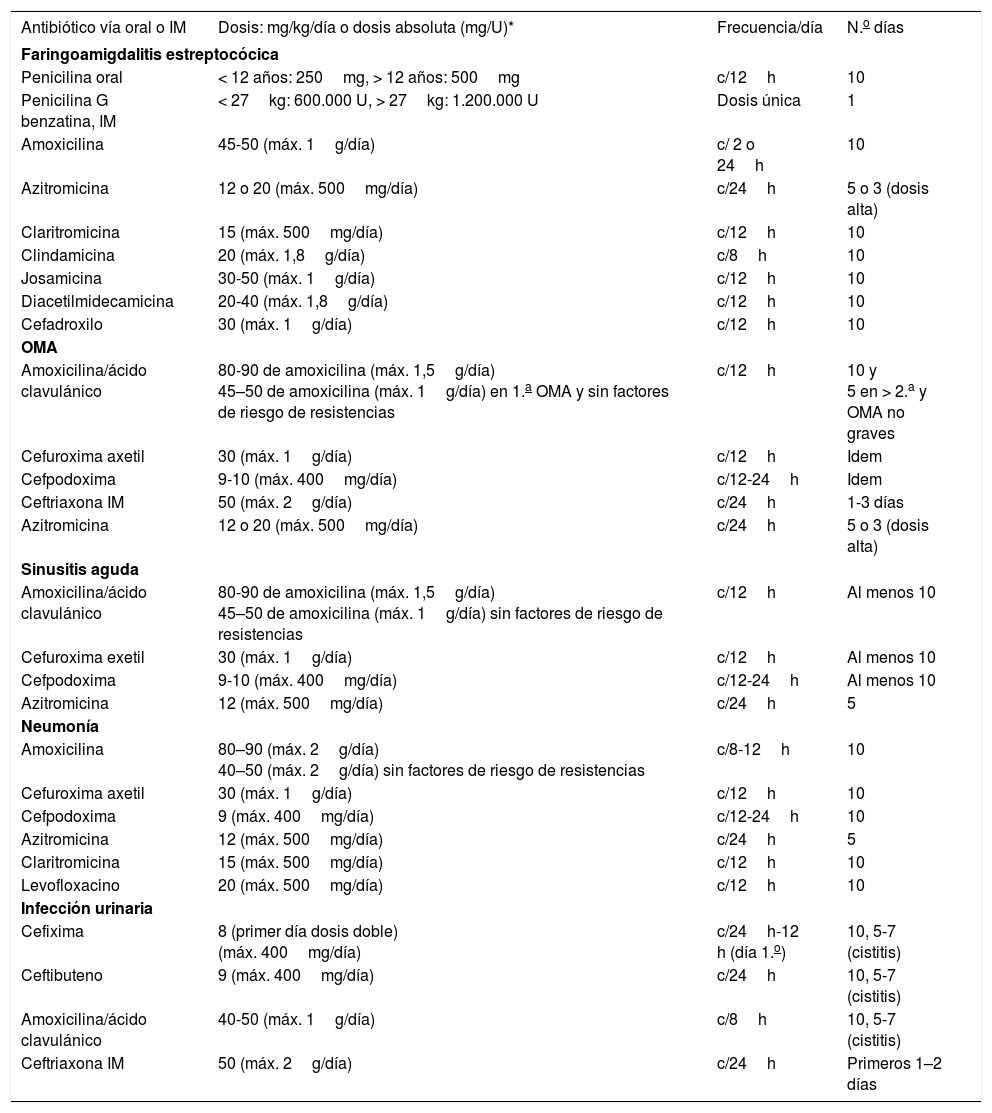
Los antibióticos, la dosificación y duración del tratamiento pueden observarse en la tabla 4.
Antibióticos. Dosificación y duración del tratamiento en las infecciones más comunes
| Antibiótico vía oral o IM | Dosis: mg/kg/día o dosis absoluta (mg/U)* | Frecuencia/día | N.o días |
|---|---|---|---|
| Faringoamigdalitis estreptocócica | |||
| Penicilina oral | < 12 años: 250mg, > 12 años: 500mg | c/12h | 10 |
| Penicilina G benzatina, IM | < 27kg: 600.000 U, > 27kg: 1.200.000 U | Dosis única | 1 |
| Amoxicilina | 45-50 (máx. 1g/día) | c/ 2 o 24h | 10 |
| Azitromicina | 12 o 20 (máx. 500mg/día) | c/24h | 5 o 3 (dosis alta) |
| Claritromicina | 15 (máx. 500mg/día) | c/12h | 10 |
| Clindamicina | 20 (máx. 1,8g/día) | c/8h | 10 |
| Josamicina | 30-50 (máx. 1g/día) | c/12h | 10 |
| Diacetilmidecamicina | 20-40 (máx. 1,8g/día) | c/12h | 10 |
| Cefadroxilo | 30 (máx. 1g/día) | c/12h | 10 |
| OMA | |||
| Amoxicilina/ácido clavulánico | 80-90 de amoxicilina (máx. 1,5g/día) 45–50 de amoxicilina (máx. 1g/día) en 1.a OMA y sin factores de riesgo de resistencias | c/12h | 10 y 5 en > 2.a y OMA no graves |
| Cefuroxima axetil | 30 (máx. 1g/día) | c/12h | Idem |
| Cefpodoxima | 9-10 (máx. 400mg/día) | c/12-24h | Idem |
| Ceftriaxona IM | 50 (máx. 2g/día) | c/24h | 1-3 días |
| Azitromicina | 12 o 20 (máx. 500mg/día) | c/24h | 5 o 3 (dosis alta) |
| Sinusitis aguda | |||
| Amoxicilina/ácido clavulánico | 80-90 de amoxicilina (máx. 1,5g/día) 45–50 de amoxicilina (máx. 1g/día) sin factores de riesgo de resistencias | c/12h | Al menos 10 |
| Cefuroxima exetil | 30 (máx. 1g/día) | c/12h | Al menos 10 |
| Cefpodoxima | 9-10 (máx. 400mg/día) | c/12-24h | Al menos 10 |
| Azitromicina | 12 (máx. 500mg/día) | c/24h | 5 |
| Neumonía | |||
| Amoxicilina | 80–90 (máx. 2g/día) 40–50 (máx. 2g/día) sin factores de riesgo de resistencias | c/8-12h | 10 |
| Cefuroxima axetil | 30 (máx. 1g/día) | c/12h | 10 |
| Cefpodoxima | 9 (máx. 400mg/día) | c/12-24h | 10 |
| Azitromicina | 12 (máx. 500mg/día) | c/24h | 5 |
| Claritromicina | 15 (máx. 500mg/día) | c/12h | 10 |
| Levofloxacino | 20 (máx. 500mg/día) | c/12h | 10 |
| Infección urinaria | |||
| Cefixima | 8 (primer día dosis doble) (máx. 400mg/día) | c/24h-12 h (día 1.o) | 10, 5-7 (cistitis) |
| Ceftibuteno | 9 (máx. 400mg/día) | c/24h | 10, 5-7 (cistitis) |
| Amoxicilina/ácido clavulánico | 40-50 (máx. 1g/día) | c/8h | 10, 5-7 (cistitis) |
| Ceftriaxona IM | 50 (máx. 2g/día) | c/24h | Primeros 1–2 días |
IM: intramuscular; OMA: otitis media aguda.
Es el tratamiento de elección en niños no alérgicos a la misma. El EbhGA es universalmente sensible11,12. Por vía oral, la fenoximetilpenicilina potásica y fenoximetilpenicilina benzatina son igualmente efectivas, aunque la segunda tiene un comportamiento farmacocinético más favorable y mejor sabor. La penicilina G benzatina en inyección intramuscular está indicada si no está asegurado el cumplimiento por vía oral, prevalencia de fiebre reumática y en pacientes de países en desarrollo. Se recomienda inyectar la dosis prevista en un volumen no mayor de 1ml en niños con menos de 27kg y de 2ml en los de más peso o mayores de 6 años. La inyección es dolorosa y actualmente apenas se recomienda. La penicilina asociada a procaína para disminuir el dolor es también efectiva, aunque puede aumentar las reacciones de hipersensibilidad13.
AmoxicilinaTiene un perfil farmacocinético-farmacodinámico favorable que permite una o dos dosis al día durante 10 días y es equiparable a penicilina en eficacia clínica y tasas de fracaso bacteriológico e incluso superior en la prevención de recaídas4,12,14. La presentación en suspensión es preferible en menores de 6 años por su mejor sabor. Amoxicilina-ácido clavulánico no es un antibiótico de primera elección pues EbhGA no produce betalactamasas.
Cefalosporinas por vía oralVarios metaanálisis señalan que consiguen curaciones clínicas y bacteriológicas similares e incluso superiores a la penicilina, motivo por el que se han recomendado como de elección15,16. Pero analizando estos estudios al aplicar mejores criterios de calidad, las diferencias en la erradicación bacteriológica con la penicilina no son superiores al 10%, no tan altas como para justificarlas de primera elección17,18. Se recomiendan en niños alérgicos a la penicilina con reacción retardada. La elegida es cefadroxilo por su espectro antibacteriano más corto por lo que las cefalosporinas de segunda y tercera generación no tienen cabida en el tratamiento12.
Macrólidos y lincosamidasEstán indicados en alérgicos a la penicilina con reacción anafiláctica. Eritromicina ha perdido protagonismo. Azitromicina y claritromicina alcanzan elevadas concentraciones en el tejido amigdalar con un comportamiento muy similar. Se ha propuesto incrementar la dosis de azitromicina (20mg/kg/día, 3 días), pues mejora la erradicación bacteriológica19. Hay posibilidad de resistencias de EbhGA a estos 2 macrólidos si el paciente recibió cualquiera de ellos en los 3 meses anteriores20. En general, la resistencia de EbhGA a los macrólidos guarda relación con el aumento de su uso, siendo la situación reversible tras la disminución de su prescripción. En estos casos el tratamiento se basa en el resultado del cultivo de garganta y antibiograma y si la terapia es empírica es con macrólidos con anillo de 16 átomos como josamicina o diacetilmidecamicina o bien clindamicina.
Lectura rápida
Para un tratamiento empírico más racional, deben considerarse siempre ciertos principios básicos: a) proceso de probable origen bacteriano por sintomatología indicativa y si es factible con el apoyo de pruebas de diagnóstico rápido u otros recursos; b) conocer los microorganismos más probables de cada infección con información sobre posibles resistencias; c) toxicidad comparativa de los antibióticos disponibles, y d) asegurar el cumplimiento mediante una dosificación conveniente, palatabilidad y una duración idónea.
Faringoamigdalitis estreptocócicaEn la faringoamigdalitis estreptocócica, la mejor estrategia es identificar a los pacientes según la sintomatología más precisa, y confirmar la infección mediante pruebas antigénicas rápidas y/o cultivo. El tratamiento de elección, por vía oral, sigue siendo con fenoximetilpenicilina o amoxicilina. Fenoximetilpenicilina benzatina ofrece un comportamiento farmacocinético más favorable y mejor sabor que la potásica. Lo mismo es atribuible para amoxicilina, que permite una dosificación de 2 dosis al día.
La otitis media aguda (OMA) se diagnostica más por lo que se ve con el otoscopio que por lo que se oye al elaborar la historia21. La American Academy of Pediatrics propuso definir la OMA con los siguientes requisitos:
- —
Comienzo agudo.
- —
Presencia de derrame en oído medio por abombamiento y ausencia de movilidad de la membrana timpánica, nivel líquido o burbujas o evidencia de supuración.
- —
Eritema y otalgia que interfieren con la actividad normal y sueño.
Por su influencia en la decisión terapéutica también define la OMA como grave si existe fiebre (> 39°C) y dolor agudo, moderado o importante, referido al oído, que altera el sueño y la actividad normal22. Los conceptos de OMA grave o menos grave, para la toma de decisiones, no parecen de ayuda y no están basados en pruebas. Deben interpretarse con recelo, sobre todo en lactantes en los que la disquisición de otalgia es difícil y cuando el límite de > 39°C es tan decisivo si los niños están recibiendo por ejemplo ibuprofeno. Es importante distinguir entre OMA y una otitis media con exudado (OME) definida por la presencia de derrame en oído medio sin certeza clínica de infección y que se diagnostica con frecuencia como OMA. No hay evidencia de que en la OME los antibióticos influyan en la evolución del proceso.
Lectura rápida
Una buena práctica para reducir el uso de antibióticos es realizar un diagnóstico preciso de la otitis media aguda (OMA), dado el aumento de prescripciones antibióticas en supuestas OMA, sobre todo en lactantes. El tratamiento antibiótico está indicado en niños menores de 2 años con criterios de OMA y mayores de 2 años con OMA bilateral o supurativa.
Amoxicilina-ácido clavulánico es de elección por su mejor perfil farmacocinético-farmacodinámico. Amoxicilina a 80–90mg/ kg/día (c/12h) alcanza una concentración en el oído medio por encima de las CIM deseadas para los neumococos potencialmente resistentes.
Las aisladas con más frecuencia son Streptococcus pneumoniae, Haemophilus influenzae no tipificable (Hi-nt) y Moraxella catarrhalis pero su protagonismo e importancia está cambiando después del impacto de la vacuna neumocócica conjugada. Los serotipos neumocócicos contenidos en la vacuna han desaparecido virtualmente del oído medio (y nasofaringe) de niños vacunados. La colonización cambió a serotipos no vacunales (de momento en menor cuantía aunque alguno como el 19A con especial resistencia antibiótica) y a H. influenzae no tipificable. El protagonismo de M. catarrhalis es menor que los otros otopatógenos e infecciones mixtas por bacterias y virus respiratorios se han demostrado en dos tercios de los aspirados del oído medio de niños con OMA hecho que puede aumentar la inflamación del proceso23–25 (tabla 3).
Tratamiento antibióticoProbablemente, una buena práctica para reducir el uso de antibióticos es realizar un diagnóstico preciso de OMA. Esto es crucial ante la evidencia del aumento de prescripciones de los antibióticos por supuestas OMA, sobre todo en lactantes y la tendencia a la resistencia antibiótica de los microorganismos responsables.
Tratamiento antibiótico condicionado a la evoluciónOpción propuesta que significa retrasar la administración del antibiótico al menos 48h en niños inmunocompetentes, mayores de 6 meses de edad con OMA no grave, ante la idea de que es una infección autolimitada y los antibióticos tienen un beneficio modesto. Seis metaanálisis aprueban esta opción de tratamiento15. Sin embargo, las conclusiones de estos estudios han sido cuestionadas por defectos de diseño como por ejemplo las diferentes definiciones de OMA24,26. Otros estudios que solventan estas dudas al aplicar mejores criterios de calidad concluyen que algunos niños, sobre todo mayores de 2 años con OMA no importante, pueden ser tratados con la opción de tratamiento antibiótico condicionado a la evolución (TACE). El tratamiento antibiótico fue superior con menor número de fracasos y los síntomas se resolvieron más rápidamente en menores de 2 años y sobre todo en casos de OMA bilateral y OMA supurativa27,28.
Tratamiento antibiótico específicoDebe ser individualizado según la edad, gravedad y número de dosis de vacuna neumocócica conjugada recibidas. Con tres o más dosis, las otitis son probablemente debidas a H. influenzae no tipificable productor de betalactamasas más que a neumococos resistentes (tablas 1 y 4).
- —
Amoxicilina-ácido clavulánico. De elección por su mejor perfil farmacocinético-farmacodinámico (tabla 1). Dosis de amoxicilina de 80–90mg/kg/día en 2 administraciones diarias aumentan su concentración en el oído medio por encima de las CIM deseadas para neumococos potencialmente resistentes22,24,29. Dosis de 45mg/kg/día pueden recomendarse en la primera OMA, antes de la estación de virus respiratorios, cuando es muy improbable que se deba a bacterias resistentes y si la infección no es grave30. La dosis del componente ácido clavulánico para evitar la diarrea relacionada no debe ser superior a 10mg/kg/ día. La amoxicilina sin clavulánico erradica el 80% de cepas resistentes de un otopatógeno de menor protagonismo como M. catarrhalis pero tiene una cobertura antibacteriana inadecuada contra H. influenzae no tipificable productor de betalactamasas.
- —
Cefalosporinas. Cefuroxima axetil, cefpodoxima y ceftriaxona. En alérgicos a la penicilina con reacción retardada (no anafiláctica) o en casos de no respuesta a tratamiento con amoxicilina. Ceftriaxona debe reservarse para aquellos casos con vómitos, OMA grave, sin respuesta al tratamiento con amoxicilina-ácido clavulánico y OMA recurrente. Una dosis (50mg/kg) por vía intramuscular consigue concentraciones altas en oído medio durante más de 48h. Después de la primera dosis, si no hay mejoría clínica, se repite la misma dosis uno o 2 días más31.
- —
Macrólidos. Azitromicina tiene mejor actividad in vitro que claritromicina y en dosis más altas (20mg/kg/día, 3 días) aumenta su actividad bactericida32.
- —
Antibióticos no recomendados por su escasa actividad contra alguno o ninguno de los otopatógenos más frecuentes: cefalexina, cefaclor, cefixima, ceftibuteno, eritromicina, clindamicina y trimetoprima-sulfametoxazol (co-trimoxazol).
Se debe diferenciar entre rinosinusitis aguda y sinusitis aguda de origen bacteriano. La rinosinusitis por una infección viral de vías aéreas superiores se resuelve sin tratamiento en 7–10 días. El diagnóstico de sinusitis bacteriana es clínico y se sospecha en niños menores de 6 años con secreción nasal mucopurulenta anterior y/o posterior o tos o ambas, persistentes más de 10 días o que empeoran tras una mejoría inicial. También en casos de comienzo más significativo con fiebre alta (> 39°C), secreción nasal mucopurulenta de más de 3 días y dolor o inflamación facial33,34. El examen radiológico está indicado en niños mayores de 6 años, diagnóstico no claro, síntomas que empeoran o de mayor gravedad o en recurrencias.
Lectura rápida
El tratamiento antibiótico de la sinusitis aguda acelera la recuperación y reduce el riesgo de complicaciones. Existe una similitud entre la patogenia y microbiología de las OMA y la infección de los senos paranasales y amoxicilina-ácido clavulánico (dosis altas de amoxicilina), cefuroxima y cefpodoxima tienen actividad contra las bacterias responsables.
NeumoníaTratamiento antibiótico de la neumonía orientado según la edad, aspectos clínicos, pruebas analíticas e información radiológica. En los niños de 3 meses a 5 años la cobertura contra los neumococos debe realizarse con amoxicilina en dosis altas. Las variaciones en las dosis recomendadas de amoxicilina no han sido bien estudiadas y alguna revisión indica una dosis estándar (40–50mg/kg/día) si no hay datos que sugieran resistencias a neumococo.
Existe una similitud entre la patogenia y microbiología de las OMA y la infección de los senos paranasales. La información disponible de los microorganismos que causan OMA es representativa de los cultivos de senos paranasales (tabla 3).
Tratamiento antibióticoAcelera la recuperación y reduce el riesgo de complicaciones (de órbita e intracraneales). Amoxicilina-ácido clavulánico (con dosis altas de amoxicilina), cefuroxima axetil y cefpodoxima tienen actividad contra las bacterias responsables. Si existe fiebre >39°C o vómitos, una opción es administrar una dosis intramuscular de ceftriaxona (50mg/kg), iniciando el antibiótico oral al día siguiente si ya no hay vómitos. En niños con reacción anafiláctica a la penicilina, el tratamiento es con azitromicina 5 días o claritromicina 10 días (la alternativa de clindamicina no parece razonable pues no es activa contra H. influenzae no tipificable). La duración del tratamiento es al menos de 10 días o bien hasta que el paciente está asintomático, continuando otros 7 días más (tabla 4).
Lectura rápida
Resistencias in vitro de neumococos a los betalactámicos no implica un fracaso del tratamiento de la neumonía dada la buena difusión de amoxicilina en el tejido pulmonar inflamado. En mayores de 5 años y probable origen neumocócico, el tratamiento es como en los menores de 5 años. Si los datos sugieren infección por M. pneumoniae, el tratamiento debe efectuarse con azitromicina 5 días.
Mediante la aportación de los signos y síntomas y la ayuda del examen radiológico. En general un comienzo brusco, fiebre > 38,5°C, aleteo nasal, quejido espiratorio y crepitantes en la auscultación sugieren neumonía neumocócica. Un comienzo más gradual, con fiebre no demasiado alta, tos frecuente y tendencia a broncospasmo puede indicar una infección por Mycoplama pneumoniae, Chlamydophila pneumoniae o viral. Hallazgos radiológicos como infiltrados alveolares, consolidación lobular con o sin broncograma razonablemente sugieren una neumonía bacteriana y opacidades peribronquiales bilaterales y simétricas, hiperinsuflación y atelectasias subsegmentarias son más características de neumonías virales35. Niños menores de 3 años con fiebre > 39°C sin foco, leucocitosis > 20.000/|J, procalcitonina > 1ng/ml y/o proteína C reactiva > 7mg/dl pueden tener una neumonía “oculta”. Está indicado el examen radiológico36.
Bacterias causantesStreptococcus pneumoniae es el principal causante de neumonía adquirida en la comunidad (NAC) a cualquier edad. Debido al impacto de la vacuna neumocócica conjugada la incidencia de NAC por serotipos vacunales disminuyó en > 50% en niños, pero el efecto de la vacuna en neumonías complicadas es menos claro. M. pneumoniae es el protagonista en niños en edad escolar y mayores aunque en algún estudio se señala una media de edad de 5 años. C. pneumoniae también se ha documentado en niños de 5 a 15 años pero la proporción de casos no está clara. Otros microorganismos son menos frecuentes y tienen menor protagonismo en la decisión de tratamiento antibiótico37–39 (tabla 3).
Tratamiento antibióticoMuchos niños sin afectación general pueden tratarse en régimen ambulatorio. Tratamiento empírico según la edad, presentación clínica, pruebas analíticas y hallazgos de la radiografía (tabla 4).
- —
Niños de 3 meses a 5 años cobertura contra neumococos con betalactámicos: amoxicilina en dosis altas cada 8–12 h35,38. Las variaciones en las dosis recomendadas no se han estudiado bien y algunas revisiones recomiendan dosis estándar de 40–50mg/kg/ día si no hay datos que sugieran resistencias a neumococo40,41. Las resistencias in vitro de neumococos a los betalactámicos no implican necesariamente un fracaso de tratamiento de la NAC. La definición de resistencia a la penicilina (aplicable a amoxicilina) en el escenario de neumonía neumocócica ha cambiado a una CIM de > 4μg/ml42. Dada la buena difusión de los betalactámicos por vía oral en el tejido pulmonar inflamado, el concepto de resistencia es diferente que el considerado al tratar meningitis u OMA por la dificultad para erradicar neumococos resistentes de estos lugares infectados. Si no hay otros factores de riesgo, amoxicilina-ácido clavulánico no es un antibiótico de elección en la NAC pues S. pneumoniae no produce betalactamasas.
Cefuroxima axetil y cefpodoxima también son eficaces. Se reservan para niños con alergia no anafiláctica a la penicilina. Si la fiebre es alta y se desea una efecto antibiótico más rápido está justificado administrar una dosis de ceftriaxona intramuscular (50mg/kg) sólo el primer día.
Clindamicina o azitromicina están indicadas en niños con reacción anafiláctica a la penicilina.
- —
En los niños mayores de 5 años y sospecha fundada de neumonía neumocócica el tratamiento es el mismo que en los menores de 5 años. Si la información disponible sugiere infección por M. pneumoniae, tratamiento con azitromicina durante 5 días. En algunas situaciones, cuando los datos se solapan, parece prudente tratar ambas bacterias con un betalactámico y azitromicina pues las complicaciones de no tratar la infección neumocócica tienen más trascendencia que si se omite tratar la infección por M. pneumoniae (el efecto antibiótico es menos claro y las complicaciones son raras)35. Una quinolona, levofloxacino, es una opción en niños mayores cuando hay temor o evidencia de resistencias de neumococo a los macrólidos, pues es efectiva contra neumococo y bacterias atípicas. Aunque los recelos de seguridad de las quinolonas en pautas cortas son actualmente menores, no se recomiendan en el tratamiento empírico inicial43.
Hay una diferente presentación clínica según la edad del niño. Los niños mayores suelen mostrar unos signos y síntomas más típicos de infección de vías o de parénquima renal (pielonefritis) y los niños más pequeños, sobre todo lactantes, expresan una sintomatología más inespecífica. Si bien los síntomas pueden sugerir el diagnóstico, en el momento actual una infección del tracto urinario (ITU) es la causa bacteriana más frecuente de fiebre sin foco en un niño menor de 3 años. La ITU es muy probable si: a) la esterasa leucocitaria y los nitritos son positivos en el examen de la tira reactiva (Multistix) de orina bien recogida; b) detección de bacteriuria por microscopia y tinción de Gram de la orina si están disponibles con prontitud. Estas pruebas permiten tomar ya una decisión terapéutica antes de confirmar la infección mediante el urocultivo15,44.
Lectura rápida
El tratamiento antibiótico debe implantarse sin demora en la infección urinaria, sobre todo en lactantes febriles con riesgo alto de pielonefritis aguda. Por vía oral se demostró que es tan efectivo como por vía parenteral en lactantes mayores de 2–3 meses sin factores de riesgo. La cobertura contra Escherichia coli (considerando la posibilidad de resistencias) con cefixima o ceftibuteno o amoxicilina-ácido clavulánico. Una dosis de ceftriaxona intramuscular los primeros 1–2 días continuando después con el tratamiento vía oral podría evitar el ingreso hospitalario.
Lectura rápida
Restringir el uso de antibióticos debe ser una medida efectiva porque las bacterias resistentes no tienen ninguna ventaja competitiva en ausencia de una exposición antibiótica y porque la colonización con microorganismos resistentes suele ser transitoria.
La enseñanza y discusión con los padres es probablemente el aspecto más importante en la reducción del uso inapropiado de los antibióticos.
Escherichia coli se aísla en el 70-80% de los casos de niños básicamente sanos. Según áreas geográficas, las tasas de resistencias de E. coli a amoxicilina y cotrimoxazol están aumentando45. Otras bacterias menos frecuentes son Proteus, Klebsiella, Serratia, Enterobacter y Pseudomonas más en relación con malformaciones o anomalías del tracto urinario, instrumentación, colocación de catéteres y profilaxis antibiótica de reflujos vesicoureterales (tabla 3).
Tratamiento antibióticoDebe instaurarse sin demora sobre todo en niños lactantes febriles con alta probabilidad de pielonefritis aguda. Tratamientos por vía oral están demostrando ser tan efectivos como por vía parenteral en lactantes mayores de 2–3 meses sin factores de riesgo (sin gravedad, ni anomalías del tracto urinario, ni vómitos)46. Tratamiento antibiótico con cobertura suficiente para E. coli (considerando la posibilidad de resistencias) con cefixima (en una dosis doble el primer día) o ceftibuteno o amoxicilina-ácido clavulánico. Una dosis de ceftriaxona por vía intramuscular los primeros 1–2 días continuando después con el tratamiento por vía oral podría evitar el ingreso hospitalario47. En el momento actual amoxicilina y cotrimoxazol deben obviarse por la frecuencia de aislamientos de E. coli resistentes a estos antibióticos. Una reciente exposición a algún antibiótico (sobre todo amoxicilina) en los 2 meses anteriores de una ITU, se ha asociado a resistencias a amoxicilina-ácido clavulánico, lo cual deber ser tenido en cuenta al elegir el antibiótico2. La nitrofurantoína, aunque se elimina por la orina, no alcanza valores terapéuticos en suero y no es de elección en niños con ITU febril cuando es probable la afectación renal. Los niños alérgicos a la penicilina con reacción retardada pueden ser tratados con las cefalosporinas citadas y en casos de reacción anafiláctica, tratamiento con un aminoglucósido o cotrimoxazol si se dispone de resultados de sensibilidad antibiótica o incluso una quinolona (ciprofloxacino) (tabla 4).
ConclusiónPor motivos no justificados, se prescriben antibióticos en algunos procesos o síntomas en los que no existe una indicación demostrada (tabla 5). Tan importante es reducir el volumen de prescripciones como mejorar la calidad del uso de los antimicrobianos. Un metaanálisis demostró que el tratamiento antibiótico de niños con infecciones respiratorias inespecíficas ni acortó la duración de la infección ni previno la aparición de neumonía bacteriana48. La utilización juiciosa y apropiada de los antibióticos es un gesto de responsabilidad médica para preservar la eficacia de las defensas de la población contra las infecciones bacterianas más frecuentes. Según una reciente investigación realizada en atención primaria, hay evidencia de que los niños y adultos que reciben un antibiótico para tratar una infección respiratoria o urinaria desarrollan resistencia bacteriana a ese antibiótico49. Este efecto puede durar hasta 12 meses. Restringir el uso de antibióticos tiene que ser una medida efectiva porque las bacterias resistentes no tienen ninguna ventaja competitiva en ausencia de una exposición antibiótica y porque la colonización con microorganismos resistentes suele ser transitoria. La enseñanza y discusión con los padres es probablemente el aspecto más importante en la reducción del uso inapropiado de los antibióticos.
Procesos o síntomas susceptibles de tratamiento con antibióticos sin una indicación demostrada
| Catarro común con rinitis “purulenta” |
| Faringoamigdalitis, sobre todo en menores de 2 años |
| Bronquiolitis y bronquitis |
| Fiebre alta sin foco |
| Procesos febriles de más de 48h |
| Temor infundado a sobreinfecciones bacterianas de procesos víricos |
| Otalgia aislada o diagnóstico no seguro de OMA |
| OMA en mayores de 2 años sin otros factores de riesgo |
OMA: otitis media aguda