Dentro de las opciones de tratamiento de la infección de la vía aérea, hay una vía de administración que permite la diseminación directa del fármaco en el foco de infección por medio de los antibióticos en aerosol (AA).
Aunque los antibióticos inhalados se han usado ampliamente, en la bibliografía no hay una gran base científica que apoye su utilización. La mayoría se usan empíricamente con la única prueba, en muchas ocasiones, de algunos casos o de la opinión de un grupo de expertos1. Además, hasta hace poco, la utilización de AA era controvertida debido a la falta de indicación clara al inicio del tratamiento, la no existencia de formulaciones apropiadas, los pocos estudios controlados sobre dosis para el seguimiento, al miedo a crear resistencias bacterianas y la dificultad de administración en pacientes intubados.
Desde que en 1998 la Food and Drug Administration aprobó la administración de la solución de tobramicina para inhalación (TOBI®), se han utilizado otros antibióticos como polimixinas, vancomicina, ticarcilina y gentamicina, fundamentalmente en la fibrosis quística (FQ), pero también en otras enfermedades respiratorias, aunque hay menos experiencia2.
Puntos clave
En la FQ la infección de las vías respiratorias se inicia en edades muy tempranas de la vida y, una vez establecida, es muy difícil si no imposible erradicarla, por lo que se convierte en infección crónica (30-40%). Son pocos los antibióticos eficaces que se pueden dar por vía oral (v.o.) o intravenosa (i.v.) y hay pruebas de que la utilización de AA mejora la función pulmonar, reduce el número de bacterias y disminuye las exacerbaciones de la enfermedad3.
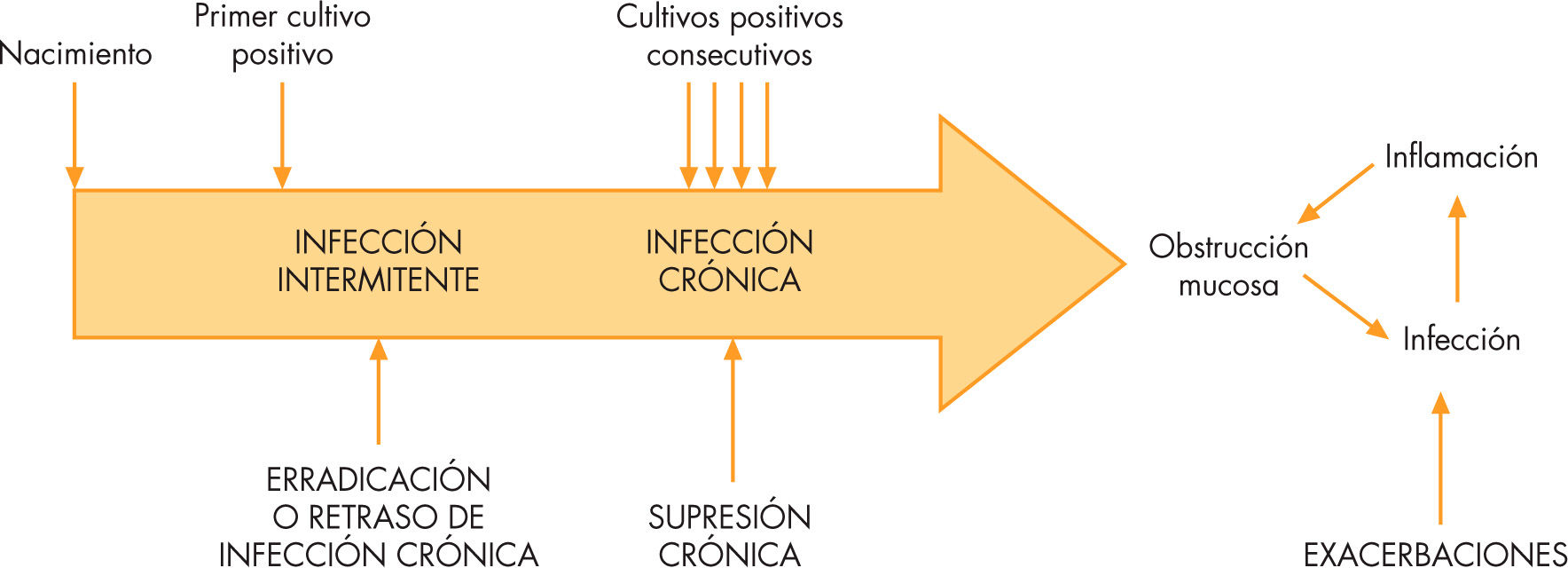
Al nacimiento no hay infección, pero se establece muy pronto por patógenos respiratorios como Staphylococcus aureus, Haemophilus influenzae y Streptococcus pneumoniae, microorganismos que prevalecen en la primera infancia pero pueden continuar durante toda la vida. Le sigue un período de infección intermitente o, más bien, de cultivos positivos intermitentes. En ese momento puede estar ya estableciéndose una infección crónica, aunque con pequeña carga de microorganismos, que no siempre se detectan en los cultivos. Sin embargo, llega el momento en que el crecimiento bacteriano se demuestra en todos los cultivos pasando a llamarse infección crónica (fig. 1)4,5. Una vez establecida la enfermedad, los microorganismos más frecuentemente implicados son: Pseudomonas aeruginosa y Burkholderia cepacia (previamente Pseudomonas cepacia), Stenotrophomonas maltophilia, S. aureus resistente a la meticilina, que se está incrementando en los últimos años, y Mycobacterium no-tuberculosis (M. avium complex, M. abcesus), que producen una enfermedad pulmonar acelerada y una respuesta inflamatoria tan intensa que lesiona las vías aéreas y altera los mecanismos de defensa local, dando lugar al desarrollo progresivo de bronquiectasias e insuficiencia respiratoria. Éstas son las causas principales de la morbimortalidad en el 90% de los casos en la FQ5–8.
Estrategias y objetivos del tratamiento antibiótico en fibrosis quística. Adaptada de Flume5.
Estos microorganismos, una vez establecidos, son muy difíciles de erradicar y se aíslan repetidamente debido a una pobre penetración del antibiótico en el foco de infección, aparición de resistencia espontánea o adquirida, defecto en las defensas de las mucosas en la FQ y producción de biopelículas por las bacterias que interfiere con la muerte por fagocitosis9.
Según la situación en la que se encuentre paciente, se requieren diferentes estrategias (tabla 1):
- –
Tratamiento profiláctico. El tratamiento profiláctico para prevenir la infección por microorganismos respiratorios habituales como S. aureus, H.influenzae y S. pneumoniae no debe recomendarse en la práctica diaria, pues se asocia con la adquisición de P. aeruginosa en un alto porcentaje de pacientes10,11.
- –
Tratamiento colonización inicial. En el primer aislamiento de P. aeruginosa se recomienda el tratamiento precoz e intenso para retrasar la colonización crónica. Si la infección es leve puede utilizarse ciprofloxacino oral durante 3–4 semanas, pero si el paciente no está estable se administrarán betalactámicos con aminoglucósidos i.v. durante 2–3 semanas. Al mes del tratamiento si el cultivo persiste positivo se administrará un segundo ciclo, y si continúa positivo se actuará como ante una infección crónica asociando tratamiento inhalado con tobramicina o colistina12 de forma continua durante 6–12 meses13–15. Hay diferentes estrategias usando tratamiento con ciprofloxacino v.o. o i.v., solo o combinado con tratamiento inhalado de tobramicina o colistina. La duración no está estandarizada y varía de 3–4 semanas a 6–12 meses.
- –
Tratamiento colonización crónica. Intenta mantener la supresión bacteriana y minimizar el daño que produce la continua presencia de los microorganismos. Aunque hay diversas opiniones, el uso de antibióticos inhalados, colistina 1–3 millones de unidades cada 12 h o tobramicina 300 mg/12 h en ciclos de 28 días, muestra una mejoría clara en la función pulmonar y una importante disminución de la densidad de microorganismos en el esputo14.
- –
Tratamiento exacerbaciones agudas. Está estandarizado que cuando los pacientes tienen 2 o más síntomas, como aumento de la tos o de la expectoración con cambio de color, hemoptisis, cansancio, anorexia y/o pérdida de peso, fiebre, cambios en la auscultación pulmonar o aparición de más infiltrados radiográficos, se debe iniciar un tratamiento con antibióticos para reducir el inóculo bacteriano. Los fármacos de elección son penicilinas anti-Pseudomonas (piperazilina, ticarcilina), cefalosporinas (ceftazidima, cefepima), monobactames (aztreonam) o carbapenemes (imipenem, meropenem, pero no ertapenem) en combinación con aminoglucósidos (generalmente tobramicina) durante 2–3 semanas. El tratamiento debe ser i.v. y sólo en infecciones moderadas se administran quinolonas orales con intervalos de, al menos, 3 meses entre los ciclos para reducir la posibilidad de resistencias. Para evitarlas, se aconsejan tratamientos combinados con tobramicina inhalada que alcanza en vías respiratorias concentraciones 100 veces más altas que con administración sistémica. Sin embargo, la utilización en períodos prolongados puede dar lugar a un incremento gradual de la concentración mínima inhibitoria (CMI) > 128 mg/l, que es el punto de corte para la resistencia de tobramicina nebulizada. Las recomendaciones incluyen ciclos de 4 semanas de tratamiento alternando con 4 semanas de no tratamiento14.
Tratamiento de la infección por Pseudomonas aeruginosa
| Primer aislamiento sin signos de colonización | Infección aguda | Mantenimiento crónica colonización/infección |
|---|---|---|
| Ciprofloxacino 15–20 mg/kg/día, 2 v.o., 3–4 semanas dosis ± tobramicina inhalada o colistina inhalada | 2 antibióticos por vía i.v., 14–21 días + tobramicina inhaladaa o colistina inhaladab | Ciprofloxacino 15–20 mg/kg/día, 2 dosis v.o., 3–4 semanas, cada 3–4 meses + tobramicina inhaladaa o colistina inhaladab, 14–28 días |
i.v.: vía intravenosa; v.o.: vía oral.
Cuando hay fallos para erradicar la colonización crónica por P. aeruginosa, deben buscarse alternativas terapéuticas a la administración intermitente de antibióticos por v.o., i.v. y/o inhalada, como es la administración continua de antibióticos para optimizar la farmacodinamia basándose en la sensibilidad del microorganismo obtenido por lavado broncoalveolar16.
Los controles de la infección por P. aeruginosa deben de ser mensuales en la fase de colonización, cada 2–3 meses en la infección establecida y siempre en las exacerbaciones y durante la hospitalización.
Algunos macrólidos, como la azitromicina, pueden mejorar la función pulmonar en pacientes con FQ e infección crónica por P. aeruginosa, debido a sus propiedades antiinflamatorias. Sin embargo, parece que esta mejoría es temporal y se ha demostrado un aumento de resistencia a macrólidos de un número importante de portadores de S. aureus17,18.
RinosinusitisLos antibióticos nebulizados en la rinosinusitis del adulto se usan cada vez con más frecuencia con beneficios superiores a los sprays, pero no hay estudios en niños. Antibióticos como ciprofloxacino y tobramicina se podrían utilizar en las rinosinusitis crónicas del niño19.
Bonquiectasias no-FQSon múltiples las enfermedades que se relacionan con el desarrollo de bronquiectasias. Todas implican una infección, un deficiente drenaje de la vía aérea, obstrucción y/o alteraciones de las defensas del huésped. Clínicamente, se produce tos crónica, aumento de la viscosidad del esputo y dilatación de la vía aérea. La progresión de las bronquiectasias no-FQ es similar a la de las bronquiectasias FQ y, por lo tanto, se pueden manejar con igual tratamiento, aunque la experiencia sea menor. El tratamiento con AA ha demostrado su eficacia al disminuir el número de bacterias en el esputo y el número de hospitalizaciones, pero no está claro que mejore la función pulmonar en las exacerbaciones y el riesgo de broncoespasmo puede ser mayor3,20.
TraqueobronquitisLos niños gravemente enfermos intubados con signos de infección respiratoria, que persiste a pesar del tratamiento con potentes antibióticos, pueden beneficiarse de determinados AA que alcancen altas concentraciones en el pulmón. Se ha demostrado que este tratamiento retrasa la infección crónica por P. aeruginosa, disminuye el uso de antibióticos sistémicos y reduce la resistencia bacteriana y la neumonía asociada a la ventilación asistida21.
Neumonía nosocomialLos AA también podrían ser de utilidad en el tratamiento de la neumonía nosocomial en pacientes no FQ. Sin embargo, un reciente metaanálisis concluye que no hay evidencia suficiente que demuestre su beneficio22.
Neumonía asociada a ventilación mecánicaLa neumonía asociada a ventilación mecánica (NAV) aumenta significativamente la morbimortalidad en las unidades de cuidados intensivos23. Los AA pueden eliminar las bacterias de la vía aérea y mejorar el pronóstico, pero la utilidad de la terapia para uso rutinario está cuestionada. Se necesitan más datos sobre eficacia y seguridad. Los grupos de consenso no lo recomiendan, sobre todo en monoterapia. Hay inquietud acerca del coste, desarrollo de resistencias antibióticas y otros riesgos. Es necesario estandarizar en qué pacientes, a qué dosis y cuánto tiempo de aminoglucósidos o quinolonas son los más adecuados. Es posible que en un futuro, no muy lejano, los AA sean útiles para prevenir la NAV24–26.
Principios generales de la vía de administración inhalatoriaDesde el punto de vista farmacodinámico, los antibióticos se dividen en 2 grandes grupos27:
- –
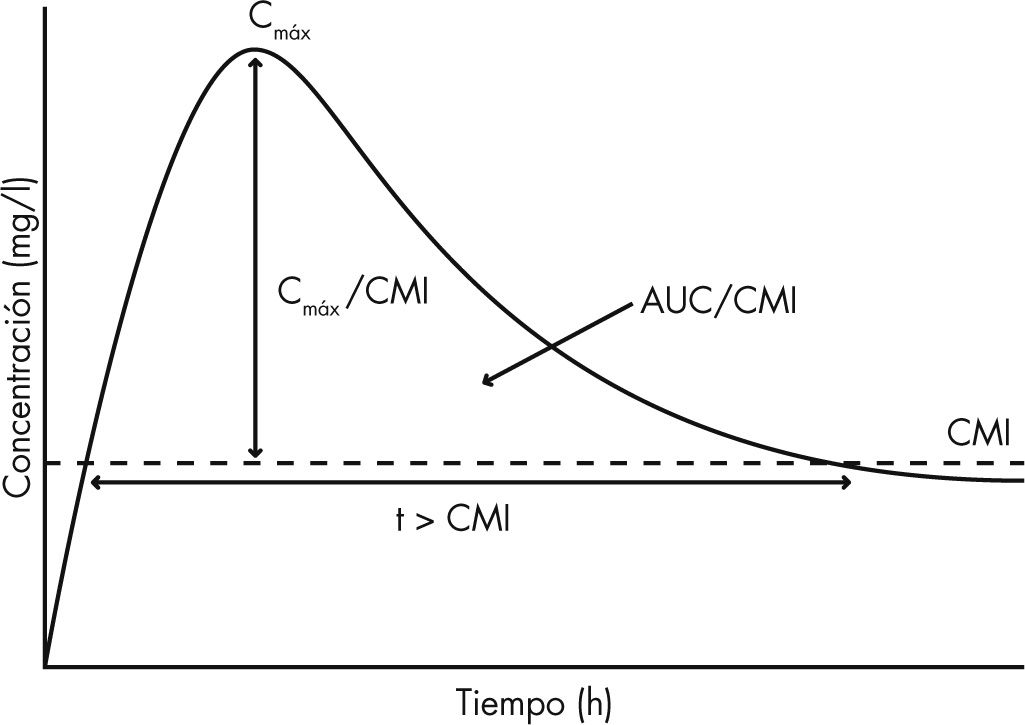
Dependientes de la concentración. Aquellos cuya eficacia depende de que se alcancen concentraciones elevadas en el foco de infección, como aminoglucósidos o fluoroquinolonas.
- –
Dependientes del tiempo. Aquellos que requieren concentraciones menos elevadas pero que precisan mantener valores suficientes, por encima de la CMI del microorganismo infectante, durante la mayor parte del intervalo terapéutico, como los betalactámicos (fig. 2).
Uno de los puntos críticos en la eficacia de un antibiótico es que alcance concentraciones adecuadas en el lugar de la infección. En el tratamiento de las infecciones localizadas en las vías aéreas esto no siempre es posible utilizando las vías de administración sistémicas (v.o., i.v., intramuscular [i.m.]). Además, la administración sistémica implica que también se alcancen concentraciones elevadas en otros órganos y tejidos del organismo, pudiendo dar lugar a efectos secundarios importantes, como la nefrotoxicidad por aminoglucósidos. El método de administración, las propiedades fisicoquímicas (pH y osmolaridad), la dosis usada y las características particulares del paciente pueden afectar a la eficacia y seguridad1,28.
La vía inhalatoria permite la administración de antibióticos en forma de aerosol, de modo que se deposita el fármaco directamente en las vías aéreas. Por esta vía se pueden alcanzar concentraciones muy elevadas en el lugar de la infección (muy superiores a las que se alcanzarían por vía sistémica), permitiendo obtener así la máxima eficacia, especialmente en el caso de antibióticos dependientes de la concentración. Además, como hay una mínima absorción a la sangre, se reduce la posibilidad de aparición de toxicidad sistémica. Sin embargo, también presenta algunos inconvenientes derivados de las dificultades del manejo de los dispositivos de administración y de la elevada variabilidad en la cantidad de fármaco liberado. Por otra parte, puede haber toxicidad local y no está totalmente exenta la posibilidad de absorción sistémica (especialmente cuando se administran grandes cantidades de antibiótico), con el consiguiente riesgo de aparición de efectos adversos5,29–33.
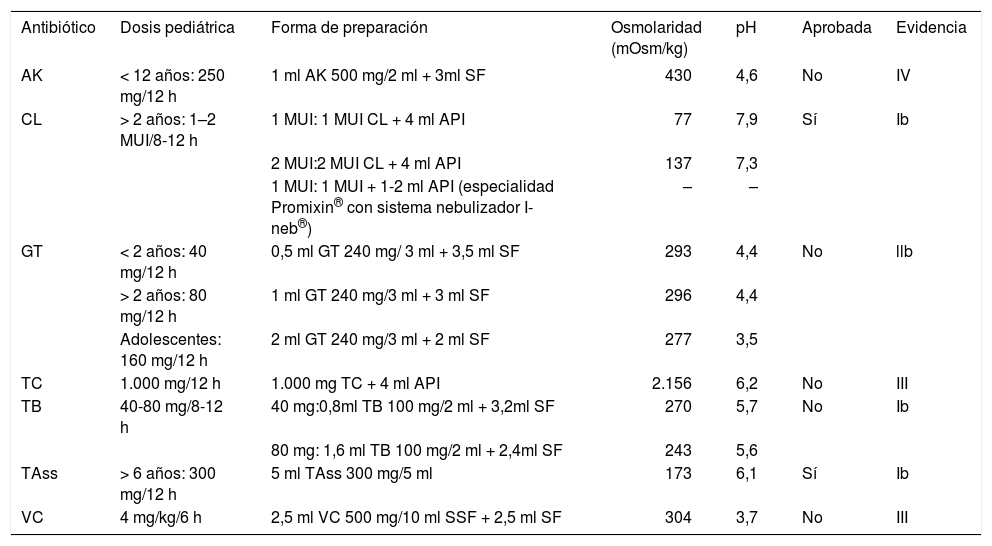
Numerosos antibióticos se han administrado por vía inhalatoria (aminoglucósidos, penicilinas, cefalosporinas, monobactames, polimixinas, quinolonas, vancomicina, etc.), si bien muy pocos de ellos se han ensayado en estudios controlados (tobramicina, colistina, aztreonam)5. Actualmente, sólo 2 antibióticos comercializados en España tienen aprobada su utilización por vía inhalatoria (tobramicina y colistina). Para administrar otros antibióticos por vía inhalada, se diluyen en agua o en solución salina según la estabilidad fisicoquímica del agente antiinfeccioso, pH y osmolaridad. En la tabla 2 se recoge la dosificación y modo de preparación de algunos de los antibióticos utilizados por vía inhalatoria en pediatría. En la tabla 3 se detallan los niveles de evidencia.
Dosificación y preparación de antibióticos por vía inhalatoria en pediatría
| Antibiótico | Dosis pediátrica | Forma de preparación | Osmolaridad (mOsm/kg) | pH | Aprobada | Evidencia |
|---|---|---|---|---|---|---|
| AK | < 12 años: 250 mg/12 h | 1 ml AK 500 mg/2 ml + 3ml SF | 430 | 4,6 | No | IV |
| CL | > 2 años: 1–2 MUI/8-12 h | 1 MUI: 1 MUI CL + 4 ml API | 77 | 7,9 | Sí | Ib |
| 2 MUI:2 MUI CL + 4 ml API | 137 | 7,3 | ||||
| 1 MUI: 1 MUI + 1-2 ml API (especialidad Promixin® con sistema nebulizador I-neb®) | – | – | ||||
| GT | < 2 años: 40 mg/12 h | 0,5 ml GT 240 mg/ 3 ml + 3,5 ml SF | 293 | 4,4 | No | llb |
| > 2 años: 80 mg/12 h | 1 ml GT 240 mg/3 ml + 3 ml SF | 296 | 4,4 | |||
| Adolescentes: 160 mg/12 h | 2 ml GT 240 mg/3 ml + 2 ml SF | 277 | 3,5 | |||
| TC | 1.000 mg/12 h | 1.000 mg TC + 4 ml API | 2.156 | 6,2 | No | III |
| TB | 40-80 mg/8-12 h | 40 mg:0,8ml TB 100 mg/2 ml + 3,2ml SF | 270 | 5,7 | No | Ib |
| 80 mg: 1,6 ml TB 100 mg/2 ml + 2,4ml SF | 243 | 5,6 | ||||
| TAss | > 6 años: 300 mg/12 h | 5 ml TAss 300 mg/5 ml | 173 | 6,1 | Sí | Ib |
| VC | 4 mg/kg/6 h | 2,5 ml VC 500 mg/10 ml SSF + 2,5 ml SF | 304 | 3,7 | No | III |
AK: amikacina; API: agua para inyección; CL: colistina; GT: gentamicina; MUI: millón de unidades internacionales; TAss: tobramicina sin sulfitos; TB: tobramicina; TC: ticarcilina; VC: vancomicina; SSF: solución salina fisiológica.
Tomada de referencia 1.
Escala de la calidad de la evidencia (niveles I a IV)
| Ia | Metaanálisis, estudios aleatorizados o revisiones sistémicas de estudios clínicos aleatorizados sin ninguna limitación metodológica |
| Ib | Metaanálisis, estudios aleatorizados o revisiones sistémicas de estudios clínicos aleatorizados con alguna limitación metodológica |
| IIa | Estudios semiexperimentales, estudios de cohorte, estudios de casos control, sin ninguna limitación metodológica (mirando variaciones y factores de confusión) |
| IIb | Estudios semiexperimentales, estudios de cohorte, estudios de casos control, sin ninguna limitación metodológica (mirando variaciones y factores de confusión) |
| III | Estudio descriptivo (longitudinal o de seguimiento, trasversal, correlación ecológica y otros). Series temporales. Récords y base de database |
| IV | Informes de comités de expertos. Opiniones basadas en la experiencia clínica. Estudios de casos |
Modificada de Clemente Bautista1.
El depósito y distribución del antibiótico en las vías respiratorias inferiores presenta una elevada variabilidad en función de diversos factores dependientes tanto del dispositivo como del paciente.
Factores dependientes del dispositivoSe pueden citar el tamaño de la partícula, la velocidad y las características de la molécula (pH, osmolaridad, propiedades higroscópicas, viscosidad, tensión superficial). Entre ellos, el más determinante es el tamaño de la partícula, de modo que clásicamente se ha considerado que un tamaño entre 5 y 10 μm garantiza el depósito del fármaco en las vías respiratorias altas y en la orofaringe, mientras que para llegar a depositarse en las vías bajas y en los alvéolos el tamaño de la partícula debe estar comprendido entre 1 y 5 μm. En el caso de los niños, diversos estudios apuntan que un tamaño de partícula de 2–3 μm garantiza el mejor resultado, independientemente de la edad y de la gravedad de su enfermedad, si bien este dato debería confirmarse en ensayos controlados. En cuanto al pH y la osmolaridad de la solución que hay que nebulizar, deben ser lo más cercanos a valores fisiológicos (7 ± 0,5 y 300–400 mOsm/kg, respectivamente)29,34. La solución ideal debe tener una osmolaridad entre 150 y 550 mOsm/kg y un pH de 7 ± 0,51.
Factores dependientes del pacienteSe puede destacar el flujo inspiratorio, el volumen corriente o tidal, la frecuencia respiratoria, el tiempo de apnea voluntario, la anatomía de las vías respiratorias altas, la obstrucción de vías bajas, las habilidades físicas y cognitivas, el cumplimiento del tratamiento o la edad. Todos estos factores explican la variabilidad interindividual de la vía inhalatoria que se observa en los estudios clínicos. Esto es especialmente relevante en la población pediátrica ya que se trata de pacientes con vías respiratorias más pequeñas, frecuencias respiratorias más rápidas y volúmenes inhalatorios menores que la población adulta. Además, los niños tienden a respirar por la nariz, que puede actuar como filtro para el aerosol disminuyendo la cantidad de fármaco que llega a los pulmones. Por otra parte, los niños están inquietos e incluso lloran durante la administración del aerosol, lo cual también dificulta la administración34. Algunos pacientes presentan tos durante la inhalación y broncoconstricción durante la nebulización, en estos casos si se usa un broncodilatador se puede reducir la irritación bronquial y el broncoespasmo35.
También es muy importante la interacción entre el paciente y el dispositivo de inhalación, de modo que el paciente o cuidador debe ser capaz no sólo de su correcta utilización sino también de su limpieza y mantenimiento ya que hay evidencia de que los nebulizadores pueden ser una fuente de infección si no se realiza una limpieza adecuada36.
Dispositivos para inhalaciónHay numerosos dispositivos para administrar fármacos por inhalación. Entre ellos, los más utilizados para la administración de antibióticos son los nebulizadores, los cuales transforman los medicamentos líquidos en una niebla y con ellos es posible administrar gran variedad de fármacos a elevadas dosis. Unicamente requieren una mínima coordinación con la respiración del paciente, por lo que pueden utlizarse en enfermos de distinta gravedad. Entre sus inconvenientes se puede citar sus largos tiempos de nebulización (hasta 20 min por dosis), la necesidad de llevar a cabo un mantenimiento cuidadoso (limpieza y desinfección) y que son dispositivos voluminosos, pesados, ruidosos y que requieren una fuente de alimentación29,34.
Hay distintos tipos de nebulizadores (de chorro o jet, ultrasónicos, de membrana) y pueden presentar diferencias importantes en cuanto a tamaño de partícula, capacidad y tiempo de nebulización. Por ello, es importante saber cuál es el dispositivo ideal en cada caso. Recientemente, se han desarrollado nuevos dispositivos (Respimat®, AERx®, AeroNeb Go®, AeroDose®, eFlow®, I-neb®) que mejoran algunos de los inconvenientes de los nebulizadores clásicos34.
También se ha desarrollado una formulación de tobramicina en polvo seco que se puede administrar por un simple inhalador cuya eficiencia puede permitir una significativa disminución de la dosis de fármaco que se debe administrar. Actualmente se está ensayando (fase 3) para pacientes con FQ37.
ConclusionesLa administración de antibióticos por vía inhalatoria permite alcanzar elevadas concentraciones en el foco de infección con una toxicidad sistémica mínima y es de utilidad en patologías como la FQ y otras enfermedades respiratorias. Sin embargo, hay evidencias muy limitadas respecto a su eficacia y seguridad, especialmente en la población pediátrica, relativas a cuáles son los antibióticos más adecuados para administrar por vía inhalatoria, en qué pacientes se deben utilizar, cuándo debe iniciarse el tratamiento, a qué dosis, con qué frecuencia y durante cuánto tiempo. Es necesario desarrollar ensayos clínicos bien diseñados que permitan responder a todas estas cuestiones.
Los autores agradecen al Dr. Miguel Gobernado la revisión crítica del artículo.