Puntos clave
Neisseria meningitidis es una de las 3 principales bacterias capsuladas causantes de infecciones graves, como la meningitis y la sepsis, en todo el mundo, siendo los niños de 1 a 4 años y los adolescentes quienes presentan la mayor incidencia de la enfermedad1. Aunque la frecuencia de la infección meningocócica es baja comparada con otras enfermedades infecciosas en la edad pediátrica, la enfermedad meningocócica invasiva (EMI) se caracteriza por presentar una elevada letalidad (8-14%)2 y una progresión clínica rápida, incluso después de iniciado el tratamiento, si el diagnóstico no ha sido precoz. Además, alrededor del 11-19% de los supervivientes pueden sufrir secuelas permanentes importantes, como sordera, amputaciones, discapacidades neurológicas o intelectuales3.
La EMI sigue siendo un problema de alta prioridad en salud pública. La vacunación frente a los serogrupos de N. meningitidis más prevalentes constituye la estrategia más racional para prevenir la enfermedad meningocócica. A diferencia de las vacunas antimeningocócicas de polisacáridos capsulares planas, las nuevas vacunas de polisacáridos conjugados confieren protección desde la infancia, por su capacidad de estimular una respuesta inmune mediada por células T e inducir altas concentraciones de anticuerpos bactericidas circulantes4. La participación de las células colaboradoras en la respuesta inmune proporciona inmunidad a largo plazo, debido a la producción de células B de memoria5.
El éxito de los programas de vacunación antimeningocócica frente al serogrupo C en el Reino Unido y en España, países pioneros en la vacunación sistemática infantil frente a esta enfermedad, con una reducción espectacular de la incidencia de EMI por este serogrupo, demuestra que las vacunas antimeningocócicas conjugadas son capaces de controlar la enfermedad a nivel poblacional6–8. Actualmente se dispone de 2 vacunas conjugadas tetravalentes frente a meningococo. La vacuna ACWY-D (MenACWY-D; Menactra®, Sanofi Pasteur, Swiftwater, Pensilvania, EE.UU.) fue la primera en ser autorizada en EE.UU. en 2005, para la vacunación sistemática de los niños de 11 y 12 años, y de las personas de 11 a 55 años con riesgo elevado de EMI9; en el año 2007 se extendió la vacunación sistemática a todos los adolescentes de 11 a 18 años, y la de las personas de alto riesgo de entre 2 y 55 años10. En Canadá se aprobó su uso en el año 2006 para las personas de 2 a 55 años con alto riesgo de EMI11. La vacuna ACWY-CMR197 (Menveo™, Novartis Vaccines, Siena, Italia), es la segunda vacuna conjugada tetravalente autorizada en Norteamérica12 y la primera en Europa13, con autorización en España desde marzo de 2010.
Es de esperar que las nuevas vacunas antimeningocócicas conjugadas tetravalentes permitan un mejor control de la enfermedad en aquellas zonas con circulación de diversos serogrupos. No obstante, la protección total se alcanzará cuando se disponga además de vacunas eficaces frente a N. meningitidis serogrupo B.
En este trabajo se hace una revisión de la epidemiología actual de la enfermedad meningocócica en el mundo y de las características de la nueva vacuna MenACYW-CMR197 (Menveo™).
Epidemiología de la enfermedad meningocócica en el mundoAgente causal y patogeniaNeisseria meningitidis es un diplococo gramnegativo aerobio que contiene una cápsula de polisacáridos formada por unidades repetitivas de sacáridos que definen el serogrupo del microorganismo. Se conocen 13 serogrupos, pero la mayoría de los casos se deben a los serogrupos A, B, C, W135 e Y1. Los serogrupos B y C son los que se asocian más frecuentemente con enfermedad endémica, mientras que el A suele ser responsable de brotes epidémicos. Las infecciones por los serogrupos Y y W135 son menos frecuentes (10-20% de casos). Recientemente el serogrupo X ha emergido como causa de EMI en África14.
La enfermedad se caracteriza por fiebre alta de aparición brusca, cefalea intensa, náuseas y vómitos, rigidez de nuca y un exantema petequial, precedido a veces de uno maculopapuloso. Su mortalidad es elevada, superior al 50% en los países con pocos recursos sanitarios, y entre el 5 y el 15% en los países desarrollados1,2. Tiene una distribución bimodal en relación con la edad, con una incidencia máxima en niños menores de 5 años, especialmente los menores de un año, y un segundo pico en la adolescencia15.
Entre el 5 y el 10% de la población es portador asintomático del microorganismo16, lo que favorece su transmisión. La epidemiología de la colonización por los diferentes serogrupos es importante en la prevención de la enfermedad invasiva, ya que las vacunas conjugadas actúan sobre el estado de portador, permitiendo así la interrupción de la transmisión y la subsiguiente adquisición de inmunidad de grupo5. La tasa de portadores varía entre regiones geográficas y entre grupos de edad. En Europa, la cifra aumenta con la edad hasta alcanzar el 25% en adolescentes de 15 a 19 años y el 32% en las personas de 25 años17, siendo el serogrupo B el más frecuente (30-40%), seguido de cepas no serogrupables (11-40%), serogrupo Y (10-15%), serogrupo C (5-7%) y serogrupo W-135 (3-4%)17,18. La duración del estado de portador puede ser crónica, transitoria o intermitente, y depende de las características de la bacteria y del huésped. Es más frecuente en personas que residen en colectivos cerrados (militares, residencias de estudiantes) y en los que participan en encuentros multitudinarios, como la peregrinación anual a La Meca, en Arabia Saudí19.
La transmisión se produce de persona a persona por vía respiratoria, a través de las gotas y aerosoles que producen los enfermos al toser o estornudar. El período de incubación oscila entre 1 y 10 días, generalmente de 3 a 4, y el riesgo de transmisión persiste mientras el microorganismo está presente en la nasofaringe. A las 24h de iniciado el tratamiento antibiótico, ya no existe riesgo de contagio, ya que desaparece el estado de portador.
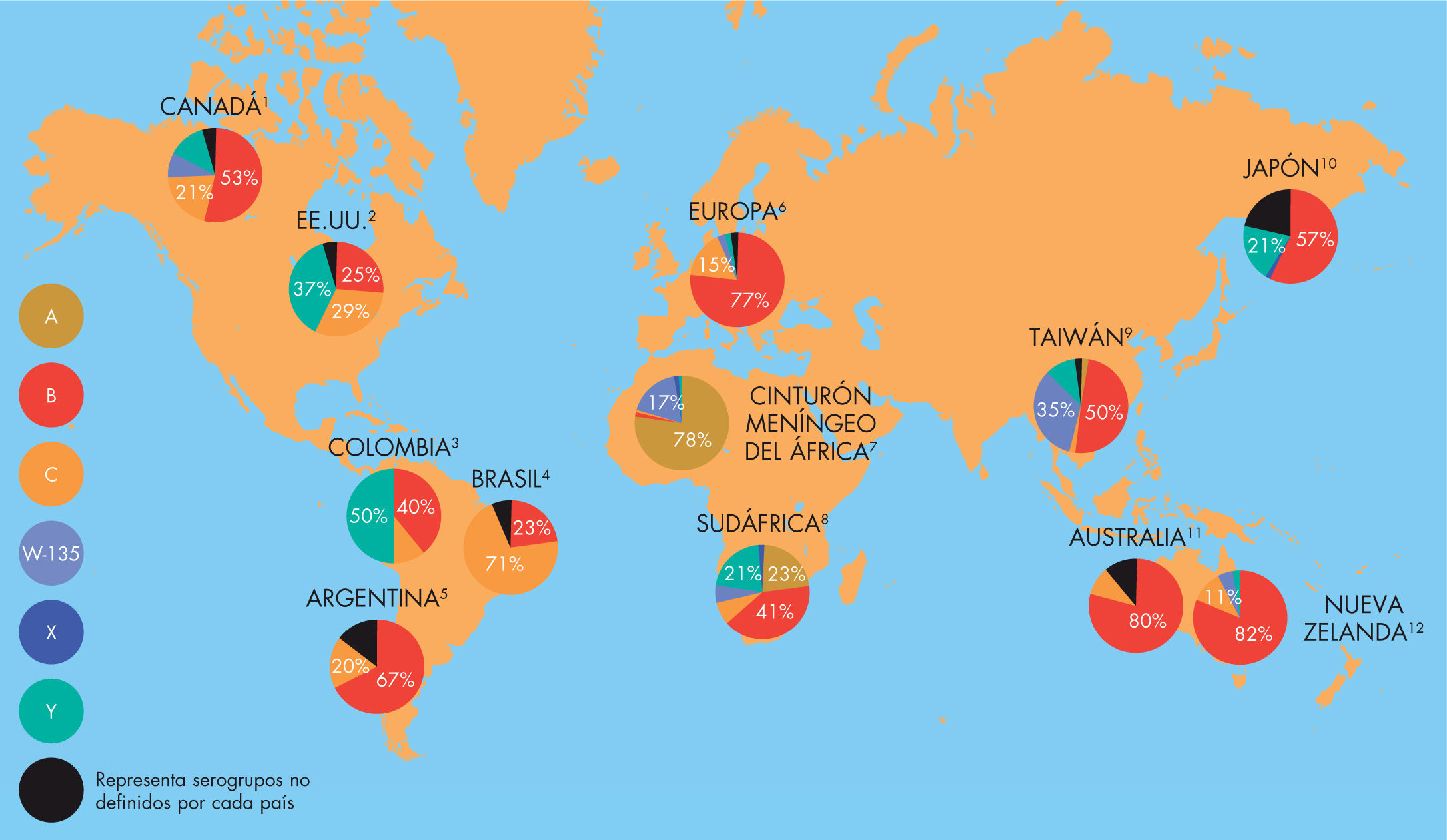
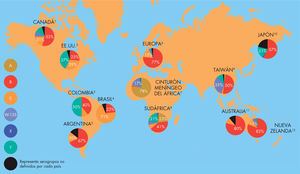
Distribución geográficaLa enfermedad meningocócica es una enfermedad de distribución mundial (fig. 1). Según datos de la Organización Mundial de la Salud (OMS), cada año se producen alrededor de 1,2 millones de casos y cerca de 135.000 muertes20. Su incidencia en algunos países en vías de desarrollo puede llegar hasta 100-500 casos por 100.000 habitantes y es muy variable según las áreas geográficas. En EE.UU., las tasas son de 0,35 casos por 100.000 y en Europa, de 1,01 por 100.0001. Se consideran países de baja endemicidad aquellos con tasas de incidencia inferiores a 3 por 100.000 habitantes.
Distribución mundial de serogrupos causantes de enfermedad meningocócica invasiva.
1) Public Health Agency of Canada. Canada Communicable Disease Report (CCDR). June 2007;33:1-15; 2) CDC. Active Bacterial Core Surveillance Report, Emerging Infections Program Network, Neisseria meningitidis, 2007; 3) Ines Agudelo et al. Emerg Infect Dis. 2008;14:990-1; 4) Ciccone et al. BEPA. 2006;3:7-12; 5) Chiavetta et al. Revista Argentina de Microbiologia. 2007;39:21-27; 6) EU-IBIS Network. Serogroup analysis: 2006.www.euibis.org; 7) Nicolas et al. J Clin Microbiol. 2005;43:5129-5135; 8) Coulson et al; Group for Enteric, Respiratory and Meningeal Disease Surveillance in South Africa. Emerg Infect Dis. 2007;13:273-81; 9) Chiou et al. BMC Infect Dis. 2006;6:25; 10) Takahashi et al. J Med Microbiol. 2004;53:657-62; 11) Australian Meningococcal Surveillance Programme. CDI. 2007;31:185-93; 12) Martin et al. Wellington, New Zealand: Ministry of Health; 2007.
La infección es endémica en regiones cálidas, dando lugar tanto a casos esporádicos como a brotes, con un incremento durante los meses de invierno y primavera. En África, en la zona conocida como cinturón de la meningitis, es donde se registran la mayoría de las epidemias, con ciclos que en el pasado se producían cada 8-12 años, y que, desde el inicio de los años 1980, se han acortado y tienen un patrón más irregular, con ciclos de 2 a 3 años1. El cinturón de la meningitis se sitúa en África subsahariana y comprende los países que están en la franja que va desde Senegal y Guinea-Bissau hasta Sudán y Etiopía21. Las epidemias más recientes tuvieron lugar a mediados de 1990, con 350.000 casos y miles de muertes. Los países más afectados han sido Nigeria, Burkina Faso, Malí y Níger. En 2007, el país más afectado fue Burkina Faso, con más de 22.000 casos asociados al serogrupo A y 1.490 muertes en los primeros 4 meses del año22.
La distribución geográfica de los distintos serogrupos difiere entre sí. El serogrupo A predomina en África Central (desde Gambia hasta Etiopía), en Oriente Medio y en el sur de Asia1. El serogrupo B es el más frecuente en Europa, Norteamérica y Australia, causando entre el 30 y 40% de los casos en EE.UU. y Canadá1,11 y hasta el 80% de casos en algunos países de Europa15. El serogrupo C es más prevalente en América del Sur, aunque en los 90 experimentó un notable incremento en Europa (especialmente en Reino Unido y España), lo que justificó la introducción de la vacuna antimeningocócica C conjugada en el calendario de inmunizaciones sistemáticas de varios países6–8. En los últimos 20 años, el serogrupo Y ha emergido como una causa importante de EMI en EE.UU., con un incremento desde sólo un 2% del total de casos en el período 1989-1991 a un 34% en 200723. El serogrupo W-135 es la causa predominante de EMI endémica en Sudáfrica24, y uno de los serogrupos predominantes en África, asociado a epidemias en Burkina Faso, Arabia Saudí y China1. Este serogrupo se ha diseminado desde África a otros continentes; representa sólo el 4% de casos esporádicos de EMI en EE.UU.23, pero en Reino Unido y Francia se ha convertido desde el 2002 en el tercero más frecuente, después del B y el C15. Además, el clon causante de estos casos se relaciona genéticamente con un clon virulento de N. meningitidis serogrupo C, lo que sugiere un posible switching capsular que dota de mayor virulencia al serogrupo W-1351. En los últimos años, el serogrupo X, que era muy poco frecuente, ha sido la causa del 51% de los casos de meningitis meningocócica en Niger14 y ha provocado brotes en Kenia y Uganda.
Los viajeros internacionales pueden adquirir y contribuir a la diseminación de determinados clones de N. meningitidis. Aunque la incidencia de EMI en viajeros es muy baja, la detección del serogrupo W-135 en peregrinos que han viajado a La Meca indica el posible riesgo de colonización por este serogrupo y su posterior difusión a otros lugares del mundo19.
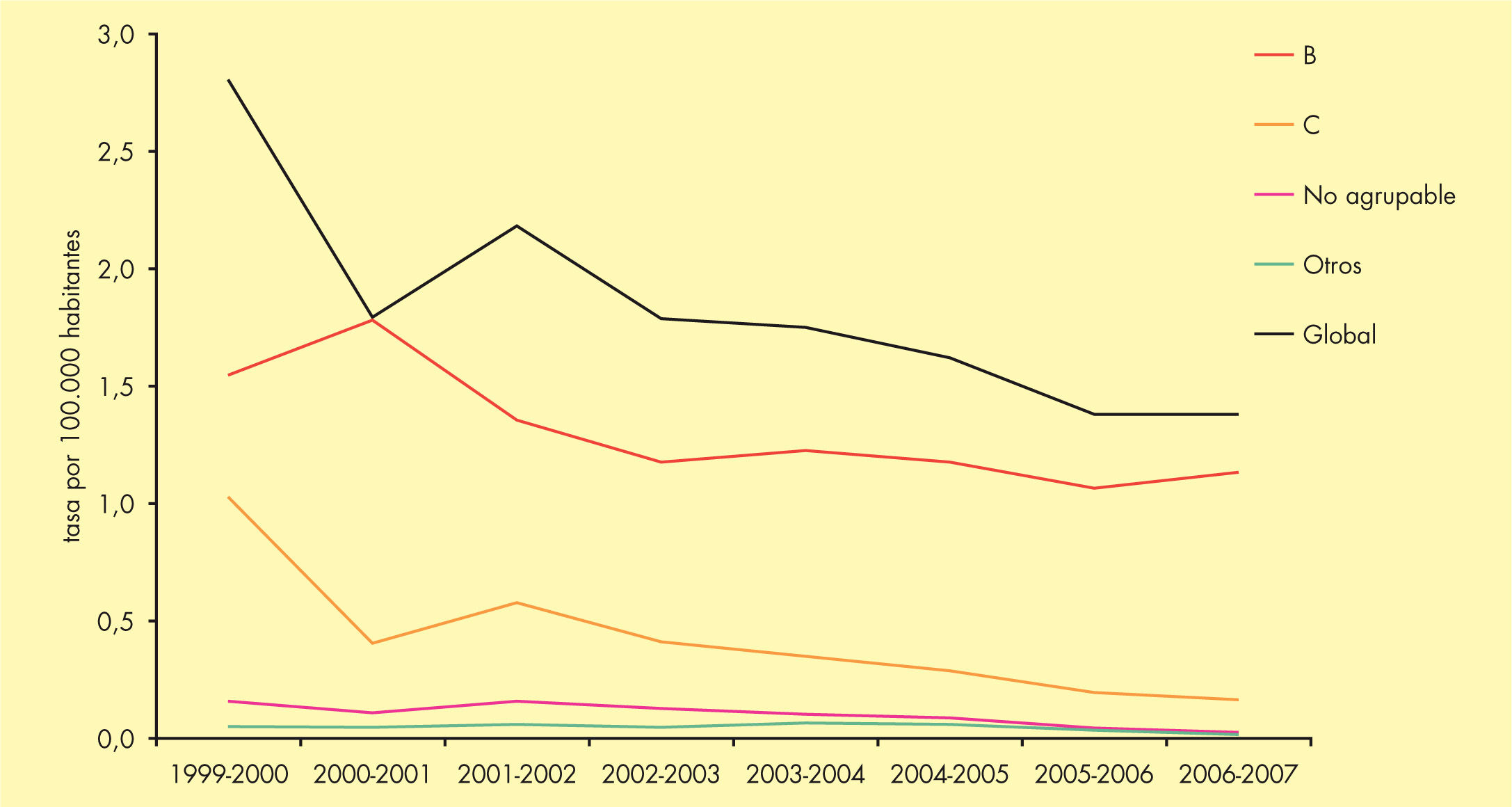
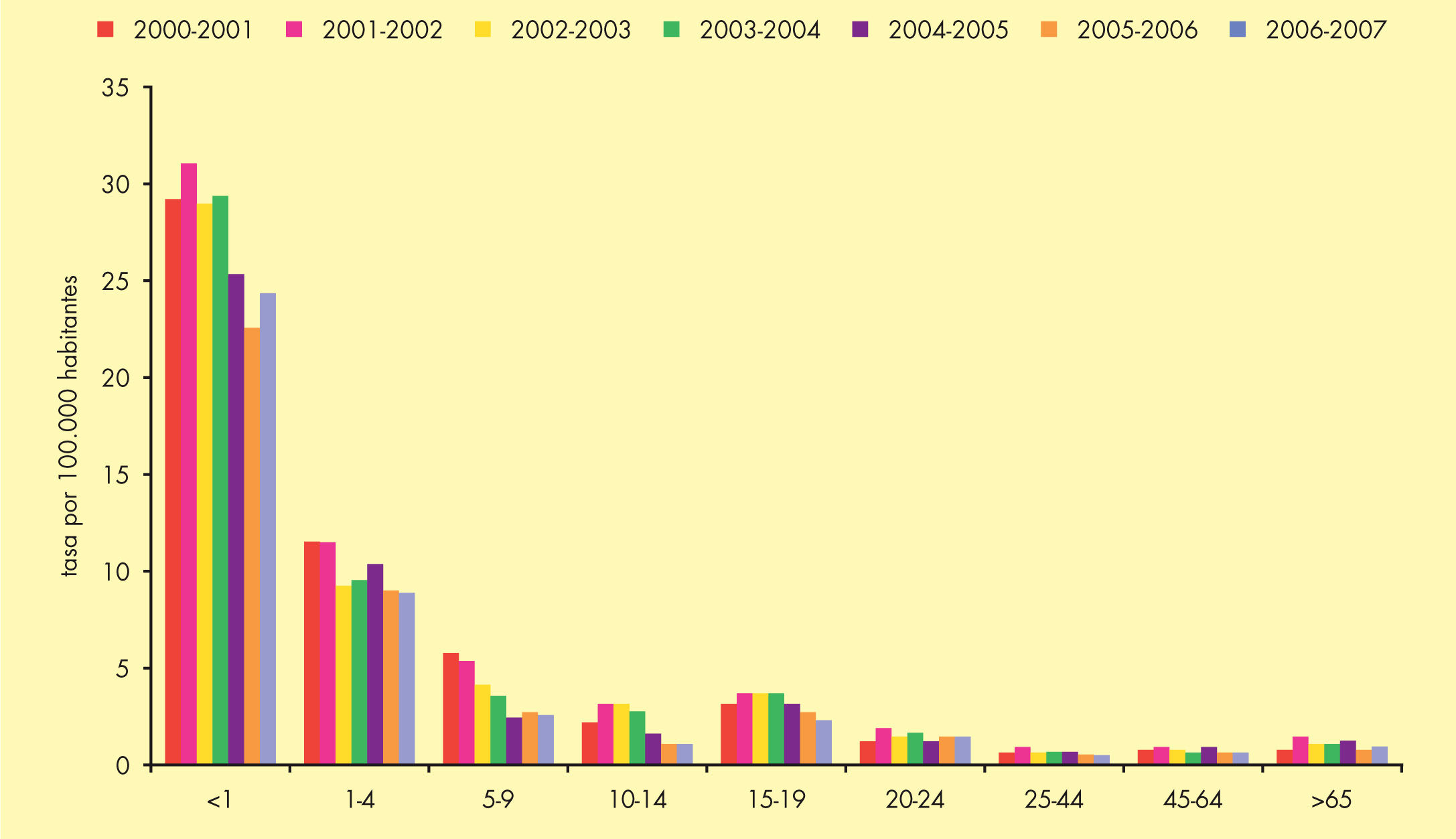
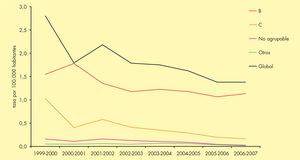
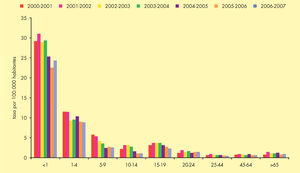
Incidencia en EspañaLa incidencia de EMI en España ha presentado una tendencia decreciente durante el período 1999-2007. La tasa declarada en 2006-2007ha sido de 1,37 casos por 100.000 habitantes6. Este descenso se debe principalmente a la disminución mantenida de los casos producidos por el serogrupo C desde la introducción de la vacunación sistemática en el año 2000. Actualmente el serogrupo B es el predominante, y representa casi el 80% del total de casos (fig. 2). El mayor número de casos se produce en niños menores de un año, seguido de los de 1 a 4 años (fig. 3).
Evolución de los serogrupos causantes de enfermedad meningocócica invasiva en España (1999-2007). Adaptada de Cano et al6.
Enfermedad meningocócica invasiva en España. Casos confirmados y tasas por 100.000 habitantes, por grupos de edad. Temporadas 2000-2007. Adaptada de Cano et al6.
Actualmente se dispone de dos vacunas conjugadas tetravalentes frente a meningococo: la vacuna tetravalente ACWY-D (MenACWY-D; Menactra®, Sanofi Pasteur, Swiftwater, Pensilvania, EE.UU.), sólo autorizada en EE.UU. y Canadá9,10, y la vacuna ACWY-CMR197 (Menveo™, Novartis Vaccines, Siena, Italia), que es la única disponible en Europa (tabla 1). En esta revisión sólo se describirán las características de la vacuna ACWY-CRM197, por ser el preparado disponible en nuestro país.
Características de las vacunas MenACWY-D (Menactra®) y MenACWY-CRM (Menveo™)
| Característica | MenACWY-D | MenACWY-CRM197 |
|---|---|---|
| Lugar de autorización | EE.UU. y Canadá | Europa y EE.UU. |
| Fecha de autorización | 2005 y 2006 | 2010 |
| Proteína transportadora | Toxoide de difteria | Toxoide de difteria mutado |
| Vía de administración | IM | IM |
| Pauta vacunal (dosis) | Una | Una |
| Indicaciones | EE.UU. | EE.UU. |
| 11-18 años | 11-18 años | |
| 2-55 años en riesgo | 2-55 años en riesgo | |
| Canadá | Europa | |
| 2-55 años en riesgo | Adolescentes a partir de 11 años y adultos | |
| Uso en niños < 2 años | No autorizado | No autorizado |
La vacuna contiene 10μg de oligosacáridos capsulares de meningococo serogrupo A y 5μg de los serogrupos C, Y y W-135. Cada uno de los oligosacáridos está unido de forma covalente a una mutante atóxica de la toxina diftérica (CMR197).
Los ensayos clínicos precomercialización de la vacuna se han realizado utilizando 2 formulaciones distintas, una adyuvada con fosfato de aluminio (MenACWY-CMR+) y otra sin adyuvante (MenACWY-CMR). Se seleccionó la vacuna no adyuvada para su autorización y posterior comercialización, ya que la adición del adyuvante no se asoció a una mayor inmunogenicidad.
InmunogenicidadLa eficacia clínica de las vacunas antimeningocócicas disponibles puede estimarse a través de la cuantificación de las concentraciones de anticuerpos bactericidas inducidos por la vacuna, que es un buen parámetro subrogado de protección25. La medición del título de anticuerpos posvacunación se realiza mediante la técnica de ensayo bactericida del suero dependiente de complemento (siglas en inglés: hSBA). Se realiza incubando progresivas diluciones de suero humano con colonias de N. meningitidis y la adición de complemento humano. Los niveles de SBA se expresan con el recíproco de las diluciones séricas que consiguen eliminar al menos el 50% de los meningococos. Diferentes comités de expertos, así como las agencias reguladoras del medicamento, han adoptado como correlator de protección un título de hSBA ≥ 1:4. La hSBA se considera el método estándar requerido por las agencias reguladoras del medicamento para medir la inmunogenicidad de estas vacunas.
A continuación se muestran los resultados de los ensayos clínicos precomercialización realizados con esta vacuna en personas de diferentes grupos de edad.
Lactantes (0-12 meses). Se han realizado ensayos clínicos con una pauta de administración acelerada (2, 3 y 4 meses) y con la estándar (2, 4 y 6 meses), que han mostrado una excelente respuesta, con inducción de anticuerpos protectores (hSBA ≥ 1:4) frente a los 4 serogrupos en el 81-99% de los vacunados. La administración de 2 dosis, a los 2 y 4 meses, también induce una respuesta inmune elevada, con títulos de hSBA ≥ 1:4 frente a los serogrupos C, Y y W-135 en el 82-95% de los lactantes vacunados26, aunque sólo el 50-57% alcanzaron protección frente al serogrupo A27. Sin embargo, la administración de una dosis de refuerzo a los 12 meses produce un incremento del porcentaje de niños protegidos frente a todos los serogrupos de hasta el 79 y 100%27. La respuesta inmune frente al serogrupo A ha sido similar con ambas formulaciones de la vacuna. El retraso de la administración de la primera dosis a los 6 meses de vida, seguida de una segunda dosis al año de edad, produce una respuesta inmune comparable a la observada con la vacunación más temprana, con títulos de hSBA ≥ 1:4 para el serogrupo A en el 86% de los vacunados y en el 100% para los otros serogrupos incluidos en la vacuna28. Aún no se dispone de datos publicados sobre la inmunogenicidad de una única dosis, administrada a los 12 meses.
Niños de 1 a 2 años. Los ensayos clínicos realizados hasta estos momentos indican que se necesitan 2 dosis durante el segundo año de vida para conseguir una protección adecuada frente a todos los serogrupos incluidos en la vacuna29. Entre el 49 y el 96% de los vacunados adquieren concentraciones de hSBA ≥ 1:4 con una sola dosis, y el 91-96% después de la segunda dosis. Aunque una única dosis es capaz de inducir memoria inmunitaria, con producción de títulos de anticuerpos protectores en el 100% de los vacunados tras una dosis booster 8 meses después con vacuna tetravalente no conjugada, los datos indican que son necesarias 2 dosis de vacuna conjugada, ya que la protección frente a formas invasivas depende más de la persistencia de anticuerpos bactericidas que de la memoria inmune30.
- —
Niños de 2 a 10 años. Una sola dosis induce la producción de títulos de anticuerpos seroprotectores (hSBA ≥ 1:4) en el 82-95% de los niños vacunados un mes después de la vacunación31.
- —
Adolescentes (11-18 años). La administración de una única dosis induce títulos protectores de anticuerpos en el 75-96% de vacunados de este grupo de edad para todos los serogrupos32,33.
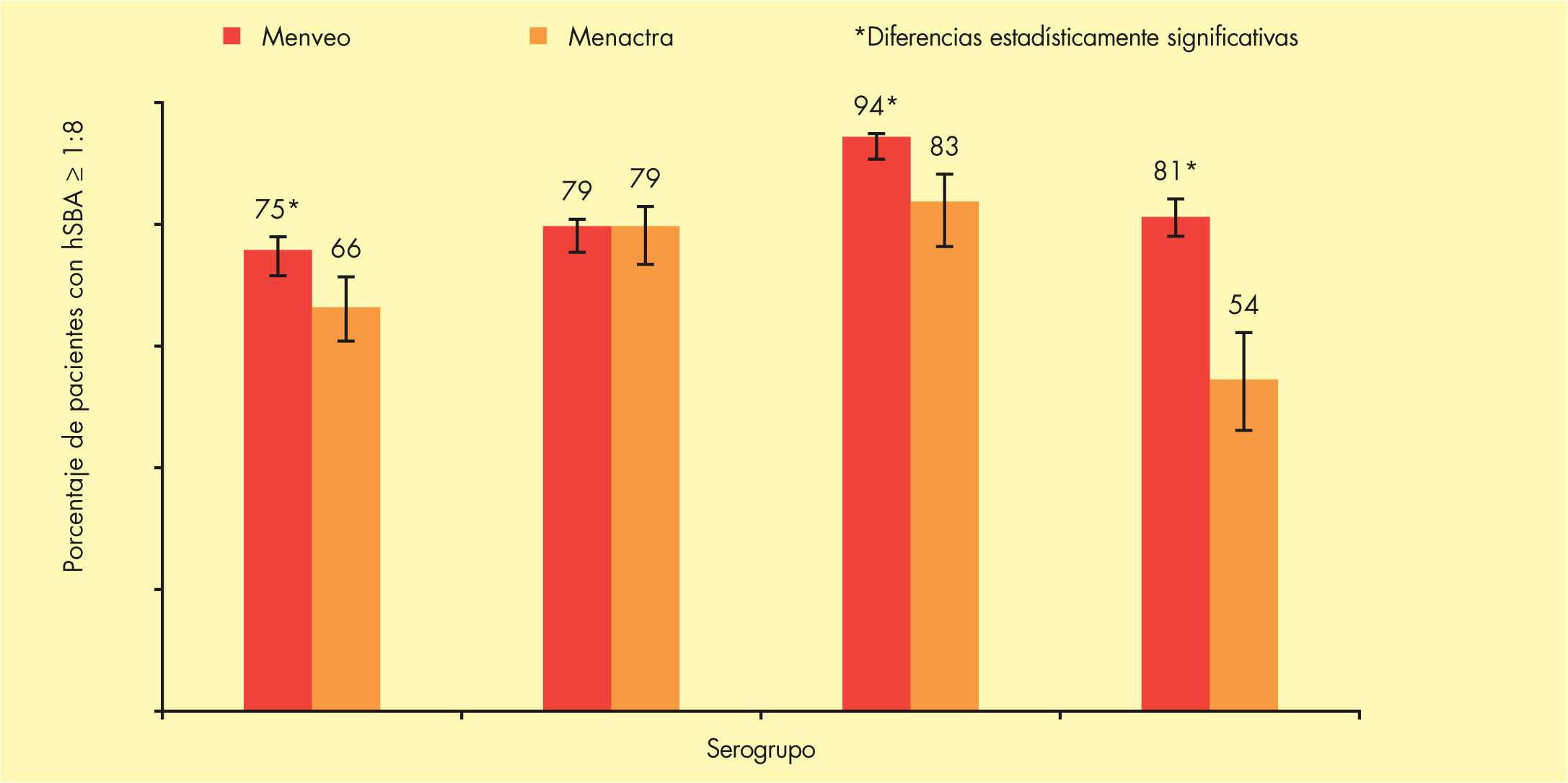
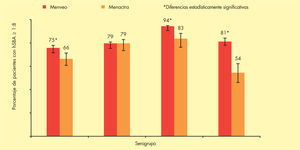
Un ensayo clínico en fase III que ha comparado la inmunogenicidad de Menveo™ en relación con Menactra® muestra que el porcentaje de sujetos con títulos de hSBA ≥ 1:8 frente a los serogrupos A (75 frente a 67%), W-135 (96 frente a 88%) e Y (88 frente a 69%) fue estadísticamente superior en los vacunados con Menveo™, con concentraciones geométricas medias de anticuerpos superiores para todos los serogrupos33 (fig. 4).
Inmunogenicidad de la vacuna Menveo™ en adolescentes en comparación con Menactra®. Adaptada de Jackson et al33.
Adultos. Un ensayo clínico en fase III realizado en EE.UU. en personas de 19-55 años, indica criterios de superioridad inmunógena de Menveo™ para los serogrupos C, W-135, e Y, comparada con Menactra®34. Otro estudio en fase III en adultos realizado en América Latina muestra resultados similares35.
Duración de la protecciónAl igual que ocurre con la vacuna antimeningocócica C conjugada cuando se administra en los primeros 12 meses de vida, los anticuerpos funcionales frente a todos los serogrupos disminuyen a partir de esta edad, en especial si se utilizan pautas con 2 dosis26. Sin embargo, la administración de una dosis de refuerzo a los 12 meses de edad permite alcanzar una respuesta inmunógena comparable frente al serogrupo A entre la pauta vacunal de 3 y 2 dosis, con inducción de títulos de hSBA ≥ 1:4 en el 86-94% de vacunados para este serogrupo, en el 96-98% para el serogrupo C y en el 100% para los serogrupos W-135 y Y, independientemente de la pauta vacunal utilizada en la primovacunación, aunque las concentraciones geométricas medias de anticuerpos son superiores si la serie primaria ha sido de 3 dosis26. Una única dosis de Menveo™ a los 12 meses de vida, sin primovacunación previa, es también inmunógena, con títulos de anticuerpos frente al serogrupo C similares a las inducidas por una dosis de vacuna antimeningocócica C conjugada monovalente administrada en esta misma edad28. Así mismo, si se había administrado una dosis previa de Menveo™ a los 6 meses de edad, el 100% de los vacunados alcanzan concentraciones de hSBA superiores al cut-off de protección para los serogrupos C, W135 e Y, y el 86% para el serogrupo A28.
Aún no se dispone de resultados publicados sobre la persistencia de anticuerpos tras la primovacunación en niños de 1 a 2 años de edad, sin embargo es lógico esperar un descen so de la inmunidad funcional, tal como se observa tras la administración de la vacuna conjugada frente al serogrupo C.
En niños de 2 a 10 años de edad, los títulos de anticuerpos funcionales disminuyen rápidamente a lo largo del tiempo, en especial para los serogrupos A y C, y permanecen elevados para W-135 e Y, lo que indica la necesidad de dosis de refuerzo posteriores con el objetivo de mantener la protección en la adolescencia31.
En adolescentes, los estudios precomercialización muestran una persistencia de los títulos de anticuerpos en niveles elevados para los serogrupos C, W-135 e Y al menos 12 meses después de la vacunación, con porcentajes del 77, 82 y 93% de sujetos con títulos hSBA ≥ 1:8 frente a los 3 serogrupos, respectivamente. Por el contrario, sólo el 29% de los adolescentes mantenían títulos hSBA ≥ 1:8 frente al serogrupo A32,33. Estos datos señalan la necesidad de dosis de refuerzo en países con elevada circulación de este serogrupo, como los del cinturón africano de la meningitis.
Seguridad vacunalMenveo™ presenta un buen perfil de seguridad en todos los grupos de edad. La reacción local más frecuente es el eritema en el lugar de la administración, que se presenta en el 73-87% de los lactantes, seguido del dolor y la induración. Las reacciones generales, como irritabilidad y somnolencia, se observaron en el 50-81% de los lactantes vacunados, y la fiebre ≥ 38ºC en el 6% de vacunados27. En adolescentes y adultos, las reacciones locales han sido las más frecuentes, en especial el dolor de cualquier intensidad, descrito por el 44% de los vacunados33; entre las reacciones generales destaca la cefalea, referida por el 35-40% de casos32,33.
Las tasas de reacciones adversas estudiadas han sido similares a las descritas con la vacuna antimeningocócica C conjugada.
No se han observado diferencias importantes de reactogenicidad entre Menveo™ y Menactra®34,35.
No se dispone de datos suficientes en estos momentos para evaluar el posible riesgo de síndrome de Guillan-Barré asociado a la vacuna.
No se ha observado un aumento de la reactogenicidad al administrar Menveo™ simultáneamente con las vacunas hexavalente y la antineumocócica conjugada heptavalente en lactantes, ni con la dTpa y la vacuna frente al virus del papiloma humano (VPH) en adolescentes36.
Coadministración con otras vacunasMenveo™ puede administrarse simultáneamente con otras vacunas del calendario de vacunaciones sistemáticas de la infancia que incluyan difteria, tétanos, tos ferina acelular, poliomielitis inactivada, Haemophilus influenza tipo b y sus combinaciones. No se ha observado interferencia antigénica en la respuesta inmunógena de los diferentes antígenos vacunales26,27. Tampoco se ha detectado interferencia en la administración simultánea con la vacuna antineumocócica conjugada heptavalente, a pesar de que comparten la misma proteína transportadora26,27.
La administración de Menveo™ simultáneamente con vacuna dTpa (Boostrix™ de GSK) y VPH (Gardasil™ de Merck&Co.) en adolescentes no muestra interferencia antigénica entre los distintos preparados36.
Indicaciones actuales en EspañaEn marzo de 2010, la Agencia Europea de los Medicamentos (EMA) autorizó la comercialización de Menveo™ en los 27 estados de la Unión Europea. Según consta en su ficha técnica, la vacuna está indicada para la prevención de la EMI por los serogrupos A, C, W-135 e Y en adolescentes desde los 11 años y adultos sin límite de edad13.
La vacuna debe ser administrada por vía intramuscular, preferentemente en el músculo deltoides en una sola dosis (0,5ml).
Se consideran contraindicaciones para la vacunación, la hipersensibilidad a la sustancia activa, o a cualquiera de los excipientes contenidos en la vacuna, incluido el toxoide diftérico utilizado para su conjugación (CRM197), así como el antecedente de una reacción adversa grave tras la administración de una vacuna con componentes similares.
A pesar de que no se dispone aún de evidencia científica que avale la inmunogenicidad y la seguridad de la vacuna en embarazadas o en mujeres en período de lactancia, se recomienda vacunar si existe un alto riesgo de exposición.
En España, la indicación más racional en estos momentos es la inmunización de personas con exposición a los serogrupos A, C, W-135 e Y, como son los viajeros a países con elevada circulación de estos serogrupos. La vacunación antimeningocócica tetravalente es obligatoria para aquellos viajeros a Arabia Saudí que acuden para la peregrinación a La Meca, según reglamento internacional21, y se recomienda a los viajeros que se dirigen a zonas endémicas de África y Asia o que viajen a países donde se hayan notificado epidemias recientemente (tabla 2). La autorización actual de Menveo™ a partir de los 11 años de edad limita su administración a viajeros mayores de esta edad.
Indicaciones de vacunación antimeningocócica conjugada tetravalente según el nivel de evidencia
| Nivel de evidencia | |
|---|---|
| Indicación | |
| Peregrinos a La Meca en Arabia Saudí | AII |
| Viajeros a países del cinturón africano de la meningitis, especialmente durante la estación seca | AII |
| Viajeros a países africanos fuera del cinturón donde se han presentado epidemias recientesa | AII |
| Viajeros a países (incluye países industrializados) donde se hayan producido brotes esporádicos en los últimos 6 meses | CIII |
| Jóvenes que se desplazan a países con recomendación de vacunación sistemática en adolescentes con vacuna conjugada tetravalente, que vayan a vivir en residencias universitarias o en colectivos cerrados | — |
| Circunstancia que incrementan el riesgo | |
| Viajes largos y con contacto estrecho con la población | |
| Personal sanitario que atienda a pacientes sin protección o personal de laboratorio que manipule muestras de meningococo | |
| Edad menor de un año | |
| |
Otro grupo importante a considerar en nuestro medio son los jóvenes que se desplazan a otros países industrializados con un patrón de circulación de serogrupos del meningococo diferente al nuestro, y que vayan a residir en residencias universitarias o albergues2.
En cualquier caso, la decisión de recomendar la vacuna se hará en función de una cuidadosa evaluación del riesgo de exposición, considerando 4 factores: el destino, la edad, el estado de salud previa y la naturaleza y duración de la exposición37 (tabla 2).
Los datos aportados por la vigilancia epidemiológica de la EMI en nuestro país a lo largo de los próximos años serán claves para la toma de decisiones de la necesidad de modificar los programas actuales de vacunación antimeningocócica, así como los serogrupos a incluir para su prevención.