Puntos clave
El reloj circadiano (o relojes circadianos) es una de las funciones biológicas más indispensables para los organismos vivos y actúa como un regulador multifuncional que permite la anticipación de las variables biológicas a los cambios periódicos que tienen lugar como consecuencia de los ciclos ambientales. Entre los ritmos que genera se incluyen los de sueño-vigilia, secreciones hormonales, temperatura corporal, presión arterial y la mayoría de los procesos fisiológicos, bioquímicos y comportamentales del organismo.
El reloj circadiano es, pues, una función biológica indispensable para los organismos vivos, actúa como un regulador multifuncional ajustando el sistema homeostásico. Las células ganglionares de la retina (realmente sólo el 1-2% de ellas son capaces de responder a la luz), que son fotorreceptores modificados, son los responsables a través del pigmento melanopsina que poseen, de la llamada «visión sin imágenes o visión circadiana» y contienen la ruta de entrada al reloj (la unidad de fototransducción) y las células del núcleo supraquiasmático producen la señal de salida del reloj (melatonina). Cada una de estas células sería un sistema circadiano: el ritmo circadiano es generado a nivel celular.
Alrededor del 10% del genoma está bajo control del reloj circadiano.
Melatonina: revisión de su papel en la fisiologíaLa melatonina fue descubierta en 19581 y representa una de las primeras señales biológicas que aparecieron sobre la Tierra2 siendo su función la de proteger a los organismos frente al estrés oxidativo generado por la intensa radiación ultravioleta.
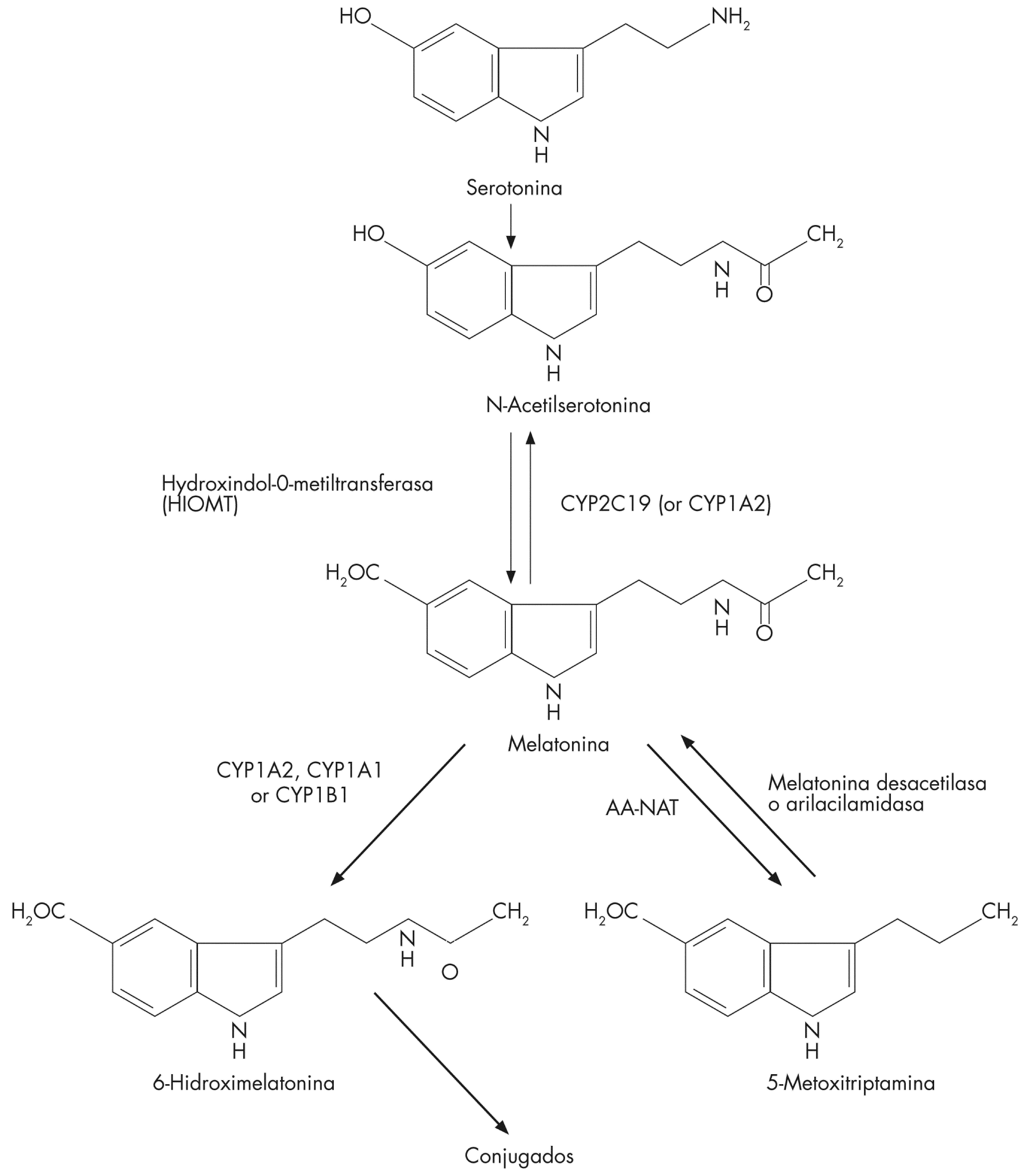
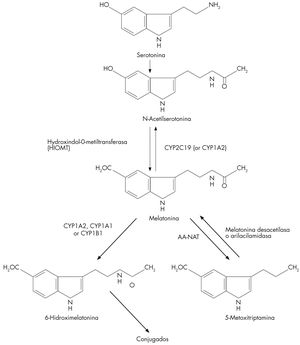
SíntesisSe sintetiza fundamentalmente en la glándula pineal durante la fase oscura en todas las especies estudiadas, representando el código químico de la noche, y su función principal (aunque no la única) es contribuir a difundir el mensaje rítmico generado por el reloj circadiano central (localizado en el núcleo supraquiasmático del hipotálamo). También se sintetiza en la retina (ejerce funciones relacionadas con la adaptación a la oscuridad y protección frente a radicales libres), tracto gastrointestinal (células cromafines), piel, médula ósea y linfocitos3. En su síntesis, el triptófano es hidroxilado a 5-hidroxitriptófano y éste es descarboxilado a 5-hidroxitriptamina (serotonina). La serotonina es convertida a N-acetilserotonina por la N-acetiltrasferasa (NAT). La N-acetilserotonina, vía la enzima hidroxindol-O-metiltrasferasa (HIOMT), se convierte en melatonina (fig. 1).
La luz ambiente modula la liberación de la noradrenalina (NE), neurotransmisor que regula el ascenso nocturno de la producción de la melatonina al actuar sobre los receptores beta; el número de receptores beta sobre la membrana de los pinealocitos se incrementa por la noche permitiendo la máxima acción de la NE y estimulando la liberación de melatonina4. La síntesis de melatonina es inhibida de forma aguda e inmediata por la luz brillante, a través de la inhibición de la actividad de la vía simpática regulada por el núcleo supraquiasmático. La producción de melatonina presenta una marcada variabilidad interindividual. En niñas, la amplitud del patrón de secreción circadiano es significativamente superior con una mayor secreción nocturna. Se observa un descenso significativo de la secreción entre los estadios I y II de desarrollo puberal con descenso mantenido posterior en los siguientes estadios5.
Distribución6Tras su síntesis no se almacena, se segrega por difusión simple facilitada por su alta liposolubilidad (aunque también es hidrosoluble); pasa a través de todas las membranas celulares siendo frecuentemente concentrada en el núcleo y organelas celulares, los capilares y líquido cefalorraquídeo (LCR) (la concentración del LCR en 30–40 veces la del plasma, concentración que disminuye rápidamente a medida que se aleja de la glándula pineal). Atraviesa con facilidad la barrera hematoencefálica.
Presenta un ritmo circadiano de secreción con máximos durante la noche que está presente en todos vertebrados, independientemente de que su actividad máxima sea durante el día o durante la noche.
La biodisponibilidad oral es buena; las dosis actualmente recomendadas en adultos (1–5mg) producen en 1h concentraciones plasmáticas que son de 10 a 100 veces mayores que las del pico nocturno fisiológico, para descender a los valores normales en 4–8h (su vida media en adultos sanos es de 30 a 60min). Dosis bajas (0,1-0,3 MG) administradas durante el día producen niveles que están dentro del intervalo normal nocturno. El 60-70% de la melatonina plasmática está unida a la albúmina. La melatonina es metabolizada en el hígado y riñón tras su hidroxilación y posterior conjugación con sulfato, siendo excretada en forma de 6-sulfatoximelatonina (aMT6s) en la orina. Aproximadamente el 90% de la melatonina administrada exógenamente aparece como aMT6s en la orina. Tras su administración, la melatonina se detecta en sangre, saliva, orina, LCR (con concentraciones muy superiores a la sangre), cámara anterior del ojo (niveles semejantes a la sangre), líquido amniótico, leche materna y folículos preovulatorios7. Es interesante señalar que la administración de melatonina exógena no parece afectar a la síntesis y liberación de la melatonina endógena.
OntogeniaLos pinealocitos fetales son capaces de sintetizar melatonina desde la 26 SG; sin embargo, no existe ritmo circadiano de la melatonina al nacimiento; éste aparece entre las 9 y las 12 semanas de edad y está completamente establecido a los 5–6 meses8. Se ha observado la existencia de ritmos semicircadianos y circadianos ya a la tercera semana de vida. Entre la sexta y la duodécima se inicia el aumento gradual de la amplitud del ritmo hacia la instauración del ritmo circadiano9.
Alcanza sus niveles máximos entre el año y los 3 años con valores plasmáticos de alrededor 250pg/ml. Los niveles comienzan a descender justo antes de la pubertad con valores plasmáticos de alrededor 100pg/ml en el adulto10.
La naturaleza de la relación entre la melatonina pineal y la fisiología reproductiva en humanos permanece aún sin dilucidar ya que no aparece consistentemente una relación entre pubertad y descenso de la melatonina11,12. Es posible que la asociación entre melatonina y desarrollo puberal pueda ser el resultado de la maduración del eje neuroendocrino-gonadal más que el reflejo de su papel regulador de la pubertad6,13. No obstante, dado que los estudios publicados no permiten descartar un posible papel de la pineal en el desarrollo gonadal, el principio de precaución aconseja limitar los tiempos de administración y las dosis en la edad pediátrica.
Funciones con evidencia científicaSe han descrito 2 tipos de receptores de membrana (MT1, MT2) responsables de los efectos cronobiológicos de la melatonina. Estos receptores están presentes en el núcleo supraquiasmático de hipotálamo, en varias áreas cerebrales (plexos coroideos, arterias cerebrales, hipófisis, etc.) y en órganos periféricos como órganos linfoides, glándulas suprarrenales, corazón, pulmones, tracto gastrointestinal, glándulas mamarias, riñones, órganos reproductivos femeninos, etc., de manera que encontrar un órgano sin receptores melatonínicos constituye la excepción más que la regla. En el núcleo supraquiasmático la activación nocturna del receptor MT1 produce aumentos en la amplitud de su ritmo circadiano de actividad nerviosa, mientras que la activación del receptor MT2 induce adelantos o retrasos de fase en respuesta a la administración de melatonina al comienzo o al final del período de descanso nocturno, respectivamente. La actuación de la melatonina sobre receptores de membrana MT1 y MT2, así como sobre receptores citosólicos y nucleares también parece ser responsable de la activación de enzimas antioxidantes como glutatión peroxidasa, superoxidodismutasa y catalasa; todas ellas enzimas esenciales en la protección frente al estrés oxidativo.
Incluso en ausencia de receptores, por su alta capacidad de difusión, la melatonina tiene efectos sistémicos celulares básicos modulando las funciones mioticas y citosqueléticas a través de su unión con la calmodulina así como por su función de eliminación de radicales libres14,15.
De manera reducida entre las acciones fisiológicas de la melatonina como molécula totipotente podemos destacar algunas:
- —
Facilita la propensión al sueño regulando su ritmo circadiano16.
- —
Actúa sobre las funciones retinianas, promoviendo la adaptación de la retina a la oscuridad. Al mismo tiempo modula la conductancia de la membrana de los bastones de la retina14,17.
- —
Posee efectos antioxidantes directos e indirectos (induciendo la actividad de enzimas antioxidantes) frente a radicales libres de oxígeno3,18.
- —
Reduce la generación de radicales libres de oxígeno en la mitocondria.
- —
Actúa como oncostático en varios tipos de tumores como el de mama, próstata y colorrectal, entre otros. Protege frente a la actuación de algunos agentes carcinogénicos como el 7,12-dimethylbenzanthracene (DMBA), safrol19,20.
- —
Tiene un papel en la regeneración ósea.
- —
Regula la secreción de bicarbonato por el tracto gastrointestinal.
- —
Es inmunomoduladora, potencia la actividad de los linfocitos Th1.
- —
Posee ligeros efectos hipotensores21.
- —
Modula la actividad de algunos neurotransmisores. En general potencia la actividad del ácido gammaaminobutírico (GABA) y reduce la actividad y neurotoxicidad del glutamato.
- —
Puede modificar la función de los neurotransmisores del SNC. Los niveles de serotonina y GABA se incrementan en el cerebro tras la administración de la misma.
- —
Acción sobre el estado nutricional22,23.
- —
Acción sobre la temperatura23.
- —
Acción sobre el sistema reproductivo3,24.
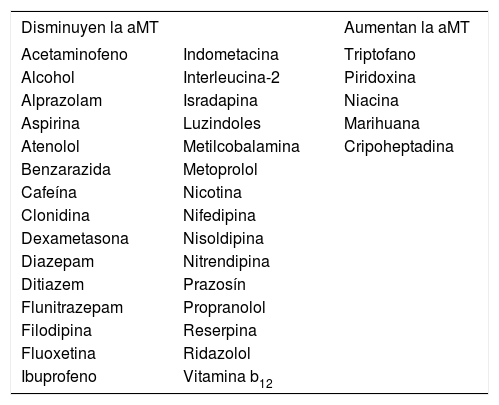
Una serie de sustancias o fármacos alteran la liberación de melatonina (tabla 1).
Influencia de los fármacos en la secreción
| Disminuyen la aMT | Aumentan la aMT | |
|---|---|---|
| Acetaminofeno | Indometacina | Triptofano |
| Alcohol | Interleucina-2 | Piridoxina |
| Alprazolam | Isradapina | Niacina |
| Aspirina | Luzindoles | Marihuana |
| Atenolol | Metilcobalamina | Cripoheptadina |
| Benzarazida | Metoprolol | |
| Cafeína | Nicotina | |
| Clonidina | Nifedipina | |
| Dexametasona | Nisoldipina | |
| Diazepam | Nitrendipina | |
| Ditiazem | Prazosín | |
| Flunitrazepam | Propranolol | |
| Filodipina | Reserpina | |
| Fluoxetina | Ridazolol | |
| Ibuprofeno | Vitamina b12 |
aMT: sulfatoximelatonina.
Aunque la introducción del uso de la melatonina en el tratamiento de los problemas del sueño en niños con problemas del desarrollo fue en 1994, todavía carecemos de estudios a largo plazo sobre su seguridad. Algunos indicios apuntan a que la eficacia terapéutica de la melatonina exógena exige como requisito la presencia de una reducción de la melatonina endógena3,25.
Los efectos de la melatonina exógena sobre el sueño se resumen en:
- 1.
En sujetos normales, dosis de 1–3mg producen un aumento significativo de la latencia REM comparada con placebo23.
- 2.
Disminuye la latencia de inicio de sueño más en niños que en adultos:
- —
< 17 años: -17,0min (intervalo de confianza [IC] al 95%: 33,5-0,5).
- —
18–65 años: -11,2min (IC 95%: -22,7-5,4).
Esta disminución de la latencia de inicio de sueño es significativa en los pacientes con síndrome de retraso de fase mientras que en los pacientes con insomnio es clínicamente insignificante.
- —
- 3.
No tiene efecto sobre la calidad del sueño, tiempo de vigilia intrasueño, tiempo total de sueño o porcentaje de sueño REM.
- 4.
No tiene efecto sobre la latencia de sueño en pacientes con alteraciones del sueño secundarias a otras enfermedades. En este aspecto el efecto de la melatonina no difiere entre niños y adultos ni varía con la dosis utilizada o la duración del tratamiento.
La melatonina actúa como agente cronobiológico (sincronizador interno) estabilizando y reforzando los ritmos biológicos (ritmo vigilia-sueño, temperatura corporal, cortisol, etc.) más que como un hipnótico; no altera el tiempo total de sueño. Este efecto cronobiológico que propicia la reorganización de las fases de sueño depende en gran medida del momento de su administración. Cuando se administra por la tarde y en la primera parte de la noche adelanta la fase de sueño, mientras que la administración en la segunda parte de la noche o la mañana retrasa la fase de sueño. La dosis de melatonina que produce estos cambios de fase varía de 0,5 a 10mg; dependiendo, en parte, de la magnitud del cambio de fase de la dosis. Este cambio de fase se atribuye a la acción del receptor MT2 de la melatonina que está presente en el SNC y su influencia directa en la actividad eléctrica y metabólica cerebral. En el tratamiento del SRF es más efectiva cuando se administra 5h antes del inicio de la secreción de melatonina o 7h antes del inicio de sueño. Como la melatonina cruza la barrera placentaria, es posible que tenga un papel en la regulación biológica del feto3.
DosificaciónBasándonos en las series de casos y ensayos clínicos publicados (todos en niños mayores de un año), en todos los casos la melatonina debe administrarse a la misma hora (entre 30 y 60min antes de la hora habitual de ir a dormir). La dosis recomendada es de 1–3mg, valorando la necesidad de aumentar o disminuir según la respuesta. En ocasiones los niños con trastornos neurológicos pueden necesitar dosis mayores. Si la dosis en muy baja puede no ser eficaz y si, al contrario, es demasiado alta desaparecen los efectos cronobiológicos quedando sólo los hipnóticos
Momento de administraciónEl efecto cronobiológico que propicia la reorganización de las fases de sueño depende en gran medida del momento de su administración. Cuando se administra por la tarde y en la primera parte de la noche adelanta la fase de sueño, mientras que la administración en la segunda parte de la noche o la mañana retrasa la fase de sueño. La dosis de melatonina que produce estos cambios de fase varía de 0,5 a 10mg; dependiendo, en parte, de la magnitud del cambio de fase de la dosis. Este cambio de fase se atribuye a la acción del receptor MT2 de la melatonina que está presente en el SNC y su influencia directa en la actividad eléctrica y metabólica cerebral. En el tratamiento del síndrome de retraso de fase es más efectiva cuando se administra 5h antes del inicio de la secreción de melatonina o 7h antes del inicio de sueño. Con ello, el 80% de los pacientes de 6–12 años de edad adelantan el inicio del sueño una hora.
Efectos secundarios y seguridad de la melatonina exógenaSe dispone de datos en niños mayores de 3 años con seguimiento de 2 años; en niños menores de 2 años no existen datos sobre su seguridad con seguimientos mayores de 3 meses.
La melatonina exógena es bien tolerada. En la mayoría de los estudios clínicos y series de casos no se han detectado efectos adversos significativamente diferentes al placebo. Entre estos efectos se han señalado la aparición de26: náusea (1,5%), cefalea (7,8%), mareo (4,0%), somnolencia (20,33%) y catarro (1%).
Estos efectos secundarios no varían con la dosis, la presencia o ausencia de alteración del sueño, tipo de alteración del sueño, duración del tratamiento, sexo, edad (> 1 año), formulación de la melatonina o medicación concurrente.
La mayoría de los estudios evalúan la seguridad a corto plazo mientras que hay dudas teóricas, aunque no constatadas por estudios, sobre el efecto de la melatonina en el sistema endocrino al existir receptores de la melatonina en las glándulas suprarrenales y en los ovarios27,28.
Los estudios sobre seguridad tienen N pequeñas (media de 62)29,30,32 (tabla 2). Este tamaño muestral influye en los resultados con un incremento del error estándar26.
Estudios sobre la seguridad de la melatonina
| Año | N | Edad (años) | Varones (%) | Enfermedad | Dosis | Duración (semanas) | Tipo de estudio |
|---|---|---|---|---|---|---|---|
| Camfield, 1996 | 6 | 8,8 (3–13) | 67 | Alteraciones del desarrollo | 0,5-1,0mg | 10 | Aleatorizado |
| Dodge, 2001 | 17 | 7,4 (1–15) | (¿) | Alteraciones del desarrollo | 5mg | 10 | Aleatorizado |
| McArthur, 1998 | 9 | 10 meses-1 año | (¿) | Síndrome de Rett | 2,5-7,5mg | 4 | Aleatorizado |
| Wirojanan, 2009 | 12 | 7 (2–15) | (¿) | Autismo | 3mg | 4 | Aleatorizado |
- A.
Según la patología:
- 1.
Con datos basados en MBE: los datos están recogidos de estudios aleatorizados pero están basados en estudios con muestras pequeñas y en los que el significado clínico de los beneficios obtenidos no está todavía bien definido.
- —
Síndrome de retraso de fase circadiana.
- —
Disminución de la latencia de sueño33.
- —
Espectro autista34: tanto los pacientes como los portadores muestran ausencia de incremento nocturno de melatonina. Se desconoce si el uso de la melatonina antes de los 3 años puede ser beneficioso.
- —
Síndrome de Smith-Mageni35: existe una inversión del ritmo circadiano de la melatonina.
- —
Niños invidentes: la administración de melatonina en dosis de 0,5-4mg mejora el sueño al regular el ritmo circadiano; los beneficios se mantienen a largo plazo (incluso 6 años en algunos pacientes) sin efectos adversos importantes.
- —
Síndrome de Rett: dosis de 2,5 a 7,5mg mejoran el sueño.
- —
Distrofia muscular de Duchene: la administración de melatonina reduce los valores plasmáticos de creatincinasa, alaninoaminotransferasa (20%) y mioglobina (28%), lo que indica que la melatonina reduce el proceso inflamatorio y la hiperoxidación en estos pacientes reduciendo la degeneración muscular36.
- —
Epilepsia intratable: con la administración de melatonina se observa una mejoría en la calidad de sueño y una reducción significativa de la frecuencia e intensidad de las crisis37.
- —
- 2.
Sin evidencia científica clara, basados en series de casos tratados en la literatura:
- —
Insomnio infantil no ocasionado por un retraso circadiano de la secreción de melatonina.
- —
Diabetes tipo 1: el 40% de los pacientes presentan trastornos del sueño. En muchas complicaciones participa un incremento de producción de radicales libres38,39.
- —
Anorexia nerviosa: en ella se produce un aumento de los niveles plasmáticos de melatonina como probable marcador de la alteración gonadal; su ritmo circadiano permanece pero la concentración global es superior.
- —
Deterioro cognitivo: no hay pruebas suficientes que apoyen la efectividad de la melatonina para el tratamiento de secuelas cognitivas y no cognitivas de la demencia40.
- —
Ansiedad: la melatonina no es útil para el tratamiento de la ansiedad en los niños, no hay diferencias entre la melatonina y el placebo41.
- —
Contraindicación absoluta: asma42. El empeoramiento del asma nocturna está asociado a una elevación de la melatonina así como a un retraso del pico sérico de la misma de manera que la melatonina elevada puede contribuir a la patogenia del asma nocturna.
- —
- 1.
- B.
Según la edad del paciente:
- 1.
Niños menores de 6 meses: no se recomienda su utilización en estos niños.
- 2.
Niños de 6 a 12 meses de edad:
- —
Eficacia: su eficacia como regulador del ritmo circadiano del sueño ha sido demostrada.
- —
Duración de su uso: no se recomienda su uso más de 4 semanas.
- —
Su utilización debe estar indicada y supervisada por su médico pediatra o por un médico experto en sueño.
- —
Seguridad: no existen datos científicos sobre la ausencia de efectos secundarios más allá de pasados 3 meses después de finalizada su utilización.
- —
- 3.
Niños de 1 a 3 años:
- —
Eficacia: su eficacia como regulador del ritmo circadiano del sueño ha sido demostrada.
- —
Seguridad: su seguridad a corto plazo (3 meses después de finalizado su uso) está demostrada. No se dispone de datos de seguimiento sobre su seguridad y ausencia de efectos secundarios a más largo plazo.
- —
Su utilización debe estar indicada y supervisada por su médico pediatra o por un médico experto en sueño. Este debe indicar y controlar la duración de la recomendación.
- —
- 4.
Niños mayores de 3 años:
- —
Eficacia: su eficacia como regulador del sueño ha sido demostrada.
- —
Su utilización debe estar indicada y supervisada por su médico pediatra o por un médico experto en sueño. Este debe indicar y controlar la duración de la recomendación.
- —
Seguridad: no se han visto efectos secundarios no deseados durante los primeros 3 años de seguimiento tras finalizar el tratamiento. No existen datos a más largo plazo.
- —
La eficacia y la seguridad de la melatonina a largo plazo en adultos están demostradas.
- —
- 1.
El uso de la melatonina siempre debe estar acompañado del control de las condiciones ambientales del sueño y de los cambios de actitudes y hábitos de sueño y régimen de vida que se consideren oportunos.
La cantidad de melatonina habitualmente recomendada oscila de 1 a 3mg al día. Dada la diversidad de sus funciones y el desconocimiento de la seguridad de su uso a medio o largo plazo, no es adecuado ni saludable aumentar, sin indicación y control de su pediatra o del médico experto en sueño, la dosis recomendada de melatonina.
ConclusiónLa eficacia de la melatonina como agente cronobiológico, así como la buena tolerancia de las preparaciones de melatonina están demostradas. Sin embargo, a pesar de que un agente con tan múltiples acciones y receptores en casi todos los órganos de la economía puede tener efectos secundarios, éstos todavía no se han investigado a medio y largo plazo en el niño.
Los escasos estudios sobre el uso de la melatonina en niños (mayores de un año) sugieren que la melatonina puede ayudar a reducir la latencia de sueño de los niños con problemas de sueño, pero la generalización de estos hallazgos es problemática por los pequeños tamaños de muestra de estos estudios y el escaso tiempo de seguimiento. La generalización de su uso clínico para el tratamiento del insomnio y del trastorno del síndrome de retraso de fase a estas edades debería ir precedida de la realización de amplios estudios controlados que determinen la seguridad a corto, medio y largo plazo además de su eficacia en la población pediátrica (especialmente en menores de 3 años).
Todos los consensos de tratamiento de los problemas del sueño en el niño43 indican que en los casos en los que se considere necesario el tratamiento farmacológico, éste debe ir siempre acompañado de tratamiento conductual y de un adecuado control y seguimiento por parte del pediatra o del experto en sueño.