Los aneurismas de aorta abdominal inflamatorios son una entidad diferente de los aneurismas de aorta ateroscleróticos. Esta entidad se caracteriza por el engrosamiento de la pared aórtica, está asociada a fibrosis retroperitoneal y a adherencias de los órganos circundantes, como los uréteres y la vena cava. Suele afectar a varones sexagenarios y fumadores, y la clínica típica es una tríada consistente en dolor abdominal, fiebre y elevación de la velocidad de sedimentación eritrocitaria. El angio-TC es el gold standard en el diagnóstico, ya que permite la visualización del aneurisma, con una hipertrofia de tejidos blandos periaórticos. En los últimos años se ha propuesto el tratamiento endovascular como una opción eficaz. Sin embargo, la cirugía abierta realizada por cirujanos expertos puede ser una buena solución en casos seleccionados, ya que además permite tratar el atrapamiento ureteral. Con este artículo queremos hacer un repaso sobre la última evidencia en diagnóstico y tratamiento de esta entidad.
Inflammatory abdominal aortic aneurysm is a distinct type of abdominal aortic aneurysm. This disease usually affects men in their 60's, with tobacco use as usual finding. Periaortic wall thickness with retroperitoneal fibrosis, and adhesion to adjoining organs such as ureters or inferior vena cava, are also common findings. Clinical symptoms found in this disease are as follows: abdominal or back pain, fever, and elevated erythrocyte sedimentation rate. Computed tomography scan with contrast enhancement is the gold standard for the diagnosis, showing an infrarrenal aortic aneurysm with a soft tissue inflammatory rind. In the past few years endovascular treatment has been proposed as an effective option. However, open surgery performed by expert surgeons may be a good solution in selected cases, since it also enables ureteral entrapment to be treated. A review of the latest evidence in the diagnosis and treatment of this condition is presented in this article.
El aneurisma de aorta abdominal inflamatorio (AAAI) es una enfermedad infrecuente, con un tratamiento complejo y, frecuentemente, con abordaje multidisciplinar.
El AAAI se define como la tríada de engrosamiento de la pared aórtica, fibrosis periaórtica y retroperitoneal y adherencia de órganos periaórticos. Se considera una variante diferente de los aneurismas aórticos de origen aterosclerótico. La fibrosis retroperitoneal es un proceso fibrótico progresivo, que causa compresión sobre la región retroperitoneal desde la fosa renal a la pelvis, y que puede causar obstrucción ureteral, hidronefrosis secundaria e insuficiencia renal de diferente severidad, entre otros1,2.
En 1935, James et al. publicaron el primer caso de un paciente con uremia, secundaria al atrapamiento renal por un proceso inflamatorio retroperitoneal, que también tenía un aneurisma de aorta abdominal. Posteriormente, en 1972, fueron Walker et al. quienes acuñaron el término de «AAAI», y publicaron una serie de 19 casos que asociaban aneurisma de aorta abdominal y fibrosis retroperitoneal1,3,4.
El objetivo de este artículo es revisar la evidencia publicada hasta el momento sobre los AAAI, centrado especialmente en su diagnóstico y tratamiento.
Patogenia y epidemiologíaLos AAAI se consideran una variante de los aneurismas de aorta abdominal (AAA), con una prevalencia entre el 2 y 18% del total de AAA1–3. La incidencia de AAAI en autopsia se encuentra entre el 2,5 y el 10% del total de AAA4.
Su fisiopatología es aún una incógnita y probablemente sea de origen multifactorial. Una de las hipótesis presentadas defiende que se trata de una respuesta inflamatoria de la pared aórtica a un antígeno de origen desconocido, que provoca un infiltrado local de macrófagos y linfocitos, que activan la proteólisis a través de la cadena de citocinas. Esto conlleva una pérdida de integridad de la pared aórtica y favorece el desarrollo del aneurisma, a la vez que se desarrolla una capa de tejido fibrótico2. Otros autores se muestran a favor de la formación, en primer lugar, de un aneurisma, con una inflamación local secundaria asociada, en relación con antígeno de la placa de ateroma5. También se ha postulado su relación con las vasculitis de vaso grande, como la arteritis de células gigantes y arteritis de Takayasu, llegando a encontrarse series de pacientes con arteritis de Takayasu que asociaban AAAI hasta en un 45% de los pacientes. También se ha descrito la hipótesis de la etiología infecciosa, relacionada con la sífilis, tuberculosis, salmonelosis, infección por herpes o citomegalovirus4,6.
Algunos estudios los relacionan con un proceso autoinmune subyacente. En los últimos años, se ha descrito una nueva entidad llamada «enfermedades sistémicas relacionadas con la inmunoglobulina IgG4», que se puede manifestar en forma de pancreatitis autoinmunes, fibrosis retroperitoneal o AAAI, y en las que se puede objetivar un aumento en los niveles plasmáticos de IgG4 o unos infiltrados de células plasmáticas productores de IgG4, en los tejidos afectos5,7,8. Haug et al. publicaron un estudio de casos y controles en el que demostraron la asociación estadísticamente significativa de los AAAI con enfermedades autoinmunes, al compararlos con los AAA ateroscleróticos. Se piensa que hay una cierta predisposición genética familiar, habiéndose demostrado en varios estudios la asociación de esta enfermedad con ciertos alelos del grupo HLA6,9,10.
Respecto a la histología, se puede observar una pérdida de células de músculo liso y células elásticas en la capa arterial media, que son sustituidas por tejido fibrótico. El tejido periaórtico suele mostrar tejido de granulación con abundante tejido esclerótico infiltrado a base de linfocitos maduros, fundamentalmente9,11.
Los AAAI suelen aparecer en pacientes más jóvenes, con una media de edad en torno a los 65 años, respecto a una media de 71 años en los AAA de etiología aterosclerótica1,11,12.
Los principales factores de riesgo para el desarrollo de aneurismas inflamatorios son el sexo masculino y el tabaquismo2,6,13,14. Se ha objetivado una clara asociación con el sexo masculino, con un ratio hombre:mujer que llega hasta el 30:1. El tabaquismo activo o como antecedente está presente en el 77-100% de los casos, como muestran series como las de Pennell et al., Sakamoto et al., Prifti et al., entre otras. Incluso se ha propuesto que la asociación de este tipo de aneurismas con el tabaco es más fuerte que la de los aneurismas ateroscleróticos13,15.
Clínica y diagnósticoLa tríada típica de los aneurismas inflamatorios consiste en dolor abdominal o de espalda, pérdida de peso y aumento de la velocidad de sedimentación eritrocitaria, por lo que su hallazgo en un paciente con un AAA nos debe hacer sospechar la presencia de un AAAI (tabla 1). El dolor se suele caracterizar como sordo y continuo, aunque en aquellos pacientes con compresión ureteral puede aparecer como dolor cólico.
Frecuencia clínica preoperatoria
| Variables | N | % |
|---|---|---|
| Dolor abdominal | 29 | 83 |
| Dolor lumbar | 26 | 74 |
| Pérdida de peso | 28 | 80 |
| Fiebre | 22 | 63 |
| Trombosis venosa profunda | 3 | 8,6 |
| Hidronefrosis | 2 | 5,7 |
| Asintomático | 6 | 17 |
| Mantle sign | 27 | 77 |
Fuente: Prifti et al.4.
El síndrome constitucional suele estar presente hasta en 2/3 de estos pacientes. La fiebre, la anorexia, la fatiga, la pérdida de peso y las mialgias suelen tener una evolución insidiosa a lo largo de la enfermedad. Una escasa proporción de pacientes con AAAI se mantiene asintomáticos a lo largo del proceso1,4.
La fibrosis retroperitoneal asociada suele provocar síntomas en los órganos adyacentes. Así, hasta un 25% de los pacientes asocian hidronefrosis en algún grado, secundarias al atrapamiento ureteral. Pueden asociar hematuria, poliuria o infección de vías urinarias. También se han descrito casos de trombosis venosa profunda como consecuencia del atrapamiento de la vena cava inferior, en los casos más severos y evolucionados4. La angina intestinal y el estreñimiento, debidos a la afectación intestinal de la fibrosis retroperitoneal, son raros10.
Para llegar al diagnóstico de certeza son fundamentales las técnicas de imagen. La ecografía abdominal nos permite confirmar la presencia de un aneurisma aórtico; y en los pacientes con anatomías más favorables podremos observar la fibrosis retroperitoneal como una capa hipo- o isoecoica que rodea la aorta e incluso los uréteres, causando una hidronefrosis uni- o bilateral. Es bien sabido que la ecografía es una prueba operador-dependiente y artefactada por la grasa y el aire abdominal, lo cual hace que la ecografía tenga una baja sensibilidad para el despistaje de AAAI. La urografía intravenosa suele objetivar una tríada de medialización de los uréteres, compresión extrínseca e hidronefrosis. Estos hallazgos también pueden encontrarse en tumores de las vías urinarias, procesos inflamatorios y adenopatías, por lo que se requerirán otras pruebas para confirmar el tratamiento10.
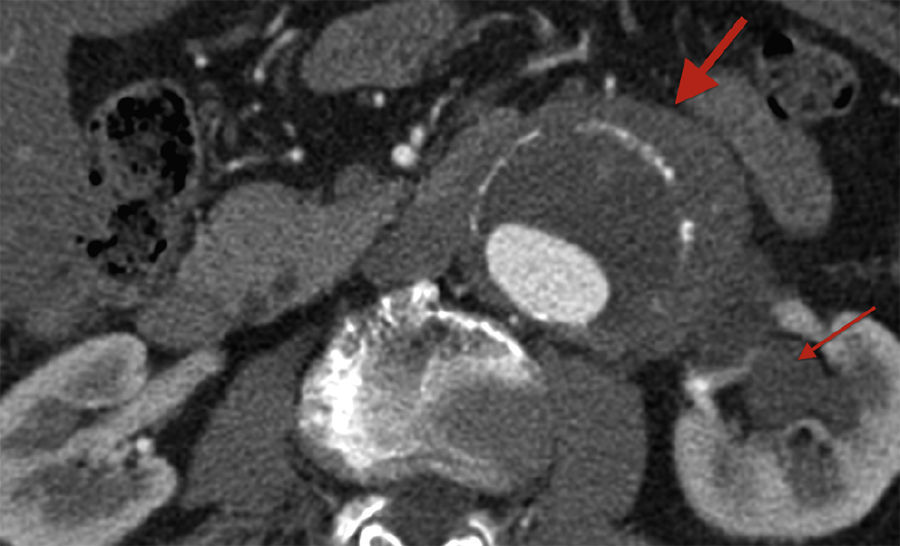
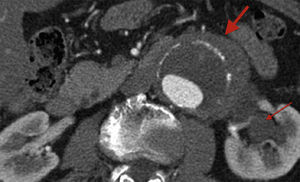
El gold standard para el diagnóstico de la fibrosis retroperitoneal es la angio-TC, con una sensibilidad mayor del 90%. La TC permite visualizar una imagen típica de placa hipertrófica, homogénea e isodensa, de los tejidos blandos periaórticos, llamada mantle sign, que realzan tras la inyección de contraste (fig. 1). También permite caracterizar el aneurisma y sus ramas y valorar la afectación de los tejidos adyacentes por la fibrosis, como la vena cava (70%), la vena renal izquierda (50%), el uréter (44%) y el sigma (20%)10,16. La resonancia magnética nuclear también puede utilizarse para diagnosticar esta enfermedad, al poder visualizarse la fibrosis retroperitoneal como hipointensa en T1. Los beneficios de esta prueba son la ausencia de radiación, el uso de contraste yodado y la alta resolución de la pared aórtica y tejidos blandos circundantes2,10.
También se ha descrito la utilidad de la tomografía por emisión de positrones con 18-flurodeoxyglucosa y asociada a la TC o resonancia magnética nuclear en el diagnóstico de los AAAI y de la fibrosis retroperitoneal, ya que es captada por los focos inflamatorios periaórticos2,17.
Desde el punto de vista de la microbiología, tanto los hemocultivos como los cultivos de la muestra quirúrgica suelen resultar negativos en la mayoría de los pacientes4.
Es fundamental hacer el diagnóstico diferencial entre aneurisma micótico e inflamatorio, debido al compromiso vital que supone el retraso en el diagnóstico del primero. Además, la infección puede ser reagudizada por el tratamiento médico de los aneurismas inflamatorios, que consiste en corticoesteroides o inmunosupresores12. La clínica larvada e insidiosa de los aneurismas micóticos, junto con la ausencia de fiebre y hemocultivos negativos hasta en un 25% de los casos, hace que en ocasiones sea complicado hacer el diagnóstico diferencial con los AAAI. Las pruebas de imagen como la angio-TC, con hallazgos de gas en la pared aórtica, abscesos periaórticos o inflamación de partes blandas periaórticas, están a favor de un aneurisma infeccioso19. La tomografía por emisión de positrones también puede ayudar a evaluar la actividad de la infección5. Una anamnesis detallada, una exploración física completa y las pruebas de imagen suelen ayudar durante el proceso diagnóstico.
TratamientoPara los AAAI de más de 50mm, las principales líneas de tratamiento son la cirugía convencional mediante abordaje transperitoneal o retroperitoneal, o el abordaje endovascular para la colocación de una endoprótesis aórtica.
La complejidad del abordaje abierto de los AAAI se debe a la disección de la capa fibrótica periaórtica y del riesgo de lesionar los órganos cercanos como uréteres, intestino o venas, debido a las adherencias. Así pues, esta técnica se suele asociar a un mayor tiempo quirúrgico, mayor transfusión sanguínea y, finalmente, a una mayor morbimortalidad, que puede llegar a triplicar la obtenida en la técnica endovascular2. Todo lo anteriormente expuesto hizo que, tras el implante de la primera endoprotesis aórtica por Juan Parodi en 1991 y ulterior desarrollo exponencial del Endo-Vascular Aortic Repair (EVAR), se comenzara a plantear como una alternativa ventajosa en el tratamiento definitivo de los AAAI1. En los últimos años, la mayoría de las series coinciden en un éxito técnico de la técnica endovascular mayor del 90%, además de que es una técnica mínimamente invasiva y, por lo tanto, con un postoperatorio más corto y menor tasa de complicaciones. Sin embargo, había dudas acerca de la duración de los dispositivos en estos pacientes y de la evolución de la fibrosis retroperitoneal y sus consecuencias.
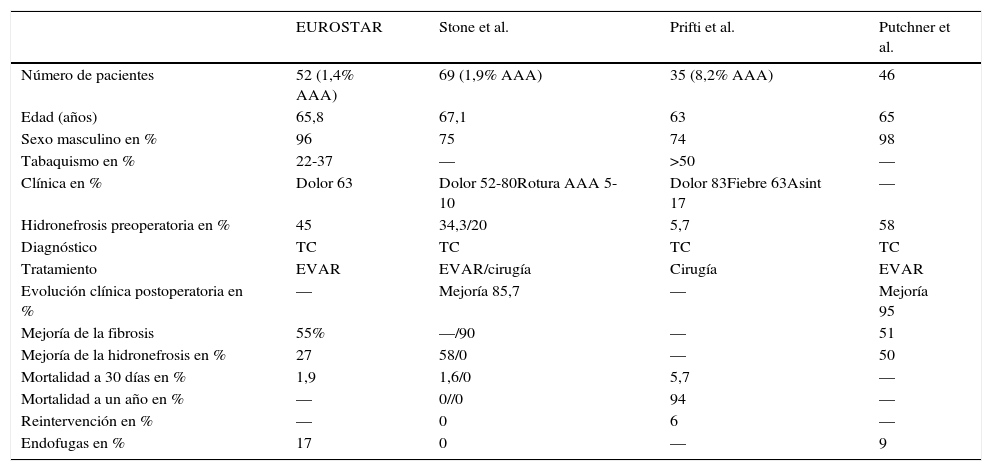
En 2005, Lange et al.11,17 publicaron un estudio retrospectivo a partir del registro europeo EUROSTAR, en que se comparaban los resultados a corto y medio plazo del tratamiento aórtico endovascular en pacientes con AAA y AAAI. Respecto al tiempo operatorio, este estudio mostró ausencia de diferencia en el tiempo quirúrgico, fugas o conversión primaria a cirugía abierta. Encontró diferencias significativas en las estenosis de las extensiones ilíacas, que se multiplicaban por 18 veces en el grupo de los aneurismas inflamatorios. A lo largo del seguimiento, tampoco se objetivaron diferencias en las fugas, estenosis o kinking ni en la mortalidad, objetivándose regresión del saco aneurismático en el 87% de los casos. Respecto a afectación renal de los pacientes con AAAI, se encontró mejoría de la hidronefrosis y del atrapamiento ureteral en el postoperatorio hasta en la mitad de los casos. Por otro lado, se objetivó empeoramiento de la función renal en más del 30% de los pacientes, aunque ninguno de ellos requirió hemodiálisis. El metaanálisis publicado por Puchner et al.6 recopila todos los estudios sobre EVAR en los AAAI. Tras análisis de todos ellos, se confirma la involución del saco aneurismático, así como la regresión de la fibrosis periaórtica y la mejoría de la hidronefrosis en el 50% de los casos, con un 9% de fugas y 31% de reintervenciones, fundamentalmente por fugas y trombosis de las endoprótesis. Así, el EVAR se mostró como una técnica eficaz y segura, con una tasa de éxito de más del 95% y baja tasa de mortalidad, en el tratamiento de los AAAI. Se ha creado la tabla 2 a modo de resumen de los principales estudios.
Tabla-resumen de los estudios más importantes sobre AAAI
| EUROSTAR | Stone et al. | Prifti et al. | Putchner et al. | |
|---|---|---|---|---|
| Número de pacientes | 52 (1,4% AAA) | 69 (1,9% AAA) | 35 (8,2% AAA) | 46 |
| Edad (años) | 65,8 | 67,1 | 63 | 65 |
| Sexo masculino en % | 96 | 75 | 74 | 98 |
| Tabaquismo en % | 22-37 | — | >50 | — |
| Clínica en % | Dolor 63 | Dolor 52-80Rotura AAA 5-10 | Dolor 83Fiebre 63Asint 17 | — |
| Hidronefrosis preoperatoria en % | 45 | 34,3/20 | 5,7 | 58 |
| Diagnóstico | TC | TC | TC | TC |
| Tratamiento | EVAR | EVAR/cirugía | Cirugía | EVAR |
| Evolución clínica postoperatoria en % | — | Mejoría 85,7 | — | Mejoría 95 |
| Mejoría de la fibrosis | 55% | —/90 | — | 51 |
| Mejoría de la hidronefrosis en % | 27 | 58/0 | — | 50 |
| Mortalidad a 30 días en % | 1,9 | 1,6/0 | 5,7 | — |
| Mortalidad a un año en % | — | 0//0 | 94 | — |
| Reintervención en % | — | 0 | 6 | — |
| Endofugas en % | 17 | 0 | — | 9 |
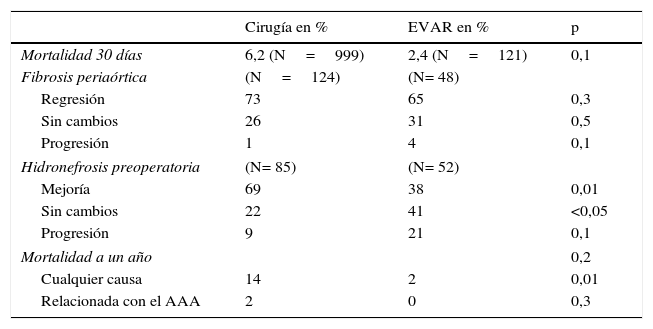
Posteriormente, Paravastu et al.16 realizaron una revisión sistemática comparando la cirugía y el EVAR como tratamiento de los AAAI. Concluyeron que no había diferencia respecto a la mortalidad a los 30 días, aunque sí en la mortalidad al año por cualquier causa a favor del tratamiento endovascular. Esta mejoría en los datos de mortalidad desaparecía al tener solamente en cuenta las muertes relacionadas con los aneurismas. Por otro lado, aunque no se dilucidaron diferencias en la evolución postoperatoria de la fibrosis periaórtica, sí se objetivó una mejoría significativa de la hidronefrosis tras la cirugía (tabla 3). A pesar de tratarse de una revisión, está basada en estudios no aleatorizados y con recogida de datos retrospectiva, por lo que sus resultados deben ser interpretados con cautela.
Evolución postoperatoria tras cirugía y EVAR
| Cirugía en % | EVAR en % | p | |
|---|---|---|---|
| Mortalidad 30 días | 6,2 (N=999) | 2,4 (N=121) | 0,1 |
| Fibrosis periaórtica | (N=124) | (N= 48) | |
| Regresión | 73 | 65 | 0,3 |
| Sin cambios | 26 | 31 | 0,5 |
| Progresión | 1 | 4 | 0,1 |
| Hidronefrosis preoperatoria | (N= 85) | (N= 52) | |
| Mejoría | 69 | 38 | 0,01 |
| Sin cambios | 22 | 41 | <0,05 |
| Progresión | 9 | 21 | 0,1 |
| Mortalidad a un año | 0,2 | ||
| Cualquier causa | 14 | 2 | 0,01 |
| Relacionada con el AAA | 2 | 0 | 0,3 |
Fuente: Paravastu et al.16.
La evolución de la fibrosis retroperitoneal tras la cirugía no es clara12, pues mientras algunos estudios publicados defienden la frecuente remisión completa de la fibrosis retroperitoneal tras la cirugía, otros muestran una remisión parcial o cierta persistencia en un porcentaje importante de pacientes. Esto hace necesario mantener un control radiológico estricto mediante angio-TC, tras la cirugía o EVAR, para seguimiento y tratamiento médico, si procede.
Cuando en las pruebas de imagen se objetiva una uropatía obstructiva secundaria al atrapamiento ureteral, asociada o no a alteración de la función renal, se requiere una valoración urológica prequirúrgica, para derivación utereral si fuese necesario1,11,16.
En aquellos casos con fibrosis retroperitoneal sintomática asociada a un aneurisma que no reúne criterios quirúrgicos, se puede ofrecer un tratamiento médico. El objetivo del tratamiento médico es detener la evolución de la reacción fibroinflamatoria, revertir la compresión sobre los uréteres y resto de los órganos abdominales, mejorar la clínica sistémica y evitar las recaídas. El tratamiento clásico es a base de glucocorticoides. Aunque no existe acuerdo sobre la dosis y duración del tratamiento, varios estudios han mostrado una rápida mejoría de la clínica y reducción de la capa fibrótica. Otra opción son los inmunosupresores, como tamoxifeno, ciclofosfamida o micofelato, aunque los resultados hasta el momento son discretos10,17. También se ha descrito la utilización de tratamiento médico asociado al EVAR, pero el escaso número de pacientes tratados y los resultados contradictorios hacen que no podamos llegar a conclusiones sobre esta terapia3,16.
Vaglio et al.18 publicaron el primer ensayo clínico que comparaba el tratamiento de mantenimiento con corticoides o tamoxifeno durante 8 meses, en pacientes con fibrosis retroperitoneal idiopática, tras conseguir la remisión con un tratamiento de inducción común para todos los pacientes con prednisona. Este estudio mostró una eficacia del tratamiento de inducción en todos los casos respecto a la clínica y al síndrome inflamatorio. Los pacientes con tratamiento corticoideo de mantenimiento tuvieron menor tasa de recidivas durante el tratamiento y mayor tendencia a la remisión de la fibrosis retroperitoneal. En cambio, no se objetivaron diferencias en las recidivas durante el seguimiento. Por lo tanto, este estudio apoya el empleo de la corticoterapia como tratamiento de primera línea en pacientes con fibrosis retroperitoneal sintomática, a pesar de sus efectos secundarios.
ConclusiónLos AAAI siguen siendo un reto para los cirujanos vasculares debido a su compleja fisiopatología y escasa evidencia sobre el tratamiento óptimo.
Los estudios publicados han mostrado que el tratamiento endovascular aórtico permite realizar una correcta exclusión de estos aneurismas, con una baja morbimortalidad perioperatoria y, a medio plazo, con una tasa de reintervención similar a los aneurismas de etiología ateroesclerótica. Los resultados respecto a la mejoría de la fibrosis retroperitoneal y las manifestaciones renales son más ambiguos, debido a la frecuente persistencia o incluso progresión de la capa fibrótica sobre los órganos adyacentes tras el tratamiento endovascular, que requirieren cirugía en un segundo tiempo para la liberación del órgano afecto. Todos los estudios revisados coincidían en la mayor morbimortalidad de la cirugía abierta en este tipo de aneurismas, que en algunas series triplica la del tratamiento endovascular. No obstante, la mejoría de la fibrosis retroperitoneal y sus consecuencias se consigue en la mayoría de los pacientes.
Aquellos pacientes con fibrosis retroperitoneal sintomática se pueden beneficiar de un tratamiento médico, fundamentalmente a base de prednisona a largo plazo, que conlleva una rápida mejoría clínica, biológica y radiológica.
Así pues, podemos aceptar que el EVAR es una opción eficaz y segura en el tratamiento de los AAAI, que poseen una anatomía adecuada y alto riesgo para la cirugía convencional. La cirugía abierta quedará reservada para aquellos casos no abordables por vía endovascular o con una uropatía obstructiva secundaria a la fibrosis retroperioneal que requiera tratamiento, ya que en manos expertas tiene buenos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.