Múltiples estudios demuestran que la escala de riesgo Finnvasc tiene alto valor predictivo de mortalidad y amputación mayor precoces en pacientes con revascularización de miembros inferiores por isquemia crítica (IC). Se estudió la aplicabilidad de Finnvasc en nuestro centro.
Material y métodosSe estudió a 190 pacientes tratados mediante revascularización infrainguinal por IC desde enero de 2012 hasta diciembre de 2013. Se estratificaron grupos según la puntuación Finnvasc y se midieron los eventos adversos postoperatorios. Mediante un análisis de la varianza (ANOVA) se estudió la asociación entre la puntuación obtenida y la ocurrencia de eventos adversos. Se utilizó la curva ROC para estimar el valor predictivo de la escala de riesgo.
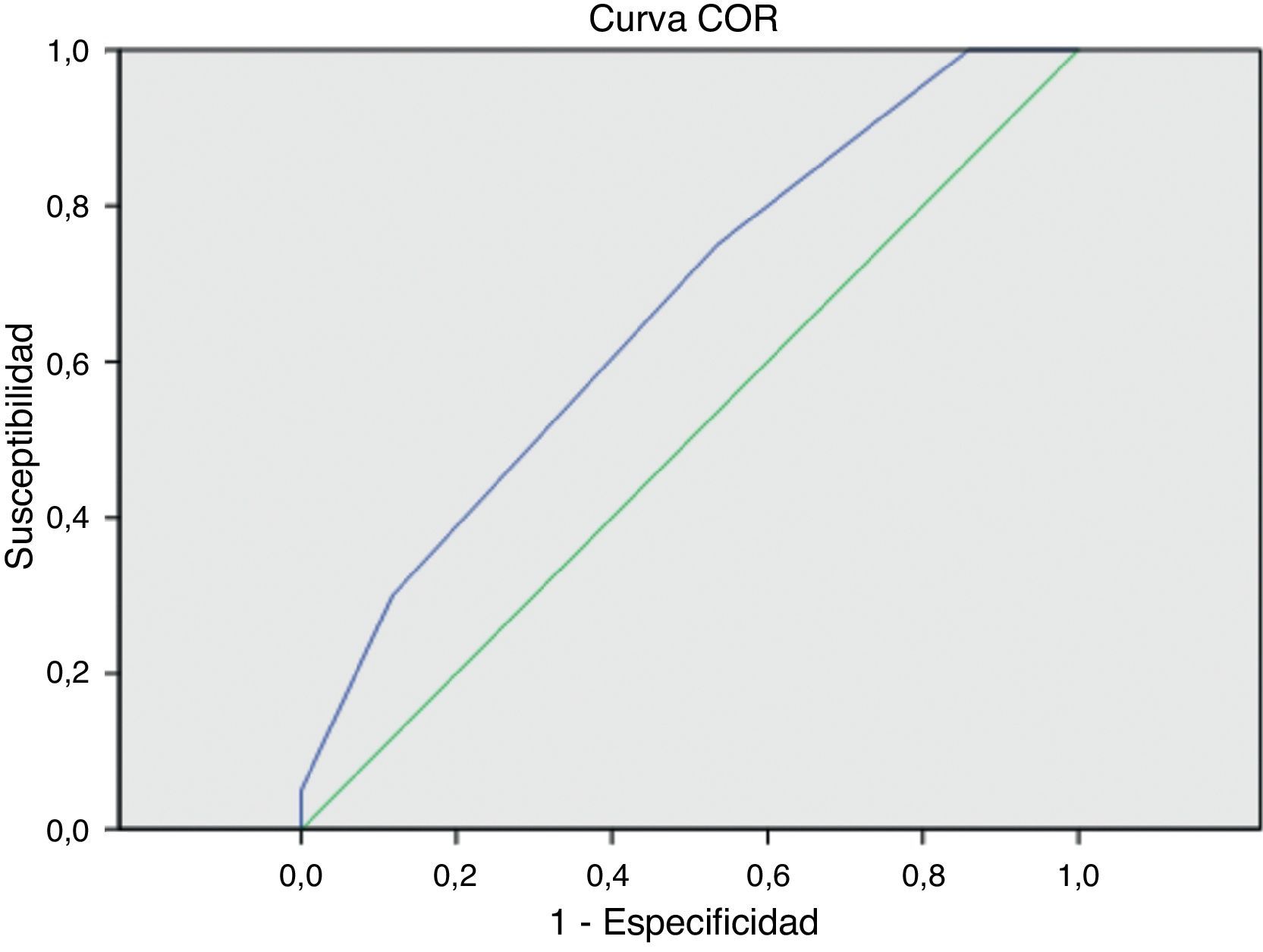
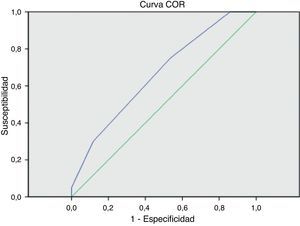
ResultadosEn los primeros 30 días postoperatorios, 6 pacientes (3,2%) fallecieron y 14 (7,4%) fueron amputados. Para los grupos con puntuación de 0, 1, 2 y ≥3, la incidencia de amputación fue de 0; 3,3; 10 y 15%. La mortalidad fue 0; 5; 1,3 y 7,7% y la mortalidad/amputación combinada fue de 0; 8; 11 y 23% respectivamente. El ANOVA para estas diferencias no obtuvo significación estadística (p=0,08; p=0,2; p=0,057 respectivamente). Las curvas ROC muestran que el valor de la escala fue regular para predecir amputación mayor precoz (AUC=0,694; 0,570-0,818) y malo para mortalidad precoz (AUC=0,563; 0,316-0,811). La curva ROC para mortalidad/amputación combinada fue similar (AUC=0,664; 0,543-0,785).
ConclusionesLa escala Finnvasc en la población de nuestro estudio no ha demostrado un valor predictivo aceptable para la mortalidad y la amputación. Además, no se objetivó una relación estadísticamente significativa para estas variables aisladas o combinadas.
Many studies show that the Finnvasc risk score predicts early mortality and major amputation in patients with critical lower limb ischemia (CI) after revascularization. A study is made on the applicability of the score in our center.
Material and methodsA total of 190 patients underwent infrainguinal revascularization for CI from January 2012 to December 2013. The patients were stratified into 4 groups according to the Finnvasc score. The incidence of postoperative adverse events was measured. Analysis of variance (ANOVA) was used to determine the association between the score and adverse events. The ROC curve was used to estimate the predictive value of the risk score.
ResultsIn the first 30 postoperative days, 6 patients (3.2%) died and 14 (7.4%) underwent major amputation. For groups with scores of 0, 1, 2 and ≥3, the incidence of amputation was 0, 3.3, 10 and 15%; the mortality rate was 0, 5, 1.3 and 7.7%, and the mortality/amputation combined was 0, 8, 11 and 23%, respectively. The ANOVA for these results did not achieve statistical significance (P=.08; P=.2; P=.057, respectively). The ROC curves showed that the score was average for predicting early major amputation (AUC=.694; 0.570-0.818) and poor for predicting mortality (AUC=.563; 0.316-0.811). The ROC curve for mortality/amputation combined was similar (AUC=.664; 0.543-0.785).
ConclusionsThe Finnvasc score in the studied population did not demonstrate an acceptable predictive value for early mortality and major amputation.
La presencia de isquemia crítica (IC) de miembros inferiores confiere un elevado riesgo de pérdida de la extremidad y de eventos cardiovasculares, siendo la cardiopatía isquémica y la enfermedad cerebrovascular las principales causas de mortalidad1,2. Varios estudios indican que la incidencia de amputación por IC ha disminuido considerablemente gracias al tratamiento endovascular y la cirugía abierta3–5. Sin embargo, el riesgo perioperatorio de eventos adversos en los pacientes con IC es mayor que la población general1,2,6,7. Con el uso de procedimientos endovasculares como alternativa a la cirugía abierta, las tasas de mortalidad y amputación mayor postoperatorias inmediatas siguen variando ampliamente del 0 al 4% y del 3 al 21%, respectivamente8–10. Esto ha llevado al diseño de escalas de riesgo en cirugía para estratificar a los pacientes con alto riesgo quirúrgico. En cirugía vascular, en concreto, la escala de riesgo Finnvasc ha demostrado tener un buen valor predictivo para el riesgo postoperatorio de mortalidad/amputación mayor precoz en los pacientes con IC tratados mediante revascularización infrainguinal11–13.
El principal objetivo de este trabajo fue valorar la aplicabilidad de la escala Finnvasc en los pacientes con IC tratados mediante revascularización infrainguinal en nuestro hospital. Además, estimar la incidencia de eventos adversos y describir las características demográficas de estos pacientes.
Materiales y métodosSe estudió a 190 pacientes tratados mediante revascularización infrainguinal por IC (grados III y IV de Fountaine), desde enero de 2012 hasta diciembre de 2013. El estudio incluyó todas las intervenciones quirúrgicas y endovasculares realizadas en el sector infrainguinal y las angioplastias ilíacas asociadas a revascularización infrainguinal. Se incluyeron intervenciones programadas y urgentes. Se estudió la aplicabilidad de la escala de riesgo Finnvasc. Esta escala ha sido validada para revascularización infrainguinal quirúrgica y endovascular, y tiene en consideración la presencia de 4 factores: cardiopatía isquémica, diabetes mellitus, cirugía urgente y gangrena o necrosis, asignando un punto a cada variable presente13. Se considera que una puntuación ≥3 es de alto riesgo quirúrgico y supone un riesgo aproximado del 20% en conjunto para amputación/mortalidad precoz.
Se calculó la puntuación Finnvasc para cada paciente y se estratificaron en 4 grupos según la puntuación obtenida (0, 1, 2, ≥3). El análisis estadístico de los datos se efectuó utilizando el software SPSS (versión 19.0.1; IBM SPSS statistics). Utilizando el análisis de la varianza (ANOVA), se estudió la asociación entre la puntuación obtenida y la ocurrencia de eventos adversos mayores. Se utilizó la curva receiver operating characteristic curve (ROC) para estimar el valor predictivo de la escala para la amputación y la mortalidad precoces. Los datos numéricos fueron expresados mediante la media±desviación típica y los datos categóricos, en porcentaje. Se consideró estadísticamente significativo un valor de p<0,05. Se definieron como eventos adversos mayores, tras revascularización infrainguinal, la mortalidad y la amputación mayor precoces, ocurridas durante el mismo ingreso o dentro de los 30 primeros días postoperatorios.
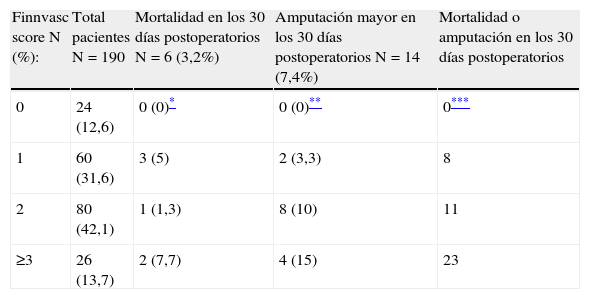
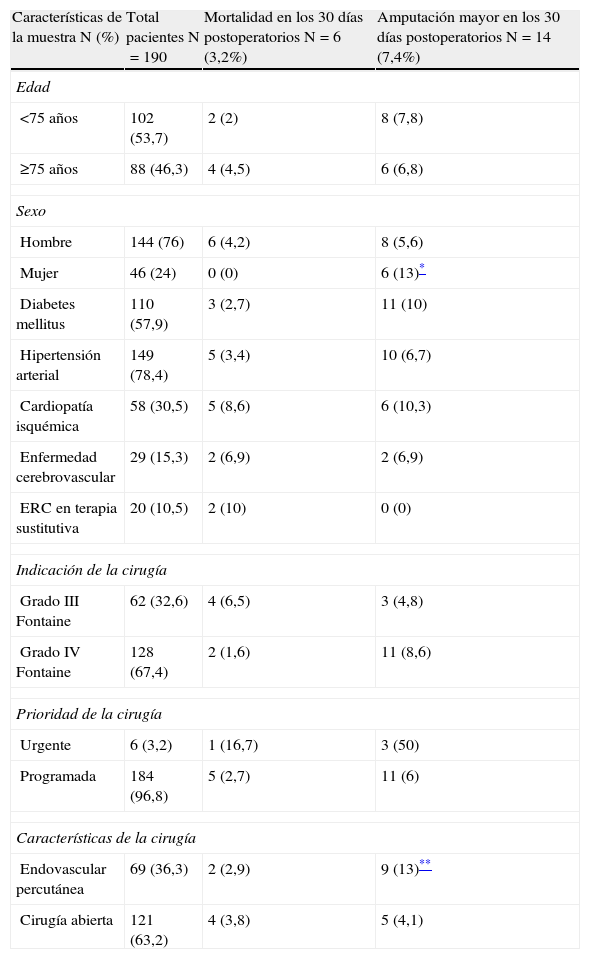
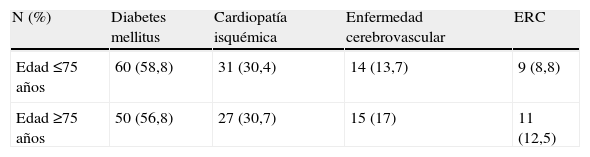
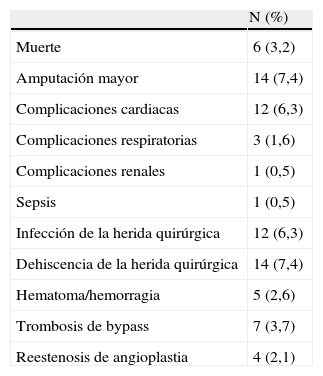
ResultadosEn el grupo de pacientes estudiados la edad media fue de 72±12 años, de los cuales el 76% fueron hombres y el 24% mujeres. En los primeros 30 días postoperatorios, 6 pacientes (3,2%) fallecieron y 14 (7,4%) fueron tratados mediante una amputación mayor. En las tablas 1–4 se resume la incidencia de eventos adversos mayores en los distintos grupos y las características demográficas de la muestra. Para los grupos con puntuaciones de 0, 1, 2 y ≥3, la incidencia de amputación fue de 0; 3,3; 10 y 15%; y la mortalidad fue 0; 5; 1,3 y 7,7% respectivamente, sin embargo el análisis de varianza para estas diferencias no obtuvo significación estadística (p=0,08 para amputación y p=0,2 para mortalidad). La incidencia combinada de amputación/mortalidad fue de 0, 8, 11 y 23% para los grupos con puntuaciones de 0, 1, 2, ≥3 respectivamente (p=0,057). Las causas de mortalidad por orden descendente fueron: eventos cardiovasculares, insuficiencia respiratoria y sepsis. Excluyendo los eventos adversos mayores, las complicaciones más frecuentes fueron dehiscencia de la herida quirúrgica (7,4%), eventos cardiovasculares no mortales (6,3%) e infección de la herida quirúrgica (6,3%) (tabla 5).
Mortalidad y amputación precoces según la puntuación Finnvasc
| Finnvasc score N (%): | Total pacientes N=190 | Mortalidad en los 30 días postoperatorios N=6 (3,2%) | Amputación mayor en los 30 días postoperatorios N=14 (7,4%) | Mortalidad o amputación en los 30 días postoperatorios |
| 0 | 24 (12,6) | 0 (0)* | 0 (0)** | 0*** |
| 1 | 60 (31,6) | 3 (5) | 2 (3,3) | 8 |
| 2 | 80 (42,1) | 1 (1,3) | 8 (10) | 11 |
| ≥3 | 26 (13,7) | 2 (7,7) | 4 (15) | 23 |
Características demográficas de la muestra
| Características de la muestra N (%) | Total pacientes N=190 | Mortalidad en los 30 días postoperatorios N=6 (3,2%) | Amputación mayor en los 30 días postoperatorios N=14 (7,4%) |
| Edad | |||
| <75 años | 102 (53,7) | 2 (2) | 8 (7,8) |
| ≥75 años | 88 (46,3) | 4 (4,5) | 6 (6,8) |
| Sexo | |||
| Hombre | 144 (76) | 6 (4,2) | 8 (5,6) |
| Mujer | 46 (24) | 0 (0) | 6 (13)* |
| Diabetes mellitus | 110 (57,9) | 3 (2,7) | 11 (10) |
| Hipertensión arterial | 149 (78,4) | 5 (3,4) | 10 (6,7) |
| Cardiopatía isquémica | 58 (30,5) | 5 (8,6) | 6 (10,3) |
| Enfermedad cerebrovascular | 29 (15,3) | 2 (6,9) | 2 (6,9) |
| ERC en terapia sustitutiva | 20 (10,5) | 2 (10) | 0 (0) |
| Indicación de la cirugía | |||
| Grado III Fontaine | 62 (32,6) | 4 (6,5) | 3 (4,8) |
| Grado IV Fontaine | 128 (67,4) | 2 (1,6) | 11 (8,6) |
| Prioridad de la cirugía | |||
| Urgente | 6 (3,2) | 1 (16,7) | 3 (50) |
| Programada | 184 (96,8) | 5 (2,7) | 11 (6) |
| Características de la cirugía | |||
| Endovascular percutánea | 69 (36,3) | 2 (2,9) | 9 (13)** |
| Cirugía abierta | 121 (63,2) | 4 (3,8) | 5 (4,1) |
Complicaciones postoperatorias en los 30 días postoperatorios
| N (%) | |
| Muerte | 6 (3,2) |
| Amputación mayor | 14 (7,4) |
| Complicaciones cardiacas | 12 (6,3) |
| Complicaciones respiratorias | 3 (1,6) |
| Complicaciones renales | 1 (0,5) |
| Sepsis | 1 (0,5) |
| Infección de la herida quirúrgica | 12 (6,3) |
| Dehiscencia de la herida quirúrgica | 14 (7,4) |
| Hematoma/hemorragia | 5 (2,6) |
| Trombosis de bypass | 7 (3,7) |
| Reestenosis de angioplastia | 4 (2,1) |
Al aplicar la curva ROC, el área bajo la curva (AUC) de la escala de riesgo fue regular para predecir amputación mayor precoz (AUC=0,694; 0,570-0,818) y malo para predecir mortalidad precoz (AUC=0,563; 0,316-0,811). La curva ROC para mortalidad/amputación combinada fue similar (AUC=0,664; 0,543-0,785) (fig. 1).
DiscusiónLos pacientes con IC de miembros inferiores presentan un mayor riesgo perioperatorio que la población general14. Debido a esto, durante los últimos decenios, varios estudios han tratado de identificar los factores relacionados a un mayor riesgo perioperatorio en este grupo de pacientes, con el fin de poder mejorar su pronóstico1,12,15–18. Los factores que se han asociado de forma invariable a mayor riesgo perioperatorio, en general y principalmente en cirugía vascular, son la presencia de cardiopatía isquémica, diabetes mellitus, enfermedad renal crónica avanzada, antecedentes de eventos cerebrovasculares y la misma enfermedad arterial periférica por sí misma1,2,6,14,15,17,19. En cirugía vascular se ha relacionado la presencia de diabetes mellitus y necrosis tisular con peor pronóstico para la extremidad, aun después un procedimiento de revascularización con buen resultado16. A pesar de conocer todos estos factores, no hay una forma exacta de cuantificar el riesgo perioperatorio para cada paciente. Todo esto ha motivado el desarrollo de escalas de riesgo específicas como por ejemplo, Finnvasc o PREVENT III. Constituyen una forma objetiva de estratificar a los pacientes, por lo que podrían ser una herramienta útil en la toma de decisiones, sobre todo, en el paciente con múltiples comorbilidades. Pero el hecho de que existan tantos factores asociados a un peor pronóstico tras la cirugía de revascularización en IC, hace que sea muy difícil la elaboración de escalas pronósticas que incluyan todas las variables asociadas a eventos adversos y por lo tanto que sea aplicable en la práctica diaria15,19.
La escala Finnvasc fue desarrollada en Finlandia a partir del Finnvasc registry que incluía a más de 5.000 pacientes revascularizados por IC. Inicialmente fue validada para la revascularización quirúrgica infrainguinal y posteriormente para la revascularización endovascular, incluyendo algunos casos de angioplastia ilíaca siempre que se realizasen asociadas a procedimientos en el sector infrainguinal. En estos estudios la escala Finnvasc ha demostrado tener valor predictivo para amputación/mortalidad precoz a los 30 días postoperatorios. Además se trata de una escala de fácil aplicación que se puede realizar a pie de cama del enfermo. Se considera que los pacientes con puntuación de 3 y 4 presentan el mayor riesgo (7 y 12% para mortalidad y 12 y 18% para amputación respectivamente), presentando en conjunto un riesgo aproximado de más del 20% de amputación/mortalidad para los pacientes con puntuación ≥311. A diferencia de la escala Finnvasc, la escala de riesgo PREVENT III fue diseñada para estimar la supervivencia libre de amputación a un año12. Tiene en consideración la edad, presencia de hemodiálisis, coronariopatía y pérdida de tejido como factores de riesgo. A pesar de que en la práctica diaria no nos basamos en una única prueba en concreto para la toma de decisiones, pensamos que podría ser de utilidad el contar con una forma específica de estratificar a nuestros pacientes. Así que decidimos valorar la aplicabilidad de la escala Finnvasc en nuestros pacientes.
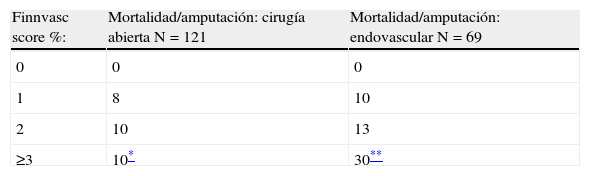
La tasa de mortalidad y amputación mayor observada en nuestra serie fue baja9,10,20. Otros hallazgos en el presente estudio fueron que la incidencia de amputación fue más elevada en las mujeres que en los hombres (13 frente a 5,8% respectivamente), sin embargo, esta diferencia no fue estadísticamente significativa (p=0,09). Al igual que otros estudios, la edad tampoco influyó en el resultado postoperatorio11,13. La incidencia de eventos adversos fue similar para los pacientes ≥75 años y para los más jóvenes. Esto podría estar en relación con la elevada incidencia de comorbilidades en los pacientes más jóvenes (tabla 4). Según el tipo de intervención, endovascular frente abierta, la mortalidad fue similar: 2,9 y 3,8% para revascularización endovascular y abierta, respectivamente. La incidencia de amputación fue mayor para los procedimientos endovasculares (13 frente a 4,1%). Estas diferencias no fueron estadísticamente significativas (p=0,06) (tabla 3).
Al analizar los resultados de mortalidad y amputación por separado en los distintos grupos según la puntuación obtenida, encontramos que la incidencia de eventos adversos es similar a la esperada según la escala Finnvasc13. Sin embargo, la diferencia entre los distintos grupos fue mayor para amputación que para mortalidad, probablemente en relación con la baja incidencia de mortalidad en la muestra. Estas diferencias no obtuvieron significación estadística en el análisis.
Queremos destacar que los resultados se aproximaron mucho a la significación estadística para el evento combinado mortalidad o amputación (p=0,057). Otro dato importante es que la diferencia entre cada grupo de riesgo fue significativamente mayor para el evento combinado, principalmente para los pacientes con una puntuación ≥3. En este grupo de pacientes la incidencia de mortalidad o amputación fue ≥20% (tabla 1). Al separar los pacientes en 2 categorías según el tipo de intervención (endovascular frente a abierta), obtuvimos resultados similares (tabla 2). Esto se explicaría porque la escala no tiene en cuenta el tipo de intervención y está diseñada para aplicarse de la misma forma en todos los pacientes11,13.
El valor predictivo con las curvas ROC no fue aceptable para las variables aisladas o combinadas. Creemos que una posible razón por la que la escala de riesgo no demostró su validez externa en la población de nuestro estudio es la baja incidencia de eventos adversos mayores en la muestra (tablas 1 y 3).
Las complicaciones más frecuentes en la muestra fueron las relacionadas con la herida quirúrgica. En el análisis separamos infección y dehiscencia como complicaciones. El motivo es que en muchos pacientes la causa de la dehiscencia fue una linforrea persistente, hematoma, reintervención y, en algunos casos, traumatismo. Los cultivos en estos casos fueron negativos en todo momento. El porcentaje de complicaciones relacionadas con la herida quirúrgica fue similar a los descritos en la literatura21,22.
ConclusionesLa tasa de mortalidad y amputación mayor observada fue baja. La escala de riesgo Finnvasc en la población de nuestro estudio no ha demostrado tener un valor predictivo aceptable para la mortalidad y la amputación precoces. Además, no se objetivó una relación estadísticamente significativa para estas variables aisladas ni combinadas.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Protección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.