La cirugía carotídea en pacientes asintomáticos sigue siendo un tema controvertido. Su coste-efectividad se ha cuestionado por el número de pacientes que es necesario tratar para prevenir un ictus, especialmente en contraste con la cirugía en pacientes sintomáticos.
ObjetivosAnalizar los resultados de una serie de pacientes, en un único centro, sometidos a cirugía por estenosis carotídea asintomática (ECA), así como la estimación de ictus teóricamente prevenidos y la extrapolación a distintos intervalos y tasas de morbimortalidad.
Material y métodosDiseño. Cohorte histórica. Población. Pacientes sucesivos sometidos a endarterectomía por ECA>70% en los últimos 5 años. Método. Se revisaron los expedientes clínicos de todos los pacientes sometidos a cirugía por ECA en el periodo 2009-2013. Análisis estadístico. Descriptivo, análisis de supervivencia, estimación de ictus prevenidos en base al número de pacientes que es necesario tratar teóricos.
ResultadosSe identificaron 111 procedimientos en 97 pacientes con una edad media de 67,4±3,4 años. Factores de riesgo clásicos: tabaquismo (70,4%), hipertensión (80,9%), diabetes (42,6%), dislipidemia (62,6%). Mortalidad (30 días): un caso (0,9%). Morbilidad neurológica (30 días): ningún caso (0%). Durante el seguimiento (2,7 años, pérdidas: 6,3%) se registraron 6 muertes (5,4%), un ictus ipsilateral (0,9%) y 4 reestenosis (3,6%). El número de ictus teóricamente prevenidos se estimó en 7,3 a los 5 años.
ConclusiónCon base en los resultados de esta serie y de la estimación de ictus prevenidos, bajo distintos supuestos de morbimortalidad y seguimiento, creemos que la endarterectomía no debe descartarse como tratamiento de elección en pacientes con ECA, siempre y cuando se mantenga un riesgo quirúrgico y una expectativa de vida adecuados.
Carotid surgery on asymptomatic patients is still controversial. Its cost-effectiveness has been questioned due to the number of patients needed to treat to prevent a stroke, especially when compared with surgery on symptomatic patients.
ObjectivesTo analyse a series of patients, in a single centre, subjected to surgery due to asymptomatic carotid stenosis (ACS), as well as to determine the theoretically prevented strokes and to extrapolate to different intervals and morbimortality rates.
Material and methodsDesign. Historic cohort. Population. Successive patients subjected to endarterectomy for ACS>70% in the last 5 years. Method. A review was made of the medical records of all the patients subjected to surgery due to ACS in the period 2009-2013. Statistical analysis. Descriptive, analysis of survival, estimate of prevented strokes based on theoretical number of patients needed to treat.
ResultsA total of 111 procedures were identified in 97 patients with a mean age of 67.4±3.4 years. The classic risk factors were: smoking (70.4%), hypertension (80.9%), diabetes (42.6%), and dyslipidaemia (62.6%). Mortality (30-day): on case (0.9%). Neurological morbidity (30-day): no cases (0%). During follow-up (2.7 years, losses: 6.3%), 6 (5.4%) deaths were recorded, as well as one (0.9%) ipsilateral stroke and 4 (3.6%) re-stenosis. The number of theoretically prevented strokes was estimated at 7.3 at 5 years.
ConclusionBased on the results of this series and the estimation of strokes prevented, using different morbidity, mortality and follow-up intervals, it appears that endarterectomy should not be ruled out as a treatment of choice in patients with ACS, provided that there is a reasonable surgical risk and life expectancy.
La cirugía carotídea en pacientes asintomáticos sigue siendo un tema controvertido.
La indicación de la endarterectomía (EA) como método de elección en el manejo de los pacientes con estenosis carotídea sintomática se estableció en la década de los 80 a raíz de los estudios North American Symptomatic Carotid Endarterectomy Trial (NASCET)1 y European Carotid Surgery Trial (ECST)2.
El estudio NASCET aleatorizó 2.885 pacientes en 2 grupos: EA carotídea y mejor tratamiento médico (MTM), con un tiempo de seguimiento inicialmente previsto de 5 años. El ECST, con un diseño similar, incluyó 3.024 pacientes durante 10 años. Aunque el método de medición de la estenosis fue ligeramente diferente, con una tendencia a la sobrestimación en el ECST respecto al NASCET, y una mayor morbilidad quirúrgica en el estudio europeo (7,5% en el ECST vs. 5,8% en el NASCET), ambos presentaron resultados similares en el grupo de estenosis>70%. La diferencia en la incidencia de ictus ipsilaterales respecto al MTM fue de 8,9 vs. 28,3%, y 10,5 vs. 19% en el NASCET y ECST, a los 3 y 5 años, respectivamente.
A raíz de estos resultados, la EA carotídea se estableció, y sigue considerándose en la actualidad, el tratamiento de elección en el manejo de la estenosis carotídea>70% en pacientes sintomáticos, aunque el uso del stenting ha ido ganando terreno como método alternativo, especialmente en pacientes de riesgo quirúrgico elevado.
Sin embargo, el beneficio de la EA en pacientes asintomáticos permaneció controvertido, con resultados variables en los principales estudios observacionales (Mayo Asymptomatic Carotid Endarterectomy Study Group3, 1992; Libman et al.4, 1994; Caracci et al.5, 1989). En la década de los 90, sendos estudios aleatorizados, llevados a cabo por los mismos grupos involucrados en el NASCET y el ECST, demostraron, de forma aparentemente, concluyente el beneficio del procedimiento en los grupos de estenosis severa (ECI>60%) frente al mejor tratamiento médico de la época, basado fundamentalmente en el control de los factores de riego vascular y el uso de antiagregantes.
El estudio Asymptomatic Carotid Atherosclerosis Study (ACAS)6 incluyó 1.662 pacientes, y el Asymptomatic Carotid Surgery Trial (ACST)7, 3.120 con ECI>60% asintomática, que fueron aleatorizados en 2 grupos, con un diseño similar al de los estudios anteriores sobre pacientes sintomáticos. Aunque, de nuevo, la morbimortalidad a los 30 días del procedimiento fue ligeramente superior en el estudio europeo (3,1% en el ACST frente a 2,3% en el ACAS), el seguimiento a los 5 años demostró una menor incidencia de ictus en el grupo quirúrgico frente al de MTM: 6,4 vs. 11,8%, y 5,1 vs. 11% en el ACST y ACAS, respectivamente.
Esta diferencia se mantuvo en el reanálisis de los resultados del ACST a los 10 años, registrando una incidencia de ictus ipsilaterales del 13,4% en el grupo de pacientes tratados mediante EA carotídea, frente al 17,9% en el de pacientes sometidos a MTM8.
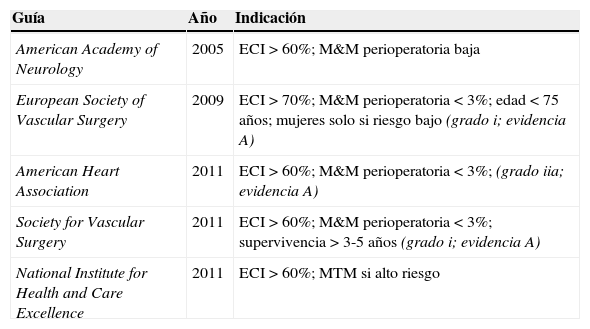
La evidencia aportada por estos estudios (grado A) se consideró suficiente para establecer la indicación de EA en pacientes asintomáticos y su incorporación en la mayor parte de las guías internacionales de tratamiento (tabla 1).
Principales guías internacionales e indicación para el tratamiento de estenosis carotídea en pacientes asintomáticos
| Guía | Año | Indicación |
|---|---|---|
| American Academy of Neurology | 2005 | ECI>60%; M&M perioperatoria baja |
| European Society of Vascular Surgery | 2009 | ECI>70%; M&M perioperatoria<3%; edad<75 años; mujeres solo si riesgo bajo (grado i; evidencia A) |
| American Heart Association | 2011 | ECI>60%; M&M perioperatoria<3%; (grado iia; evidencia A) |
| Society for Vascular Surgery | 2011 | ECI>60%; M&M perioperatoria<3%; supervivencia>3-5 años (grado i; evidencia A) |
| National Institute for Health and Care Excellence | 2011 | ECI>60%; MTM si alto riesgo |
ECI: estenosis carótida interna; MTM: mejor tratamiento médico; M&M: morbimortalidad.
Sin embargo, su coste-efectividad se ha cuestionado por el número de pacientes que es necesario tratar (NNT) para prevenir un ictus a los 5 años (NNT: 17 en el ACAS vs. NNT: 19 en el ACST), especialmente en contraste con la cirugía en pacientes sintomáticos (NNT: 5 en el NASCET-3 años vs. NNT: 12 en el ECST-5 años) (tabla 2). Más recientemente, la reducción progresiva de la incidencia de ictus en los países occidentales, así como el refinamiento del MTM tras la incorporación de las estatinas en la prevención del riesgo cardiovascular global, ha introducido nuevos elementos de incertidumbre sobre la eficacia de la EA carotídea en estos pacientes.
Estimación del número de ictus prevenidos a los 5 años por cada 100 pacientes tratados en función de los valores de morbimortalidad y número de pacientes necesario a tratar de los principales estudios epidemiológicos
| Estudio (tiempo de seguimiento) | Morbimortalidad operatoria | NNT | Ictus prevenidosa |
|---|---|---|---|
| Asintomáticos | |||
| ACAS (5 años)6 | 2,3% | 17 | 5,9 |
| ACST (5 años)7 | 3,1% | 19 | 5,3 |
| ACST (10 años)8 | 3% | 22 | 4,6 |
| ACST (5 años)13 | 0% (teórico) | 12 | 8,3 |
| ACST (10 años)13 | 0% (teórico) | 13 | 7,4 |
| Serie actual (5 años)b | 0,9% | 14 | 7,3 |
| Serie actual (10 años)c | 0,9% | 15 | 6,5 |
| Sintomáticos | |||
| ECST (60-99%) (5 años)2 | 7,5% | 12 | 8,5 |
| NASCET (70-99%) (3 años)1 | 5,8% | 5 | 19,4 |
| NASCET (50-69%) (5 años)26 | 6,7% | 15 | 6,5 |
ACAS: Asymptomatic Carotid Atherosclerosis Study; ACST: Asymptomatic Carotid Surgery Trial; ECST: European Carotid Surgery Trial; NASCET: North American Symptomatic Carotid Endarterectomy Trial; NNT: número de pacientes que es necesario tratar.
El objetivo de este estudio consistió en: analizar los resultados de una serie de pacientes, en un único centro, sometidos a cirugía por estenosis carotídea asintomática (ECA), así como valorar el número de ictus teóricamente prevenidos y su extrapolación a distintos supuestos de seguimiento y morbimortalidad.
Pacientes y métodoDiseño: cohorte histórica. Retrospectivo. Población: pacientes sucesivos sometidos a EA por ECA en los últimos 5 años. Indicación para EA: estenosis carotídea>70% asintomática. Método: se revisaron los expedientes clínicos de todos los pacientes sometidos a cirugía por ECA en el periodo comprendido entre enero 2009-diciembre 2013. Se realizaron 2 intentos de contacto telefónico en aquellos casos sin control durante más de un año. Análisis estadístico: descriptivo, análisis de supervivencia. Estimación de número de ictus prevenidos por extrapolación del NNT de los 2 principales estudios epidemiológicos (ACAS y ACST) con los valores de morbimortalidad teóricos de dichos estudios y de la serie actual, así como de distintos periodos de tiempo considerados (5 y 10 años).
ResultadosEl análisis de la base de datos informatizada permitió identificar 111 procedimientos de EA por ECI>70% en 97 pacientes asintomáticos realizados en el periodo 2009-2013. Noventa pacientes eran hombres, y 7, mujeres, con una edad media de 67,4±3,4 años. Entre los factores de riesgo vascular destacó el antecedente de tabaquismo (70,4%), hipertensión arterial (80,9%), diabetes (42,6%) y dislipidemia (62,6%).
El diagnóstico de ECI>70% se estableció mediante eco-doppler tomando como base el criterio de velocidad sistólica máxima>200cm/s, previamente validado en nuestro Laboratorio de Diagnóstico Vascular, y se confirmó mediante prueba de imagen (angio-TC o angio-RM). Se calculó el porcentaje de estenosis en función de la relación entre el diámetro arterial en el punto de máxima estenosis y la ACI distal a la misma (método NASCET).
Noventa y siete procedimientos fueron unilaterales, y bilateral en 14 (14,4%) pacientes. La técnica quirúrgica más utilizada fue la EA convencional y cierre con parche de PTFE o pericardio bovino, seguida de la EA por eversión en 14 (12,6%) casos, según la preferencia del cirujano.
La técnica anestésica de elección fue la anestesia general, excepto en 22 (19,8%) pacientes intervenidos bajo anestesia locorregional. Se utilizó protección cerebral mediante shunt intraluminal en 20 (18%) procedimientos, a discreción del cirujano, en función del método de monitorización intraoperatoria disponible. En todos los casos esta se llevó a cabo mediante oximetría cerebral (Invos®) y, de forma selectiva, doppler transcraneal o potenciales evocados somatosensoriales en el contexto de un estudio de investigación. Los criterios utilizados para la indicación de colocación de shunt incluyeron la disminución de los niveles de oximetría>20% respecto al hemisferio contralateral, disminución de la velocidad sistólica máxima en la arteria cerebral media (ACM) (doppler transcraneal)>50% respecto a los valores previos al pinzamiento, o disminución de los potenciales motores (potenciales evocados somatosensoriales) ipsilaterales.
La mortalidad perioperatoria (30 días) incluyó un (0,9%) paciente, como consecuencia de insuficiencia respiratoria aguda. No se produjeron accidentes neurológicos en dicho periodo. Las complicaciones sistémicas incluyeron 2 (1,8%) casos de neumonía intrahospitalaria, y las locales: hematoma de herida en 6 (5,4%) casos, lesión de pares craneales en 4 (3,6%) por lesión del x par (uno), rama mandibular del facial (2) y síndrome de Horner transitorio (uno), e infección de herida operatoria en otro caso.
El tiempo medio de seguimiento fue de 2,7 años. Durante dicho periodo, fallecieron 6 (5,4%) pacientes. Se detectó un ictus (0,9%) por oclusión de la ACM ipsilateral y 4(3,6%) reestenosis>70%, 2 de las cuales fueron sometidas a stenting de la ACI. A pesar de al menos 2 intentos de contacto telefónico, no se consiguió información de 15 (6,3%) pacientes, siendo considerados como pérdidas de seguimiento.
La estimación de ictus teóricamente prevenidos, en función de los valores de morbimortalidad y NNT de los 2 principales estudios epidemiológicos (ACAS y ECST) y de la serie actual, aparecen reflejados en la tabla 2.
DiscusiónAunque la indicación de EA carotídea en pacientes asíntomáticos aparece en las recientes revisiones de las recomendaciones de las principales sociedades científicas (ESVS 20099, American Heart Association 201110, Society for Vascular Surgery 201111) (tabla 1), su beneficio ha sido cuestionado por otros grupos.
Los principales argumentos para esta postura discrepante se basan en la necesidad de tratar un mayor número de pacientes para la prevención de un ictus y en la mayor eficacia del MTM, especialmente con el uso intensivo de estatinas en estos pacientes.
En efecto, el NNT para prevenir un evento es uno de los mejores indicadores de la eficacia de un tratamiento con finalidad preventiva. Su cálculo se establece como la inversa de la reducción del riesgo absoluto por efecto de dicho tratamiento. Por ejemplo, la incidencia de ictus ipsilaterales en el estudio ACAS fue de un 5,1% en el grupo sometido a EA, frente al 11% en el grupo control (MTM). Por tanto, se estima que la reducción en el riesgo absoluto fue del 5,9% y, por tanto, 17 ([1/5,9]×100) el NNT o endarterectomías que es necesario realizar para prevenir un ictus. No obstante, tan importante como este parámetro es el tiempo de seguimiento del estudio, 5 años en el diseño inicial tanto del ACAS como del ECST, y 10 años en la revisión del ACST de 2010 (ver tabla 2). Con cierta frecuencia se observan en la literatura valores de NNT desproporcionadamente elevados correspondientes a extrapolaciones o periodos de seguimiento intermedio a 2 o 3 años. Sin embargo, esta tergiversación en la interpretación de los resultados debería prevenirse si queremos realizar comparaciones objetivas entre los distintos estudios. Una forma alternativa de presentación es la reducción en el riesgo anual de ictus por efecto del tratamiento. Sin embargo, estas cifras no tienen en cuenta el comportamiento no lineal de la enfermedad, o la dilución del beneficio, como consecuencia del aumento del riesgo de muerte por otras causas, al considerar intervalos de tiempo excesivamente largos. No obstante, es necesario tener en cuenta que la expectativa de vida de estos pacientes supera ampliamente los 5 años, estimándose en un 73% los que sobrepasan dicho umbral en el modelo de Conrad et al.12, y, por tanto, el beneficio esperado debería extrapolarse a dicha expectativa.
Esta argumentación ha sido extensamente expuesta y reflexionada por Naylor13. En su artículo, algunos de cuyos datos aparecen reflejados en la tabla 2, recoge extrapolaciones asumiendo una morbimortalidad del 0% y tiempos medios de seguimiento de 10 años. Como puede apreciarse, su efecto sobre el número de ictus finalmente prevenidos en una serie como la aquí presentada tendría un efecto similar, con una reducción adicional de alrededor del 50% del riesgo de ictus. Valores de morbimortalidad como los de la presente serie (0,9%) sitúan el nivel de eficacia del tratamiento en una posición intermedia, con la prevención teórica de 7,3 ictus a los 5 años.
La disminución en la incidencia de ictus en las 2 últimas décadas es una observación constatada en diversos estudios. Abbot14, en su metaanálisis de 11 estudios entre 1985 y 2007, registró un descenso desde el 3,5 hasta el 1,7% en ECI>50% asintomáticas. Por otra parte, se estima en un 67% la reducción de la tasa de ictus ipsilaterales, a los 5 años, en el intervalo de tiempo que separa los 2 principales estudios epidemiológicos, 11% en el ACAS (1995)6 y 3,6% en la segunda versión del ACST (2010)8.
La explicación a este fenómeno no está completamente aclarada, aunque se ha asociado a un mejor control de los factores de riesgo vascular y, muy especialmente, al uso de estatinas en la población de riesgo.
Con base en estas observaciones, y en los resultados de algunos estudios (ASED 200515, SPARCL 200716, SMART 200717, Oxford Vascular 200718, ACSRS 201019, SAMMPRIS 201020), se ha evidenciado que, en la actualidad, el MTM es el tratamiento de elección ante pacientes con ECI asintomática.
En efecto, Abbot14, a partir de los principales datos de su metaanálisis, disminución de la incidencia de ictus y coste entre 3 y 8 veces inferior, plantea que el tratamiento médico es la mejor alternativa.
No obstante, algunos argumentos pueden esgrimirse en contra de esta generalización. En primer lugar, la mayor parte de estos estudios presentan un bajo nivel de evidencia (nivel ii, grado B), a veces sobre muestras no homogéneas que incluyen pacientes sintomáticos y, en su mayoría, sobre pacientes con grados moderados de estenosis, en los que la EA carecería de indicación.
Por otra parte, los beneficios del MTM también se extienden al grupo de pacientes sometidos a EA carotídea. No debemos olvidar que, aunque tan solo el 10% de los pacientes incluidos en el ACST tomaban estatinas en 1993, su uso se generalizó hasta el 80% de los pacientes al final del periodo de seguimiento (2006-2008)8. Además, aunque las cifras de morbimortalidad perioperatoria de estos estudios obligaron a establecer un umbral de seguridad del 3% para garantizar el beneficio del tratamiento quirúrgico, estas se han mostrado inferiores en series posteriores. De hecho, los resultados preliminares a 12 meses del ACST221 y los del CREST22 ofrecen tasas de morbimortalidad perioperatoria del 1 y 1,3%, respectivamente, similares a la de nuestra serie.
Una baja relación coste-efectividad se ha argumentado en contra de la EA carotídea en pacientes asintomáticos14,23. Sin embargo, son múltiples las variables a considerar en el diseño de estos modelos predictivos, ofreciendo distintas interpretaciones. De hecho, Nagaki et al.24, en su análisis sobre pacientes de bajo riesgo quirúrgico, evidencian un beneficio de 0,38 y 0,16 QALY en pacientes sintomáticos y asintomáticos, respectivamente. Por otra parte, Thapar et al. estimaron un coste de 3.254£/QALY ganado por efecto de la EA carotídea en pacientes asintomáticos de edad<75 años. Dicho coste estaría muy por debajo del umbral de C/E considerado como aceptable en Reino Unido (20.000£)25.
Volviendo a la argumentación del inicio de la discusión, la pregunta objetiva debería plantearse en los términos de si está justificado operar a 100 pacientes para evitar que entre 5 y 8 de ellos desarrollen un ictus en los 5 años siguientes.
La respuesta desde una perspectiva intuitiva y humanitaria sería probablemente afirmativa, dados los efectos potencialmente devastadores de la enfermedad en el paciente y su entorno.
Los detractores probablemente argumentarán mediante el silogismo inverso que, aunque consiguiéramos evitar un ictus en ese número de pacientes, al menos uno de ellos sufrirá un ictus o fallecerá en el intento, y entre 92 y 95 podrían haberse ahorrado la intervención.
La paradoja surge al observar que esta discusión apenas se suscita al hablar del mismo tratamiento en pacientes que ya han sido afectados por la enfermedad, incluso con secuelas irreversibles. La finalidad del tratamiento en pacientes sintomáticos sigue siendo preventiva y con unos márgenes reducidos. Es verdad que el número de ictus prevenidos en este grupo aumenta hasta los 9-19 en el mismo grado de estenosis. No obstante, no debemos olvidar que, principalmente a partir del reanálisis de los resultados del NASCET26, la indicación del tratamiento se liberalizó en el grupo de pacientes sintomáticos con ECI>50%, incluyéndose como indicación de EA en las guías de la Society for Vascular Surgery y la American Heart Association. Sin embargo, su beneficio se reduce a prevenir menos de 7 ictus a los 5 años, inferior al teóricamente obtenido en la presente serie sobre pacientes asintomáticos27 (ver tabla 2).
Desde una perspectiva economicista, el coste de la intervención es relativamente bajo, y no supera el umbral de coste-efectividad socialmente aceptable en la mayor parte de los países occidentales, aunque, a diferencia de la cirugía en pacientes sintomáticos, es necesario añadir el coste del screening. Aparentemente, este no estaría justificado en la población general, ni aun por encima de los 65 años (prevalencia<5%), pero sí probablemente en nuestros pacientes, con enfermedad vascular establecida (prevalencia>20%).
No obstante, independientemente de la postura final, partidarios y detractores coinciden, en general, en que la estimación del riesgo de la ateromatosis carotídea, basada exclusivamente en la reducción del diámetro de la luz arterial por efecto de la estenosis, es probablemente insuficiente.
Un enfoque más adecuado del problema requeriría una mayor precisión en la estratificación del riesgo de ictus y la estimación de la probabilidad de supervivencia. Existen cada vez más aproximaciones en la identificación de las subpoblaciones de mayor riesgo, tanto desde la perspectiva de la caracterización de la placa mediante técnicas de imagen (US19, RM28, TC29, PET-TC30), como hemodinámicas, a partir de la identificación de señales embólicas en el doppler transcraneal31, detección de lesiones silentes28, tendencia a la progresión de la placa32 o identificación de factores protectores como la calcificación33.
En conclusión, con base en los resultados de nuestra serie, la estimación de ictus prevenidos bajo distintos supuestos de morbimortalidad perioperatoria y seguimiento, y argumentos expuestos en la discusión, creemos que la EA no debe descartarse como tratamiento de elección en pacientes con ECA, siempre y cuando se mantengan un riesgo quirúrgico y expectativa de vida adecuados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.