La enfermedad tromboembólica venosa es un proceso patológico que abarca tanto la trombosis venosa profunda como el tromboembolismo pulmonar. Son muchos los estudios que recogen la alta incidencia de esta enfermedad en pacientes afectos de lesiones neurológicas como la lesión medular, el traumatismo craneoencefálico o el ictus, todos ellos pacientes susceptibles de ingreso en centros de rehabilitación.
En la literatura publicada existe controversia acerca de la necesidad de screening de enfermedad tromboembólica venosa en estos pacientes, el tiempo de mantenimiento de la profilaxis o los fármacos a utilizar tanto en la profilaxis como una vez se establece la sospecha o el diagnóstico definitivo de dicha enfermedad.
Con esta revisión de la literatura pretendemos hacer un consenso para intentar aclarar dudas y establecer unas directrices de sospecha, diagnóstico y tratamiento que nos ayuden en la práctica clínica diaria.
Venous thromboembolism is a disease that includes both deep vein thrombosis and pulmonary embolism. Many studies reflect the high incidence of this disease in patients with neurological injuries such as, spinal cord injury, traumatic brain injury, or stroke, and all these patients are candidates for admission to rehabilitation centres.
There is controversy in the published literature on the need for screening of deep vein thrombosis in these patients, time on prophylaxis drug maintenance or the drugs to use for prophylaxis once suspected or when the definite diagnosis of this disease is established.
A review of the literature is presented in order to attempt to clarify these doubts and establish guidelines for suspicion, diagnosis and treatment to help us in daily clinical practice.
La enfermedad tromboembólica venosa (ETEV) es un proceso patológico que abarca tanto la trombosis venosa profunda (TVP) como el tromboembolismo pulmonar (TEP). Es una importante causa de morbimortalidad en los pacientes con lesión neurológica, en fase de rehabilitación aguda y crónica1.
La incidencia de las ETEV diagnosticadas y no diagnosticadas varía ampliamente según la población que sea estudiada y los métodos diagnósticos empleados. Los TEP clínicos ocurren entre un 26% y un 67% de las TVP proximales no tratadas, y se asocian con una mortalidad de un 11% a un 23%. Si fuesen tratadas, estas cifras descenderían a un 5% y 1% respectivamente2.
En cuanto a la lesión medular, un reciente metaanálisis data la incidencia de TVP en lesionados medulares del 5,3% al 38,6% con una incidencia media del 16,9%; la mayoría de los datos han sido analizados en Norteamérica y Europa3. Otros estudios, en diferentes áreas geográficas, muestran incidencias desde 4,8% al 40%, siendo la más baja en la población asiática4.
En pacientes con ictus sin profilaxis se ha estimado una prevalencia de hasta un 50% en las 2 primeras semanas. En muchos casos la TVP se desarrolla en la primera semana. La edad avanzada, la gravedad de la parálisis de las extremidades y la presencia de deshidratación son factores de riesgo importantes en su desarrollo. Alrededor del 15% de pacientes con una TVP no tratada sufre un TEP, una importante causa de mortalidad en estos pacientes. La mayoría de casos fatales se produce entre la segunda y la cuarta semana5,6.
La relación entre la ETEV y los traumatismos craneoencefálicos (TCE) ha sido reconocida desde hace más de un siglo. Sin embargo, es difícil ofrecer unas cifras exactas sobre su incidencia7. La incidencia de la ETEV varía según la literatura revisada y oscilan entre un 10% y un 90%7.
El objetivo del presente trabajo es resumir el consenso realizado por un grupo de expertos sobre la profilaxis y tratamiento de la ETEV en la lesión medular y el daño cerebral adquirido, auspiciado por el Capítulo Español de Flebología y Linfología de la Sociedad Española de Angiología y Cirugía Vascular.
Presentación clínicaClínica de trombosis venosa profundaLos signos y síntomas incluyen el edema de pantorrilla, tirantez, pitting, venas superficiales dilatadas, aumento de temperatura y eurritmia. El signo de Homans es inespecífico y poco sensible. Con la rodilla en flexión realizar dorsiflexión forzada de tobillo, el dolor en la pantorrilla es sugestivo de TVP. Se observa solo en el 33% de los pacientes de media. La mayoría de los expertos creen que es poco específico, insensible y poco fiable. Existen protocolos y escalas con criterios clínicos para facilitar el diagnóstico de TVP. La más importante de ellas es la escala de Wells (tabla 1).
Predicción clínica de trombosis venosa profunda (puntuación de Wells)
| Cáncer activo | 1 |
| Parálisis, paresia o inmovilización de miembros inferiores | 1 |
| Postración en cama más de 3 días | 1 |
| Sensibilidad localizada de distribución en venas profundas | 1 |
| Hinchazón completa de un miembro | 1 |
| Hinchazón unilateral de la pantorrilla mayor de 3 cm | 1 |
| Edema unilateral | 1 |
| Venas superficiales colaterales | 1 |
| Diagnóstico alternativo tan o más probable que trombosis venosa | –2 |
Interpretación≥3 puntos riesgo elevado, 1 a 2 puntos riesgo moderado, <1 punto bajo riesgo.
La trombosis en los MMSS supone del 1% al 4% de todos los episodios, clasificadas como primarias o secundarias, siendo estas las más frecuentes, y están relacionadas con el esfuerzo y el estado de hipercoagulabilidad.
Tromboembolismo pulmonarRepresenta la complicación más frecuente y grave de la TVP. La clínica consiste en disnea, dolor costal, taquicardia o cualquier otro tipo de arritmia. Casi el 50% son asintomáticos. El embolismo ocluye una o varias arterias pulmonares, con efectos hemodinámicos que producen un aumento del trabajo del ventrículo derecho y de la estación interalveolar e hipoxemia debido a un fallo cardíaco. Se traduce en el paciente con difícil y mala respuesta a las maniobras de reanimación cardiopulmonar. Del 10% al 20% son letales, pero una vez tratados, el riesgo y los síntomas disminuyen después de las 2 primeras semanas.
DiagnósticoDímero-DLos niveles de D-dímero típicamente están aumentados en pacientes con TVP en fase aguda, pero muchas otras situaciones pueden aumentar sus niveles (embarazo, edad, cáncer, procesos inflamatorios, traumatismo, etc.). El D-dímero tiene alta sensibilidad (90-100%) pero baja especificidad (19-94%). Se usa como primera prueba diagnóstica, junto con la sospecha clínica, para la realización posterior de una eco-doppler. Presenta un valor predictivo negativo cercano al 100%.
Eco-dopplerPrimer método de diagnóstico no invasivo. Se trata de un método coste-efectivo en la vigilancia de los eventos trombóticos en pacientes lesionados medulares ingresados en centros de rehabilitación8. Hoy día es una pieza clave en el diagnóstico de TVP en pacientes con sospecha clínica, constituyendo en todos los protocolos la exploración estándar de forma sistematizada.
Michiels9 demostró un alto valor predictivo positivo (98%) para trombosis proximal, pero pierde sensibilidad para venas distales. En una última revisión del 201110 presenta alta sensibilidad (89% a 96%) y especificidad (96% a 100%). Como ventaja no es invasiva, es barata, portátil, pero está limitada por la subjetividad del explorador y la visibilidad en determinados territorios y pacientes obesos o con edema importante.
FlebografíaPrueba considerada como la prueba oro (gold standard) tanto en sintomáticos como en asintomáticos. Se considera en los últimos tiempos como una herramienta inadecuada, ya que es invasiva, con potenciales complicaciones, costosa y técnicamente más complicada, y también existe un riesgo sobreañadido de trombosis por la inducción del contraste.
Angio tomografía computarizada pulmonarSe considera el gold standard en el diagnóstico del TEP, con una especificidad y sensibilidad del 99% al 100%.
Métodos de screening para trombosis venosa profunda en pacientes con lesión medularPodemos concluir que el eco-doppler es la primera opción, aunque no es suficiente para la confirmación del diagnóstico en todos los casos, principalmente en sectores distales con alta sospecha diagnóstica sin confirmación por el mismo, siendo aquí el gold standard la flebografía.
Factores de riesgoDivididos en generales, genéticos y adquiridos (tablas 2-4).
Factores de riesgo de enfermedad tromboembólica venosa
| Edad |
| Sexo masculino |
| Fractura de pelvis |
| Fracturas de las extremidades inferiores |
| Lesiones cerebrales traumáticas |
| Elevada puntuación en el Injury Severity Score |
| Lesiones torácicas |
| Intervenciones quirúrgicas |
| Lesiones medulares espinales agudas |
Factores de riesgo genéticos de enfermedad tromboembólica venosa
| Déficit de antitrombina |
| Grupo sanguíneo A |
| Mutación factor v Leiden |
| Niveles elevados de factores de coagulación |
| Hiperhomocisteinemia |
| Anticoagulante lúpico |
| Metil tetrahidrofolato reductasa (si niveles elevados de homocisteína) |
| Déficit de proteína C |
| Déficit de proteína S |
| Mutación del gen de protrombina 20210 |
| Factores de riesgo adquiridos no diagnosticados |
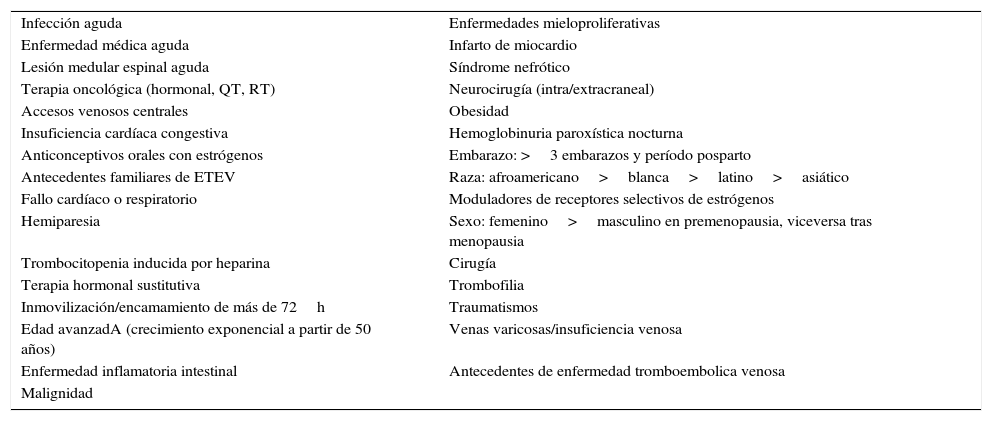
Factores de riesgo adquiridos de enfermedad tromboembólica venosa
| Infección aguda | Enfermedades mieloproliferativas |
| Enfermedad médica aguda | Infarto de miocardio |
| Lesión medular espinal aguda | Síndrome nefrótico |
| Terapia oncológica (hormonal, QT, RT) | Neurocirugía (intra/extracraneal) |
| Accesos venosos centrales | Obesidad |
| Insuficiencia cardíaca congestiva | Hemoglobinuria paroxística nocturna |
| Anticonceptivos orales con estrógenos | Embarazo: >3 embarazos y período posparto |
| Antecedentes familiares de ETEV | Raza: afroamericano>blanca>latino>asiático |
| Fallo cardíaco o respiratorio | Moduladores de receptores selectivos de estrógenos |
| Hemiparesia | Sexo: femenino>masculino en premenopausia, viceversa tras menopausia |
| Trombocitopenia inducida por heparina | Cirugía |
| Terapia hormonal sustitutiva | Trombofilia |
| Inmovilización/encamamiento de más de 72h | Traumatismos |
| Edad avanzadA (crecimiento exponencial a partir de 50 años) | Venas varicosas/insuficiencia venosa |
| Enfermedad inflamatoria intestinal | Antecedentes de enfermedad tromboembolica venosa |
| Malignidad |
La población de pacientes con enfermedades neurológicas o neuroquirúrgicas presenta alto riesgo de sufrir ETEV, lo que apoya la utilización temprana de tromboprofilaxis en todos los pacientes con estas lesiones, ya sea mediante medidas mecánicas o farmacológicas11.
Profilaxis mecánicaDebe iniciarse en el periodo temprano de la lesión, en cuanto sea factible realizarla12. Tiene mayor importancia en casos en los que existe contraindicación para utilizar profilaxis farmacológica. El uso aislado de medidas de profilaxis mecánica podría no ser adecuado para la prevención de TVP13.
- -
Compresión neumática intermitente. No está disponible en todos los hospitales y centros de rehabilitación debido a su coste. Debe realizarse con un dispositivo programable y con material ajustable que cubra el pie y la pierna. Se suele aplicar durante 3h al día, separadas en 2 aplicaciones diarias (para evitar el daño vascular que podría ocasionar una excesiva compresión14.
- -
Medias elásticas de compresión. Son citadas en todos los artículos como adyuvantes a la terapia de compresión intermitente. En la base de su actividad está la disminución de la capacitancia venosa. No se cita en ningún artículo la gradación de la presión que debe ejercer la media de compresión en el tobillo, así que tomaremos como medida básica de presión la que se suele utilizar en la insuficiencia venosa crónica de 30-40mmHg.
- -
Deambulación precoz. La mejor medida para realizar profilaxis en estos pacientes, cuyo factor de riesgo más importante es la inmovilización, es la deambulación temprana en cuanto sea posible. En un artículo publicado en relación con el terremoto de Pakistán recogen que la utilización regular de ejercicios de movilidad y masajes de compresión de las extremidades paralizadas es una intervención profiláctica relativamente exitosa para la prevención de TVP15.
- -
Interrupción de la vena cava inferior. Según la guía de prevención de la asociación americana (ACCP) de 2008, no se recomienda el uso de filtros de vena cava como profilaxis primaria de ETEV; es decir, en ausencia de TVP diagnosticada11.
Inicialmente se utilizaba heparina no fraccionada (HNF) y se han realizado múltiples estudios comparando diferentes dosificaciones de esta con heparina de bajo peso molecular (HBPM). Finalmente, estudios recientes, han visto superioridad en la utilización de HBPM en comparación con HNF en pacientes con lesión medular16. El inicio del tratamiento con HBPM debe ser lo antes posible, tan pronto como se haya asegurado la correcta hemostasia.
La HBPM más utilizada es la enoxaparina a dosis de 40mg al día12. Se debe realizar recuento de plaquetas para vigilar la trombocitopenia inducida por heparina. En pacientes con enfermedad renal, mayores, con diabetes mellitus o con riesgo de sangrado se debe ajustar la dosis de HBPM al aclaramiento de creatinina. Enoxaparina es la única HBPM con reducción de dosis fija en pacientes con insuficiencia renal grave (aclaramiento <30ml/min): 20g/24h.
En cuanto a la duración óptima de tratamiento se recomienda un mínimo de 2 semanas, siendo la duración máxima un tema de discusión que no termina de estar totalmente claro.
Profilaxis: aspectos particulares- -
Profilaxis después del ictus. La indicación de inicio de la profilaxis debe tomarse en los primeros días de ingreso hospitalario. La duración del período de profilaxis tromboembólica más allá de los primeros 14 días es un tema sujeto a controversia en la literatura, y de difícil extensión directa a la práctica clínica habitual.
Tanto en el paciente isquémico como en el hemorrágico la literatura médica apoya el uso de profilaxis de la enfermedad tromboembólica, especialmente con HBPM sobre otras medidas farmacológicas y no farmacológicas de profilaxis, si no existen factores de riesgo que hagan pensar en un riesgo hemorrágico excesivo17,18.
- -
Prevención en paciente con ictus isquémico en la fase aguda. Una opción es la prevención con HBPM a dosis profiláctica, iniciándose en las primeras 48h y manteniéndose durante el ingreso hospitalario o hasta que se recupere la movilidad. No se recomienda el tratamiento con medias de compresión elásticas. La combinación de tratamiento farmacológico con sistema de compresión neumática intermitente podría proporcionar un beneficio adicional18.
- -
Prevención en paciente con ictus hemorrágico en la fase aguda. Existe menor información de la profilaxis con heparina después de una hemorragia cerebral primaria. Aparentemente la profilaxis con heparina no aumenta el riesgo de resangrado de manera significativa. No parece existir diferencias con lo que respecta a iniciar la profilaxis con dosis bajas de heparina en el día segundo o cuarto, en cuanto a beneficio ni riesgos. Una opción de tratamiento en el paciente con una hemorragia aguda primaria y movilidad limitada es el tratamiento con HBPM a dosis profilácticas. En pacientes con un riesgo de resangrado inaceptable puede hacerse prevención mecánica con compresión intermitente neumática18.
- -
Duración de la anticoagulación. La duración óptima de la profilaxis con heparina en paciente con ictus no está bien determinada. La mayoría de estudios consideran como tiempo de tratamiento habitual los primeros 14 días de ingreso hospitalario, y en la práctica clínica real la duración de la profilaxis, en muchas ocasiones, coincide con la duración del ingreso hospitalario agudo y a menudo es inferior a 14 días.
En el paciente médico, en el estudio EXCLAIM19, se demostró que la extensión de la profilaxis con enoxaparina 40mg al día (28 días) reduce el riesgo de trombosis comparado con placebo (2,5% vs. 4% respectivamente), aunque paralelamente se asocia a un aumento de sangrado mayor (0,8% vs. 0,3%)9-11. En el análisis del subgrupo de pacientes con ictus de este estudio EXCLAIM, donde se analizan 198 participantes con fármaco activo vs. 191 con placebo, se obtienen unos porcentajes de tromboembolismo de 2,4% vs. 8%; por el contrario, el porcentaje de sangrados mayores es de 1,5% vs. 0%. Por tanto, probablemente la relación beneficio-riego favorable solo se observaría en grupos de alto riesgo seleccionados, con múltiples factores de riesgo trombótico19.
- -
Profilaxis después de la lesión medular (LM). La profilaxis farmacológica de la ETEV en la LM puede realizarse con uno de los 4 grupos de fármacos anticoagulantes. Los más utilizados son los 2 primeros (aunque la HBPM ha demostrado mayor eficacia y menores complicaciones hemorrágicas que las HNF) seguidos del tercero manteniendo un International Normalized Ratio (INR) de 2-3 (grado de recomendación B)20,21 (tabla 5).
Tabla 5.Profilaxis farmacológica de la enfermedad tromboembólica venosa en lesión medular
Heparinas de bajo peso molecular (HBPM) Dalteparina (5.000UI/24hsc)
Enoxaparina (40mg/24hsc)
Tinzaparina (4.500UI/24hsc)Heparinas no fraccionadas 5.000UIsc/12h en LM incompleta o ajustado a APTT en LM completa Antivitamina K Acenocumarol o warfarina manteniendo INR entre 2-3 Inhibidores directos del factor Xa Fondaparinux 2,5mg sc/24h LM: lesión medular.
La duración de la profilaxis después de la LM es controvertida. Se dice que debe ser individualizada, dependiendo de la condición médica, el apoyo y el riesgo del paciente (nivel ii, grado de recomendación B). Debe mantenerse 8 semanas en pacientes con LM sin complicaciones y 12 semanas o hasta el alta de rehabilitación para aquellos ASIA A, B y C no funcionales con lesiones asociadas u otros factores de riesgo12,22
- -
Profilaxis después del TCE. Se acepta que la heparina administrada tras 24h del ingreso hospitalario en pacientes con TCE es segura para evitar los fenómenos tromboembólicos y evitar las complicaciones de sangrado23. Se contraindica la profilaxis en fase aguda en pacientes con un sangrado activo, con un sangrado periespinal o con coagulopatía no controlada. En la guía de 2007 de Bratton se sugiere el uso de medias de compresión o compresión neumática intermitente en las extremidades inferiores, salvo lesión a ese nivel, hasta que los pacientes caminen. Consideran, además, que las HBPM o dosis bajas de HNF se deberían usar combinadas con agentes mecánicos, aunque hay un riesgo de hemorragia intracraneal. También creen que no existe suficiente evidencia para recomendar un medicamento en particular, dosis o tiempo de duración24.
La duración de la profilaxis en la mayoría de los pacientes viene determinada por su situación clínica y, en general, las guías de práctica clínica no ofrecen datos concluyentes como cuál debe de ser la dosis, qué medicamento es mejor y cuál ha de ser la duración25. En general, se tiende a retirar la profilaxis una vez que el paciente comienza a caminar, pero tampoco existen datos específicos sobre el número de metros o la cantidad de marcha que los pacientes deben de realizar. Por otro lado, existen muchos pacientes que han sufrido traumatismos severos y que no pueden caminar. En estos casos, se suelen extrapolar datos de pacientes con lesión medular, manteniendo la profilaxis durante 3 meses.
TratamientoEl tratamiento de la ETEV es la anticoagulación, a no ser que el riesgo potencial de sangrado sea demasiado alto y ponga en peligro la vida del paciente. La duración de la anticoagulación dependerá de la presencia de estado de hipercoagulabilidad subyacente o la historia previa de ETEV. En general, pacientes con daño cerebral pueden usar con seguridad los anticoagulantes para el tratamiento de TVP o de EP, a menos que el paciente tenga una contraindicación absoluta, alergia a la heparina o trombocitopenia inducida por la heparina.
Se aconseja iniciar precozmente el tratamiento anticoagulante para evitar la progresión del trombo, mejorar las consecuencias hemodinámicas que se están produciendo, minimizar recurrencias (precoces y tardías) y secuelas.
Tratamiento de la trombosis venosa profunda (tabla 6)- -
Heparina no fraccionada. Se aconseja en perfusión IV continua manteniendo el tiempo parcial de tromboplastina activado en 50-60seg.
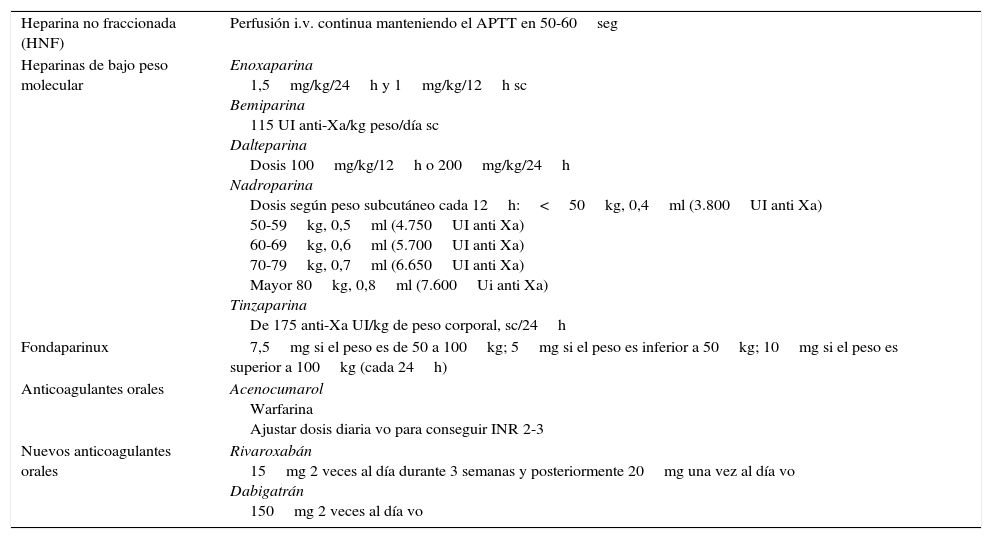
Tabla 6.Tratamiento de la trombosis venosa profunda
Heparina no fraccionada (HNF) Perfusión i.v. continua manteniendo el APTT en 50-60seg Heparinas de bajo peso molecular Enoxaparina
1,5mg/kg/24h y 1mg/kg/12h sc
Bemiparina
115 UI anti-Xa/kg peso/día sc
Dalteparina
Dosis 100mg/kg/12h o 200mg/kg/24h
Nadroparina
Dosis según peso subcutáneo cada 12h:<50kg, 0,4ml (3.800UI anti Xa)
50-59kg, 0,5ml (4.750UI anti Xa)
60-69kg, 0,6ml (5.700UI anti Xa)
70-79kg, 0,7ml (6.650UI anti Xa)
Mayor 80kg, 0,8ml (7.600Ui anti Xa)
Tinzaparina
De 175 anti-Xa UI/kg de peso corporal, sc/24hFondaparinux 7,5mg si el peso es de 50 a 100kg; 5mg si el peso es inferior a 50kg; 10mg si el peso es superior a 100kg (cada 24h) Anticoagulantes orales Acenocumarol
Warfarina
Ajustar dosis diaria vo para conseguir INR 2-3Nuevos anticoagulantes orales Rivaroxabán
15mg 2 veces al día durante 3 semanas y posteriormente 20mg una vez al día vo
Dabigatrán
150mg 2 veces al día vo - -
Heparinas de bajo peso molecular. Las HBPM25,26 presentan una respuesta anticoagulante predecible a dosis fijas y ajustadas a peso corporal, mayor biodisponibilidad, eliminación exclusivamente renal y vida media más larga. Las dosis de las distintas HBPM aconsejables en el tratamiento inicial de la ETEV se recogen en la tabla 6.
- -
Fondaparinux. Es una alternativa a la HNF o HBPM en pacientes en riesgo de trombocitopenia inducida por la heparina. No altera las pruebas de coagulación ni induce la formación de anticuerpos plaquetarios. Su prolongada vida media permite una única dosis al día. Es tan eficaz y segura como la HBPM.
Las ventajas evidentes de las HBPM son que proporcionan mayor comodidad al paciente al no tener que estar conectado permanentemente a una bomba de perfusión, se alcanza más rápidamente el nivel óptimo de anticoagulación, no se requieren controles a intervalos impredecibles y permite al paciente ser tratado en su domicilio.
Es preferible usar la HNF en casos de prever una brusca supresión del tratamiento, en pacientes de edad avanzada, en pacientes con riesgo elevado de complicaciones hemorrágicas, en diabéticos o pacientes con enfermedad renal crónica.
El tratamiento con anticoagulantes orales puede iniciarse el mismo día que se inicia el tratamiento heparínico, pero este último no puede suprimirse antes del 5.° día y hasta que INR sea mayor o igual a 2 durante al menos 24h (como indican las guías ACCP 2012).
- -
Anticoagulantes orales. El efecto anticoagulante se manifiesta entre los 2 y 6 días, en relación directa con la vida media de los factores vitamina K dependientes; el factor vii es el primero en disminuir tras iniciar el tratamiento. La vida media del acenocumarol son 10h y la de la warfarina entre 30 y 80h.
El tiempo para conseguir anticoagulación eficaz es así más corto con acenocumarol que con warfarina, al igual que la recuperación al suprimir el fármaco (de 2 días frente a los 3 a 5 días de la warfarina). Los cumarínicos se administran vía oral, junto con el tratamiento con heparina. Se emplean altas dosis de inicio (10mg de warfarina o 4mg de acenocumarol al día) excepto en ancianos, desnutridos, hepatópatas o pacientes con alto riesgo de hemorragia. El tratamiento con heparina se interrumpe cuando el INR se encuentra en rango terapéutico en 2 mediciones separadas al menos 24h. Las dosis se ajustan para mantener un INR entre 2 y 3.
- -
Nuevos anticoagulantes orales: rivaroxabán. Los ensayos clínicos que apoyan su uso son en el tratamiento de la ETV el EINSTEIN-TVP y el de la EP el EINSTEIN-PE. Dabigatrán ha demostrado no inferioridad frente a warfarina en pacientes con TVP de extremidad inferior en el ensayo RECOVER. Posteriormente han aparecido apixabán y edoxabán.
En un primer episodio de ETEV, con trombosis de causa secundaria (factores reversibles transitorios tales como un postoperatorio, embarazo, puerperio) o en quienes han sufrido un único episodio de TVP distal aislada no provocada, la duración de la profilaxis secundaria sería de 3 meses. En estos pacientes con trombosis venosas distales se aconseja anticoagulación por el riesgo de que la trombosis ascienda.
Para pacientes con un primer episodio de ETEV idiopática o con una trombofilia (heterocigoto para factor v Leiden, déficit de antitrombina, proteína S, proteína C, hiperhomocisteinemia, niveles de factor viii elevados) se aconseja terapia anticoagulante de 6 a 12 meses.
Pacientes con primer episodio de ETEV que presentan anticuerpos antifosfolípido o trombofilia múltiple (por ejemplo, factor v Leiden más mutación G20210a del gen de la protrombina) al menos se aconseja 12 meses de anticoagulación (valorar la anticoagulación indefinida).
Si presenta 2 o más episodios de ETEV, anticoagulación indefinida.
Las HBPM son más eficaces que los anticoagulantes orales en los pacientes con TVP y cáncer.
En estos pacientes se administra HBPM durante los primeros 3 a 6 meses y posteriormente se administran anticoagulantes orales o se prosigue con HBPM indefinidamente o hasta la resolución del cáncer.
Eliminación del trombo en la trombosis venosa aguda- -
Trombólisis sistémica: no se aconseja la administración sistémica de trombolíticos, sino que el fármaco debe infundirse directamente en la masa del trombo, trombólisis directa mediante catéter que puede ser beneficiosa en pacientes seleccionados. Pueden asociarse procedimientos adicionales como angioplastia o la colocación de un stent; su única indicación aceptada actualmente es el tratamiento de la flegmasía cerúlea dolens en pacientes jóvenes.
- -
Trombectomía venosa. Los datos son limitados. Podría reducir los síntomas agudos y la morbilidad postrombótica en determinados pacientes con TVP iliofemoral aguda. Después de la trombectomía, los pacientes deben recibir terapia anticoagulante igual que los que no se someten a este procedimiento. Es ineficaz para controlar la enfermedad tromboembólica y no evita la aparición del síndrome postrombótico.
El empleo de un filtro permanente redujo el riesgo de EP a corto y largo plazo, pero a costa de aumento del riesgo de TVP a los 2 años. Las indicaciones absolutas para la colocación de un filtro de vena cava son: contraindicación absoluta de anticoagulación y TVP recurrente después de adecuada anticoagulación.
Tratamiento del tromboembolismo pulmonar27En la mayoría de los casos el tratamiento es el mismo que para la TVP, la anticoagulación ya descrita previamente. Las HBPM son hoy la primera opción en el tratamiento del TEP agudo no complicado, tratamiento que incluso puede llevarse a cabo en régimen ambulatorio. La anticoagulación con heparina reduce el riesgo de TEP recurrente en un 40% y reduce su mortalidad de un 25% a un 2,5%. Una vez que se diagnostica un TEP, o si existe alta sospecha clínica, se debería comenzar con la anticoagulación siempre y cuando no exista gran riesgo de sangrado por la enfermedad de base. Se inicia con HBPM o fondaparinux. La HNF es una opción y se prefiere cuando el riesgo de sangrado es más alto, debido a su corta acción y reversibilidad27.
- -
Trombólisis. En pacientes con TEP hemodinámicamente inestables se aconseja la trombólisis directa con catéter con el activador del plasminógeno tisular recombinante (rtPa) para lograr una lisis rápida del coágulo en la trombosis masiva de arterias pulmonares, a pesar de los riesgos hemorrágicos. Se aconseja la dosis de 100mg de activador tisular del plasminógeno durante 2h.
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.