La frecuencia de la trombosis venosa profunda distal oscila entre un 20 y un 50% de todas las trombosis profundas de los miembros inferiores y presenta los mismos factores de riesgo que las proximales y que el embolismo pulmonar, con un 50% menos de riesgo de recurrencia. Su historia natural, deficientemente conocida, explica el debate sobre su importancia. La complicación más frecuente es el síndrome postrombótico. El ecodoppler es el método diagnóstico más empleado. El dímero D solo no excluye la trombosis, no es útil como factor pronóstico de recurrencia ni se asocia con el síndrome postrombótico. La selectina P soluble combinada con el índice de Wells es una prueba diagnóstica excelente. La anticoagulación varía entre 3 meses e indefinidamente según la trombosis sea provocada o idiopática. En caso de cáncer se recomienda continuar el tratamiento hasta pasados 6 meses después de su curación o de su remisión completa.
The frequency of the distal deep vein thrombosis is between 20 and 50% of all deep lower limb thrombosis, and has the same risk factors as proximal and pulmonary embolism, and with 50% lower risk of recurrence. Its natural history is not well-known, and may explain the debate about its importance. The most common complication is post-thrombotic syndrome. The echo-Doppler is the most used diagnostic method. D-dimer alone does not exclude thrombosis, is not useful predictors of recurrence, and is associated with post-thrombotic syndrome. Soluble P-selectin, combined with the Wells index is an excellent diagnostic test. Anticoagulation varies between 3 months and indefinitely depending on whether the thrombosis is provoked or idiopathic. If cancer, it is recommended to continue treatment until 6 months after cure or complete remission.
Las trombosis venosas profundas distales (TVPD) son frecuentemente diagnosticadas en pacientes con sospecha de TVP o de embolismo pulmonar (EP), y representan la mitad de todas las TVP diagnosticadas de los miembros inferiores1,2. A pesar de su frecuencia, son uno de los problemas más debatidos en el campo de la enfermedad tromboembólica venosa (ETEV). Esto se debe a la falta de consenso para definir el nivel anatómico por debajo del cual una trombosis se considera distal y a que su historia natural y el riesgo potencial de sus complicaciones tromboembólicas son insuficientemente conocidos debido a la escasez de estudios no intervencionistas, prospectivos y ciegos3. Así, los contradictorios resultados clínicos obtenidos hasta ahora no permiten aplicar unas directrices claras que determinen en qué casos estaría justificado su diagnóstico y tratamiento3,4. Las principales guías clínicas recomiendan abstenerse de tratarlas y realizar únicamente ecografías seriadas —a los 7 y 15 días—, si los síntomas no son graves y el riesgo de extensión es bajo5. Sin embargo, esto es solo una recomendación de grado 2C, lo que implica que otras alternativas terapéuticas pueden ser igualmente razonables6.
El objetivo de nuestro estudio es proporcionar al médico unas pautas de actuación que le permitan conocer en todo momento cómo enfocar esta enfermedad para ofrecer a cada tipo de paciente el tratamiento más adecuado.
La red venosa profunda distal de los miembros inferioresIncluye las 2 venas tibiales anteriores, posteriores y peroneas que acompañan a las arterias correspondientes. Estas 3 redes venosas, que ecográficamente son fácilmente identificables, confluyen y dan lugar a la vena poplítea3. Las venas profundas de la pantorrilla comprenden 2 grupos de venas musculares: las sóleas que se conectan con las venas tibiales posteriores o las peroneas, y las gastrocnemias que drenan en la vena poplítea. Las trombosis venosas musculares aisladas de la pantorrilla no deberían diferenciarse del resto de las TVPD de los miembros inferiores (TVPDMI), dado que clínicamente se consideran un todo anatómico7,8.
EpidemiologíaFrecuenciaLas variaciones existentes sobre la prevalencia de las TVPDMI se deben a una serie de factores.
En primer lugar, al método diagnóstico utilizado, ya sea la flebografía o el ecodoppler (ED). En el primer caso la proporción es del 20% y el segundo representa el 50% de las TVP de los miembros inferiores5.
En segundo lugar, a los tipos de estudios realizados: a) pacientes médicos o quirúrgicos asintomáticos examinados para descartar/confirmar una TVP; b) pacientes ambulatorios con sospecha de TVP o EP; c) pacientes diagnosticados previamente de EP en los que se investiga un posible foco embolígeno; d) a partir de qué nivel de sospecha clínica se realiza el ED y qué diámetro venoso bajo compresión se considera diagnóstico de TVP3,5.
La prevalencia de la TVPDMI para los pacientes con sospecha de EP o TVP oscila entre el 7-11% y el 4-15% respectivamente, y entre el 23 y el 59% para los diagnosticados previamente de TVP1,2. Esta variación puede atribuirse, al menos parcialmente, a las diferentes poblaciones investigadas, así como a las distintas estrategias y protocolos diagnósticos empleados. Se considera que si todos los pacientes fueran explorados con ED, estas trombosis representarían la mitad de todas las TVP diagnosticadas9. Por el contrario, muy pocas TVPDMI pueden confirmarse si el diagnóstico se basa solo en el examen de las venas proximales3.
Factores de riesgoPresentan los mismos factores de riesgo que las TVP proximales (TVPP) y que el EP. Esto confirma que se trata de una expresión clínica diferente de una misma enfermedad, la ETEV5. Las TVPP se asocian a factores de riesgo permanentes como la edad ≥75 años, la insuficiencia cardiaca o respiratoria crónicas y el cáncer1,5. Por el contrario, las TVPDMI se vinculan a factores de riesgo temporales como la inmovilización, la cirugía, los viajes recientes o los traumatismos1,5. La presencia de alteraciones hereditarias trombofílicas no afecta a su prevalencia, aunque una etiología sistémica o los estados protrombóticos parecen más frecuentes en las trombosis distales bilaterales5.
Historia naturalRiesgo de extensión proximal y de embolismo pulmonarSu historia natural, dominada por el riesgo espontáneo de su extensión proximal y el consiguiente EP, es deficientemente conocida, lo que explicaría en gran parte el debate actual sobre la importancia de esta entidad3,5. En ausencia de tratamiento, y a la luz de revisiones recientes, se han demostrado unas tasas de extensión proximal que oscilan entre el 8 y el 15% en pacientes no tratados10. Estas diferencias podrían ser consecuencia del tipo de trabajo realizado, del perfil de las trombosis, de las características de su extensión y de la demora diagnóstica5. Un estudio prospectivo11 muestra que más del 90% de las TVPDMI diagnosticadas, pero no tratadas, y monitorizadas con ED tenían una resolución espontánea completa y solo un 3% presentaban una extensión proximal a los 5-7 días posdiagnóstico, lo que concuerda con datos obtenidos de estudios clínicos efectuados con ED seriados12. Las tasas de EP sintomático en las TVPDMI no tratadas varían entre el 1,6 y el 2,6%, debido a que muchas de estas trombosis asociadas a EP pueden haberse originado en las venas proximales13.
Recurrencia tromboembólicaAlgunas investigaciones14–16 evidencian que el riesgo de recurrencia tromboembólica es un 50% menor que el de las TVPP, y que las tasas acumuladas a los 5 años de seguimiento son 4,8 veces mayores en estas que en las distales17. En un estudio prospectivo realizado en 11.086 pacientes con ETEV aguda y anticoagulados durante 3 meses, las tasas fueron equivalentes (2,7 y 2,2%; p < 0,01)18. El único trabajo llevado a cabo sobre la historia natural de la TVPDMI muestra unas tasas de recurrencia del 7,8% a los 3 meses de seguimiento en los pacientes sin tratamiento antitrombótico11. Una investigación4 desarrollada con ED seriados uno y 2 meses después del episodio trombótico agudo indica que el riesgo de recurrencia está relacionado con el sexo masculino o con pacientes con cáncer, pero necesita ser confirmado con estudios prospectivos aleatorizados.
Síndrome postrombóticoAunque es la complicación más frecuente de la TVP19, disponemos de escasas investigaciones prospectivas, ciegas y no intervencionistas que permitan comprender claramente su fisiopatología e importancia clínica. Un trabajo realizado en 224 pacientes con TVP confirmadas venográficamente muestra que, a los 5 años, el 30% de los que padecían una trombosis distal desarrolló un síndrome postrombótico (SPT)20. Otros 2 estudios han detectado también signos (11%) y síntomas (37%) de insuficiencia venosa a los 5 años de seguimiento21,22.
Para tratar de obviar estos problemas, recientemente se han identificado 4 factores pronósticos de riesgo de SPT23: a) trombo extendido en su presentación; b) una regresión del trombo inferior al 50%; c) un índice de llenado venoso mayor de 2,5ml/s y d) una tasa anormal de flujo sanguíneo (<60% del volumen deplecionado a los 2 s). A cada uno de los 4 ítems se les da un punto, de tal forma que los pacientes con 2 o menos no presentarán un SPT en los 5 años siguientes, mientras que los que alcanzan una puntuación superior a 2 tienen un riesgo significativo de desarrollarlo con una sensibilidad del 100% y una especificidad del 83%. Este estudio tiene una serie de limitaciones debidas al pequeño tamaño de la muestra y a que las puntuaciones se calculan a los 6 meses del episodio trombótico agudo, que es cuando la mayor parte de los SPT se han desarrollado. Se han propuesto una serie de biomarcadores inflamatorios —la interleucina-6, la proteína C-reactiva y la molécula-1 de adhesión intercelular—, como factores pronósticos del SPT, pero hasta el momento no se conoce su utilidad clínica para identificar a pacientes con TVP con riesgo de padecerlo24.
DiagnósticoEl ED es el método más empleado en la práctica clínica diaria para diagnosticar la TVP3,5. Aunque existe un amplio consenso para definirla —pérdida de compresión de un segmento venoso—, las formas de realizar el examen varían de unas zonas a otras.
En los países anglosajones se practica un primer examen ecográfico solo de las venas proximales. En el supuesto de que no se confirme la TVPP, al paciente se le practica una segunda exploración entre 7 y 14 días más tarde con el fin de descartar una eventual extensión trombótica. Esta estrategia se basa en la premisa de que, en el 20% de los pacientes con sospecha de TVP, la mitad de ellos padecerán una trombosis distal y únicamente el 10% de estas últimas se extenderán proximalmente5. Esta forma de abordar el problema presenta una serie de puntos débiles. En primer lugar, porque la rentabilidad del segundo examen ecográfico es muy baja (del 1 al 5%) y la pérdida de pacientes puede llegar al 70%25. En segundo lugar, porque la ecografía proximal no admite efectuar un diagnóstico diferencial con un hematoma, un quiste poplíteo o una arteriopatía periférica26. Por último, porque en términos de eficacia clínica no permite más que hacer un diagnóstico de exclusión de las TVPP.
Por el contrario, tanto en nuestro país como en los de nuestro entorno se efectúa un ED de todas las venas profundas de los miembros inferiores que facilita el diagnóstico inicial de TVPD3,8. Con este procedimiento la exploración de la red venosa distal se realiza desde la trifurcación de la vena poplítea, lo que incluye las venas tibiales posteriores y peroneas, las gastrocnemias (medial y lateral) y las sóleas (medial y lateral). Las venas tibiales anteriores, en general, no se exploran ya que raramente son afectadas por una trombosis.
El dímero D es un biomarcador con una alta sensibilidad cuya ausencia o disminución permite excluir la TVP en los pacientes con un bajo índice de Wells27. Sin embargo, su baja especificidad (30%) y sus valores elevados en procesos inflamatorios no específicos como el cáncer, el embarazo e incluso en la edad avanzada, no permite, mediante su sola determinación, descartar una TVPDMI en pacientes con un tiempo ≥ 4 días entre la aparición de los síntomas y la realización28,29de esta prueba. Al contrario que en las TVPP, tampoco se ha podido demostrar su utilidad como factor pronóstico de recurrencia tromboembólica29 ni su conexión con el SPT, ya sea en el episodio trombótico agudo o a los 3 meses de seguimiento30. Un estudio realizado en pacientes con TVPP demuestra que la combinación de un índice de Wells ≥ 2 y una selectina P soluble (sPel) ≥ 90ng/ml puede diagnosticar una trombosis con un valor predictivo positivo del 91% y una especificidad del 97,5%31.
TratamientoLas escasas investigaciones prospectivas y retrospectivas desarrolladas hasta ahora sobre su tratamiento en distintas situaciones clínicas (pacientes posquirúrgicos, ambulatorios o con trombosis venosas musculares) han dado resultados contradictorios3. Un metaanálisis32 que incluye 8 estudios en los que los pacientes fueron anticoagulados al menos durante un mes concluye que la anticoagulación puede disminuir la incidencia del EP y la propagación trombótica. Dos estudios aleatorizados25,33, que comparan 2 estrategias diagnósticas —ED seriados proximales o de todo el miembro—, no encuentran diferencias significativas de riesgo tromboembólico a los 3 meses de seguimiento, por lo que deducen que no es indispensable diagnosticarlas y tratarlas. Un estudio prospectivo realizado en pacientes no tratados con TVPDMI indica que 7 días después de ser diagnosticadas las tasas de extensión proximal fueron mucho más bajas de lo esperado (3,1%). Con todo, a los 3 meses de seguimiento, las complicaciones fueron significativamente más elevadas en los pacientes con trombosis proximales que con trombosis distales (7,8 y 0,8%, respectivamente)11. Todo ello ha dificultado la existencia de un consenso internacional que indique con claridad cuándo, cómo y durante cuánto tiempo tratarlas. Así, el American College of Chest Physician (ACCP)5 recomienda hacerlo solo cuando presenten una serie de factores de riesgo de extensión (tabla 1). La National Clinical Guide Centre34 no menciona el tratamiento de la TVPD …ya que esta es menos probable que cause un SPT o un EP que una trombosis proximal.
Factores de riesgo para la extensión de las TVPDMI
| • Dímero-D positivo • Trombos>5cm de diámetro o cercanos a las venas proximales • Trombosis en múltiples venas distales • Factores desencadenantes no reversibles • Cáncer en actividad • Historia de tromboembolismo venoso • Trombosis en pacientes hospitalizados |
Fuente: Kearon et al.5.
En la práctica clínica es extremadamente difícil, si no imposible, al menos en nuestro país, aplicar este tipo de recomendaciones por varios motivos. En primer lugar, porque un paciente diagnosticado de TVP espera, y debe recibir, el tratamiento anticoagulante que alivie su sintomatología clínica y suprima el episodio trombótico agudo. En segundo lugar, por la posible propagación del trombo y, aunque rara, por la aparición de un EP con o sin extensión trombótica. En consecuencia, debemos dirigir nuestros esfuerzos a determinar el tipo y duración de la anticoagulación que permita suprimir el accidente trombótico agudo y reducir tanto el riesgo de recurrencia tromboembólica como de hemorragias.
En este sentido, un metaanálisis de 4 ensayos aleatorizados con un seguimiento de 1 a 3 años, encuentra riesgos similares de recurrencia a los 3, 6 o 12 meses de terapia anticoagulante (RR: 1,12; IC 95%: 0,88-1,45)5. El análisis individualizado de los pacientes de estos 4 estudios, y de otro35, que compara 3 con 27 meses de anticoagulación, tampoco encuentra un incremento del riesgo de recurrencia después de la supresión del tratamiento en pacientes anticoagulados durante 3 meses (RR: 1,19; IC 95%: 0,86-1,65). Por otra parte, los ensayos que comparan 3 con 6 o 12 meses de anticoagulación encuentran un mayor número de hemorragias (RR,: 2,49; IC 95%: 1,20-5,16) cuanto más prolongada sea la terapia36,37. Estos datos indican que, en los casos en que exista riesgo de extensión (ver tabla 1), o si en controles sucesivos la TVP se extiende a las venas proximales, debería realizarse un tratamiento anticoagulante5.
Por todo ello, proponemos las siguientes pautas de anticoagulación en función de que las TVPDMI sean provocadas, idiopáticas o asociadas a cáncer:
Trombosis venosas profundas distales de miembros inferiores provocadasLas trombosis provocadas por factores de riesgo reversibles quirúrgicos, tratadas con antivitaminas K (AVK), tienen unas tasas de recurrencia tromboembólica al año y a los 5 años de suprimir el tratamiento del 1 y del 3% respectivamente5,38. Por el contrario, en pacientes con trombosis causadas por desencadenantes no quirúrgicos, como un embarazo, el riesgo de recurrencia al año y a los 5 años de seguimiento es del 5 y del 15%5. Debido a que en ambas situaciones este riesgo es bajo, no es necesario proseguir la anticoagulación más de 3 meses. Sin embargo, si el paciente está todavía recuperándose de una ETEV o si los factores desencadenantes no se han resuelto completamente puede prolongarse más tiempo38.
En pacientes con tratamiento hormonal sustitutivo o anticonceptivos orales que presenten una trombosis se recomienda, previa supresión de estos, anticoagular durante 3 meses38. Una posible excepción a esta norma estaría en enfermas en las que no pueden eliminarse por indicaciones ginecológicas. En este caso se recomienda un tratamiento combinado con anticoagulantes, aunque es conveniente, al menos un mes antes de suprimir estos últimos, retirar la terapia hormonal o anticonceptiva38,39.
Los defectos trombofílicos (factorV Leiden, protrombina 20210A, antitrombina, anticoagulante lúpico y los factores VIII y XI), se asocian con un bajo riesgo de recurrencia tromboembólica (0,4% por paciente/año) (RR: 3,7; IC 95%: 1,03-13,2)38,40. También tiene un bajo riesgo la presencia de anticuerpos antifosfolípido (anticoagulante lúpico y anticuerpos anticardiolipina) en pacientes con un primer episodio de ETEV y en aquellos con una TVPD38,41. Por todo ello, en ambos casos se considera suficiente una anticoagulación de 3 meses, además de no estar justificada la práctica rutinaria de análisis específicos por su inutilidad para predecir la probabilidad de recurrencia38.
Trombosis venosas profundas distales de miembros inferiores idiopáticasPueden tener un bajo riesgo de recurrencia independientemente de que se suspenda la anticoagulación a los 3 o a los 6 o más meses, con un RR de 0,59 y un IC 95% de 0,35-0,98 para los primeros 6 meses de seguimiento, y un RR de 0,72 y un IC 95% de 0,48-1,04 para los primeros 24 meses de seguimiento38. Sin embargo, estudios clínicos que comparan 3 con 6 o 12 meses de anticoagulación encuentran más hemorragias mayores con terapias más prolongadas (RR: 2,49; IC 95%: 1,20-5,16)5,38. Por estas razones es preferible suspender inicialmente la anticoagulación a los 3 meses en lugar de a los 6. En el caso de que presenten un segundo episodio tromboembólico, el riesgo de recurrencia en el primer año sería del 10, y del 30% a los 5 años: esto justificaría una anticoagulación indefinida5,42.
En ausencia de contraindicaciones, el tratamiento se inicia con heparinas de bajo peso molecular (HBPM), heparinas no fraccionadas o fondaparinux. Cualquiera de estos fármacos debe simultanearse con la administración de AVK durante un mínimo de 5 días hasta que la relación internacional normalizada (INR) sea igual o superior a 2, por lo menos durante 24h, momento en el que se suspenderá la medicación parenteral43. Distintos estudios44,45 han confirmado que los nuevos anticoagulantes orales, ya sean los inhibidores de la trombina (dabigatrán), ya sean del factor Xa (rivaroxabán, apixabán o edoxabán), son tan efectivos y probablemente tan seguros como los tratamientos estándares de la ETEV aguda. Además, presentan un 50% menos de hemorragias intracraneales y una pequeña reducción de las extracraneales. En cualquier caso, no necesitan administración parenteral, tienen menos interacción con los alimentos y pueden administrarse a dosis fijas. Por el contrario, su efecto anticoagulante disminuye rápidamente en caso de incumplimiento (8-16h de vida media) y no disponemos de análisis estandarizados que monitoricen la coagulación, ni de antídotos específicos44,45.
Trombosis venosas profundas distales de miembros inferiores asociadas a cáncerLas trombosis provocadas por un factor persistente o progresivo, como el cáncer, tienen un riesgo de recurrencia del 20% en el primer año, sobre todo si se desarrolla rápidamente, es metastásico o recibe quimioterapia38,46. Habitualmente se emplean las HBPM porque, además de no incrementar el riesgo de hemorragia, pueden interferir con la actividad antitumoral al inhibir la angiogénesis, la actividad enzimática en el entorno tumoral o la proliferación celular inducida por el factor de crecimiento tumoral47,48. Se recomienda continuar el tratamiento hasta pasados 6 meses después de su curación o de su remisión completa, ya que el riesgo de recurrencia tromboembólica es 8 veces mayor si se suprime antes38. Pasado este tiempo, su retirada no incrementa las tasas de recurrencia ni las de mortalidad49. Si el cáncer está en remisión pero no curado y hay evidencias indirectas de bajo riesgo de recurrencia o ausencia de metástasis, es razonable suprimir la medicación, al menos temporalmente, o tratarlo con un anticoagulante oral38. Los datos clínicos sobre los nuevos anticoagulantes orales para el tratamiento de la ETEV en estos enfermos, aunque limitados, han demostrado no ser inferiores a la terapia estándar44,45. El dabigatrán50 podría inhibir la invasión y las metástasis de los tumores malignos de mama. El apixabán51 ha probado su seguridad en la profilaxis de los pacientes con enfermedad metastásica, así como una buena tolerancia y bajas tasas de hemorragias mayores. El rivaroxabán52 ha acreditado su efectividad al incrementar la permeabilidad y la degradación del trombo en sangre de voluntarios sanos.
Prevención del síndrome postrombóticoMedias de compresión elásticasEntre el 20 y el 50% de los pacientes con TVPP —no disponemos de datos respecto a las TVPD—, desarrollan un SPT que en la mayor parte de los casos se padece meses o años después19. Algunos estudios24 indican que su incidencia acumulada aumenta incluso a los 10-20 años posteriores al episodio trombótico, y que entre el 5 y el 10% presentan un cuadro severo que incluye las úlceras venosas.
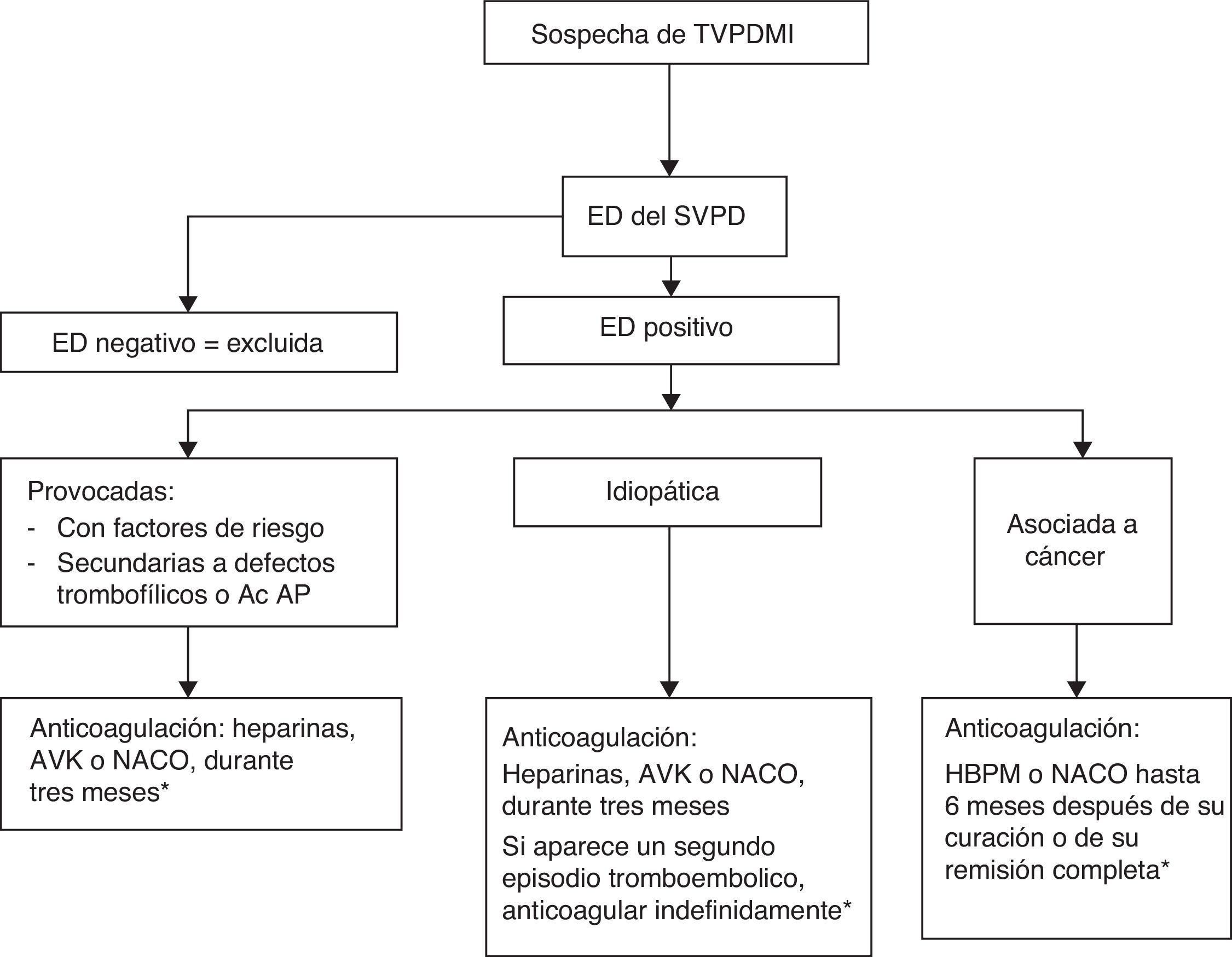
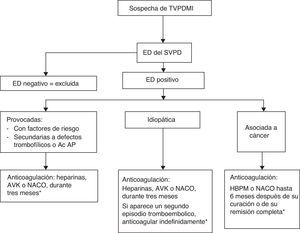
Las guías del ACCP5 señalan que aunque la eficacia de las medias de compresión elásticas para la prevención del SPT es dudosa, mejoran el edema y el dolor en la fase trombótica aguda y alivian los síntomas en estos pacientes. Sin embargo, dado que los estudios19 sobre los que se apoya esta recomendación han sido abiertos, realizados en muy pocos hospitales, con pequeñas muestras y diseños diferentes, el nivel de recomendación fue solo de grado 2B. Para confirmar o no su utilidad se diseñó un gran estudio multicéntrico53, aleatorizado y doble ciego con un seguimiento de 2 años en el que los pacientes utilizaron medias con un gradiente de presión de 30-40mmHg o medias placebo de idéntico aspecto con menos de 5mmHg de presión en los tobillos. La incidencia acumulada en ambos grupos fue la misma (52,6 y 52,3%): no tuvo ningún impacto sobre la tasa y la severidad del SPT. Resultados que no parecen justificar su empleo rutinario para prevenirlo. En la figura 1 se expone el algoritmo diagnóstico terapéutico de las TVPDMI.
Algoritmo diagnóstico terapéutico de las TVPDMI.
Fuente: Elaboración propia a partir de varios autores3,38.
Ac AP: anticuerpos antifosfolípido; AVK: antivitaminas K; ED: ecodoppler; HBPM: heparinas de bajo peso molecular; NACO: nuevos anticoagulantes orales; SVPD: sistema venoso profundo distal; TVPDMI: trombosis venosas profundas distales de miembros inferiores.
*Opcional: media de compresión durante la fase trombótica aguda.
En ausencia de contraindicaciones, los pacientes con TVPDMI deben tratarse inicialmente con HBPM, heparinas no fraccionadas o fondaparinux junto con AVK.
En las TVPDMI provocadas basta con una anticoagulación de 3 meses, que puede prolongarse más tiempo en el caso de que los factores desencadenantes no se hubieran resuelto completamente.
En las TVPDMI idiopáticas es suficiente un tratamiento anticoagulante de 3 meses. Solo en el supuesto de que padeciesen un segundo episodio tromboembólico estaría justificada una anticoagulación indefinida.
En las TVPDMI asociadas al cáncer, la duración del tratamiento varía entre los 6 meses posteriores a su curación o remisión completa y la anticoagulación indefinida.
Los nuevos anticoagulantes orales son tan efectivos y probablemente tan seguros como los tratamientos estándar de la ETEV aguda y pueden ser una opción válida en los pacientes con cáncer.
Las medias de compresión elásticas no deben emplearse rutinariamente para prevenir el SPT, aunque mejoran el edema y el dolor en la fase trombótica aguda y disminuyen la sintomatología en los pacientes que lo desarrollan.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.