La endotelina-1 (ET-1) interviene en la regulación del tono vasomotor y remodelado vascular y en la disfunción endotelial. El bloqueante de ET-1, bosentán, podría tener un efecto beneficioso en la enfermedad arterial.
ObjetivoAnalizar la expresión de ET-1, óxido nítrico (NO) e interleucinas 6 y 10 (IL-6, IL-10), en diabéticos con arteriopatía periférica y en controles no diabéticos. Analizar el efecto de bosentán en la expresión de mediadores inflamatorios y en la liberación de NO.
PacientesUn total de 3 grupos de sujetos; G1: controles no diabéticos (n=15), G2: diabéticos con claudicación (n=15), G3: diabéticos con lesiones tróficas (n=15).
Material y métodosAnálisis de expresión plasmática de ET-1 mediante dot-blot, de concentraciones plasmáticas de IL-6 e IL-10 (kits de ELISA). Capacidad de liberar NO mediante kit de nitratos+nitritos.
ResultadosSe observa un aumento de los niveles de ET-1 (G1: 172,9; G2: 277,1; G3: 367,3; p<0,05, unidades arbitrarias) y un descenso de IL-6 en las formas más avanzadas de la enfermedad (G1: 45,8; G2: 16,4; G3: 9,8; p<0,05 pg/ml). Bosentán elevó los niveles de IL-6 en el grupo de lesiones tróficas hasta igualarla con el grupo control. Se observó una reducción significativa de la capacidad de liberar NO por los leucocitos en G3 (G1: 16,7; G3: 12; p<0,05 μmol/L). Este efecto se revirtió significativamente en presencia de bosentán.
ConclusionesLos niveles elevados de ET-1 podrían influir en la progresión de la EAP. En la arteriopatía avanzada parece existir un descenso de la actividad inflamatoria (disminución de IL-6), lo que podría disminuir la vasodilatación (reducción de NO). Bosentán tiene un efecto antagonista sobre estos efectos, fundamentalmente en los estadios más avanzados de la enfermedad.
Endothelin-1 (ET-1) is involved in the regulation of vasomotor tone, vascular remodeling, and endothelial dysfunction. The ET-1 blocker, osentan, could have a beneficial effect on vascular disease.
ObjectiveTo analyze the expression of ET-1, nitric oxide (NO), and interleukins 6 and 10 (IL-6, IL-10), in diabetics with peripheral arterial disease (PAD) and non-diabetic controls. To analyze the effects of bosentan on the expression of inflammatory mediators and the release of NO.
PatientsG1: non-diabetic controls (n=15), G2: diabetic patients with claudication (n=15), G3: diabetics patients with trophic lesions (n=15).
Material and methodsAnalysis of plasma ET-1 expression by dot-blot, plasma concentrations of IL-6 and IL-10 (ELISA kits). Ability to release NO by nitrate + nitrite kit.
ResultsIncreased levels of ET-1 (G1: 172.9; G2: 277.1; G3: 367.3, P<.05, arbitrary units) and a decrease in IL-6 (G1: 45.8; G2: 16.4; G3: 9.8; P<.05 pg/ml) are observed in the most advanced forms of disease. Bosentan increased levels of IL-6 in the group of trophic lesions when compared with the control group. A significant reduction in the ability of NO release by leukocytes in G3 (G1: 16.7; G3: 12; P<.05 μmol/L) was observed. This effect was significantly reversed in the presence of bosentan.
ConclusionsElevated levels of ET-1 may influence the progression of PAD. In advanced artery disease, there appears to be a reduction in inflammatory activity (decrease IL-6), which could reduce the vasodilation (NO reduction). Bosentan has an antagonistic effect on these effects, mainly in the more advanced stages of the disease.
En los humanos la endotelina (ET) es la molécula vasopresora más potente y de acción más duradera1,2, siendo 100 veces más potente que la noradrenalina3,4. La concentración plasmática de ET-1 es extremadamente baja en condiciones normales, si bien localmente en la pared vascular es 100 veces mayor, lo que sugiere fundamentalmente un efecto paracrino. La ET-1 es la isoforma biológicamente más activa y supone el 80% aproximadamente de la ET total5,6. Si bien la ET-1 es sintetizada fundamentalmente en las células endoteliales, se ha comprobado que también puede ser producida por el tejido vascular endotelial y por el músculo liso, por los miocitos cardíacos, por las células epiteliales respiratorias, neuronas, islotes pancreáticos, fibroblastos y macrófagos4,7.
La ET-1 media sus diferentes efectos a través de 2 diferentes subtipos de receptores: ET-A y ET-B8. Los receptores ET-A están localizados fundamentalmente en las células musculares lisas de la pared vascular y son responsables de la respuesta contráctil y vasopresora de la ET-19. El papel de los receptores ET-B en la regulación vascular es más compleja. Por ejemplo, los receptores ET-B localizados en el endotelio vascular median la vasodilatación a través de la liberación de factores relajantes como el óxido nítrico (NO) y la prostaciclina (PGI2). Este subtipo de receptor sin embargo también puede condicionar vasoconstricción cuando los receptores están localizados en las células musculares lisas, igual que los receptores ET-A. Este fenómeno se observa en determinadas situaciones como la diabetes mellitus (DM)6. En consecuencia, el efecto contráctil global de la ET-1 depende fundamentalmente del tipo de receptor predominante, bien ET-A y ET-B en las células musculares lisas, bien ET-B en las células endoteliales.
Bosentán fue el primer bloqueante de los receptores de la ET aprobado por la FDA para el tratamiento de los pacientes con hipertensión arterial pulmonar10,11. Se trata de un bloqueante de receptores ET-A y ET-B. El bloqueo de ET-A reduce la presión arterial, la retención de sal y agua, la proteinuria, la producción de ROS (especies de oxígeno reactivo), la inflamación y la fibrosis. El bloqueo de ET-B reduce la vasodilatación mediada por NO, el aclaramiento de ET-1, lo que condiciona vasoconstricción y retención hidrosalina.
Diferentes líneas de investigación indican que el sistema ET juega un papel importante en el daño vascular que se produce en la diabetes. Se ha comprobado que los niveles en plasma de ET-1 están elevados en pacientes con diabetes tipo 1 y 212,13. Así mismo se ha observado una correlación positiva entre los niveles de ET-1 y las complicaciones diabéticas. Los niveles de ET-1 están más elevados en los pacientes diabéticos con microalbuminuria, niveles elevados de hemoglobina glucosilada y retinopatía12,14. En estados de resistencia a la insulina, existe un disbalance entre los efectos insulinodependientes sobre el NO y la liberación de la ET-1 en el endotelio, condicionando daño endotelial. Estudios clínicos han demostrado que el bloqueo de los receptores ET-A tiene efectos beneficiosos sobre la resistencia a la insulina y la disfunción vascular15.
ObjetivosEn el presente trabajo pretendemos determinar si existen diferentes niveles plasmáticos de ET-1, liberación de NO y expresión de moléculas mediadoras de la inflamación en pacientes diabéticos con arteriopatía periférica en diferentes estadios clínicos y en controles no diabéticos. Por último se va a analizar cómo el bloqueante bosentán interviene en la expresión de mediadores inflamatorios y en la liberación de NO.
Material y métodosSe trata de un estudio in-vitro en el que se determina en el plasma de los sujetos las moléculas ET-1, interleucinas IL-6 e IL-10 y la liberación de NO. Posteriormente el plasma de estos pacientes se ha incubado con bosentán con el fin de comprobar las variaciones en la síntesis y liberación de interleucinas y de NO.
PacientesSe han incluido 3 grupos de pacientes. El primer grupo (G1) lo forman controles no diabéticos en los que se ha descartado la presencia de enfermedad arterial (EAP) mediante anamnesis clínica, exploración física y la realización de un índice tobillo-brazo (ITB) con resultado normal. Se trata de sujetos de características similares en cuanto a edad y sexo a los grupos 2 y 3. El grupo 2 (G2) está formado por pacientes que acuden a la consulta de Cirugía Vascular por presentar claudicación intermitente y en los que se confirma la presencia de EAP mediante exploración clínica y la presencia de un ITB patológico. El tercer grupo (G3) está compuesto por sujetos que ingresan en nuestro Servicio por presentar lesiones tróficas secundarias a EAP, como se comprobó mediante un estudio hemodinámico severamente patológico. Fueron descartados de este estudio los pacientes con lesión trófica neuropática con ninguna o mínima afectación isquémica.
Técnicas de laboratorioPara la determinación y cuantificación de las diferentes moléculas analizadas se han empleado:
- •
Niveles de expresión plasmática de ET-1: dot-blot. Unidad de medida: unidades arbitrarias (u.a.).
- •
Concentraciones plasmáticas de IL: kits de ELISA. Unidad de medida: pg/ml.
- •
Capacidad de liberar NO: kit de nitratos+nitritos. Unidad de medida: μmol/L.
Se ha empleado el paquete estadístico SPSS 20. Los test estadísticos utilizados han sido Kruskall-Wallis, Wilcoxon y chi-cuadrado, según las variables analizadas. Significación estadística p<0,05.
ResultadosSe ha incluido un total de 45 sujetos, 15 en cada grupo de análisis.
Las características demográficas se recogen en las tablas 1 y 2.
Características demográficas (II)
| Mediana-rango | G1 (n = 15) | G2 (n = 15) | G3 (n = 15) | p |
|---|---|---|---|---|
| Edad | 71 (59-83) | 65 (59-79) | 73 (57-88) | 0,11 |
| Glucosa | 96 (79-128) | 140 (116-228) | 123 (104-168) | 0,13 |
| col-Total | 157 (110-298) | 184 (164-215) | 149 (120-167) | 0,07 |
| col-HDL | 44 (39-57) | 55 (42-68) | 38 (30-49) | 0,004 |
| col-LDL | 86 (78-102) | 108 (99-157) | 72 (59-90) | 0,01 |
| PCR | 0,6 (0,4-1,2) | 3,8 (1,3-5,2) | 5,3 (2,2-7,8) | 0,018 |
Aunque no ha habido diferencias en edad y sexo entre controles y grupos de pacientes, sí se ha observado una mayor frecuencia de factores de riesgo cardiovascular en los grupos G2 y G3, como hipertensión y tabaquismo. El grupo de claudicantes ha presentado niveles elevados de colesterol pese a ser el grupo con mayor prevalencia de consumo de estatinas. Se ha determinado la PCR como marcador inflamatorio, comprobándose que ha sido mayor cuanto más avanzada estaba la enfermedad, siendo esta diferencia estadísticamente significativa.
Niveles de endotelina 1, interleucina 6, interleucina 10Se ha observado un mayor nivel de ET-1 en los pacientes claudicantes que en el grupo control, presentando los niveles más altos el grupo de lesiones tróficas (G1: 172,9 u.a., G2: 277,1 u.a. y G3: 367,3 u.a.; p = 0,01) (fig. 1).
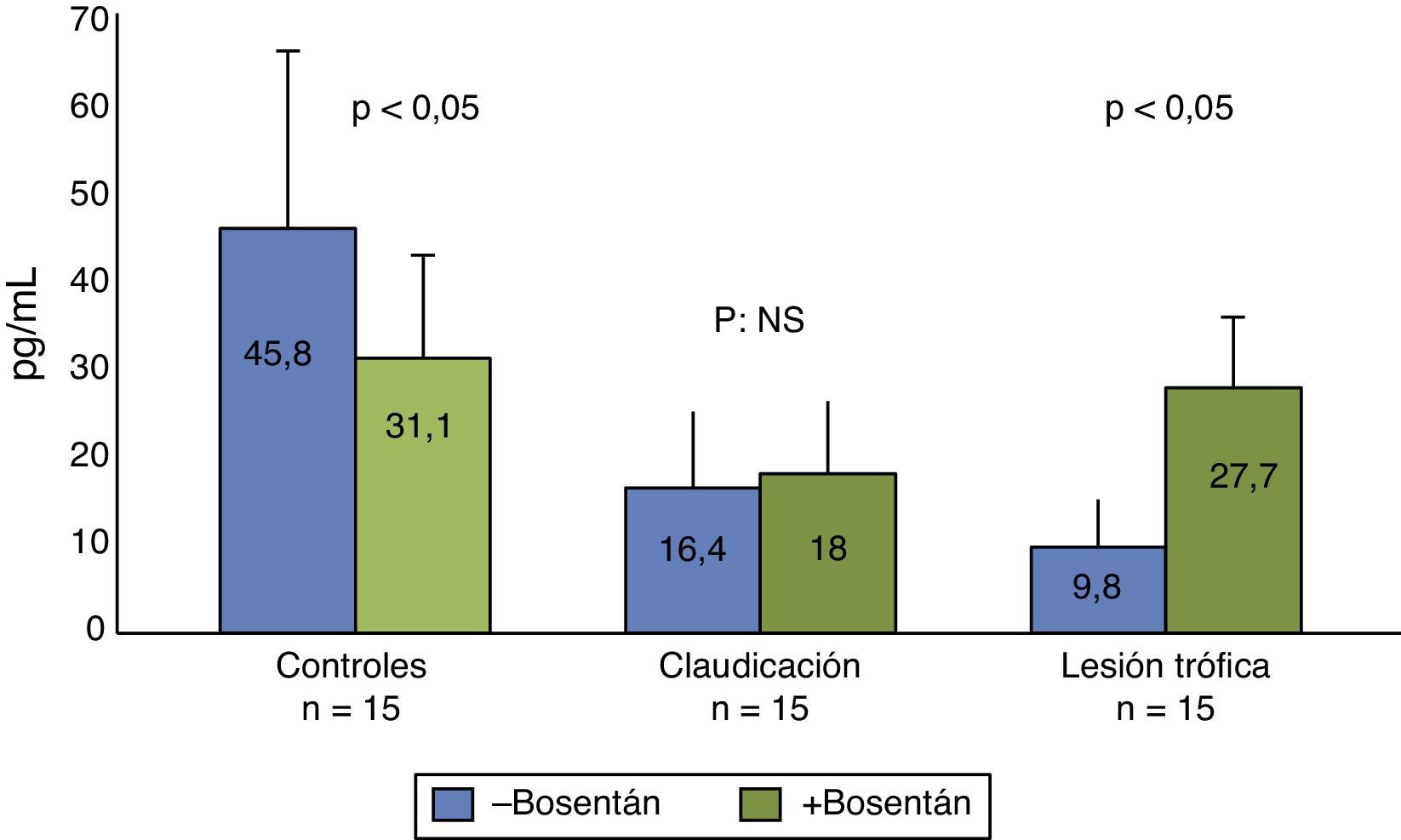
También se han comprobado diferencias significativas en los niveles de la IL proinflamatoria IL-6 (G1: 45,8 pg/ml; G2: 16,4 pg/ml y G3: 9,8 pg/ml; p = 0,02) pero no en los niveles de la IL antiinflamatoria IL-10 (G1: 447,6 pg/ml; G2: 428,8 pg/ml y G3: 326,8 pg/ml; p: NS) (fig. 2). La administración de bosentán ha reducido la respuesta inflamatoria mediada por IL-6 en el grupo control, efecto contrario al observado en el grupo de lesiones tróficas, en el que ha aumentado la capacidad de liberación de IL-6 (fig. 3). Bosentán no ha modificado los niveles de IL-10 con respecto a los niveles basales en ninguno de los grupos de tratamiento (fig. 4).
Liberación de óxido nítricoLa capacidad de liberación de NO se ha comprobado que estaba reducida de forma basal en el grupo de lesiones tróficas con respecto al grupo control. En ambos grupos la administración de bosentán ha aumentado la capacidad de síntesis y liberación de NO, de forma que el grupo de lesiones tróficas tras la administración de bosentán presenta los mismos niveles de NO que el grupo control de forma basal (fig. 5).
DiscusiónEl papel de la ET-1 como factor implicado en el desarrollo de la EAP es poco conocido, si bien se sabe que su acción es fundamentalmente paracrina y dependiente del tipo de receptor ET-A y ET-B sobre el que actúe. En el sistema vascular, la endotelina vía activación de los receptores ET-A imprime un tono basal vasoconstrictor y contribuye al desarrollo de la enfermedad vascular en la arteriosclerosis y en la hipertensión16,17. La obesidad, que se asocia frecuentemente a la hipertensión, es una condición que se encuentra frecuentemente junto a diabetes y resistencia a la insulina, interviniendo en la activación del sistema renina-angiotensina-aldosterona18. Estudios recientes indican que la proteinuria en los diabéticos está directamente asociada con la activación de la ET-119 a través de los receptores ET-A.
Debido al aumento de la actividad del sistema ET en la DM hemos elegido para el presente estudio a pacientes diabéticos con EAP, claudicantes y con lesiones tróficas, comparándolos con sujetos no diabéticos libres de la enfermedad. De esta forma pretendemos evaluar el sistema ET-1 en la DM y en las diferentes fases de la arteriopatía periférica.
Se ha elegido un grupo control sin DM ni EAP porque este grupo presenta teóricamente los niveles basales normales de las moléculas estudiadas, lo que permitiría una mejor comparación con los pacientes con EAP. No obstante la DM per se podría justificar niveles alterados en las parámetros analizados, si bien los diferentes niveles de estas moléculas en los grupos G2 y G3 (todos diabéticos) implican una diferente expresión según el grado de EAP independiente de la DM.
Se ha observado que en pacientes diabéticos la acción de los ET-B estaría alterada, de forma que su sobreexpresión en las células musculares lisas de la pared arterial tendría unos efectos similares de vasoconstricción a los de los receptores ET-A6, por lo que en pacientes diabéticos el bloqueo ET-A y ET-B podría tener efectos más beneficiosos que el bloqueo ET-A aislado. Basado en este efecto paradójico de los receptores ET-B en la diabetes, hemos querido estudiar el efecto del bloqueante bosentán, antagonista de los receptores ET-A y ET-B. Algunos estudios muestran que la endotelina puede contribuir a la resistencia a la insulina y a la disfunción vascular. In vitro, la exposición celular mantenida a ET-1 induce resistencia a la insulina20,21. En estudios in vivo con ratas, la inyección intraperitoneal de ET-1 se ha comprobado que induce un aumento de la glucosa endógena y de los niveles de insulina, así como un descenso de la respuesta a la insulina22. En este sentido, la ET-1 administrada en humanos induce resistencia a la insulina (síndrome euglucemia-hiperinsulinemia)23.
En los estadios iniciales, el disbalance entre el aumento de vasoconstrictores como la ET-1 y la disminución de la actividad de NO debida a estrés oxidativo de la hiperglucemia, resultan en una disminución de la relajación vascular. Esta situación crónica finalmente condiciona daño estructural, trombosis y el depósito de plaquetas en la pared vascular24,25. En nuestro estudio hemos comprobado que bosentán ha invertido este desequilibrio ET-1/NO, lo que podría tener consecuencias favorables para los pacientes diabéticos con EAP. La ET-1 no solo actúa como vasoconstrictor, sino que además estimula la proliferación de células musculares lisas vasculares, promueve la fibrosis y la inflamación. Este efecto proinflamatorio de la ET-1 sin embargo, no se ha asociado en este trabajo a un aumento de IL-6 en los pacientes diabéticos, aunque sí han presentado mayores niveles de PCR en las formas más avanzadas de la enfermedad. Hemos interpretado que la capacidad de liberar IL-6 tras la administración de bosentán en los pacientes con lesiones tróficas podría reflejar la recuperación de la viabilidad de células biológicamente inactivas en los pacientes con formas más avanzadas de EAP.
Algunas evidencias que muestran que la ET-1 está implicada en la arteriosclerosis incluyen los niveles elevados de ET-1 en pacientes con arteriosclerosis sintomática como la cardiopatía isquémica y el ictus26,27. Además, se ha comprobado que los niveles de ET-1 correlacionan positivamente con el número de sectores afectos28. Con respecto a la EAP, niveles elevados de ET-1 se han observado en la arteriopatía periférica, tanto en claudicantes como en pacientes con isquemia crítica29,30. En el estudio de de Haro se comprobó un aumento de la ET-1 fundamentalmente en el grupo de claudicantes, lo que explicó como un agotamiento del endotelio en el grupo de lesiones tróficas. Sin embargo en nuestro estudio los claudicantes han presentado una menor actividad de ET-1 que el grupo de lesiones tróficas, lo que nos hace pensar que la ET-1 puede ser un marcador de severidad y mal pronóstico cardiovascular. En el trabajo de Mangiafico se comprobaron niveles elevados de ET-1 en pacientes con EAP con respecto a un grupo control sin EAP y niveles aún mayores de ET-1 en el grupo de EAP con DM29. En este sentido se ha demostrado que niveles elevados de ET-1 se han asociado con un mayor riesgo de mortalidad cardiovascular31.
Pocos años después del descubrimiento de la ET fueron clonados los receptores de ET-1 y los bloqueantes selectivos de dichos receptores22,32. En humanos, el efecto del bloqueo del receptor ET-A a nivel de la microcirculación ha sido estudiado en pacientes con diabetes tipo 2. La infusión de bloqueantes de los receptores ET-A mejoró la microcirculación a nivel de la piel33. Este grupo demostró, en pacientes con isquemia crítica no revascularizable, que la infusión de bloqueantes ET-A se asoció a un aumento de la tensión transcutánea de oxígeno y de la presión en el pie24. En este sentido pensamos que la administración de bosentán a través del bloqueo ET-A y ET-B podría frenar e incluso revertir la acción de la ET-1, lo que podría acompañarse de un mejor pronóstico para los pacientes con EAP incluso en fases avanzadas.
ConclusionesLos niveles elevados de ET-1 podrían influir en el tono vasomotor de la arteriopatía diabética según demuestra el aumento progresivo de ET-A a medida que avanza la enfermedad. En la arteriopatía avanzada parece existir un descenso de la actividad inflamatoria (disminución de IL-6) probablemente secundario a la necrosis tisular. Esto podría influir en un descenso de la capacidad de vasodilatación en estadios avanzados de la enfermedad (reducción de NO). El antagonista de los receptores ET-A y ET-B, bosentán, ha demostrado revertir al menos parcialmente la respuesta inflamatoria y la capacidad de eliminación de NO, sobre todo en las fases más avanzadas de la enfermedad.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.