La activación de los receptores de la inmunidad innata induce un viraje fenotípico proinflamatorio de la célula endotelial provocando la síntesis de moléculas de adhesión y la liberación de citocinas por el endotelio.
ObjetivosNuestro objetivo es determinar la activación del sistema inmunitario innato a través de los receptores Toll-Like 4 (TLR4) tras la exposición de células endoteliales humanas previamente sanas a suero humano de pacientes con enfermedad arterial periférica.
Pacientes y métodosEstudio experimental traslacional. Se obtuvo suero de 30 pacientes y de 15 sujetos sanos pareados por edad y sexo. Se determinaron los niveles de proteína C reactiva (hsPCR). Las muestras de suero se incubaron en cultivo celular de endotelio de aorta humana. Se analizó la expresión génica de los receptores TLR4 en el cultivo tras su estimulación con suero.
ResultadosLos niveles de hsPCR fueron mayores en pacientes que en sujetos sanos (0,92±0,4 vs. 0,46±0,04 log10-mg/dl, p<0,0001) y en pacientes con isquemia crítica frente a pacientes claudicantes (1,27±0,4 vs. 0,74±0,2 log10-mg/dl, p=0,01). La expresión de TLR4 fue mayor tras la exposición del cultivo al suero de pacientes que tras la exposición al suero de sujetos sanos (X10-log10-QR: 1,59±0,4 vs. 1,09±0,3, p<0,0001) sin diferencias en función de la situación clínica (X10-log10-QR: 1,81±0,5 [isquemia crítica] vs. 1,50±0,4 [claudicación intermitente], p=0,16).
ConclusionesEl suero de pacientes con enfermedad arterial periférica induce una transformación genotípica proaterosclerótica de la célula endotelial a través de los receptores de membrana TLR4 de la inmunidad innata.
The activation of the innate immunity induces a pro-inflammatory phenotypic shift of endothelial cells triggering the synthesis of adhesion molecules and the release of cytokine factors by the endothelium.
ObjectivesThe aim of the study is to determine the activation of the innate immune system through the «Toll-Like 4» receptor (TLR4) after the exposure of previously healthy human endothelial cells to serum of peripheral arterial disease patients.
Patients and methodsExperimental translational study. Serum was obtained from 30 patients and 15 healthy subjects age and sex matched. The serum levels of C-reactive protein (hsCRP) were measured. All samples were incubated in cell culture of human aortic endothelial cells. The genomic expression of TLR4 receptor by cell culture after serum stimulation was analysed.
ResultsLevels of hsCRP were higher in patients than in healthy subjects (0.92±0.4 vs. 0.46±0.04 log10-mg/dl P<.0001), and in critical limb ischemia patients than in claudication patients (1.27±0.4 vs. 0.74±0.2 log10-mg/dl, P=.01). The expression of TLR4 was higher after the exposure of cell culture to patient's serum than after the exposure to healthy subjects serum (X10-log10-RQ: 1.59±0,4 vs. 1.09±0.3, P<.0001). There were no differences of TLR4 expression according to clinical severity (X10-log10-RQ: 1.81±0,5 [critical limb ischemia] vs. 1.50±0,4 [intermittent claudication], P=.16).
ConclusionsThe serum of peripheral arterial disease patients induces a genotypic pro-atherosclerotic shift of endothelial cells through TLR4 membrane receptors of the innate immunity.
La aterosclerosis es una enfermedad vascular inflamatoria crónica que provoca una lenta remodelación de la pared vascular. Dicha situación inflamatoria está estrechamente relacionada con la disfunción endotelial que se comporta como un evento patogénico primario1. La activación del endotelio provoca la sobreexpresión de moléculas de adhesión leucocitaria e induce el reclutamiento de monocitos hacia el espacio subendotelial, situación que inicia la lesión vascular aterosclerótica2. Además de los monocitos, otras células de la serie blanca como los linfocitos T, células dendríticas y mastocitos también participan en el desarrollo de la enfermedad3. En la actualidad se ha demostrado que en estos procesos se hallan involucrados componentes procedentes de la inmunidad innata y de la adaptativa4.
En este contexto, la inmunidad innata constituye la primera línea de defensa del organismo contra la infección y se encuentra programada para la detección de diversos patrones de patógenos microbianos a través de una serie de receptores específicos3. La familia de receptores Toll-Like (TLR) son los mejores caracterizados hasta el momento. Se trata de un conjunto de receptores transmembrana presentes en las células endoteliales, monocitos, linfocitos y células dendríticas. Existen 13 subfamilias diferentes de TLR en mamíferos que presentan afinidades diferentes a diversos antígenos3. La activación de dichos receptores induce un viraje fenotípico proinflamatorio de la célula endotelial a través de un mecanismo nuclear factor kappa-beta (NF-KB) dependiente que da como resultado la liberación de citocinas proinflamatorias y la producción de moléculas de adhesión3,5. En este sentido la subfamilia de receptores TLR4 se ha asociado de forma consistente con la aterosclerosis6–8.
La finalidad de este estudio es la de determinar una posible vía de activación del sistema inmunitario innato a través de los receptores TLR4 tras la exposición de células endoteliales previamente sanas a suero humano de pacientes con enfermedad arterial periférica (EAP) con el objetivo de analizar una posible vía de activación de la aterosclerosis.
Pacientes y métodosEstudio experimental traslacional controlado realizado en el servicio de angiología y cirugía vascular y en el departamento de investigación de nuestro centro. Los pacientes objetivo y los sujetos control fueron cribados en las consultas externas. Todos los sujetos incluidos firmaron un consentimiento informado de acuerdo con los principios de la declaración de Helsinki y el protocolo del estudio fue aprobado previamente por el comité ético de nuestro hospital.
Fueron susceptibles de inclusión todos aquellos pacientes diagnosticados de EAP en estadio ii de Fontaine (claudicación intermitente) y en estadio iii-iv (isquemia crítica) tras confirmación hemodinámica de la enfermedad por pruebas hemodinámicas (Doppler o claudicometría) y/o por pruebas de imagen (arteriografía o angiorresonancia de miembros inferiores). Se excluyeron todos aquellos pacientes que presentasen revascularización previa de miembros inferiores, úlceras isquémicas activas o cualquier tipo de proceso infeccioso o inflamatorio activo. Los pacientes con diagnóstico documentado de enfermedad autoinmune o reumatológica, inmunodeprimidos o trasplantados y todos aquellos en tratamiento con inmunosupresores o corticoesteroides sistémicos y/o inhalados fueron también excluidos. Fueron susceptibles para la inclusión en el grupo control todos aquellos sujetos sanos, con una exploración vascular normal sin factores de riesgo cardiovascular ni tratamiento farmacológico crónico.
En todos los sujetos se realizó un cribado serológico de marcadores autoinmunes, marcadores de neoplasia y hemocultivos. Todos aquellos con hemocultivos o algún marcador positivo fueron excluidos del análisis. El grupo de casos fue pareado por edad (máximo 2 años de diferencia) y sexo con los controles. El número de sujetos necesario para alcanzar un poder estadístico del 80% con un error alfa de 0,05 fue de 40 casos (http://calculator.stat.ucla.edu).
Se realizaron determinaciones básicas de laboratorio (glucemia, electrólitos, función renal, perfil lipídico y hemograma) en todos los individuos incluidos tras un periodo de ayuno de 12 h incluyendo la suspensión de la medicación habitual. Una muestra de suero fue obtenida para la medición de los niveles de proteína C reactiva (hsPCR) y para las determinaciones en cultivo celular. Las muestras fueron almacenadas a −60°C hasta que se realizaron las determinaciones. Los niveles hsPCR fueron medidos en el suero de los pacientes usando inmunoanálisis ultrasensible automatizado (Roche Diagnosis, Basel, Suiza). Cada muestra fue analizada por triplicado y la media de las 3 medidas fue utilizada para el análisis.
Se obtuvo una línea primaria de células endoteliales de aorta humana (HAEC) (Lonza, Wokingham, Reino Unido). El cultivo celular fue mantenido según las instrucciones del fabricante en el medio de cultivo específico para tal fin (Lonza, Wokingham, Reino Unido). Los subcultivos entre los pasos 2 y 6 fueron utilizados para el experimento.
Las células HAEC (2 × 104 células/pocillo) fueron estimuladas durante 2 h con cada una de las muestras de suero diluidas en una proporción 1/2 usando el medio de cultivo celular para la realización de la dilución. El ARN sintetizado por HAEC fue aislado usando un kit específico para la extracción de ARN puro de acuerdo con el protocolo del fabricante. Se cuantificó el ARN mediante un espectrofotómetro NanoDrop ND-1000 (NanoDrop Technologies Inc, Wilmington, DE, Estados Unidos). El ARN obtenido fue sometido a transcripción inversa (Roche Diagnostics, Indianapolis, IN, Estados Unidos).
Se analizó el número de transcripciones del gen TLR4 mediante la reacción en cadena de la polimerasa usando un cebador específico para dicho gen (TLR4 Id. 90002850, RN18S1 Id. 90003161, Roche Diagnostics, Indianapolis, IN, Estados Unidos). Se determinaron los valores de ciclo umbral mediante un programa informático (SDS software, 7500 Fast System [Version 2.0,1]). La cuantificación relativa (QR) de la expresión genómica de TLR4 fue analizada usando el método comparativo ΔΔCT9. La expresión basal en cultivo celular del gen fue determinada por triplicado antes de la estimulación con las muestras de suero.
Análisis estadísticoSe consideraron diferencias estadísticamente significativas entre grupos a aquellas con una p a 2 colas<0,05. Las pruebas de Kolmogorov-Smirnov y de Shapiro-Wilk demostraron una distribución no paramétrica de todas las variables cuantitativas, por lo que se realizó su transformación logarítmica (log10) para ajustarlas a una distribución normal. La transformación logarítmica de la variable de expresión genómica mostró una gran cantidad de valores negativos. Para una mejor interpretación de los resultados, dicha variable fue multiplicada por 10 previamente a su transformación (X10-log10). La asociación entre variables cuantitativas fue estudiada mediante la t de Student para muestras independientes y su correlación mediante la prueba de Pearson. Las variables continuas se expresan como la media±desviación estándar y las categóricas como porcentajes.
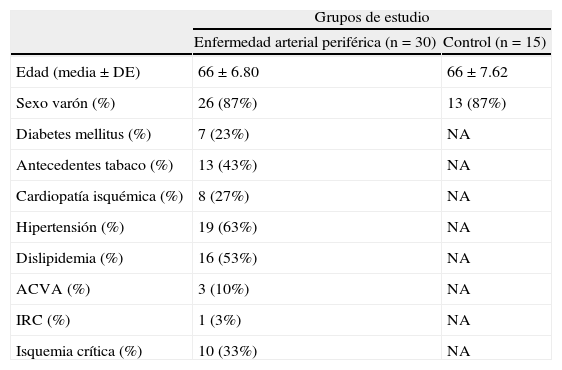
ResultadosTras un periodo de 7 meses, 482 individuos fueron cribados en nuestras consultas de los cuales 45 fueron finalmente incluidos en el protocolo (30 pacientes con EAP y 15 sujetos control). La situación clínica de los pacientes con EAP fue isquemia crítica en 10 pacientes y claudicación intermitente en 20. Las características basales de los sujetos incluidos se muestran en la tabla 1.
Características basales de los sujetos incluidos en función del grupo de estudio
| Grupos de estudio | ||
| Enfermedad arterial periférica (n=30) | Control (n=15) | |
| Edad (media±DE) | 66±6.80 | 66±7.62 |
| Sexo varón (%) | 26 (87%) | 13 (87%) |
| Diabetes mellitus (%) | 7 (23%) | NA |
| Antecedentes tabaco (%) | 13 (43%) | NA |
| Cardiopatía isquémica (%) | 8 (27%) | NA |
| Hipertensión (%) | 19 (63%) | NA |
| Dislipidemia (%) | 16 (53%) | NA |
| ACVA (%) | 3 (10%) | NA |
| IRC (%) | 1 (3%) | NA |
| Isquemia crítica (%) | 10 (33%) | NA |
NA: no aplicable.
Los niveles séricos de hsPCR fueron mayores en pacientes con EAP al ser comparados con sujetos sanos (0,92±0,4 vs. 0,46±0,04 log10-mg/dl, p<0,0001) y en pacientes con isquemia crítica frente a pacientes claudicantes (1,27±0,4 vs. 0,74±0,2 log10-mg/dl, p=0,01) (fig. 1).
La expresión genómica basal de TLR4 por HAEC (antes de la estimulación con suero) fue similar a la obtenida tras la exposición a suero control (X10-log10-QR: 1,11±0,3 vs. 1,09±0,3, p=0,75) y menor que tras la exposición a suero de pacientes con EAP (X10-log10-QR: 1,11±0,3 vs. 1,59±0,4, p<0,0001).
La expresión de TLR4 fue mayor tras la exposición de HAEC al suero de pacientes con EAP que tras la exposición al suero de sujetos control (X10-log10-QR: 1,59±0,4 vs. 1,09±0,3, p<0,0001) (fig. 2) sin observarse diferencias en función de la situación clínica (X10-log10-QR: 1,81±0,5 [isquemia crítica] vs. 1,50±0,4 [claudicación intermitente], p=0,16).
Expresión de TLR4 por el cultivo celular HAEC tras el estímulo con suero de pacientes con enfermedad arterial periférica y de sujetos sanos. Las variables se expresan en media y desviación estándar. Basal: expresión del gen sin la estimulación con suero; control: sujetos sanos; EAP: enfermedad arterial periférica; TLR4: receptor Toll-Like 4.
Los niveles séricos de hsPCR no se correlacionaron con la expresión por HAEC de TLR4 (r=0,26; p=0,16).
DiscusiónEn este estudio hemos observado que las células endoteliales humanas previamente sanas que son expuestas a suero de pacientes con EAP presentan una transformación genotípica proinflamatoria a través de los receptores de membrana TLR4 de la inmunidad innata. Dichos receptores se han relacionado de forma consistente con la aterosclerosis. Su expresión está aumentada durante el desarrollo de la placa de ateroma8. En modelos murinos ApoE −/−, la deficiencia de TLR4 disminuye el desarrollo de la lesión aterosclerótica y el infiltrado macrofágico entre un 55 y un 75%6. Además, la inactivación por mutación de la porción citoplasmática del receptor en ratones confiere resistencia a la aterosclerosis inducida a través de la dieta. Sin embargo el trasplante de médula ósea desde estos ratones a otros ApoE −/− no portadores de la mutación no frena el proceso aterosclerótico7. Estos datos orientan hacia un posible papel clave de los receptores TLR en la modulación del proceso aterogénico. Como se ha señalado previamente, los receptores TLR requieren de la presencia de ligandos específicos para su activación. Por lo tanto, a la luz de nuestros resultados, el suero de pacientes con EAP debería contener el vector necesario para la activación de la inmunidad innata. En la actualidad se conoce un amplio repertorio de ligandos, tanto exógenos como endógenos, capaces de activar la célula endotelial a través de la subfamilia TLR4, entre los que se encuentran el antígeno HSP6010,11, los lipopolisacáridos12,13 y el LDL oxidado14, entre otros. Recientemente se ha señalado que los anticuerpos anti-beta2-glucoproteína (ABGPI) circulantes podrían actuar como ligandos de los receptores TLR15–20 debido al mimetismo molecular que presentan con diversos agentes microbianos. Dichos autoanticuerpos se dirigen contra la proteína plasmática beta2-glucoproteína que posee un intenso tropismo por los fosfolípidos de la membrana celular21,22. Diversos estudios en enfermedad coronaria y EAP han puesto de manifiesto niveles elevados de ABGPI comparado con controles23–25. Además, según un reciente estudio, la disfunción endotelial y situación inflamatoria presente en los pacientes con EAP podría estar relacionada con títulos elevados de este autoanticuerpo en suero25. Por lo tanto, los ABGPI circulantes de pacientes con EAP podrían sustentar una posible vía de activación endotelial proaterogénica a través de la activación de la inmunidad innata dependiente de los receptores de membrana TLR. Esta hipótesis ha impulsado el diseño de un protocolo experimental que tiene como objeto la verificación de esta posible vía de activación y que actualmente estamos llevando a cabo.
En la actualidad, es comúnmente aceptado que la aterosclerosis es una enfermedad vascular inflamatoria crónica. En este contexto, la PCR es un marcador sistémico de inflamación que se encuentra moderadamente elevado en pacientes con EAP26. Además, la disfunción endotelial que presentan los pacientes desde las fases iniciales de la enfermedad se ha relacionado con niveles altos de dicho marcador27. En este estudio hemos observado una asociación entre los niveles plasmáticos de PCR y la severidad clínica de la enfermedad, datos congruentes con otras investigaciones publicadas en las que se demuestra una mayor carga inflamatoria en pacientes con enfermedad extensa26. No obstante, llama la atención la ausencia de correlación entre los niveles de PCR y la expresión de TLR4 por las células endoteliales. Es más, la expresión del receptor tampoco presentó asociación con la situación clínica de la enfermedad. Estos datos indican que la activación del sistema inmunitario innato podría acontecer durante las primeras fases de la enfermedad y que posteriormente otras vías secundarias y de carácter inflamatorio serían las responsables de su progresión.
La aterosclerosis es la primera causa de morbimortalidad en los países occidentales y es responsable de uno de los mayores gastos que asumen los sistemas de salud de cada país. El aumento de la esperanza de vida y los hábitos de salud en las sociedades occidentales no hacen sino esperar un incremento de la prevalencia de dicha enfermedad y sus manifestaciones clínicas y consecuentemente un aumento del gasto en el próximo siglo. La identificación específica de una posible vía de activación de la aterosclerosis podría aportar nuevas estrategias terapéuticas con el fin de disminuir la progresión de la enfermedad o de evitarla en sus fases precoces. Así mismo, la identificación de una posible vía de activación de las células endoteliales previamente sanas hacia un fenotipo proinflamatorio a través de un mecanismo autoinmunitario que engloba al sistema inmunitario innato (TLR) y que se inicia con la interacción de un vector patogénico presente en el suero de pacientes con enfermedad arterial periférica nos permitiría avanzar un escalón más en la comprensión de los mecanismos fisiopatológicos y etiopatogénicos de la aterosclerosis.
Una de las principales limitaciones de este estudio es la de no haber obtenido información acerca de la expresión proteinómica del gen estudiado, así como el no haber determinado la producción de moléculas proinflamatorias por HAEC en respuesta al estímulo del suero. La distribución asimétrica de los factores de riesgo cardiovascular entre los grupos analizados favorece que estos hayan podido actuar como factores de confusión en nuestros resultados. La estimación de los niveles de PCR traduce la situación inflamatoria sistémica de los pacientes y no describe el posible efecto proinflamatorio del suero sobre el cultivo celular. No obstante, esta misma limitación nos permite señalar que la carga inflamatoria de los pacientes con EAP depende de la extensión del tejido vascular dañado y que la activación de la inmunidad innata podría darse de forma independiente a la intensidad del proceso inflamatorio, iniciada por uno o varios vectores serológicos aún por determinar.
ConclusiónEl sistema inmunitario innato se encuentra involucrado en los procesos fisiopatológicos que modulan el proceso aterogénico. En este contexto, la interacción entre el suero de pacientes con EAP y células endoteliales previamente sanas induce una transformación genotípica proinflamatoria del cultivo celular a través de los receptores TLR4 del sistema inmunitario innato. La detección de un hipotético vector estimulador de dichos receptores en el suero de los pacientes podría permitir la identificación de una vía de activación de la aterosclerosis con implicaciones terapéuticas en un futuro.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio se ha llevado a cabo gracias a la ayuda para la investigación otorgada por el Patronato de la Fundación de la Sociedad Española de Angiología y Cirugía Vascular.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este estudio se ha llevado a cabo gracias a la ayuda para la investigación otorgada por el Patronato de la Fundación de la Sociedad Española de Angiología y Cirugía Vascular.