Las endofugas tipo II(EFII) pueden incrementar la tasa de complicaciones. Se evaluó la relación entre la cantidad de trombo en el saco con el desarrollo de EFII y el crecimiento del aneurisma.
Material y métodoSe estudió a 103 pacientes tratados mediante EVAR. El grosor máximo del trombo (GMT), los porcentajes del área (PAOT) y perímetro aórticos con trombo (PPCT, PTHP) y el grosor (GMHP) en la cara posterior se determinaron en la TC preoperatoria en: zona A (diámetro máximo), zona B (entre zona A y bifurcación) y zona C (entre inicio del aneurisma y zona A). Se cuantificó el número de ramas permeables y el diámetro del saco durante el seguimiento.
ResultadosHubo 51 endofugas (49,5%). Los pacientes con EFII presentaron unos GMT (18,6 vs. 24mm; p=0,01) y GMHP (13,9 vs. 18,9mm; p=0,003) menores en la zona A y tenían un PAOT (49,7 vs. 65,4%; p<0,001), PPCT (72,4 vs. 82,3%; p<0,001) y PTHP (63,7 vs. 74,7%; p=0,03). El número medio de ramas fue de 5 en los pacientes sin EFII frente a 6 en los que la tenían (p=0,004). Se observó un riesgo de EFII menor con: PAOT (OR=0,65 por cada aumento del 10%; IC 95%: 0,44-0,98; p=0,03), PPCT en la zona B (OR=0,69 por cada aumento del 10%; IC 95%: 0,50-0,95; p=0,01) y C (OR=0,68; IC 95%: 0,52-0,88; p=0,002), GMHP en la zona A (OR=0,71 por cada aumento de 5mm; IC 95%: 0,49-0,99; p=0,04) y PTHP en la B (OR=0,81 por cada aumento del 10%; IC 95%: 0,67-0,9; p=0,02). La arteria mesentérica inferior (AMI) permeable (OR=3,1; IC 95%: 1,1-8,9; p=0,033), el mayor número de ramas (OR=4,6 con más de 4 vasos; IC 95%: 1,8-12,2; p=0,024) y lumbares (OR=1,9 por cada incremento en una lumbar; IC 95%: 1,1-3,5; p=0,017) se asociaron a un mayor riesgo. Cuanto mayor era el PAOT, PPCT, GMHP y PTHP mayor era la tendencia a la regresión/estabilidad del saco.
ConclusionesLa cuantificación de la carga de trombo y número de ramas permeables permite determinar pacientes con mayor riesgo de EFII y crecimiento del saco durante el seguimiento.
Type II endoleaks (ELII) may increase the complication rate. An evaluation was made of the association between thrombus load and development of ELII, and aneurysm sac growth.
Material and methodmethodsA total of 103 endovascular aortic repair patients were analyzed. The maximum thrombus thickness (GMT), percentages of area (PAOT) and perimeter lined by thrombus (PPCT), and posterior thickness (GMHP) were determined from pre-operative CT at 3 levels: zone A (maximum diameter), zone B (from zone A to bifurcation), and zone C (from neck to zone A). The number of aortic side branches was recorded, and sac diameter was measured during follow-up.
ResultsA total of 51 endoleaks (49.5%) were noted. Patients with ELII had significantly less GMT (24.0 vs. 18.6mm, P=.01) and GMHP (13.9 vs. 18.9mm, P=.003) in zone A, and PAOT (49.7 vs. 65.4%, P<.001), PPCT (72.4 vs. 82.3%, P<.001), and PTHP (63.7 vs. 74.7%, P=.03). The average number of side branches was 5 in patients without ELII versus 6 with (P=.004). Lower risk of ELII was observed with: PAOT (OR=0.65 for a 10% increase, 0.44-0.98, P=.03), PPCT in zone B (OR=0.69 for each 10% increase, 0.50-0.95, P=.01), and C (OR=0.68, 0.52-0.88, P=.002), GMHP in zone A (OR=0.71 for each 5mm increase, 0.49-0.99, P=.04), and PTHP in zone B (OR=0.81 for 10% increase, 0.67-0.99, P=.02). The patent IMA (OR=3.1, 1.1-8.9, P=.033), the number of patent branches (OR=4.6 with more than 4 branches, 1.8-12.2, P=0.024), and lumbar branches (OR=1.9 for each patent lumbar, 1.1-3.5, P=.017) were associated with an increased risk of ELII. The greater PAOT, PPCT, GMHP, and PTHP were, the higher regression/stability of the sac was.
ConclusionsQuantification of the thrombus load and the number of patent side branches can be used to determine patients at increased risk of ELII and sac growth during follow-up.
El manejo del aneurisma de aorta abdominal (AAA) ha cambiado en la última década con la introducción del tratamiento endovascular (EVAR), que ha demostrado ser una alternativa eficaz en la prevención de la rotura del mismo1. A pesar de que las endoprótesis de última generación tienen una baja tasa de complicaciones2,3, la durabilidad a largo plazo de estos procedimientos no se ha establecido de forma definitiva. La existencia de endofugas (EF) en algún momento del seguimiento es una anomalía frecuente4, principalmente aquellas atribuidas a un flujo retrógrado desde las arterias lumbares y mesentérica inferior (AMI).
Generalmente, las EF tipo II (EFII) poseen un carácter benigno1, a pesar de lo cual, en una minoría de los casos pueden incrementar la incidencia de complicaciones, incluyendo crecimiento del saco aneurismático, aumento de la tasa de reintervención, necesidad de cirugía abierta y la rotura5–7. Estos hechos motivaron estudios previos con el objetivo relacionar las características morfológicas preoperatorias del aneurisma con el riesgo de desarrollar EFII y el crecimiento del saco durante el seguimiento8. Varios autores han demostrado la asociación con el número de ramas permeables; sin embargo, no ha sido bien establecida con la carga de trombo preoperatoria9,10.
Por ello, el objetivo de nuestro estudio fue determinar si la cantidad de trombo y las ramas permeables en el estudio preoperatorio estaban asociadas a una mayor incidencia de EFII y crecimiento del saco aneurismático durante el seguimiento.
Material y métodosSe realizó un análisis retrospectivo de nuestro registro de datos, mantenido prospectivamente, de los pacientes tratados mediante EVAR entre el año 2005 y el 2012. Quedaron excluidos del estudio los aneurismas ilíacos aislados, aneurismas rotos, pseudoaneurismas y hematomas intramurales. Aquellos casos con angio-TC pre- y postoperatoria de baja calidad o con un seguimiento menor de 6 meses también fueron excluidos. Para evitar factores de confusión y obtener una muestra más homogénea se seleccionó únicamente a aquellos pacientes tratados con endoprótesis Excluder de segunda generación (porosidad cero). Finalmente, nuestra muestra se conformó con 103 pacientes de un total de 191 EVAR realizados durante dicho periodo de estudio. Se obtuvieron los datos clínicos y demográficos de cada paciente.
Todos los casos fueron evaluados utilizando una angio-TC preoperatoria realizada con cortes de menos de 3mm de grosor. El seguimiento se realizó igualmente con angio-TC al mes, 6 y 12 meses y, posteriormente, de forma anual en los casos sin evidencia de endofuga o de forma semestral en el caso de haberla.
El diámetro máximo del aneurisma se midió de adventicia a adventicia. La carga de trombo se analizó utilizando los siguientes parámetros con el software de imagen OsiriX: grosor máximo de trombo (GMT), el porcentaje del área ocupada por trombo (PAOT) y el porcentaje del perímetro aórtico cubierto por trombo (PPCT). Cada medición se realizó en 3 cortes diferentes: a nivel del diámetro máximo (zona A), en la zona entre la bifurcación aórtica y la zona A (zona B) y en la zona entre el cuello y la zona A (zonaC). Teniendo en cuenta que el mayor número de EFII corresponde a arterias lumbares permeables, se estudió la carga de trombo en el hemicírculo posterior del corte transversal, midiendo el grosor máximo del trombo (GMHP) y el porcentaje de trombo cubriendo el hemiciclo posterior (PTHP) en las 3 zonas descritas. El PTHP se calculó con la siguiente fórmula:
α: ángulo libre de trombo del hemicírculo posterior.Se evaluó la permeabilidad de todas las ramas aórticas desde la renal más baja hasta la bifurcación aórtica. Cada vaso fue clasificado de acuerdo a su anatomía como arteria lumbar, AMI y renal accesoria.
Todas las TC postoperatorias fueron revisadas para la detección de EFII. Se definió como EFII precoz la detectada en los primeros 30 días tras el procedimiento y tardía después del primer mes. Asimismo, se definió como EFII persistente aquella que permaneció hasta el final del seguimiento.
Se compararon los diámetros preoperatorios y postoperatorios durante el seguimiento, clasificando los casos en 3 grupos: regresión, estabilidad y crecimiento. Se consideró crecimiento o regresión si el saco variaba ±5mm, respectivamente. Se analizó la relación entre estas variables y la presencia de EFII.
Las variables continuas se expresaron como media y desviación estándar. Las variables cualitativas se compararon con el test χ2 y el test exacto de Fisher. Las variables continuas se compararon con test t. Se realizó un análisis univariable y regresión logística multivariable para analizar la relación de una determinada variable con la existencia de EFII. Se estableció como nivel de significación estadística una p ≤ 0,05.
ResultadosDurante el período de estudio, se trató a 103 pacientes mediante EVAR, todos ellos con la endoprótesis Excluder (W.L. Gore & Associates, Flagstaff, Ariz). El seguimiento mediano de la serie fue de 22,8 meses (6,3-81,4). Se detectaron 51 EFII (49,5%), de las que fueron precoces el 74,5% (n=38) y tardías el 25,5% (n=13) restante. La tabla 1 muestra los datos demográficos y clínicos de los pacientes con y sin EFII durante el seguimiento, sin observarse diferencias significativas entre los grupos. El origen de la EFII se relacionó con arterias lumbares en el 72,5% (37), con la AMI en el 5,9% (3) y con ambas en el 13,7% (7). En 4 casos (7,8%) no pudo determinarse con certeza absoluta la arteria involucrada en la EFII. Al final del seguimiento persistieron 28 EFII (53,8%): de las EFII precoces se resolvieron espontáneamente el 53,6% en un tiempo mediano de 25,3 meses, mientras que lo hicieron en un tiempo de 8,36 meses el 53,8% de las tardías (p=0,21).
Características clínicas y demográficas de los pacientes con y sin endofuga
| Característica | Endofuga | p | |
| Sí % (n) | No % (n) | ||
| Edad | |||
| Tabaquismoa | 55,9 (19) | 44,1 (15) | 0,36 |
| Hipertensión | 47,9 (35) | 52,1 (38) | 0,62 |
| Diabetes | 35,7 (5) | 64,3 (9) | 0,27 |
| Cardiopatía isquémica | 50 (17) | 50 (17) | 0,95 |
| EPOC | 54,5 (12) | 45,5 (10) | 0,59 |
| IRC | 46,2 (12) | 53,8 (14) | 0,69 |
| Dislipidemia | 53,4 (31) | 46,6 (27) | 0,37 |
EPOC: enfermedad pulmonar obstructiva crónica; IRC: insuficiencia renal crónica.
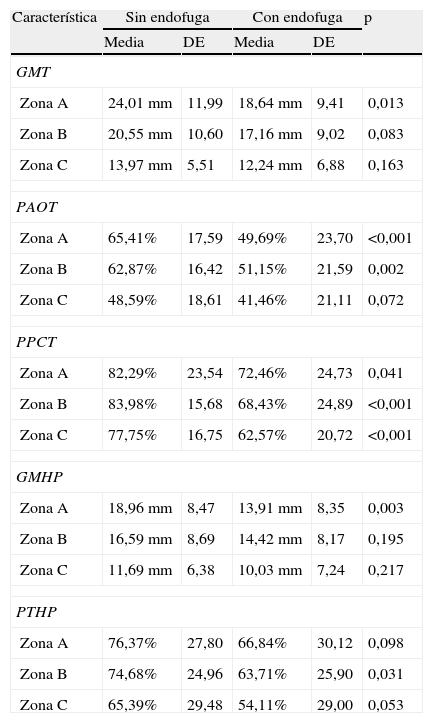
El análisis univariable mostró que la probabilidad de desarrollar una EFII disminuye a medida que aumenta la carga de trombo. Las características relacionadas con la cantidad de trombo en la TC preoperatoria se resumen en la tabla 2. El GMT (24±11,9 vs. 18,6±9,4mm; p=0,013), PAOT (63,4±17,6% vs. 49,7±23,7%; p<0,001) y PPCT (82,3±23,5% vs. 72,5±24,7%; p<0,001) en la zona A estaban asociados a un menor riesgo de EFII. En la zona B, se observaron diferencias en el PAOT (62,9±16,4% vs. 51,2±21,6%; p=0,002) y PPCT (83,9±15,7% vs. 68,4±24,9%; p<0,001). Únicamente el PPCT (77,8±16,8% vs. 62,6±20,7%; p<0,001) tuvo una asociación significativa con las EFII en la zona C.
Características anatómicas relacionadas con la carga de trombo. Análisis univariable
| Característica | Sin endofuga | Con endofuga | p | ||
| Media | DE | Media | DE | ||
| GMT | |||||
| Zona A | 24,01mm | 11,99 | 18,64mm | 9,41 | 0,013 |
| Zona B | 20,55mm | 10,60 | 17,16mm | 9,02 | 0,083 |
| Zona C | 13,97mm | 5,51 | 12,24mm | 6,88 | 0,163 |
| PAOT | |||||
| Zona A | 65,41% | 17,59 | 49,69% | 23,70 | <0,001 |
| Zona B | 62,87% | 16,42 | 51,15% | 21,59 | 0,002 |
| Zona C | 48,59% | 18,61 | 41,46% | 21,11 | 0,072 |
| PPCT | |||||
| Zona A | 82,29% | 23,54 | 72,46% | 24,73 | 0,041 |
| Zona B | 83,98% | 15,68 | 68,43% | 24,89 | <0,001 |
| Zona C | 77,75% | 16,75 | 62,57% | 20,72 | <0,001 |
| GMHP | |||||
| Zona A | 18,96mm | 8,47 | 13,91mm | 8,35 | 0,003 |
| Zona B | 16,59mm | 8,69 | 14,42mm | 8,17 | 0,195 |
| Zona C | 11,69mm | 6,38 | 10,03mm | 7,24 | 0,217 |
| PTHP | |||||
| Zona A | 76,37% | 27,80 | 66,84% | 30,12 | 0,098 |
| Zona B | 74,68% | 24,96 | 63,71% | 25,90 | 0,031 |
| Zona C | 65,39% | 29,48 | 54,11% | 29,00 | 0,053 |
GMHP: grosor máximo del trombo en el hemiciclo posterior; GMT: grosor máximo del trombo; PAOT: porcentaje del área ocupada por trombo; PPCT: porcentaje del perímetro aórtico cubierto por trombo; PTHP: porcentaje de trombo cubriendo el hemiciclo posterior.
En el hemicírculo posterior se observó un efecto protector del GMHP (18,9±8,5 vs. 13,9±8,4mm; p=0,003) en la zona A y PTHP en las zonas B (74,7±24,9% vs. 63,7±25,9%; p=0,03) y C (65,4±29,5% vs. 54,1±29%; p=0,05) (tabla 2).
El número medio de ramas permeables fue de 5 en los pacientes sin EFII frente a 6 en los que sí la tenían (p=0,004), siendo la media de lumbares permeables de 5 y 4,3 en pacientes con y sin endofuga (p=0,021), respectivamente. La permeabilidad de la AMI se observó en el 59,4% (41) de los pacientes con EFII y en el 40,6% (28) sin EF (p=0,004). En aquellos aneurismas con 2 o 3 lumbares permeables la probabilidad de EFII fue del 20%, siendo del 60% en los que presentaban 6 o más (p=0,022).
Atendiendo al análisis multivariable (tabla 3) encontramos que el GMT no se comportó como una variable independiente en ninguna zona. Por cada incremento de un 10% en el PAOT en la zona A, la odds ratio (OR) fue de 0,65 (IC 95%: 0,44-0,98; p=0,03). El PPCT también se comportó como un factor protector para el desarrollo de EF en la zona B (OR=0,69 por cada aumento del 10%; IC 95%: 0,50-0,95; p=0,01), que es donde con mayor frecuencia se originan las arterias lumbares, y en la zona C (OR=0,68; IC 95%: 0,52-0,88; p=0,002). En el hemicírculo posterior cada aumento de 5mm del GMHP en la zona A (OR=0,71; IC 95%: 0,49-0,99; p=0,04) y cada aumento de 10% en el PTHP en la zona B (OR=0,81; IC 95%: 0,67-0,99; p=0,02) también ejercieron un efecto protector.
Características anatómicas relacionadas con la carga de trombo. Análisis multivariable
| Característica | Incremento | OR (IC 95%) | p |
| GMT | |||
| Zona A | 5mm | 0,99 (0,73-1,45) | 0,87 |
| Zona B | 0,98 (0,67-1,45) | 0,93 | |
| Zona C | 0,97 (0,64-1,60) | 0,96 | |
| PAOT | |||
| Zona A | 0,65 (0,44-0,98) | 0,03 | |
| Zona B | 10% | 0,94 (0,59-1,48) | 0,77 |
| Zona C | 0,96 (0,79-1,43) | 0,67 | |
| PPCT | |||
| Zona A | 0,99 (0,85-1,42) | 0,48 | |
| Zona B | 10% | 0,69 (0,50-0,95) | 0,01 |
| Zona C | 0,68 (0,52-0,88) | 0,002 | |
| GMHP | |||
| Zona A | 0,71 (0,49-0,99) | 0,04 | |
| Zona B | 5mm | 0,93 (0,74-1,37) | 0,96 |
| Zona C | 0,98 (0,71-1,58) | 0,79 | |
| PTHP | |||
| Zona A | 0,95 (0,79-1,14) | 0,58 | |
| Zona B | 10% | 0,81 (0,67-0,99) | 0,02 |
| Zona C | 0,89 (0,74-1,69) | 0,21 | |
GMHP: grosor máximo del trombo en el hemiciclo posterior; GMT: grosor máximo del trombo; PAOT: porcentaje del área ocupada por trombo; PPCT: porcentaje del perímetro aórtico cubierto por trombo; PTHP: porcentaje de trombo cubriendo el hemiciclo posterior.
Se observó un riesgo mayor de presentar EFII durante el seguimiento en aquellos pacientes con IMA permeable (OR=3,1; IC 95%: 1,1-8,9; p=0,033), mayor número de ramas totales (OR=4,6 con más de 4 vasos; IC 95%: 1,8-12,2; p=0,024) y lumbares permeables (OR=1,9 por cada incremento en una lumbar; IC 95%: 1,1-3,5; p=0,017) (tabla 4).
Datos predictivos de EF tipo ii basados en la permeabilidad de ramas permeables
| Rama permeable | Incremento | OR (95% IC) | p |
| AMI permeable | Sí/No | 3,1 (1,09-8,89) | 0,033 |
| Total de ramas permeables | > 4 ramas | 4,6 (1,775-12,15) | 0,002 |
| Lumbares permeables | 1 lumbar | 1,4 (1,04-1,82) | 0,024 |
| Pares de lumbares permeables | 1 par | 1,9 (1,13-3,5) | 0,017 |
AMI: arteria mesentérica inferior.
Al final del seguimiento persistieron más de la mitad de las endofugas detectadas (53,8%; n=28). La evolución del diámetro del saco se lista en la tabla 5. Se produjo un crecimiento ≥5mm en 5 pacientes: 4 con EFII (80%) y uno sin ella (p=0,02). Por el contrario, se observó una regresión del saco ≥5mm en el 60,9% de los pacientes sin EF (39) y tan solo en el 39,1% de los que sí la presentaban (p=0,02). Analizando los casos con EFII persistente se confirmó de nuevo un mayor número de crecimientos en los pacientes con EFII respecto los pacientes sin ella (p = 0,03). No hubo ningún caso de complicación ni rotura del aneurisma. Se realizó punción translumbar de trombina en 2 pacientes con EFII persistente y crecimiento >5mm. Los 3 pacientes restantes no fueron tratados con métodos invasivos dada su lenta tasa de crecimiento y el alto riesgo quirúrgico.
Evolución del saco aneurismático en pacientes con y sin endofuga persistente
| Evolución | Endofuga transitoria | p | |
| No % (n) | Sí % (n) | ||
| Crecimiento (≥5mm) | 20 (1) | 80 (4) | 0,02 |
| Estabilidad (±5mm) | 35,3 (12) | 64,7 (22) | |
| Regresión (≥5mm) | 60,9 (39) | 39,1 (25) | |
| Evolución | Endofuga persistente | p | |
| No %(n) | Sí %(n) | ||
| Crecimiento (≥5mm) | 25 (1) | 75 (3) | 0,03 |
| Estabilidad (±5mm) | 27,3 (6) | 72,7 (16) | |
| Regresión (≥5mm) | 64 (16) | 36 (9) | |
Los aneurismas con mayor carga de trombo en la TC preoperatoria presentaron un menor crecimiento del saco durante el seguimiento. En cada una de las zonas se observó que cuanto mayor era el PAOT, PPCT, GTHP y PTHP, mayor era la tendencia a la regresión/estabilidad del saco (tabla 6).
Evolución del saco aneurismático con relación a la severidad de la carga de trombo
| Característica | Crecimiento | Estabilidad/regresión | p | ||
| Media | DE | Media | DE | ||
| GMT | |||||
| Zona A | 17,5mm | 13,37 | 21,6mm | 10,95 | 0,383 |
| Zona B | 14,1mm | 11,09 | 19,1mm | 9,85 | 0,224 |
| Zona C | 11,8mm | 8,21 | 13,1mm | 6,17 | 0,607 |
| PAOT | |||||
| Zona A | 27,1% | 28,48 | 59,5% | 20,47 | <0,001 |
| Zona B | 33,3% | 28,02 | 58,5% | 18,57 | 0,002 |
| Zona C | 28,1% | 20,06 | 46,1% | 19,71 | 0,033 |
| PPCT | |||||
| Zona A | 52,6% | 41,30 | 78,9% | 22,56 | 0,010 |
| Zona B | 41,7% | 33,59 | 78,4% | 19,49 | <0,001 |
| Zona C | 40,3% | 25,69 | 72,1% | 18,46 | <0,001 |
| GMHP | |||||
| Zona A | 11,3mm | 9,7 | 16,8mm | 8,63 | 0,137 |
| Zona B | 8,4mm | 6,92 | 15,9mm | 8,39 | 0,050 |
| Zona C | 5,0mm | 4,42 | 11,2mm | 6,81 | 0,030 |
| PTHP | |||||
| Zona A | 41% | 34,06 | 73,5% | 28,01 | 0,008 |
| Zona B | 37,8% | 29,49 | 71,2% | 24,53 | 0,002 |
| Zona C | 22,8% | 20,72 | 62,1% | 28,65 | 0,001 |
GMHP: grosor máximo del trombo en el hemiciclo posterior; GMT: grosor máximo del trombo; PAOT: porcentaje del área ocupada por trombo; PPCT: porcentaje del perímetro aórtico cubierto por trombo; PTHP: porcentaje de trombo cubriendo el hemiciclo posterior.
La reparación endovascular ha demostrado ser un procedimiento eficaz en la exclusión del AAA, surgiendo como alternativa a la cirugía abierta2. Debido a sus potenciales ventajas en términos de morbimortalidad, su utilización se ha incrementado de forma notable en las últimas décadas, principalmente en los pacientes de alto riesgo quirúrgico1. A pesar de los buenos resultados a corto plazo, la durabilidad del EVAR a largo plazo aún no ha sido bien establecida. Las EFII son una complicación frecuente tras la implantación de la endoprótesis, observándose en uno de cada 4 pacientes en algún momento del seguimiento4,11.
Las EFII son las detectadas con más frecuencia, pudiendo alcanzar una incidencia superior al 30%8. Se ha publicado una frecuencia muy variable de EFII como resultado de diferencias en el diseño de los estudios. Back et al.12 obtuvieron un 23% de EFII, que es mucho mayor que la indicada por el EUROSTAR registry13. La inclusión de las EFII detectadas en los 30 primeros días, un programa estricto de seguimiento durante el primer año (1,6 y 12 meses) con angio-TC y las características de esta prueba (cantidad de contraste, fase tardía,mm de los cortes) podrían explicar una incidencia en nuestra serie superior a la publicada en la literatura.
La relevancia clínica de dichas EFII es controvertida: aunque en la mayoría de las ocasiones tienen un comportamiento benigno y se cierran espontáneamente14, pueden asociarse a una mayor tasa de reintervención, crecimiento del saco y rotura5–7. En este sentido, el estudio de 873 pacientes de Jones et al.5 encontró que las EFII persistentes son un predictor significativo de rotura, con un riesgo de crecimiento del saco 23 veces mayor y de 19 veces de reintervención. Por el contrario, otros autores abogan por un seguimiento clínico, incluso en caso de crecimiento del saco aneurismático15.
La identificación de factores anatómicos preoperatorios de riesgo para el desarrollo de EFII ha sido objetivo de estudios previos. Armon et al.16 correlacionaron el grosor del trombo posterior con una menor existencia de EFII, aunque sin alcanzar la significación estadística. Posteriormente, Sampaio et al.17 asociaron la mayor carga de trombo con una menor incidencia de EFII: el PPCT, el GMT y el PTHP fueron factores predictores de EFII. Más recientemente, otro estudio18 encontró una correlación negativa con la presencia de EFII estudiando estas mismas características. En nuestro estudio, el GMT, PAOT y PPCT se asociaron significativamente a un menor riesgo de EF.
La participación de las arterias lumbares como causa de la EFII es más frecuente que la participación de la IMA12. El análisis cuantitativo del trombo según su localización en la cara posterior del saco ha demostrado su valor protector en un estudio reciente18: un incremento de 5mm en el grosor del trombo posterior a nivel del ostium de las arterias lumbares (OR=0,25; p=0,001) y un incremento del porcentaje de trombo en el hemicírculo posterior del 25% (OR=0,04; p<0,001). Sin embargo, otros estudios fallaron para establecer dicha relación9. Nuestro estudio mostró que un incremento de 5mm del GMHP en la zona A y un incremento del 10% del PTHP en las zonas B y C se asociaban a una menor probabilidad de EFII. Asimismo, GMHP en la zona A se comportó como una variable independiente.
La permeabilidad de la AMI9,19–21 y arterias lumbares22 ha demostrado ser un factor predisponente para el desarrollo de EFII. Además, en una de las series más largas de EFII persistentes, Abularrage et al.8 encontraron que la probabilidad aumentaba cuando la AMI permanecía permeable (OR=4,0; p=0,003) y con el mayor número de lumbares permeables (OR=1,24; p=0,0006). Arko et al.23 documentaron la asociación entre 2 o más lumbares permeables con el riesgo de EFII. Gorich et al.24 encontraron la misma relación con al menos 4 lumbares permeables. Brountzos et al.18 obtuvieron una fuerte correlación cuando analizaban por separado aquellas ramas que se originaban directamente del aneurisma.
En nuestro estudio, la presencia de la AMI ha sido una variable independiente para el desarrollo de EFII. Adicionalmente, cuando se combinaron todas las ramas y los pares de lumbares, se observó un mayor riesgo cuanto mayor era el número de ramas o de lumbares permeables.
Los datos de nuestro estudio indican una naturaleza benigna de este tipo de EF, no habiéndose evidenciado ningún evento fatal relacionado con la rotura del aneurisma. De las 51 EFII, 22 se resolvieron espontáneamente, siendo la mayoría precoces (15 vs. 7; p=0,21). Se observó que el crecimiento del saco era más probable en pacientes con EFII persistente. Yeung et al.25 encontraron que la baja carga de trombo preoperatoria actuaba como factor independiente de regresión del saco aneurismático en los primeros 12 meses en los pacientes sin EFII, probablemente por una mayor dificultad para la degradación del trombo en los que presentan una carga alta. Por el contrario, nuestro estudio muestra que aquellos aneurismas con mayor PAOT, PPCT y mayor cantidad de trombo en el hemicírculo posterior tienen una mayor tendencia a la regresión/estabilidad del saco.
Nuestro estudio está limitado por su carácter retrospectivo. La exclusión de 88 EVAR por mala calidad de las imágenes o ausencia de seguimiento adecuado puede también ser objeto de sesgos. Otra limitación es la relacionada con la dificultad para la valoración de la permeabilidad de las pequeñas ramas aórticas, en función de la cantidad de contraste o anatomía del paciente.
ConclusionesHemos identificado aquellas características preoperatorias que parecen predecir la existencia de endofugas tipo II. La permeabilidad de la IMA, el PPCT y el grosor del trombo en la cara posterior son variables independientes en el desarrollo de endofugas. La combinación de estos parámetros identificables en el preoperatorio podrían reconocer una cohorte de pacientes de mayor riesgo de complicaciones durante el seguimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.