El objetivo de este estudio es analizar la utilidad en nuestra práctica habitual de dos escalas de riesgo preoperatorio en la reparación endovascular de los aneurismas aórticos abdominales.
Pacientes y métodosEstudio retrospectivo sobre mortalidad y morbilidad a 30 días en 50 pacientes consecutivos con aneurisma de aorta, a los que se realizó tratamiento endovascular. Se aplicó a todos los pacientes la escala de riesgo de Egorova-Giacovelli (EE-G) y la escala de aneurismas de Glasgow (GAS). Análisis estadístico mediante el estudio de medias, curvas ROC y riesgo según el punto de corte principal publicado para ambas escalas.
ResultadosLa mortalidad a 30 días fue del 4%, y la morbilidad del 12%, presentando ambos grupos una puntuación media mayor en ambas escalas. El análisis de las curvas ROC mostró una buena exactitud, con un área bajo la curva (AUC) en la EE-G de 0,781 (IC95%:0,543-1,020; p=0,181) para la mortalidad y 0,831 (IC95%: 0,675-0,988; p=0,009) para la morbilidad. El AUC en la GAS fue 0,839 (IC 95%: 0,684-0,993; p=0,108) para la mortalidad y 0,917 (0,835-0,999; p=0,001) para la morbilidad. Cuando se utilizaron los puntos de corte la mortalidad subía del 2 al 20% (OR: 11) con la EE-G y del 2 al 8% (OR: 3,36) con la GAS; la morbilidad pasaba de 6 al 60% (OR: 21) con la EE-G y de 2 al 41% (OR: 26,42) con la GAS.
ConclusionesEste tipo de escalas pueden ayudarnos a descubrir el grupo de pacientes con mayor riesgo de presentar complicaciones en este tipo de procedimientos.
The aim of this study is to analyse the usefulness of two preoperative risk scales in the endovascular repair of abdominal aortic aneurysms in routine clinical practice.
Patients and methodsA retrospective study was conducted on the morbidity and mortality at 30 days in 50 consecutive patients with an aortic aneurysm repaired by endovascular treatment. The Egorova-Giacovelli scale (EE-G) and Glasgow Aneurysm Scale (GAS) were used on all patients. A statistical analysis of the means, ROC curves, and risk was performed using the published cut-off point for both scales.
ResultsThe mortality at 30 days was 4%, and the morbidity 12%, with both groups having a medium to high score on both scales. The analysis of the ROC curves showed good agreement, with an area under the curve (AUC) in the EE-G of 0.781 (95% CI: 0.543-1.020; P=.181) for the mortality and 0.831 (95%CI: 0.675-0.988; P=.009) for the morbidity. The AUC in the GAS was 0.839 (95%CI: 0.684-0.993; P=.108) for mortality and 0.917 (0.835-0.999; P=.001) for the morbidity. When the cut-off points were used, the mortality increased from 2% to 20% (OR: 11) with the EE-G and from 2% to 8% (OR: 3.36) with the GAS; the morbidity increased from 6% to 60% (OR: 21) with the EE-G and from 2% to 41% (OR: 26.42) with the GAS.
ConclusionsThese types of scales may help to determine the patient group with a higher risk of having complications in these types of procedures.
El uso cada vez mayor de métodos diagnósticos, así como la aplicación de programas de cribado poblacional, han hecho que se diagnostiquen aneurismas de aorta abdominal (AAA) con más frecuencia.
El tratamiento quirúrgico de los mismos conlleva una serie de riesgos, con una mortalidad histórica que llegaba al 8%, haciendo que hasta un 30% de los pacientes fuesen rechazados para cirugía, debido a su elevado riesgo1. El tratamiento endovascular de los AAA (EVAR), iniciado por Volodos y Parodi2,3, fue desarrollado inicialmente para tratar a estos pacientes de alto riesgo, debido a su carácter mínimamente invasivo. Esto hizo que la mortalidad quirúrgica bajase hasta un 4%, ya que los pacientes con mayor riesgo eran tratados mediante EVAR4,5. Actualmente, debido a los buenos resultados obtenidos en distintos ensayos clínicos en cuanto a reducción de la mortalidad a 30 días, esta técnica se ha generalizado a todos los pacientes independientemente del riesgo6–8. Los ensayos EVAR-1 y DREAM, por ejemplo, muestran una mortalidad combinada del 1,9% en el grupo EVAR frente al 5,8% en el grupo quirúrgico (RR: 3,1)7.
Estos resultados también han hecho que se intervengan pacientes cada vez con más edad y más comorbilidades. Sin embargo, los resultados no han sido tan buenos en el grupo considerado de alto riesgo, y a pesar de que diversas series indican que se pueden tratar con seguridad, otros estudios muestran una importante mortalidad, llegando al 7,3% en el ensayo EVAR-2, haciendo que la supervivencia pueda llegar a ser igual que si no se tratasen9.
Sin embargo, una de las críticas al estudio EVAR-2 es que no está claro qué paciente debe ser considerado de alto riesgo. Por lo tanto, identificar al subgrupo de pacientes que no se va a beneficiar del EVAR es una de las claves para mejorar tanto los resultados como el coste-efectividad de este procedimiento.
Una de las posibles herramientas es la utilización de escalas de riesgo preoperatorias. Estas fueron diseñadas inicialmente para tratar de identificar el grupo de pacientes de alto riesgo para cirugía, y algunas de ellas se han intentado aplicar al EVAR, siendo una de las que mejor resultado ha dado la escala de aneurismas de Glasgow (GAS)10. Recientemente se ha desarrollado también una escala específica para EVAR, publicada por Egorova y Giacovelli (EE-G)11. El objetivo de este estudio es analizar la posible utilidad de estas dos escalas en nuestra práctica habitual.
Pacientes y métodosEstudio retrospectivo sobre los pacientes tratados en nuestro centro mediante EVAR desde julio de 2006 a marzo de 2010. Los criterios para realizar EVAR fueron la presencia de una anatomía favorable y al menos una comorbilidad cardiológica, respiratoria, renal o abdominal, que hacía aumentar el riesgo quirúrgico. Se analizaron los resultados a 30 días en cuanto a mortalidad y morbilidad. Las complicaciones se definieron según las recomendaciones de la Sociedad de Cirugía Vascular/Asociación Americana de Cirugía Vascular12. Se incluyeron aquellas consideradas significativas (moderadas-severas). Las sistémicas podían ser cardiológicas (sintomáticas que requerían tratamiento médico), pulmonares (que requerían antibióticos intravenosos u hospitalización prolongada), renales (que requerían diálisis u hospitalización prolongada), cerebrovasculares (con retraso en la recuperación o con confirmación radiológica), enfermedad tromboembólica venosa (que requería tratamiento médico), coagulopatía (que requería transfusión), isquemia intestinal (que requería intervención), sangrado gastrointestinal (que requería intervención quirúrgica o endoscópica), sepsis severa (infección con nueva disfunción orgánica) o isquemia medular (con recuperación retrasada o déficit permanente). También se incluyeron las locales (hematoma, infección, pseudoaneurisma o linfocele que requerían tratamiento quirúrgico) y las complicaciones arteriales postoperatorias que requerían tratamiento quirúrgico.
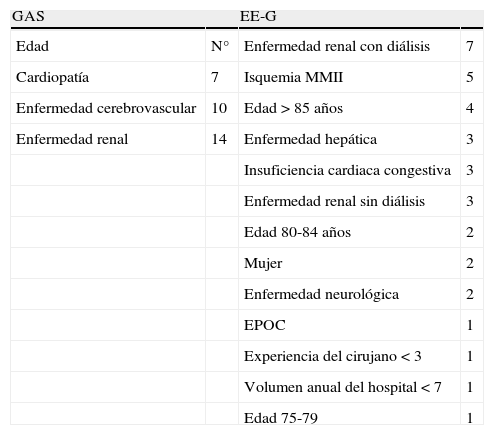
Las fórmulas para calcular las escalas de riesgo GAS y EE-G están expuestas en la tabla 1. La inclusión de las distintas enfermedades requirió la presencia activa o un diagnóstico previo de las mismas. Los puntos de corte utilizados fueron 9 para EE-G (por encima la mortalidad asciende supuestamente a más del 5%) y 86 para GAS (mejor punto de corte en estudios como DREAM o EUROSTAR)12–14.
Cálculo de escalas de riesgo
| GAS | EE-G | ||
| Edad | N° | Enfermedad renal con diálisis | 7 |
| Cardiopatía | 7 | Isquemia MMII | 5 |
| Enfermedad cerebrovascular | 10 | Edad>85 años | 4 |
| Enfermedad renal | 14 | Enfermedad hepática | 3 |
| Insuficiencia cardiaca congestiva | 3 | ||
| Enfermedad renal sin diálisis | 3 | ||
| Edad 80-84 años | 2 | ||
| Mujer | 2 | ||
| Enfermedad neurológica | 2 | ||
| EPOC | 1 | ||
| Experiencia del cirujano<3 | 1 | ||
| Volumen anual del hospital<7 | 1 | ||
| Edad 75-79 | 1 |
Cardiopatía (infarto de miocardio, revascularización, angina, enfermedad valvular severa, arritmia), enfermedad cerebrovascular (ictus, AIT), enfermedad renal (Cr>1,2mg/dl, Cl Cr<60)
El análisis estadístico se realizó con el programa G-Stat 2.0. Para cada escala se analizó la diferencia de puntuación media, y se generaron curvas ROC y la correspondiente área bajo la curva (AUC), tanto para la mortalidad como para la morbilidad. Se consideró un AUC malo entre 0,5 y 0,6, pobre entre 0,6 y 0,7, razonable entre 0,7 y 0,8, bueno entre 0,8 y 0,9 y excelente entre 0,9 y 1. Utilizando los puntos de corte se realizó un análisis del riesgo de mortalidad y morbilidad para cada grupo generado por estos puntos. Se usó la prueba «t» de Student para las variables continuas y Chi-cuadrado para las categóricas.
ResultadosEn el período descrito un total de 50 pacientes con AAA fueron intervenidos mediante EVAR en nuestro centro. Las características principales de los pacientes se describen en la tabla 2.
Datos demográficos y factores de riesgo
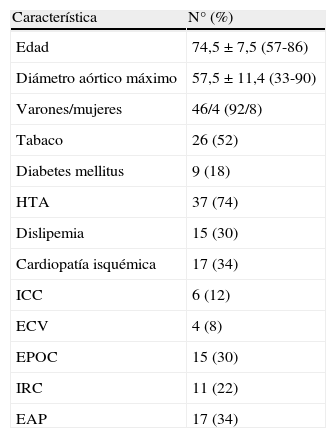
| Característica | N° (%) |
| Edad | 74,5±7,5 (57-86) |
| Diámetro aórtico máximo | 57,5±11,4 (33-90) |
| Varones/mujeres | 46/4 (92/8) |
| Tabaco | 26 (52) |
| Diabetes mellitus | 9 (18) |
| HTA | 37 (74) |
| Dislipemia | 15 (30) |
| Cardiopatía isquémica | 17 (34) |
| ICC | 6 (12) |
| ECV | 4 (8) |
| EPOC | 15 (30) |
| IRC | 11 (22) |
| EAP | 17 (34) |
En los primeros 30 días 2 pacientes fallecieron (4%), uno por insuficiencia renal aguda por trombosis renal y otro por edema agudo de pulmón secundario a deterioro de función renal. En cuanto a la morbilidad 6 pacientes presentaron complicaciones significativas (12%), 3 deterioro de función renal, uno infarto de miocardio, otro insuficiencia cardiaca congestiva y un paciente migración de prótesis que requirió un nuevo procedimiento endovascular.
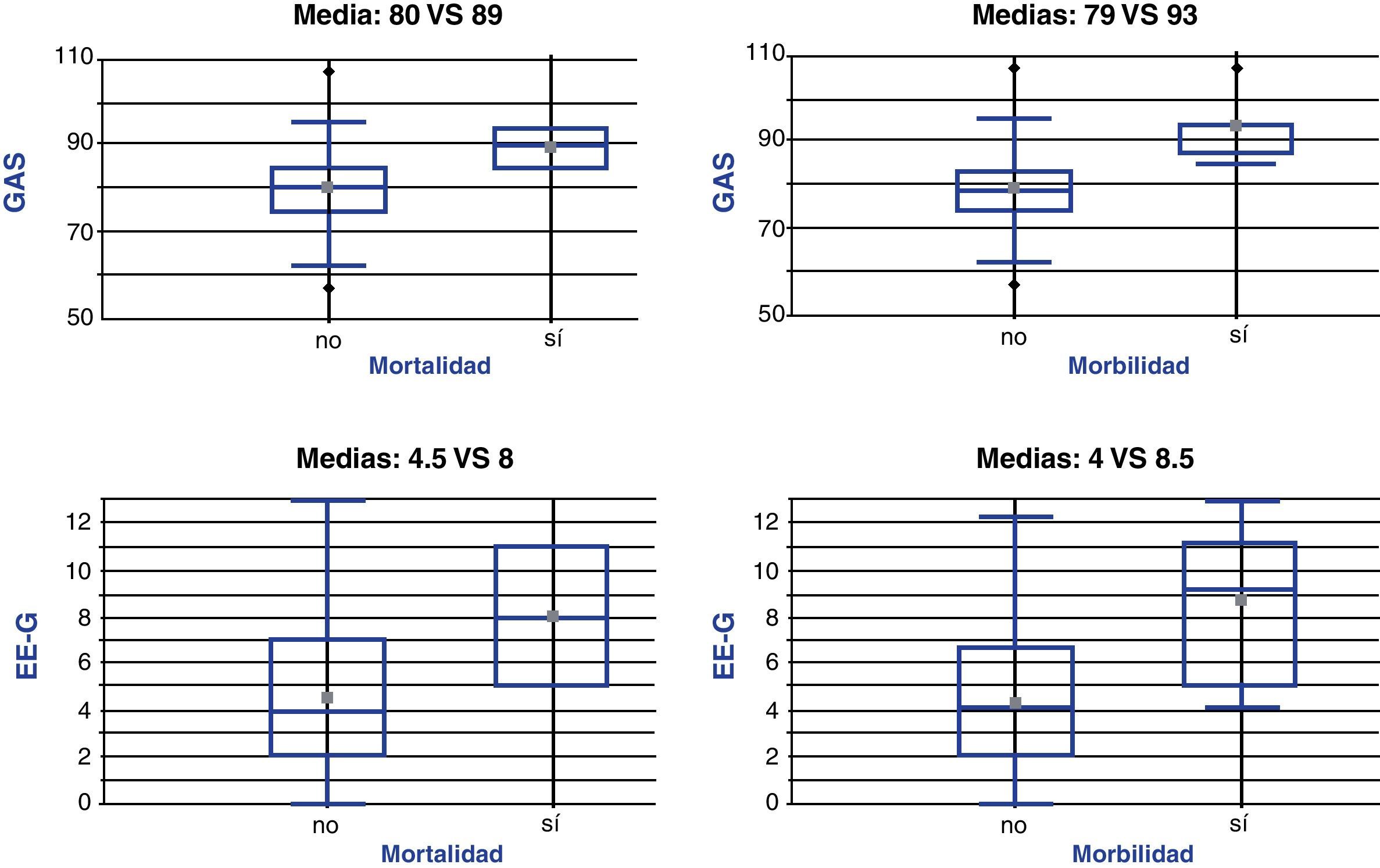
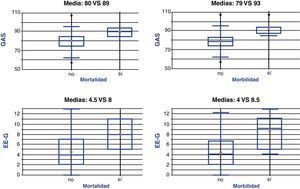
En los pacientes que fallecieron la puntuación media fue mayor en ambas escalas (fig. 1): 8±4 puntos en los pacientes fallecidos frente a 4,5±3 puntos en los pacientes vivos con la EE-G (diferencia de medias 3,4±4,9; IC 95%: 8,4-1,4; p = 0,1646) y 89±6 puntos en los fallecidos frente a 80±10 puntos en los vivos con la GAS (diferencia de medias 9±14; IC 95%: 23-5; p = 0,2139).
La puntuación media fue también mayor en los pacientes con complicaciones que en los pacientes sin ellas (fig. 1): 8,5±3,5 frente a 4±3 con la EE-G (diferencia de medias: 4,3±2,7; IC 95%: 7-1,5; p=0,0027), y 93±7 frente a 79±9 con la GAS (diferencia de medias: 14±7; IC 95%: 22-6; p=0,006).
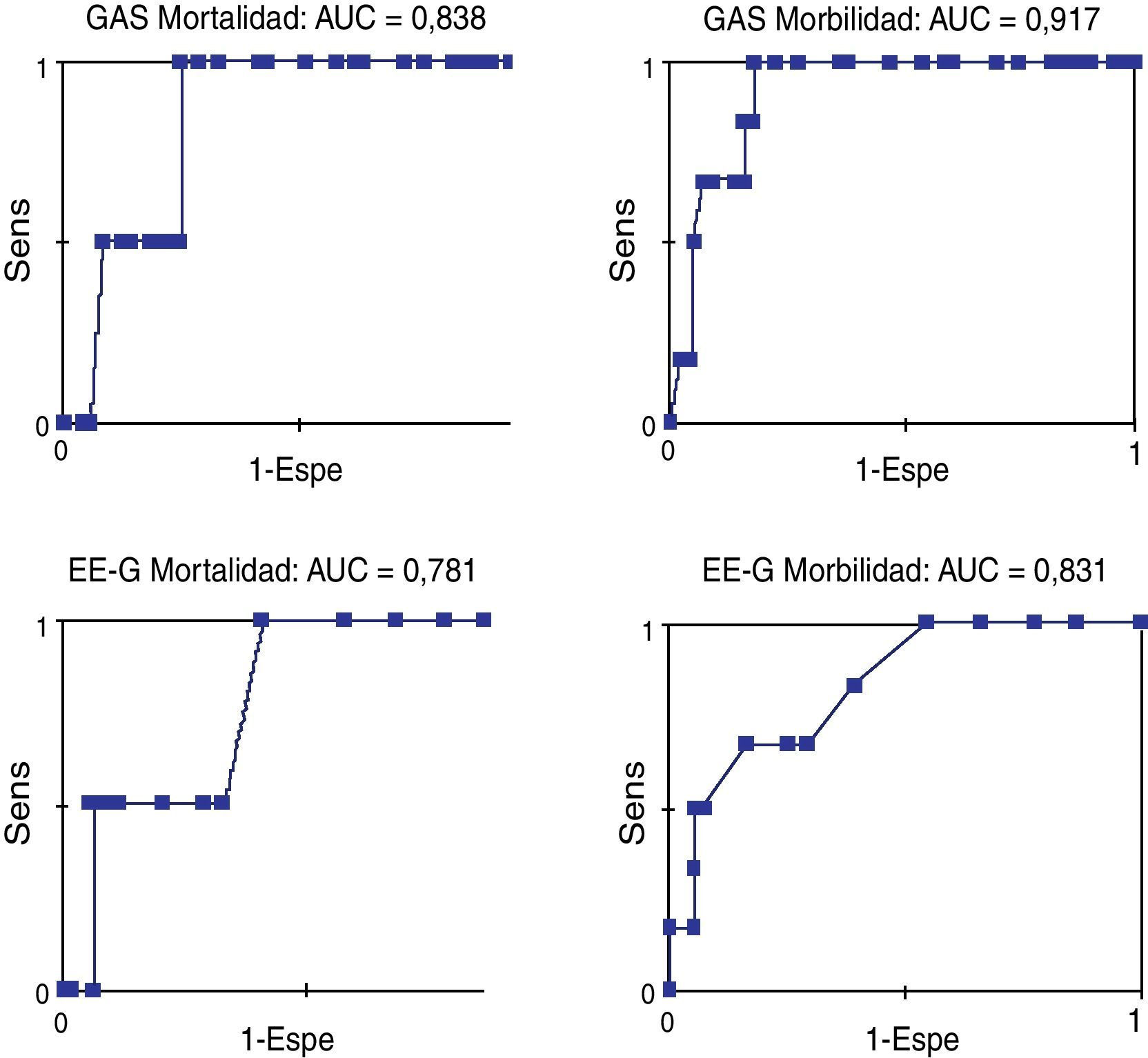
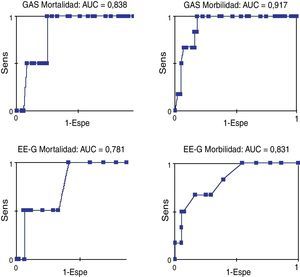
El análisis de las curvas ROC (fig. 2) mostró una buena exactitud. El área bajo la curva (AUC) en la EE-G fue 0,781 (IC 95%: 0,543-1,020; p=0,181) para la mortalidad y 0,831 (IC 95%: 0,675-0,988; p=0,009) para la morbilidad. El AUC en la GAS fue 0,839 (IC 95%: 0,684-0,993; p=0,108) para la mortalidad y 0,917 (IC 95%: 0,835-0,999; p=0,001) para la morbilidad. Es decir, la EE-G presentó una exactitud razonable para la mortalidad y buena para la morbilidad, y la GAS presentó una exactitud buena para la mortalidad y excelente para la morbilidad.
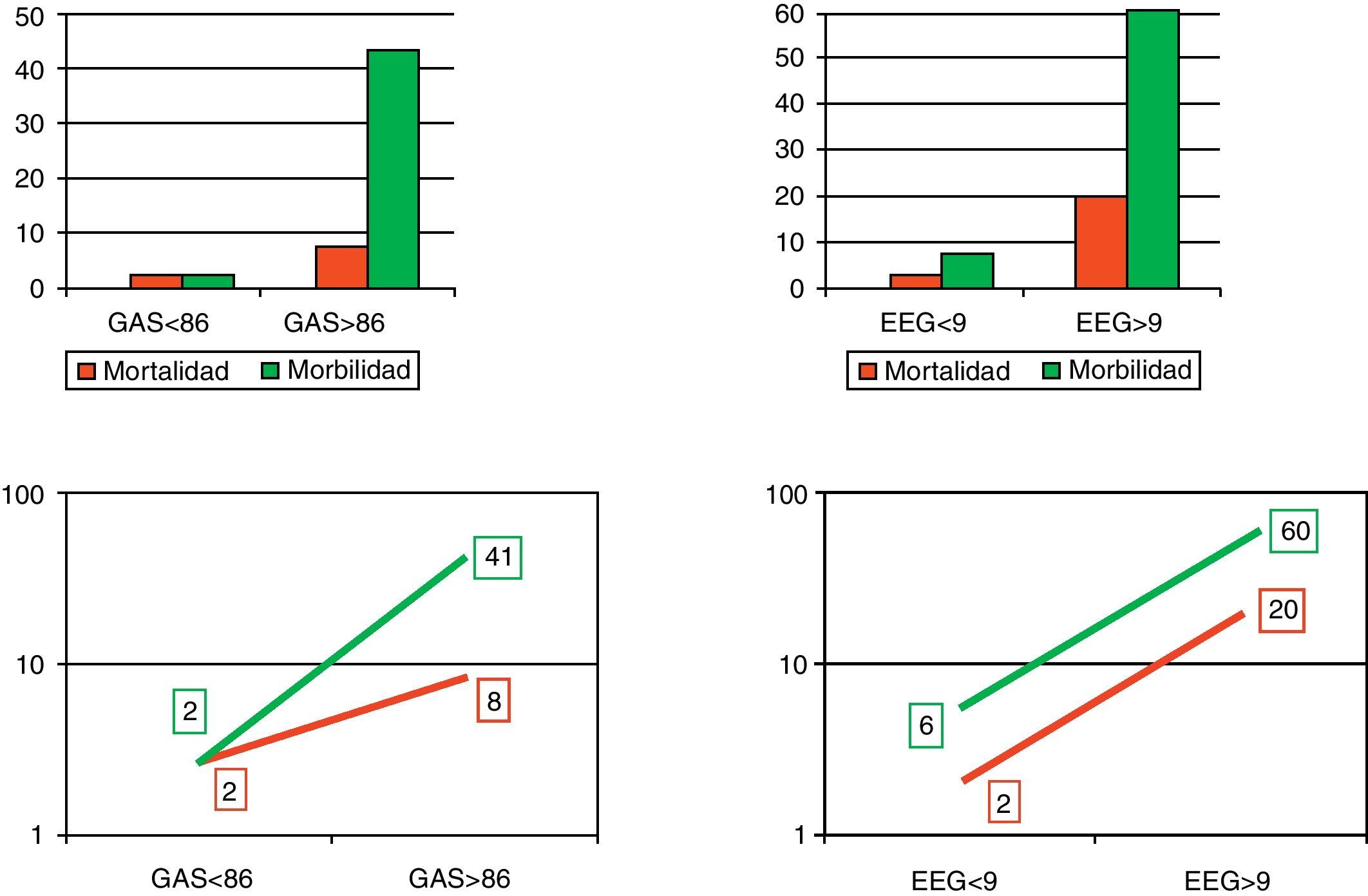
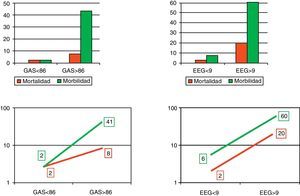
Cuando se utilizaron los puntos de corte descritos (fig. 3), con la EE-G la mortalidad subió del 2% en aquellos pacientes con menos de 9 puntos al 20% en aquellos con 9 puntos o más (OR: 11; IC 95%: 0,57-211,16; p=0,543). Con la GAS la mortalidad subió del 2% en aquellos pacientes con menos de 86 puntos al 8% en aquellos con 86 puntos o más (OR: 3,36; IC 95%: 0,19-58,28; p=0,3796). La morbilidad también subió, del 6% en los pacientes con menos de 9 puntos al 60% en los de 9 puntos o más con la EE-G (OR: 21; IC 95%: 2,47-178,22; p=0,005), y del 2% en los pacientes con menos de 86 puntos al 41% en los de 86 puntos o más con la GAS (OR: 26,42; IC 95%: 2,66-266,02; p=0,0003).
DiscusiónEl estudio EVAR-29,15 supuso una llamada de atención para el uso indiscriminado de la terapia endovascular, sobre todo en los pacientes considerados de alto riesgo, debido a la elevada mortalidad hallada en este estudio, del 7,3% a 30 días, llegando a recomendar realizar una mejora clínica de estos pacientes antes que un EVAR temprano ante la ausencia de beneficio del mismo. Sin embargo, sobre este estudio se han vertido algunas críticas, como que no queda claro qué pacientes se consideran de alto riesgo, o que el 45% de las muertes del grupo endovascular fueron preoperatorias. Además, el grupo no tratado presentó una tasa de ruptura anual de tan solo el 9%. Otros estudios han mostrado que el EVAR se puede realizar con relativa seguridad en pacientes de alto riesgo16,17. Sicard et al.18 muestran una mortalidad a 30 días del 2,9%, y en el estudio EUROSTAR19 la mortalidad en el grupo de alto riesgo fue del 5%. Estas cifras están en consonancia con las halladas en nuestra serie, con una mortalidad del 4%. En los pacientes considerados de bajo riesgo también existe una mortalidad asociada al procedimiento. Por ejemplo, en el estudio EVAR-1 la mortalidad a 30 días fue del 1,8%, en el estudio DREAM del 1,2% y en el grupo de bajo riesgo del EUROSTAR del 2%6,7,19,20. Esto hace que se pueda perder la teórica ventaja de disminuir la mortalidad por ser un procedimiento mínimamente invasivo, y que haya un grupo de pacientes que no se beneficie del mismo. Pero identificar este grupo resulta difícil, ya que la mayoría de estos estudios para considerar a los pacientes de alto riesgo incluyen muchas veces criterios subjetivos.
Las escalas de riesgo intentan identificar a ese grupo de pacientes de alto riesgo. En general se desarrollaron inicialmente para el tratamiento quirúrgico, y algunas se han intentado aplicar a la terapia endovascular1,9,21,22. Hay escalas como la propuesta por la Sociedad Americana de Cirugía Vascular23, que incluyen factores de riesgo anatómico, aunque, dada su complejidad, los mismos autores recomiendan su uso para realizar estudios sobre EVAR, de cara a homogeneizar resultados, y que en caso de querer estudiar morbimortalidad se deberían utilizar mejor escalas con factores clínicos solamente. De ellas, la GAS es una de las que mejores resultados ha producido en distintos estudios, siendo probablemente la más útil en pacientes quirúrgicos, con un AUC de >0,8 en algunas series24. Además, es fácilmente aplicable y se realiza solamente con parámetros preoperatorios. En el campo endovascular también ha demostrado su utilidad. En el estudio DREAM14, por ejemplo, mostró un AUC de 0,87 para la mortalidad, mejor resultado que para el grupo quirúrgico, y en el EUROSTAR13 mostró un AUC de 0,7, también mejor que en cirugía. Sin embargo, en otras series mostró peores resultados, aunque en ellas sigue siendo probablemente la mejor de las escalas, recomendándose su uso en la toma de decisiones. En nuestra serie el resultado fue de un AUC de 0,837, siendo la mejor de las dos escalas en este sentido. También fue mejor en cuanto a la morbilidad, con un resultado mejor que para la mortalidad (AUC: 0,917), aunque otros estudios indican que en general es mejor para predecir mortalidad que morbilidad10. Una de las críticas que se hacen sobre la GAS es su escaso valor predictivo positivo, que hace que discrimine mejor a los pacientes de bajo que a los de alto riesgo; sin embargo, aquel va a depender también de la prevalencia de las comorbilidades. Además, si se utiliza un punto de corte alto probablemente se identifiquen mejor los casos en los que sería recomendable no hacer nada, es decir, los más extremos14.
La otra escala utilizada es la publicada recientemente por Egorova y Giacovelli11, tras el análisis de 67.000 pacientes de los servicios de Medicare y Medicaid. Los resultados obtenidos en nuestra serie, aunque inferiores a los de la GAS, también fueron buenos, y de nuevo mejores para la morbilidad que para la mortalidad. Según sus autoras, con una puntuación por encima de 9, el riesgo de mortalidad asciende a más del 5%. En nuestra serie, en el grupo por encima de ese punto de corte, la mortalidad ascendía al 20% y la morbilidad al 60%, lo que indica que puede ser útil para identificar a ese grupo de pacientes con mayor riesgo. Una posible explicación para los peores resultados de esta escala frente a la GAS puede ser que no considera la cardiopatía isquémica como factor de riesgo, enfermedad con alta prevalencia en nuestra serie, además de ser una de las principales complicaciones postoperatorias tras EVAR en otros trabajos23,25.
En cuanto a las limitaciones de este trabajo está en primer lugar el bajo número de pacientes, que hace que no se puedan sacar conclusiones definitivas del mismo. Sin embargo, otros trabajos similares con mayor número de pacientes encuentran resultados parecidos para la GAS22, y en cuanto a la EE-G durante su desarrollo se realizó una validación de la misma sobre más de 22.000 pacientes.
Otra de las limitaciones es que no se utilizan factores de riesgo anatómico, aunque hay que destacar que, en general, los pacientes a los que se realiza EVAR son seleccionados previamente si son anatómicamente favorables, práctica realizada también en nuestra serie.
ConclusionesEl tratamiento endovascular en el sector aórtico posee un riesgo nada despreciable de mortalidad y morbilidad. Identificar al grupo de pacientes que no se beneficia de dicho tratamiento es muy importante de cara a mejorar los resultados. Tanto la GAS como la EE-G pueden ser de utilidad en la toma de decisiones sobre estos pacientes en nuestra práctica habitual.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
La información contenida en este manuscrito ha sido presentada como comunicación oral en el 56 Congreso Nacional de la Sociedad Española de Angiología y Cirugía Vascular, celebrado en Madrid del 10 al 12 de junio de 2010.