Registrar la incidencia de reestenosis tras endarterectomía carotídea (EDAc), observar su evolución natural e identificar los factores de riesgo para su desarrollo.
Material y métodosEstudio retrospectivo de una cohorte prospectiva de EDAc realizadas en 2006-2011. Registramos: datos clínicos, detalles quirúrgicos, desarrollo de reestenosis moderada (REM) (50-69%), reestenosis severa (RES) (≥70%) y oclusión. El seguimiento se realizó con ecodoppler carotídea en los 6, 12, 18 y 24 meses tras la intervención, y después anualmente en caso de REM/RES. Todas las RES se confirmaron con angio-RNM. Ninguna reestenosis se reintervino de forma abierta ni endovascular. Realizamos un análisis descriptivo y utilizamos chi-cuadrado/test de Fisher para la definición de factores de riesgo de RES.
ResultadosIncluimos 186 carótidas, 77 (41,4%) sintomáticas, y se utilizó parche (dacron) en 19 (10,2%) casos. El primer año detectamos 20 (10,8%) REM de las cuales 9 (45%) remitieron (a <50%) y una (5%) progresó a RES el 2.° año. Se observaron 12 (6,5%) RES el 1.er año, 4 (33,3%) remitieron (a 50-69%) durante el 2.° año y 3 (25%) más durante el 3.er año. Ninguna RES se ocluyó ni fue sintomática. Se ocluyeron 2 carótidas el primer año (una fue sintomática) y una el segundo año, sin reestenosis ≥50% previa. El uso de puntos de Kunlin aumentó el riesgo de desarrollar RES (OR 3,61; IC=95%: 1,13-11,57; p=0,023).
ConclusionesLa RES tras EDAc mayoritariamente con cierre directo es poco frecuente. La evolución natural de las RES durante el seguimiento es benigna. Los puntos de Kunlin se asocian con el desarrollo de RES.
To determine the incidence of restenosis after carotid endarterectomy (CEA), as well as to observe its natural history and identify the risk factors for its development.
Material and methodsRetrospective study of a prospective cohort of CEA performed in 2006-2011. The variables recorded were: clinical data, surgical details, incidence of moderate restenosis (MRE) (50-69%), severe restenosis (SRE) (≥70%), and occlusion. The patients were followed-up with carotid duplex-scan 6, 12, 18 and 24 months after the procedure, and annually thereafter if MRE/SRE was found. All SRE were confirmed with MRI. No restenosis was surgically or endovascularly repaired. A descriptive analysis was performed, and Chi-squared/Fisher's exact test was used for the definition of SRE risk factors.
ResultsA total of 186 patients with carotid endarterectomy were included, 77 (41.4%) performed in symptomatic patients, and a patch (dacron) used in 19 (10.2%) cases. During the first year of follow-up 20 (10.8%) MRE were found, with 9 of them (45%) regressed (to <50%) and one (5%) progressed to SRE during the second year. SRE was observed in 12 (6.5%) patients during the first year of follow-up, and 4 (33.3%) regressed (to 50-69%) during the second year, and 3 (25%) more during the third year. No SRE were occluded or became symptomatic. Two carotid arteries became occluded during the first year (one caused a stroke), and one more during the second year, without previous ≥50% restenosis. The use of Kunlin stitches increased the risk of developing SRE (OR 3,61; 95%CI: 1.13-11.57; P=.023).
ConclusionsSRE after CEA, mostly with direct suture, is infrequent. The natural history of SRE during follow-up is benign. Kunlin stitches are associated to the development of SRE.
La estenosis carotídea y su reparación quirúrgica mediante endarterectomía ha sido extensamente estudiada, quedando demostrada su superioridad respecto al tratamiento médico óptimo en pacientes seleccionados1,2. Se han publicado incidencias de reestenosis tras endarterectomía carotídea (EDAc) de 4 al 16%3. Existen 2 fenómenos etiológicos que explican la naturaleza de las reestenosis: la hiperplasia miointimal es la principal causa de la reestenosis en los 2 primeros años tras el procedimiento quirúrgico, atribuyendo a la progresión de la enfermedad arterioesclerótica las recurrencias tardías4. Los pacientes intervenidos por estenosis carotídea mantienen un cierto riesgo de eventos cerebrovasculares tanto ipsi- como contralaterales a lo largo de su seguimiento. Sin embargo, el riesgo clínico que implica el desarrollo de reestenosis carotídea no está claro, ya que, a diferencia de la reestenosis por progresión de la enfermedad, la hiperplasia intimal no presenta trombo ni superficies lipídicas friables que contribuyan a fenómenos embólicos5. Esta incertidumbre se traduce en una ausencia clara de pautas para su manejo terapéutico.
El objetivo de este estudio es definir la incidencia y evolución de reestenosis tras EDAc en los primeros 3 años de seguimiento en nuestro centro y estudiar los posibles factores que influyen tanto en su desarrollo como en su progresión.
Material y métodosRealizamos un estudio retrospectivo, basado en una cohorte prospectiva de EDAc realizadas en nuestro centro entre los años 2006 y 2011. Se excluyó a los pacientes que presentaron una mortalidad precoz (≤30 días), a aquellos que fallecieron previamente al 1.er control (30 días-6 meses), a los que presentaron una oclusión carotídea precoz (≤30días), las EDAc fallidas, las endarterectomías de la arteria carótida común y las revascularizaciones mediante bypass carótido-carotídeo o subclavio-carotídeo.
Registramos:
- -
Los datos demográficos: sexo y edad.
- -
Los factores de riesgo cardiovascular clásicos que presentaban los pacientes en el momento de la cirugía: considerando hipertensión arterial (HTA) si los pacientes presentaban tensión arterial basal >140/90mmHg en 2 mediciones basales, o si recibían tratamiento dietético o farmacológico; diabetes mellitus (DM) si los pacientes presentaban una glucemia basal ≥126mg/dL, o una HbA1c ≥ 6,7%, o si recibían tratamiento (dietético, antidiabéticos orales o insulina); y dislipidemia (DLP) si los pacientes presentaban unas cifras de colesterol total ≥ 200mg/dL o LDL-CL ≥ 100mg/dL, o HDL-CL ≥ 45mg/dL o triglicéridos ≥ 200mg/dL, o si recibían tratamiento dietético o farmacológico específico. También documentamos el hábito tabáquico activo o previo de los pacientes.
- -
La comorbilidad asociada: cardiopatía isquémica definida como antecedentes de angor, infarto agudo de miocardio o revascularización coronaria (percutánea o abierta); enfermedad pulmonar obstructiva crónica cuando el paciente había sido diagnosticado por un neumólogo y recibía tratamiento específico o seguía controles periódicos en sus consultas; e insuficiencia renal crónica (IRC) cuando se objetivó en la analítica basal una creatinina sérica >1,3mg/dL.
- -
La enfermedad vascular asociada (enfermedad oclusiva de extremidades inferiores o superiores, aneurisma de aorta o periférico, enfermedad vascular visceral) habiendo sido diagnosticado por un cirujano vascular, con tratamiento específico, médico, endovascular o quirúrgico, o controles periódicos en consultas.
- -
El tratamiento farmacológico que recibían los pacientes en el momento de la intervención, incluyendo antiagregación, inhibidores de la enzima convertidora de angiotensina/antagonistas del receptor de la angiotensina II (IECA/ARA II) y estatinas.
En cuanto a la enfermedad cerebrovascular, recogimos datos sobre la sintomatología que motivó la EDAc, definida como amaurosis fugax, accidente isquémico transitorio o ictus, o la ausencia de la misma.
Se registraron detalles quirúrgicos de la EDAc, como el tipo de anestesia utilizada (locorregional o general), la tolerancia al pinzamiento y la necesidad de shunt, el cierre directo o con parche de dacron, el tiempo de pinzamiento y el uso de puntos de Kunlin.
Las intervenciones se realizaron mediante endarterectomía convencional con heparinización sistémica (heparina sódica 1mg/kg iv), revertida con protamina al finalizar el procedimiento. En los casos intervenidos bajo anestesia locorregional se realizó un pinzamiento de prueba durante 2 min, con utilización de shunt selectivo en los casos de intolerancia clínica al pinzamiento. En todas las endarterectomías realizadas bajo anestesia general se utilizó shunt. El cierre de la arteriotomía se realizó mediante parche de dacron en los casos en los que el diámetro de la arteria carótida interna distal a la lesión medía menos de 4mm. Se utilizaron puntos de Kunlin para fijar la íntima distal a criterio del cirujano. Todos los pacientes fueron monitorizados durante las primeras 24 h en la Unidad de Cuidados Intensivos de nuestro hospital y recibieron tratamiento antiagregante en el postoperatorio (ácido acetilsalicílico las primeras 24h y después clopidogrel de forma indefinida), así como estatinas (atorvastatina 10-20mg/día).
El protocolo de seguimiento de los pacientes incluía revisión clínica y ecodoppler carotídea semestral durante 2 años. En caso de la detección de reestenosis ≥50% en este tiempo, continuábamos con controles clínicos y ecográficos anuales de forma indefinida o hasta la resolución de la reestenosis. Mantuvimos en todos los casos el tratamiento antiagregante y las estatinas. Planteamos el tratamiento quirúrgico o endovascular de una reestenosis carotídea en caso de que condicionara síntomas neurológicos o progresara a reestenosis crítica.
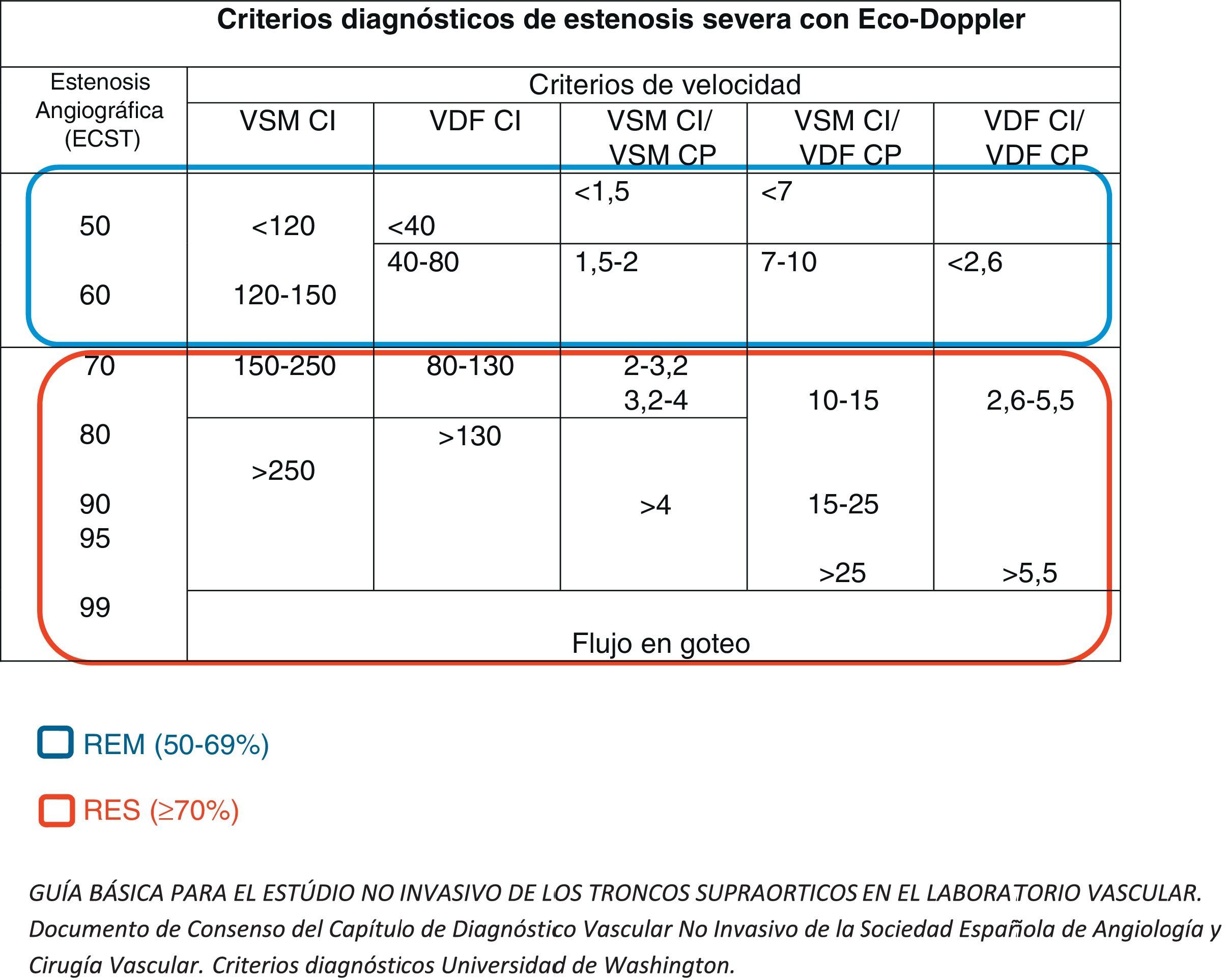
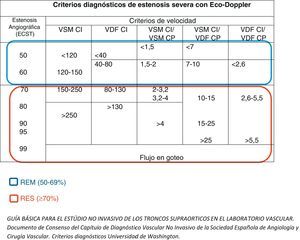
Se registraron las velocidades pico-sistólicas (VPS) y telediastólicas (VTD) en las arterias carótidas común, interna (ACI) y externa (ACE). Definimos como reestenosis moderada (REM) la reestenosis del 50-69% y reestenosis severa (RES) la reestenosis ≥70%, según los criterios diagnósticos de la Universidad de Washington (fig. 1). Todas las reestenosis, tanto moderadas como severas, se confirmaron mediante angiorresonancia magnética. Los ecodoppler de nuestra laboratorio están validados internamente, y fueron realizados por los cirujanos vasculares adjuntos al servicio.
También recogimos los eventos cerebrovasculares durante el seguimiento, tanto precoces (primeros 30 días tras la intervención) como tardíos (>30 días). Se definió como sintomática cualquier reestenosis responsable de causar accidentes cerebrovasculares, incluyendo los transitorios.
Realizamos un análisis descriptivo de los datos, expresando las variables cualitativas como n (%) y las cuantitativas como media (desviación estándar[DE]) y rango. Utilizamos los test de chi-cuadrado y Fisher para el análisis de los posibles factores de riesgo de desarrollo de RES, considerando significativo un valor p<0,05.
ResultadosSe realizaron 192 EDAc entre enero de 2006 y diciembre de 2011 en nuestro centro. Se excluyó a 4 pacientes (2 de ellos por oclusión precoz, uno por muerte precoz, y otro por fallecimiento previo al primer control), y se perdieron 2 casos en el seguimiento inmediato. El 87% (n = 162) de los pacientes eran hombres y el 13% (n=24) mujeres, con una media de edad de 70,4 (DE 9,1; 44-85).
La incidencia de tabaquismo activo era de 28,5% (n=53), el 47,3% había fumado previamente (n=88) y el 24,2% (n=45) no había fumado nunca. El 80,1% (n=149) padecía (HTA, el 38,2% (n=71) DM y el 74,7% (n=139) DLP. La incidencia de cardiopatía isquémica fue del 25,8% (n=48), el 4,8% (n=9) padecía IRC, y el 12,9% (n=24) enfermedad pulmonar obstructiva cónica. El 40,9% (n=76) de los pacientes padecía isquemia crónica de extremidades inferiores con antecedentes de cirugía vascular previa en el 23,1% (n=43). Respecto al tratamiento farmacológico, el 72,6% de los pacientes (n=135) tomaba estatinas y el 38,2% (n=71) fármacos del grupo IECA/ARA II, previamente a la intervención.
El 41,4% (n=77) de las estenosis carotídeas que motivaron la cirugía fueron sintomáticas: presentaron amaurosis fugaz el 9,1% (n=7), accidente isquémico transitorio el 31,2% (n=24) e ictus el 59,7% (n=46).
El 97,8% (n=182) de las intervenciones se realizaron con anestesia locorregional y el 2,2% (n=4) con anestesia general. En el 6,5% (n=12) de los casos fue precisa la utilización de shunt debido a la intolerancia al pinzamiento o el uso de anestesia general. Se utilizaron puntos de Kunlin en el 32,8% (n=61) y se realizó cierre con parche de dacron en el 10,2% (n=19), realizándose sutura directa en el resto de casos.
La incidencia de ictus-muerte perioperatoria fue del 1,6% (n=3), incluyendo los 4 pacientes excluidos. Dos pacientes presentaron ictus isquémico, uno de los cuales falleció, y el tercero presentó una transformación hemorrágica de un ictus previo.
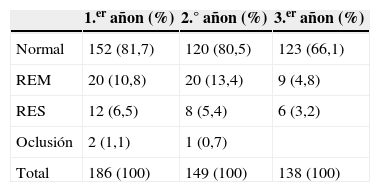
La tabla 1 resume los hallazgos ecográficos durante los 3 primeros años de seguimiento en los pacientes incluidos en el estudio.
Registramos una incidencia de RES del 6,5% (n=12) el primer año y del 5,4% (n=8) el segundo año. De los 12 casos de RES detectados el primer año, 4 (33,3%) regresaron a REM el segundo año y 3 casos más (25%) el tercer año. La incidencia de REM fue del 10,8% (n = 20) el primer año y del 13,4% (n=20) el segundo. De los 20 casos detectados el primer año, 9 (45%) presentaron un control normal el segundo año, y 2 casos (10%) más el tercer año. Un caso (5%) de REM progresó a RES el segundo año y un caso (5%) más el tercer año. Se ocluyeron 2 carótidas internas (1,1%) durante el primer año de seguimiento, provocando, una de ellas, un ictus (excluyendo las 2 oclusiones precoces previamente descritas). Otro caso (0,7%) se ocluyó durante el segundo año de seguimiento sin causar sintomatología alguna. Ninguna de las oclusiones había presentado reestenosis ≥50% previamente. Por otro lado, ninguna REM ni RES se ocluyó durante el seguimiento y ninguna de las REM ni RES fue sintomática. Ninguna reestenosis se reintervino mediante cirugía abierta o endovascular.
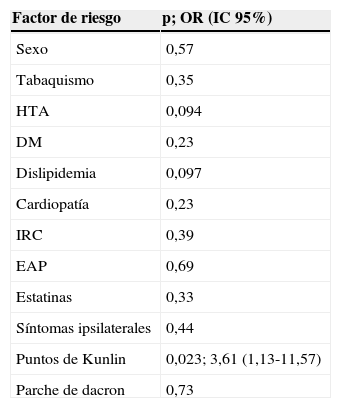
En el estudio de los factores de riesgo para el desarrollo de RES se encontró que el uso de puntos de Kunlin aumentaba de forma significativa el riesgo de desarrollar RES durante los primeros años de seguimiento, con un OR de 3,61 (IC 95%: 1,13-11,57; p=0,023). No se encontró asociación estadísticamente significativa para ningún otro de los factores estudiados (tabla 2).
DiscusiónSe estima que el riesgo de reestenosis es en torno al 10% en el primer año tras la EDAc, en torno al 3% en el segundo año y del 2% el tercer año6. Nuestros resultados concuerdan con estas estimaciones. Esto es especialmente relevante dado el escaso uso que hemos hecho del parche en el cierre de las arteriotomías carotídeas. La mayor parte de las publicaciones de los últimos años muestran un porcentaje de utilización superior al nuestro7. Las principales ventajas descritas del uso rutinario del parche son el menor riesgo de oclusión precoz y el menor riesgo de reestenosis a largo plazo, aunque esto no siempre se puede traducir en un menor riesgo de ictus, dado que no todas las oclusiones producen ictus y que el riesgo de ictus secundario a reestenosis por hiperplasia es bajo7,8. Los partidarios del uso selectivo del parche, por el contrario, destacan el menor tiempo quirúrgico y de pinzamiento que supone el cierre directo de la arteriotomía8. En nuestra serie no hemos observado una tasa de ictus-muerte ni de reestenosis mayor que en otras series publicadas que nos incline a modificar nuestra política de uso selectivo del parche. Tampoco ha surgido el uso de parche como factor protector para el desarrollo de RES en nuestro análisis.
En nuestra serie la utilización de puntos de Kunlin es el único factor que se ha asociado con un mayor riesgo de desarrollar RES. Esto se puede relacionar con la presencia de placas extensas, mal plano distal al finalizar la endarterectomía o estría grasa que progresa distalmente, que hagan necesaria su fijación y que sirvan de lecho para el desarrollo de hiperplasia local. En muchas series se describe una reestenosis precoz o estenosis residual que se asocia con un mayor riesgo de progresión hacia la RES. El seguimiento ecográfico puede identificar imágenes compatibles con placa residual o hiperplasia intimal. La primera suele mostrarse como una lesión heterogénea e irregular, mientras que la segunda muestra una imagen lisa, homogénea y ecolucente13. También se han identificado el sexo femenino y la DM como factores de riesgo independientes para el desarrollo de RES9. Otros factores de riesgo que han sido estudiados, como el tabaquismo, la hipercolesterolemia, HTA o la edad, obtienen resultados heterogéneos12. La hiperhomocisteinemia ha sido descartada como factor predisponente de reestenosis en varios estudios10,11.
Ninguna de las reestenosis, moderadas o severas, de nuestra serie presentó sintomatología alguna ni derivó en la oclusión carotídea durante el tiempo estudiado. Al contrario, un número relevante de REM y RES remitieron a grados menores de reestenosis en 1-2 años. Ninguna de las 3 oclusiones carotídeas objetivadas en nuestra serie fue precedida por reestenosis en los controles previos. Otros estudios también sugieren que la evolución natural de las reestenosis asintomáticas es en general benigna, con un riesgo de ictus o progresión hacia la oclusión bajo, incluso ante reestenosis de alto grado. En un estudio reciente donde se comparaban el tratamiento endovascular y el tratamiento quirúrgico de la estenosis carotídea, Bonati et al. observaron, en el seguimiento a largo plazo, que el riesgo de eventos cerebrovasculares era similar en aquellos casos con una reestenosis >70% y en las reestenosis <70%4-6.
El manejo de las reestenosis carotídeas sintomáticas suele ser invasivo, con la reintervención abierta (nueva endarterectomía o bypass) o, más habitualmente, el implante de un stent. La indicación quirúrgica en los casos de reestenosis asintomática es más discutida5,14. Cabe destacar que el tratamiento quirúrgico de las reestenosis no está exento de riesgo14-16. Se estima que el riesgo de ictus-muerte en la reintevención abierta es del 3-7% y del 1-3% en la reparación endovascular5, por lo que existe cierto debate sobre limitar el tratamiento quirúrgico a las reestenosis sintomáticas3-5,9,17–19. En una revisión reciente, Bekelis et al. concluían que una mortalidad perioperatoria mayor del 0,6% rara vez podría justificar un tratamiento quirúrgico preventivo, dado el carácter benigno de la enfermedad, incluso mediante técnica endovascular5. En nuestra serie no se indicó ningún tratamiento invasivo, dada la benignidad de la evolución observada, con ausencia de síntomas asociados en los casos diagnosticados y la ausencia de progresión hacia lesiones preoclusivas.
ConclusionesLas reestenosis tras EDAc mayoritariamente con cierre directo son poco frecuentes y tienen un comportamiento benigno. Se suelen mantener asintomáticas y muchas reestenosis, tanto moderadas como severas, remiten a grados menores en 1-2 años. Por ello, el manejo conservador, con vigilancia clínica y ecográfica, parece seguro.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no existe conflicto de intereses.
Los autores desean agradecer a la Sociedad Española de Angiología y Cirugía Vascular (SEACV) y a los organizadores y tutores del curso «Cómo escribir un artículo científico» (Madrid, abril 2014) la ayuda recibida para la redacción de este artículo.