Analizar la trombosis de rama en el tratamiento de aneurisma de aorta abdominal (EVAR) en nuestra serie y su relación con factores de riesgo predisponentes.
Material y métodoSe incluyeron todos los EVAR programados entre enero de 2007 y enero de 2103. Mediante angio-TC y seguimiento analizamos los factores de riesgo preoperatorios (calcificación, tortuosidad y angulación), tipo de material implantado, sobredimensión y arteria ilíaca de sellado; la incidencia y manejo de la trombosis. También analizamos las angio-TC de cada una de las trombosis. Con las variables estudiadas se realizó un análisis comparativo de casos (trombosis) y controles (libre de trombosis).
ResultadosDe los 151 pacientes tratados mediante EVAR, con un seguimiento medio de 41,7 meses, 11 pacientes (7,2%) presentaron oclusión de rama ilíaca. No se observaron diferencias entre los grupos. En el análisis por ilíacas, en el que se incluyeron 294 ilíacas tratadas (8 aortomonoilíacos) con 15 casos (5,1%) de oclusión ilíaca, se observó la asociación de la trombosis de rama con el sellado en ilíaca externa (p=0,001) y con la sobredimensión superior al 20% (p=0,003).
ConclusiónEl sellado distal en ilíaca externa y la sobredimensión ≥ 20% en el tratamiento del EVAR son factores de riesgo independientes asociados con la trombosis de rama en nuestra serie.
To analyse the limb occlusion after endovascular aortic repair (EVAR) and its predisposing risk factors.
Materials and methodsThe study included all elective EVAR cases between January 2007 and January 2013. An assessment was made of predisposing risk factors using pre-surgical angioCT scan and follow-up. A pre-surgical analysis was performed on risk factors (calcification, tortuosity, and angulation), type of endograft implanted, oversizing, and the iliac artery landing zone used. A comparative analysis was performed of the cases (occlusion) and controls (occlusion free) to assess the variables.
ResultsThe study included a total of 151 treated patients with follow-up time of 41.7 months, and 11 patients (7.2%) presented with limb occlusion. No differences were observed in the comparison between the patient groups. Of the 294 iliac arteries included in the study (with 8 aorto-uni-iliac endografts), there were 15 (5.1%) cases of limb occlusion. The analysis revealed an association between limb occlusion and using the external iliac artery as a landing zone vessel (P=.001). There was a statistically significant relationship between oversizing ≥ 20% and limb occlusion (P=.003).
ConclusionUsing external iliac artery as a landing zone vessel and oversizing ≥ 20% during EVAR are independent risk factors for limb occlusion in our case series.
En la actualidad, la reparación endovascular del aneurisma de aorta abdominal (REVA o EVAR) constituye el procedimiento más empleado en esta dolencia1. Esta técnica presenta mejores resultados en términos de morbimortalidad a 30 días frente a la cirugía abierta, sin embargo, estas diferencias se equiparan a medio y largo plazo. La mayor tasa de reintervenciones en el seguimiento es el principal inconveniente de la opción endovascular2,3.
La trombosis de rama ilíaca representa la tercera causa de reintervención en el tratamiento endovascular, tras la reparación de endofugas y la migración del dispositivo4. La frecuencia de esta complicación se sitúa entre el 0,4 y el 7,4%5,6, usualmente requiere repermeabilización7 y presenta una mortalidad asociada del 0,6-3%8,9.
Existen características anatómicas del sector aortoilíaco y otras, asociadas a la intervención, que pueden comportarse como factores de riesgo de trombosis: la calcificación, la angulación, la tortuosidad y el diámetro; la sobredimensión, la angulación entre stents del cuerpo metálico de la endoprótesis (kinking) y el sellado en ilíaca externa (IE)10.
El objetivo del estudio es analizar la trombosis de rama en el tratamiento de aneurisma de aorta abdominal (EVAR) y su relación con factores de riesgo predisponentes.
Material y métodosSe incluyeron de forma consecutiva todos los pacientes con aneurisma de aorta abdominal tratados de forma programada y endovascular entre enero de 2007 y enero de 2013, mediante endoprótesis infrarrenales con sellado distal en el sector ilíaco.
Todos los pacientes fueron tratados en un mismo centro terciario, por un equipo formado exclusivamente por cirujanos vasculares, tras presentar los casos en sesión clínica y decidir el tipo de tratamiento (la decisión final de la marca de la endoprótesis depende de un solo cirujano vascular). Para la realización del trabajo se obtuvo la aprobación del Comité Ético del mismo centro hospitalario.
Criterios de inclusión-exclusiónInclusión- -
Aneurismas aortoilíacos con diámetro aórtico mayor a 5,5cm o con ilíacas comunes mayores a 3cm.
- -
Tratamiento endovascular programado mediante endoprótesis infrarrenal.
- -
Angio-TC preoperatoria y al menos otra angio-TC de control a los 12 meses.
- -
Seguimiento clínico de al menos 12 meses.
- -
Criterios del tratamiento endovascular: el sellado proximal, respetando las instrucciones de uso en función de la endoprótesis empleada. En el sellado distal, en la ilíaca común (IC) mayor de 16mm, el sellado se prolonga hasta la IE y si es de 16 cm o menor, la fijación se realiza en la propia IC, respetando la experiencia propia publicada11–13.
- -
Tratamientos de aneurisma roto.
- -
Pérdida de seguimiento clínico o radiológico. Los pacientes fallecidos en el primer año se excluyeron del estudio comparativo, no así de las variables de mortalidad.
- -
Falta de tomografía preoperatoria.
Todas los archivos DICOM obtenidos de las angio-TC preoperatorias fueron procesados para su estudio en una estación de trabajo tipo OsiriX™ (OsiriX MD/64-bit version). Mediante este sistema informático analizamos las características arteriales como se consensuaron en el trabajo de Chaikof et al.14, y las adaptamos para un análisis binario, clasificándolas en 2grupos cada una.
- -
Calcificación del sector ilíaco mediante la distribución del calcio alrededor de la pared arterial, y clasificándola en la afectación<o ≥ 50% de la circunferencia.
- -
Tortuosidad ilíaca mediante el índice de tortuosidad (τ): cociente entre la distancia desde la bifurcación aórtica hasta el final de la IE con la arteria «estirada» L1 (mediante la realización de una línea central) y sin estirarla L2. Este índice L1/L2 lo agrupamos en<o ≥ 1,5.
- -
Angulación máxima: desde la propia estación de trabajo con la herramienta ortogonal MPR se midieron 3 angulaciones. Se clasificó mediante el mayor ángulo de los 3 obtenidos, en ≤ o > 120°.
- -
Diámetro del sector ilíaco: mediante la línea central se midieron los diámetros máximos en las zonas de sellado de ambas ilíacas (en los 3 cm distales de IC y en los 3 cm proximales de IE).
- -
Características radiológicas del cuello infrarrenal del aneurisma: se analizaron el ángulo beta del cuello infrarrenal (formado por el propio cuello y el saco aneurismático) dividiéndolo en<o ≥ 45°, su calcificación en<o ≥ 50% de la circunferencia, al igual que el trombo mural en<o ≥ 50%. También analizamos el diámetro del cuello mediante la medición de la pared arterial de fuera a fuera (outer to outer) y su longitud.
Todos los procedimientos se realizaron en un quirófano, con una arco en C (Philips 8900), por cirujanos vasculares. Bajo anestesia general y mediante abordaje femoral quirúrgico. A todos los pacientes se les administró profilaxis antibiótica mediante 1g de cefazolina 30 min antes de la intervención y 3 dosis postoperatorias, una cada 8h. La dosis de heparina sódica intraoperatoria fue de 5.000 UI. Todos los dispositivos presentan sellado infrarrenal y, dependiendo de la endoprótesis, con fijación infrarrenal o suprarrenal, y el sellado distal según los criterios descritos previamente. A todos los pacientes se les pauta antiagregación antes de la intervención y posteriormente de forma indefinida. Los pacientes completaron el postoperatorio con un mínimo de 24 h en la Unidad de Cuidados Intensivos y después en sala de cirugía vascular hasta el alta hospitalaria.
SeguimientoSeguimiento clínico: a los 30 días postintervención, a los 6 meses y anualmente, mediante examen físico vascular y anamnesis sobre sintomatología isquémica tanto glútea como de miembros inferiores (enfermedad arterial periférica) o intestinal.
El seguimiento radiológico consistió en control mediante angio-TC: en las primeras 72 h postintervención, a los 6 y 12 meses y cada año. Y con la misma estación de trabajo, se analizaron posibles complicaciones como: endofugas, crecimiento de saco aneurismático, permeabilidad de las ramas ilíacas, imágenes de acodamiento entre stents que forman el esqueleto metálico endoprotésico o kinking, migraciones proximales o distales (desplazamiento de la endoprótesis en la zona de sellado > 10mm) y alteraciones del outflow (estenosis > 70% en el sector ilíaco distal al sellado o en la femoral común).
A todos los pacientes con sospecha de trombosis de rama se les realizó una angio-TC de forma urgente o preferente dependiendo de la sintomatología. Y se analizaron los cambios morfológicos y anatómicos con respecto a los estudios previos.
Variables analizadasFactores preoperatorios del paciente: edad, sexo, fumador, exfumador, diabetes mellitus, hipertensión, dislipidemia, cardiopatía isquémica, accidente cerebrovascular, enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica (filtrado glomerular estimado <60ml/min/1,73 m2).
Factores preoperatorios del aneurisma: diámetro máximo del aneurisma, características del cuello infrarrenal (diámetro, longitud, angulación, calcificación y trombo mural) y características del sector ilíaco (ilíaca de sellado, diámetro, angulación, tortuosidad y calcificación).
Factores de la endoprótesis: marca comercial y sobredimensión en el sellado distal.
Modelo de estudio y análisis estadísticoEstudio retrospectivo sobre una base de datos recopilada de forma prospectiva. Se realizó un estudio observacional de casos y controles: fueron los casos los de trombosis de rama y los controles el resto de la muestra.
El procesamiento de datos se realizó con el programa IBM SPSS Stadistics® (versión 20) y mediante análisis estadístico básico como el test de t de Student para la comparación de medias de muestras independientes, chi-cuadrado de Pearson o el test exacto de Fisher para el contraste de proporciones, según fuesen paramétricas o no y con tablas de contingencias para variables dicotómicas. También empleamos el método de Kaplan-Meier para la tasa de permeabilidad acumulada y la supervivencia.
ResultadosEntre enero de 2007 y enero de 2013, se realizaron 156 EVAR, de los cuales 10 fueron aortomonoilíacos y el resto bifurcados. Se excluyó del estudio comparativo a 5 pacientes por mortalidad en los primeros 12 meses postoperatorios (2 casos de aortomonoilíaco y 3 bifurcados). Las 151 endoprótesis incluidas fueron: Cook Zenith (n=68), Gore Excluder (n=64) y Medtronic Endurant (n=19).
Con un seguimiento medio de 41,7±22,5 meses, un total de 11 pacientes (7,2%) presentaron oclusión de rama ilíaca. De los cuales, con la Cook Zenith fue del 8,8% (6/68); con la Gore Excluder fue de 4,6% (4/64) y con la Medtronic Endurant del 10,5% (2/19); estas diferencias no fueron estadísticamente significativas.
En la tabla 1 se representan las diferencias de las variables estudiadas en el grupo de pacientes con trombosis de rama con respecto a las variables de los que mantienen sus ramas ilíacas permeables: no se observan diferencias en las variables demográficas, factores de riesgo cardiovascular ni en las características aórticas.
Se muestran las diferencias de las variables demográficas, cardiovasculares y aórticas entre los pacientes con trombosis de rama vs. permeables
| Trombosis | Permeables | |
|---|---|---|
| N EVAR (pacientes) | 11 | 140 |
| Zenith® | 6 | 62 |
| Excluder® | 3 | 61 |
| Endurant® | 2 | 17 |
| Variables dicotómicas | n (%) | n (%) | p |
|---|---|---|---|
| Exfumador | 7 (63,6) | 81 (57,9) | 0,57 |
| Fumador | 4 (36,4) | 33 (23,6) | 0,42 |
| DM | 3 (27,3) | 23 (16,4) | 0,32 |
| HTA | 9 (81,8) | 102 (72,8) | 0,52 |
| DL | 6 (54,5) | 59 (42,1) | 0,55 |
| Cardiopatía isquémica | 2 (18,2) | 39 (27,9) | 0,35 |
| Intervención cardiaca | 1 (9) | 19 (13,5) | 0,52 |
| ACV | 2 (18,2) | 12 (8,6) | 0,29 |
| EPOC | 2 (18,2) | 37 (26,4) | 0,39 |
| IRC | 1 (9) | 21 (15) | 0,48 |
| Trombo en el cuello ≥50% | 4 (36,4) | 40 (28,6) | 0,45 |
| Calcificación en el cuello ≥50% | 4 (36,4) | 35 (25) | 0,34 |
| Angulación del cuello ≥45° | 2 (18,2) | 44 (31,4) | 0,26 |
| Variables continuas | Media (DE) | Media (DE) | p |
|---|---|---|---|
| Edad | 75,5 (4,1) | 73,7 (6,3) | 0,21 |
| Diámetro AAA | 6,9 (1,6) | 6,5 (1,6) | 0,43 |
| Diámetro cuello | 23,5 (2,6) | 24,3 (3,3) | 0,31 |
| Longitud cuello | 30,2 (15,4) | 25,3 (10,1) | 0,33 |
AAA: aneurisma de aorta abdominal; ACV: accidente cerebrovascular; DE: desviación estándar; DL: dislipidemia; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial; IRC: insuficiencia renal crónica.
Se incluyeron las 294 ilíacas tratadas de los 151 pacientes (8 aortomonoilíacos); un total de 15 casos (5,1%) presentaron oclusión ilíaca.
En la tabla 2 se representan las diferentes variables del sector ilíaco (comparación de medias entre los casos de trombosis y los permeables): destaca el sellado en IE y la sobredimensión mayor al 20% como factores asociados a la trombosis de rama de forma estadísticamente significativa. A su vez, observamos una tendencia estadística con la angulación (<120°) y la tortuosidad (>1,5); sin embargo, no se encontraron diferencias con la calcificación del sector ilíaco (>50%).
Diferencia de medias de las características ilíacas entre los casos de trombosis frente a los permeables
| Casos | Controles | |
|---|---|---|
| N ilíacas | 15 | 279 |
| Variables ilíacas | n (%) | n (%) | p |
|---|---|---|---|
| Sellado de ilíaca externa | 12 (80) | 105 (37,6) | 0,001 |
| Tortuosidad ilíaca ≥ 1,5 | 10 (66,7) | 142 (50,9) | 0,17 |
| Angulación ilíaca máxima ≤ 120° | 9 (60) | 107 (38,4) | 0,08 |
| Calcificación ilíaca ≥ 50% | 8 (53,3) | 133 (47,7) | 0,43 |
| Sobredimensión del sellado distal ≥ 20% | 11 (73,3) | 99 (35,5) | 0,003 |
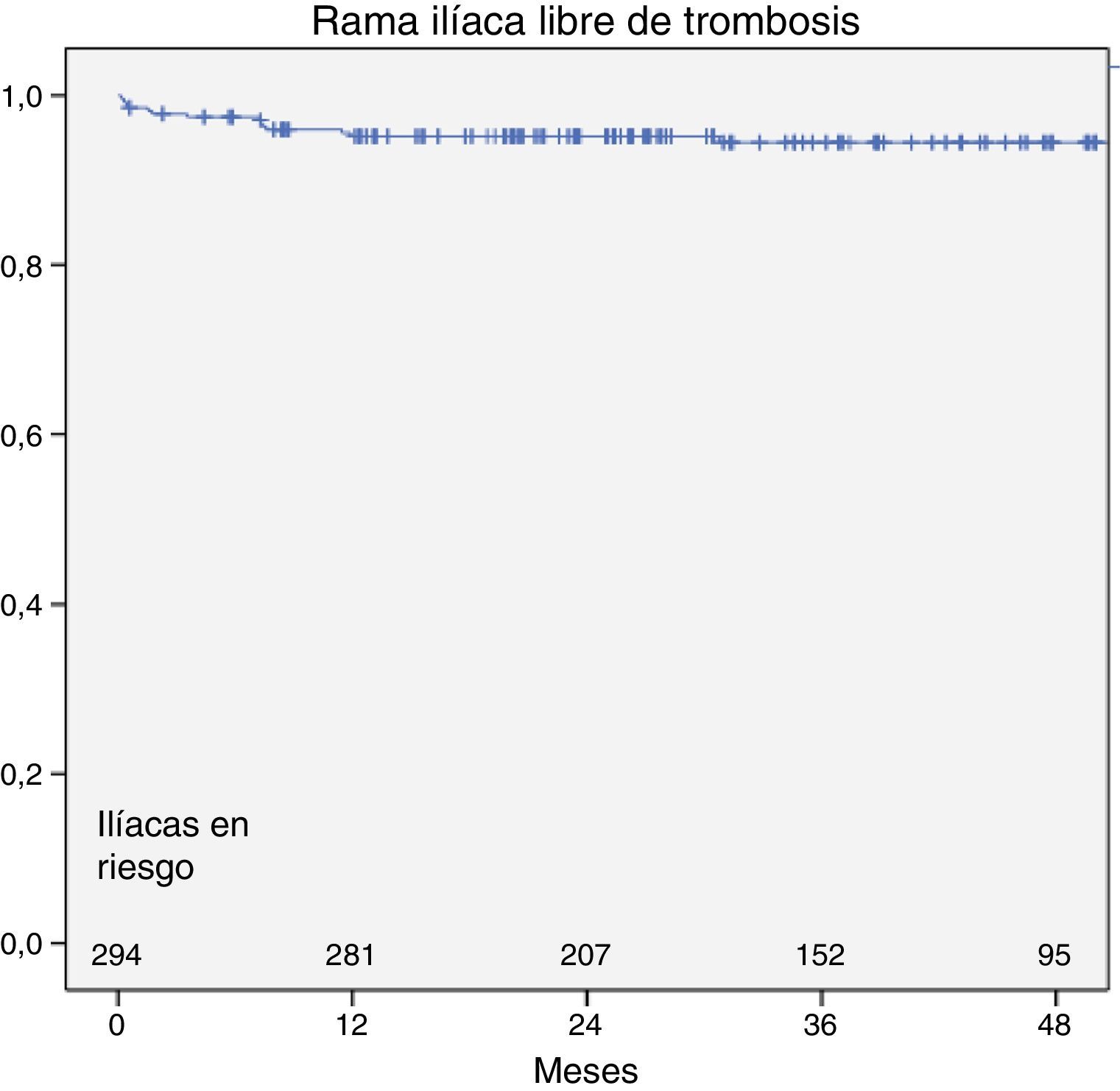
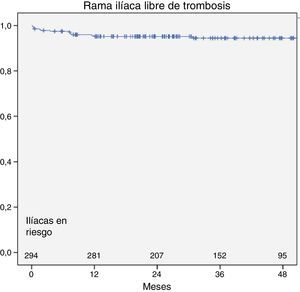
De los 11 pacientes con trombosis de rama, en 4ocurrió de forma bilateral, en diferentes episodios. De los 15 casos de trombosis, 4 (27%) ocurrieron en el primer mes y 13 (87%) durante el primer año. La permeabilidad ilíaca acumulada (o tasa de ausencia de trombosis) al mes, al año y a los 3 años fue del 98,6; 95,6 y del 95%, respectivamente (fig. 1).
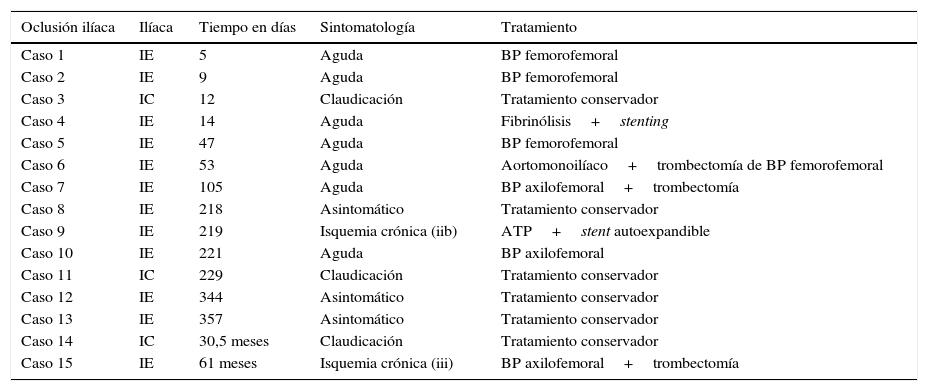
La oclusión de rama en 7 de los casos se presentó como isquemia aguda que precisó de tratamiento revascularizador urgente: 2fueron tratados de forma endovascular, uno mediante endoprótesis aortomonoilíaca más trombectomía del bypass femorofemoral previo (por trombosis contralateral previa) y otro con fibrinólisis más stent autoexpandible; 3 se trataron mediante bypass femorofemoral y 2, con bypass axilofemoral (uno asoció trombectomía de bypass femorofemoral previo por ser una endoprótesis aortomonoilíaca). Un caso se presentó como clínica de isquemia crónica grado III de La Fontaine y de forma programada se revascularizó mediante bypass axilofemoral. Y otro se presentó como clínica de claudicación a cortas distancias y se recanalizó de forma endovascular (ATP+stent autoexpandible ilíaco). Los 6 casos restantes se presentaron como clínica de claudicación a larga distancia o bien asintomáticos, y se trataron de forma conservadora (tabla 3).
Muestra las características de los 15 casos de trombosis y su tratamiento
| Oclusión ilíaca | Ilíaca | Tiempo en días | Sintomatología | Tratamiento |
|---|---|---|---|---|
| Caso 1 | IE | 5 | Aguda | BP femorofemoral |
| Caso 2 | IE | 9 | Aguda | BP femorofemoral |
| Caso 3 | IC | 12 | Claudicación | Tratamiento conservador |
| Caso 4 | IE | 14 | Aguda | Fibrinólisis+stenting |
| Caso 5 | IE | 47 | Aguda | BP femorofemoral |
| Caso 6 | IE | 53 | Aguda | Aortomonoilíaco+trombectomía de BP femorofemoral |
| Caso 7 | IE | 105 | Aguda | BP axilofemoral+trombectomía |
| Caso 8 | IE | 218 | Asintomático | Tratamiento conservador |
| Caso 9 | IE | 219 | Isquemia crónica (iib) | ATP+stent autoexpandible |
| Caso 10 | IE | 221 | Aguda | BP axilofemoral |
| Caso 11 | IC | 229 | Claudicación | Tratamiento conservador |
| Caso 12 | IE | 344 | Asintomático | Tratamiento conservador |
| Caso 13 | IE | 357 | Asintomático | Tratamiento conservador |
| Caso 14 | IC | 30,5 meses | Claudicación | Tratamiento conservador |
| Caso 15 | IE | 61 meses | Isquemia crónica (iii) | BP axilofemoral+trombectomía |
ATP: angioplastia transluminal percutánea; BP: bypass; IC: ilíaca común; IE: ilíaca externa; Isquemia crónica: clasificación de La Fontaine.
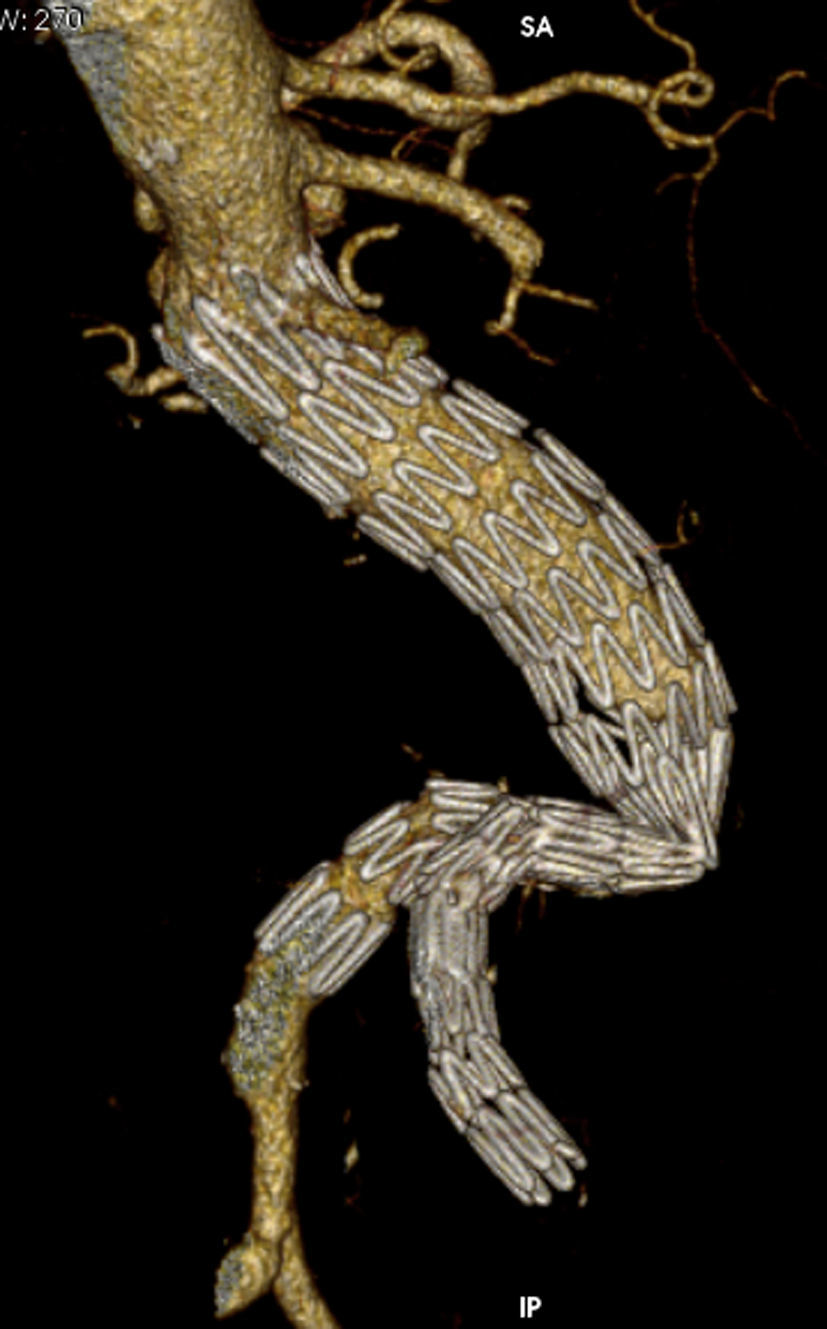
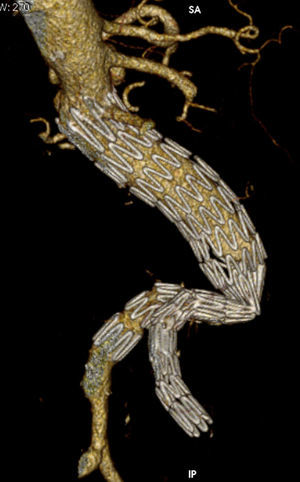
Todas las trombosis de rama fueron constatadas mediante angio-TC. En la revisión de las angio-TC de la oclusión con respecto a los estudios previos destacan cambios morfológicos: en 7 casos se observó acodamiento entre stents de la rama ilíaca o kinking, y uno de ellos como consecuencia de la remodelación del saco aneurismático (shrinkage) y migración craneal del sellado distal (fig. 2).
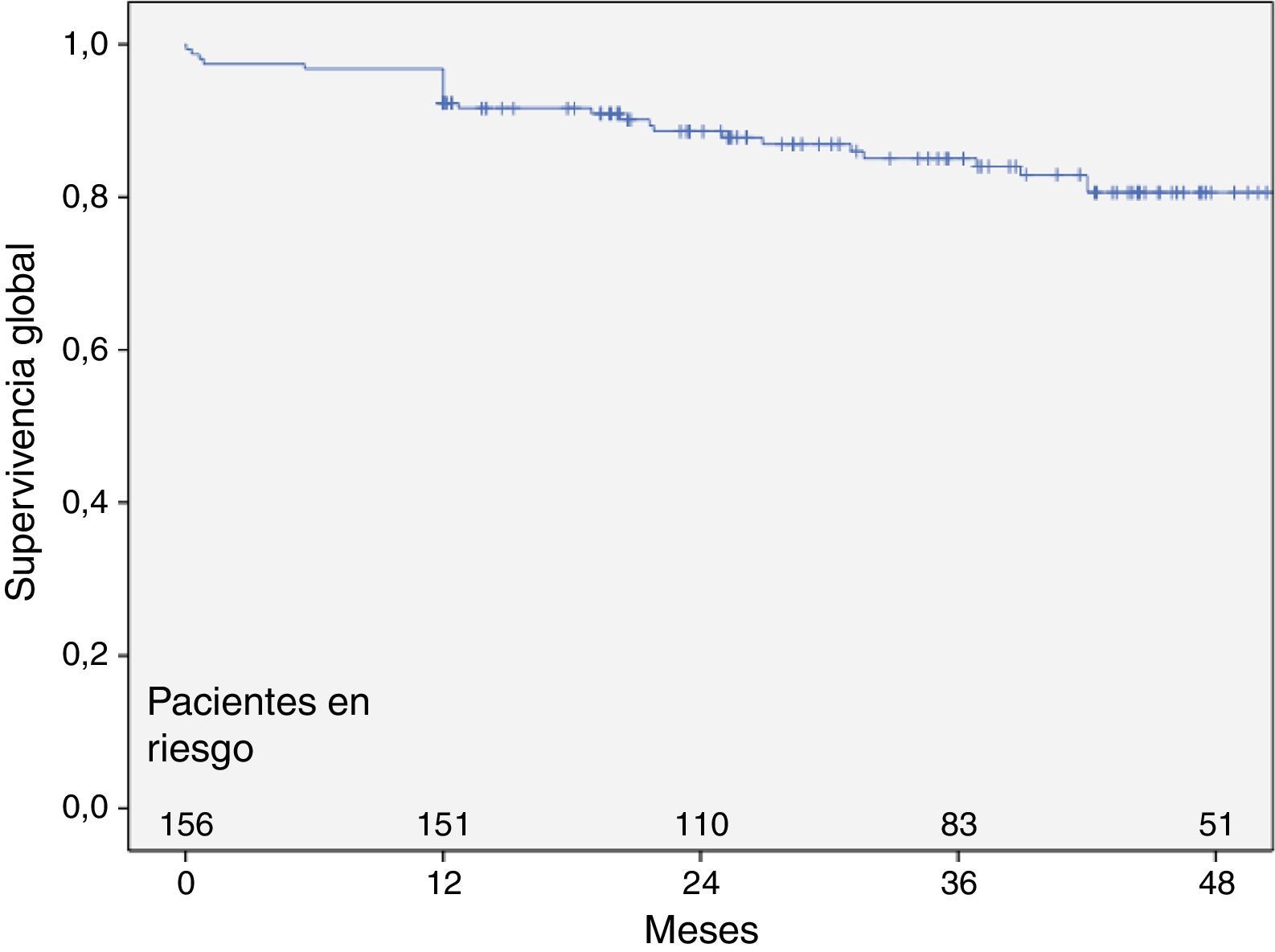
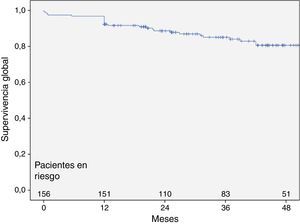
La supervivencia global de la muestra inicial de 156 pacientes, al mes, al año y a los 3 años fue del 97,4; 96,8 y del 84%, respectivamente (fig. 3). La mortalidad asociada al aneurisma fue de 3,8% (6 casos) de los cuales los 4 primeros ocurrieron el primer mes como consecuencia del propio procedimiento (mortalidad postoperatoria del 2,6%), el quinto y el sexto por infección de endoprótesis a los 5 y 14 meses, sin relacionarse en ninguno de los casos con la trombosis de rama.
DiscusiónLas causas y factores de riesgo implicados en la oclusión de rama ilíaca son múltiples y variados, y hasta un 40% de las trombosis son por causa indeterminada10.
Características preoperatorias como las demográficas, las comorbilidades y las características anatómicas del eje aortoilíaco representan un grupo de factores de riesgo no modificables para la trombosis de rama, que se pueden predecir y cuantificar14.
En estudios actuales, mediante estaciones de trabajo con procesamiento de archivos DICOM, se ha asociado la trombosis de rama con la calcificación, el trombo mural y angulación o tortuosidad ilíaca preoperatoria15,16. Sin embargo, en nuestra serie estas variables no se han relacionado con la trombosis de forma significativa. Otras variables como el índice de masa corporal, tamaño máximo del aneurisma aórtico<59mm o bifurcaciones aórticas estrechas también se han asociado con mayor riesgo de trombosis5,15,17–20. También se ha analizado la asociación de la oclusión de rama con la alteración del outflow preoperatorio10,15.
Factores intraoperatorios como la sobredimensión y la zona de sellado (IC vs. IE externa) se han asociado a la trombosis de rama, al igual que en nuestra serie6,20,21. La sobredimensión se relaciona con la falta de correcta aposición y arrugamiento de la endoprótesis con respecto a la pared arterial en el sellado distal (infolding)10,16; en el caso del sellado en IE se relaciona con el menor diámetro de la luz (algunos autores colocan el umbral de riesgo de trombosis a partir de 14mm y otros en 10mm), también se ha asociado con el empeoramiento del outflow al excluir la salida distal de la arteria hipogástrica18,20,22,23. Sin embargo, otros estudios como el de Mantas et al. (estudio comparativo entre casos con oclusión y casos controles) han sido críticos con la asociación de esta con el sellado en IE16. También se ha intentado relacionar el tipo de material endoprotésico con el aumento de riesgo, obteniendo resultados similares entre las endoprótesis actualmente comercializadas6,20,24. En nuestra serie, no existe tampoco diferencia estadística entre grupos, pero se observa una tendencia de menor riesgo en la Excluder frente a la Endurant (p: 0,29) y frente a la Zenith (p: 0,21).
En el implante del EVAR, las anatomías que no cumplen las instrucciones de uso en el sector ilíaco pueden tener más riesgo de trombosis de rama5. No obstante, hemos presentado estudios propios, en los que el 31% de los EVAR no respetaban todas las intrucciones de uso y no mostraron mayor tasa de trombosis por log rank (p: 0,8) frente al resto25.
Otros factores intraoperatorios relacionados descritos son la presencia de estenosis residuales o kinking entre los stents que forman el cuerpo metálico de la endoprótesis, que se pueden corregir mediante la colocación de stent adicional y reducen la incidencia de trombosis26,27. No obstante, no siempre es fácil observar una zona de acodamiento o estenosis, ya que la escopia muestra una imagen en 2 dimensiones, y para evitar pasarlo por alto existen opciones técnicas descritas como: la realización de series arteriográficas desde varias angulaciones, control ecográfico intravascular o intercambiar las guías rígidas en la serie final10,26,28. En nuestra serie no se reconocieron casos de acodamiento ni estenosis residual en la arteriografía final.
Otras variables que pueden aumentar el riesgo de la trombosis ocurren a posteriori, y se relacionan con el comportamiento de la prótesis y sus stents sobre la propia arteria nativa durante el seguimiento. Las migraciones distales o proximales, los cambios de tamaño del saco aórtico, tanto por crecimiento por endofugas como por efecto remodeling por reabsorción del saco, pueden provocar cambios en la conformación y derivar en el acodamiento y colapso de la pata ilíaca29. También la progresión de la enfermedad arterial distal a la prótesis se ha analizado como factor predisponente10,30. En nuestros casos de oclusión ilíaca, además de los 7 casos en los que se ha observado la imagen de kinking, en otros 5 se ha objetivado empeoramiento de la salida distal por progresión de la enfermedad arterial periférica (3 casos por estenosis de la IE, y 2 por oclusión de la arteria femoral superficial).
Faurel et al. publicaron en 2015 un estudio prospectivo que forma parte del registro ENGAGE (Endurant stent graft natural selection global postmarket registry) en el que incluyeron a 1.143 pacientes con un seguimiento de 2 años, donde analizaron la asociación de 47 variables con la trombosis de rama. Con una tasa de trombosis del 3,4%. Dividieron la muestra en 2grupos: de alto riesgo (1.115 ilíacas) o de bajo riesgo (1.171 ilíacas), resultando una diferencia de trombosis del 96,1 vs. 99,6% respectivamente (p<0,0001, log rank test). Los factores predictores fueron el sellado en IE, la IE <10mm, el diámetro del aneurisma <59mm, el acodamiento o kinking y la reintervención por endofuga20.
La isquemia aguda es la presentación más frecuente de la trombosis de rama, que supone más del 50%6,10,31. La claudicación intermitente representa entre el 30 y el 50% y entre un 17 y un 20% se puede presentar como un hallazgo casual en las pruebas de imagen realizadas durante el seguimiento6,10,31. De forma similar se objetivó en nuestra serie, en la que la presentación como isquemia aguda, crónica o asintomática fue del 47, 33 y 20%, respectivamente.
De forma similar al momento de presentación clínica de nuestra serie, la trombosis de rama en el 90% de los casos tiene lugar durante el primer año de seguimiento, y más del 50% en los 3 primeros meses6,10,31.
El número de casos de trombosis en la literatura y su manejo es limitado, y depende de la clínica del paciente y de la experiencia del médico. Las posibilidades de tratamiento incluyen la repermeabilización de la oclusión asociada a la corrección de la causa o la derivación extraanatómica, que solventa las 2cuestiones. En líneas generales, la opción quirúrgica mediante bypass extraanatómico como femorofemoral o bien axilofemoral es la opción más recurrida en la bibliografía15,16. No obstante, la trombectomía quirúrgica/endovascular o trombólisis asociada a la colocación de stent también se emplea con buenos resultados32,33.
En nuestra serie, 6 de los casos tratados (67%) se realizaron mediante derivación extraanatómica, 2de forma endovascular y un caso de forma combinada. Uno de los casos revascularizados de forma endovascular a los 3 meses presentó retrombosis con claudicación a largas distancias.
Pese a que algunos grupos pongan en duda el seguimiento mediante varias angio-TC durante el primer año5,34,35, Faurel et al. y nosotros con nuestra experiencia destacamos la importancia del seguimiento exhaustivo mediante pruebas complementarias a los pacientes de riesgo, durante este primer año, para la detección precoz de cambios en la conformación y su tratamiento20.
Las principales limitaciones del presente estudio son el pequeño número de casos que corresponden al grupo de trombosis de rama y que se trata de un análisis retrospectivo.
ConclusiónLa trombosis de rama ilíaca en EVAR se presenta en un 5,1% de los casos. El sellado distal en IE y la sobredimensión ≥ 20% del sellado se presentan como factores independientes asociados a la complicación. La mayoría se presentan el primer año y se relacionan con kinking de la extensión ilíaca durante el seguimiento.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesIncluye pacientes tratados en nuestro centro de trabajo y nuestro servicio.
Existe conflicto de interés por parte del Dr. Gómez Palonés (proctor de Gore y Cook) y del Dr. Plaza Martínez (proctor de Bard; esta casa comercial no está relacionada con el material empleado en el estudio).