El tratamiento endovascular del aneurisma de aorta abdominal (EVAR) representa uno de los grandes avances de la cirugía vascular en los últimos 50 años. A diferencia del tratamiento abierto, el EVAR precisa un seguimiento postoperatorio estricto. Durante el seguimiento, la imagen del dispositivo y del aneurisma son de extrema importancia para identificar pacientes en riesgo que precisan una intervención secundaria. Ello ha conducido a protocolos de seguimiento rigurosos basados en estudios con angio-TC. El empleo de estos protocolos de seguimiento tan intensivos son criticados actualmente tanto por la alta radiación administrada al paciente como por el empleo de medios de contraste nefrotóxicos. Los programas de seguimiento postoperatorios menos intensivos y basados en ultrasonidos parecen ser seguros en la mayoría de los pacientes. Proponemos un régimen de seguimiento postoperatorio del EVAR que varía la intensidad y frecuencia de los estudios de imagen postoperatorios en función de los hallazgos.
Endovascular aneurysm repair (EVAR) is one of the greatest advances in vascular surgery over the past 50 years. In contrast to conventional aneurysm repair, EVAR requires stringent posoperative surveillance. Imaging of the graft and aneurysm is of utmost importance during follow-up to identify patients in need of secondary intervention. This has led to rigorous follow-up protocols based on regular CT examinations. The use of these intense follow-up protocols has recently been questioned due to the high radiation doses and the frequent use of nephrotoxic contrast agents. Less intensive follow-up based on ultrasound examination appears to be safe in the vast majority of patients. We suggest an EVAR surveillance regimen that regulates the frequency and intensity of postoperative imaging based on the outcomes.
El tratamiento endovascular del anerisma de aorta abdominal (AAA) (EVAR) ha supuesto sin ninguna duda el mayor avance producido en cirugía vascular en la última década. Tras un periodo experimental, y animados por los resultados de los diversos ensayos clínicos, su uso ha devenido cada vez más común. Desde un principio se señaló la necesidad de evaluar a largo plazo la durabilidad del procedimiento en cuanto que algunos informes de endoprótesis explantadas podían hacer dudar de su estabilidad estructural. Así mismo un defecto de sellado o estabilidad del dispositivo, mantenido básicamente por la fricción generada por la fuerza radial contra la pared del vaso o entre sus distintos componentes, puede llevar a que la sangre se introduzca entre él y la pared del vaso, fracasando la despresurización del saco y persistiendo por tanto el riesgo de rotura. Este sangrado puede ser ocasionado también por el flujo retrógrado de las ramas arteriales del saco. La evaluación del resultado del tratamiento EVAR se realiza por técnicas de imagen que permitan evaluar el tamaño del aneurisma, detectar y tipificar las endofugas, dar información sobre la integridad estructural, posibles deformidades y fallos en el anclaje del dispositivo que condicionen migraciones y valorar la permeabilidad del injerto y sus ramas.
Clásicamente el protocolo de seguimiento se ha basado en la realización intensiva de estudios con angiotomografía computarizada multidetector con contraste (angio-TC) y tiene su origen en la demanda inicial de las distintas agencias evaluadoras sanitarias y en los primeros estudios aleatorizados al ser un procedimiento novedoso; de aquí, y sin base empírica el seguimiento intensivo fue incorporado a las instrucciones de uso de los fabricantes. Estos protocolos suponen un incremento del coste del procedimiento no desdeñable, ya que pueden suponer hasta el 35% del mismo, la repetición de exploraciones angio-TC entraña un riesgo carcinógeno y para la función renal del paciente con una rentabilidad baja ya que solo en el 10% de los pacientes identificaremos eventos adversos que precisen tratamiento1. Por tanto, la optimización del protocolo de seguimiento del EVAR es esencial especialmente si consideramos que cualquier beneficio que se añada redunda en un incremento del uso de esta técnica en el tratamiento del AAA.
Seguimiento con ecodoppler del EVARLa mayoría de programas de seguimiento se basan en la realización de una tomografía axial computarizada (TAC) en cada control de forma indefinida. Para que la exploración ofrezca la información adecuada, cada TAC debe incluir un barrido inicial sin contraste, otro en fase arterial y otro en fase tardía; dependiendo del grosor de los cortes esto supone una radiación efectiva no inferior a 11 mSv para cada control2. El cronograma de seguimiento comporta la realización de un control inmediato, tras la implantación del dispositivo, seguido de exploraciones a los 6, 12 y 18 meses del implante y anualmente después, siempre que no se detecten problemas que nos hagan incrementar la frecuencia de los controles o que requieran estudios complementarios. Así pues, en el mejor de los casos habremos realizado al paciente unos 9 TAC en 5 años con una dosis efectiva de casi 100 mSv. Esta dosis debe sumarse a la administrada durante el implante y en angiografías previas y a la administrada en otras radiografías (Rx) que se le realicen al paciente. Estudios realizados por el Consejo de Seguridad Nuclear y el informe BEIR VII (Biological effects of ionazing radiation) de la National Academies estadounidense establecen un ERR (exceso de riesgo relativo) de 0,97 por Sv para todos los cánceres excluyendo la leucemia. Ello significa que el riesgo de morir de cáncer de los pacientes portadores de una endoprótesis en programa de seguimiento con TAC aumenta en un 10% respecto de un paciente con las mismas características pero no sometido a radiación. Para la leucemia el ERR es aún mayor y alcanza el 1,933,4.
Alentados por el deseo de reducir la dosis de radiación a nuestros pacientes y merced a la amplia experiencia en el diagnóstico ecográfico de los aneurismas de aorta, implantamos un programa de seguimiento que emplea como examen básico el ecodoppler, reservando la TAC para los casos en los que pueda haber algún problema. El seguimiento del EVAR se centrará en:
Determinar el crecimiento o reducción del tamaño del aneurismaLa capacidad de la ecografía para la medición del diámetro aórtico es ampliamente aceptada y sus limitaciones son una variabilidad en la medición que oscila entre 0,1 y 0,2cm y la dificultad para determinar con precisión el punto de medida5. De hecho, si la comparamos con la TAC, las diferencias en las mediciones son mínimas y la correlación excelente6,7. La variabilidad interobservador es baja si se realiza la ecografía de forma estandarizada5, considerando esencialmente el diámetro anteroposterior que está exento de refracción. En casos de arterias muy tortuosas la medición más reproducible será la del diámetro menor de la sección en que la aorta sea más grande.
Comprobar la correcta permeabilidad, deformación o migración del injertoLa permeabilidad del injerto y la existencia de acodamientos u estenosis son también detectables con ecodoppler, aplicando los criterios descritos para el diagnóstico de estenosis en injerto protésico. El seguimiento de endoprótesis requiere imprescindiblemente la asociación del ecodoppler con una radiografía simple de abdomen biplanar que nos permitirá valorar la existencia de migraciones o fracturas del stent.
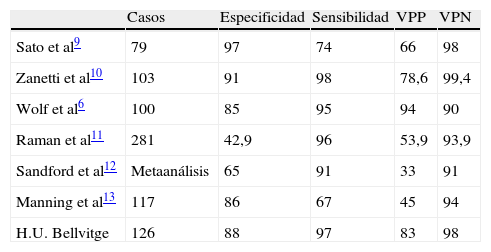
Detectar la existencia de endofugasUn aspecto poco desarrollado es la capacidad del ecodoppler para detectar la existencia de endofugas. Son numerosos los estudios que demuestran que el ecodoppler realizado por un explorador experimentado ofrece una elevada capacidad de detectar fugas con un bajo índice de falsos negativos (sensibilidad 91,7% y valor predictivo negativo [VPN] 99,4%) aunque puede sobreestimar su presencia (especificidad 98,9, VPN 78,6%)8. La tabla 1 resume la experiencia publicada respecto a la capacidad del ecodoppler para detectar endofugas en comparación con la angio-TC.
Comparación del ecodoppler con la angio-tomografía computarizada en la detección de fugas
| Casos | Especificidad | Sensibilidad | VPP | VPN | |
| Sato et al9 | 79 | 97 | 74 | 66 | 98 |
| Zanetti et al10 | 103 | 91 | 98 | 78,6 | 99,4 |
| Wolf et al6 | 100 | 85 | 95 | 94 | 90 |
| Raman et al11 | 281 | 42,9 | 96 | 53,9 | 93,9 |
| Sandford et al12 | Metaanálisis | 65 | 91 | 33 | 91 |
| Manning et al13 | 117 | 86 | 67 | 45 | 94 |
| H.U. Bellvitge | 126 | 88 | 97 | 83 | 98 |
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Sin embargo es discutible considerar la TC como patrón oro ya que en muchos casos fugas inicialmente observadas en ecodoppler y no confirmadas por TC fueron posteriormente visualizadas con resonancia magnética (RM) o con otra TC14. Asimismo en algunos el ecodoppler permite determinar el origen de la fuga, ya sea un relleno del saco aneurismático a partir de ramas lumbares o mesentérica inferior (tipo II) o a partir del injerto, anclaje proximal, distal o de segmentos intermedios (tipo I). En este campo, la utilización de ecopotenciador puede mejorar la fiabilidad de la técnica permitiendo detectar pequeñas fugas, sobre todo la tipo II, que difícilmente pueden detectarse con examen simple15,16.
Ecodoppler potenciado con ecocontrastesLos ecocontrastes son sustancias exógenas que pueden ser administradas en el torrente circulatorio o de forma intracavitaria para potenciar las señales ultrasónicas. Ultraestructuralmente, los ecocontrastes son suspensiones de microburbujas, una nueva clase de material cuya utilidad en imagen depende de la compresibilidad del gas, que es marcadamente diferente de la casi incompresibilidad tisular. Explotando esta diferencia se han desarrollado múltiples secuencias de análisis ultrasonográfico que disminuyen las señales procedentes de los tejidos e implementan las originadas desde las microburbujas, aumentando así la interfase gas (contraste)-tejido y mejorando la imagen. Las nuevas moléculas son inyectadas por vía intravenosa y pueden atravesar el lecho capilar pulmonar tras una inyección periférica, al ser mucho más pequeñas que los eritrocitos.
Los ecocontrastes se caracterizan por la capacidad de ser modificados por el tipo de insonación utilizada para detectarlos, creando señales contraste-específicas que dependen fundamentalmente de la potencia de insonación o, lo que es lo mismo, de la amplitud de la onda sonora aplicada, que puede modificarse en la práctica utilizando el Índice Mecánico17.
Técnica de examenLos exámenes óptimos se consiguen con un equipo de última generación, dotado con software específico para el análisis de imágenes generadas con ecocontraste, utilizando un IM de insonación menor de 0,1, ecocontrastes de segunda generación y una sonda curva de 3,5 a 5MHz (estos dos últimos requisitos junto con el empleo de THI, «tissue harmonic image», pueden ofrecer buenos resultados en caso de no disponer de los últimos avances tecnológicos). La exploración, con el paciente en decúbito supino, debe comenzar en modo B y doppler color, valorando fundamentalmente la morfología y diferente ecogenicidad del saco, hecho que nos va a ayudar a interpretar de manera adecuada las imágenes obtenidas tras la inyección de contraste. Deben obtenerse imágenes en proyecciones transversal y longitudinal interesando la aorta abdominal yuxtarrenal, el origen de las dos arterias renales, la totalidad de la endoprótesis incluyendo sus ramas y la morfología del saco aneurismático.
La dosis óptima de ecocontraste en el seguimiento de pacientes tras EVAR no se encuentra claramente definida18–20. La experiencia más extensa acumulada en la evaluación de pacientes tras EVAR ha sido con el contraste de segunda generación SonoVue® (Bracco, Milan), para el que actualmente se recomienda una dosis de 2,4ml seguida de una infusión en bolo de 5ml de suero salino fisiológico a través de una vía de calibre 18-20 G canalizada en cualquier vena del antebrazo.
Si existen dudas en cuanto a la contrastación de determinadas zonas, puede emplearse la llamada técnica de destrucción-reperfusión: aplicando un breve choque de ultrasonidos con un alto IM, las microburbujas estallan generando un eco de muy alta intensidad.
Ecodoppler potenciado con ecocontrastes y detección de endofugasEn la exploración con ecocontrastes, sin color, las fugas aparecen como áreas de alta atenuación por fuera del injerto y por dentro del saco aneurismático, que no eran visibles en la exploración inicial en modo B, o, como mucho, se sugerían al objetivarse hipoecogenicidad de esa área.
A la hora de valorar y tipificar una fuga durante la exploración con ecocontrastes debemos identificar y tener en cuenta los siguientes aspectos:
- -
El origen de la fuga.
- -
Los vasos colaterales que lo alimentan y permiten su drenaje, en caso de existir.
- -
La morfología de potenciación con el ecocontraste, distinguiendo fugas en las que el ecocontraste rellena una pequeña cavidad dentro del saco («cavity filling»), o aquellos en los que difunde ampliamente extendiéndose por todo el saco a través del trombo.
- -
El tiempo de llenado («wash-in») y lavado («wash out»), definidos respectivamente como el tiempo transcurrido entre la inyección periférica del contraste, así como el inicio y fin de la visualización del contraste en el saco.
Es probable que el uso de ecocontrastes mejore significativamente la capacidad del estudio ultrasonográfico en la detección de fugas, superando las limitaciones anteriormente descritas del estudio con doppler color. Debido a la mayor duración del tiempo efectivo de visualización del ecocontraste, el ensombrecimiento de los artefactos provocados por el armazón metálico de las endoprótesis, y la evaluación hemodinámica de las fugas, el estudio eco doppler potenciado con ecocontrastes parece ser más sensible y específico que la TC en la detección de fugas, sobre todo los de flujo más lento. Un reciente metaanálisis bivariado, que combina los resultados de 8 estudios diferentes comparando ecodoppler ecopotenciado y TC arroja una sensibilidad y especificidad del 98 y 88% respectivamente en la detección de endofuga8,16,18,19,21,22,15,24.
Clasificación de endofugas de acuerdo con la exploración ecocontrastadaAtendiendo a la tipificación clásica de las endofugas, las características ecográficas en la exploración ecocontrastada son las siguiente24:
Fuga tipo ILas fugas tipo I se visualizan en la exploración con ecocontrastes como grandes flujos hiperecogénicos, sincrónicos con respecto al realce intraluminal de la endoprótesis, extendiéndose desde su extremo proximal o distal hacia el saco, con una dirección caudal o craneal, respectivamente.
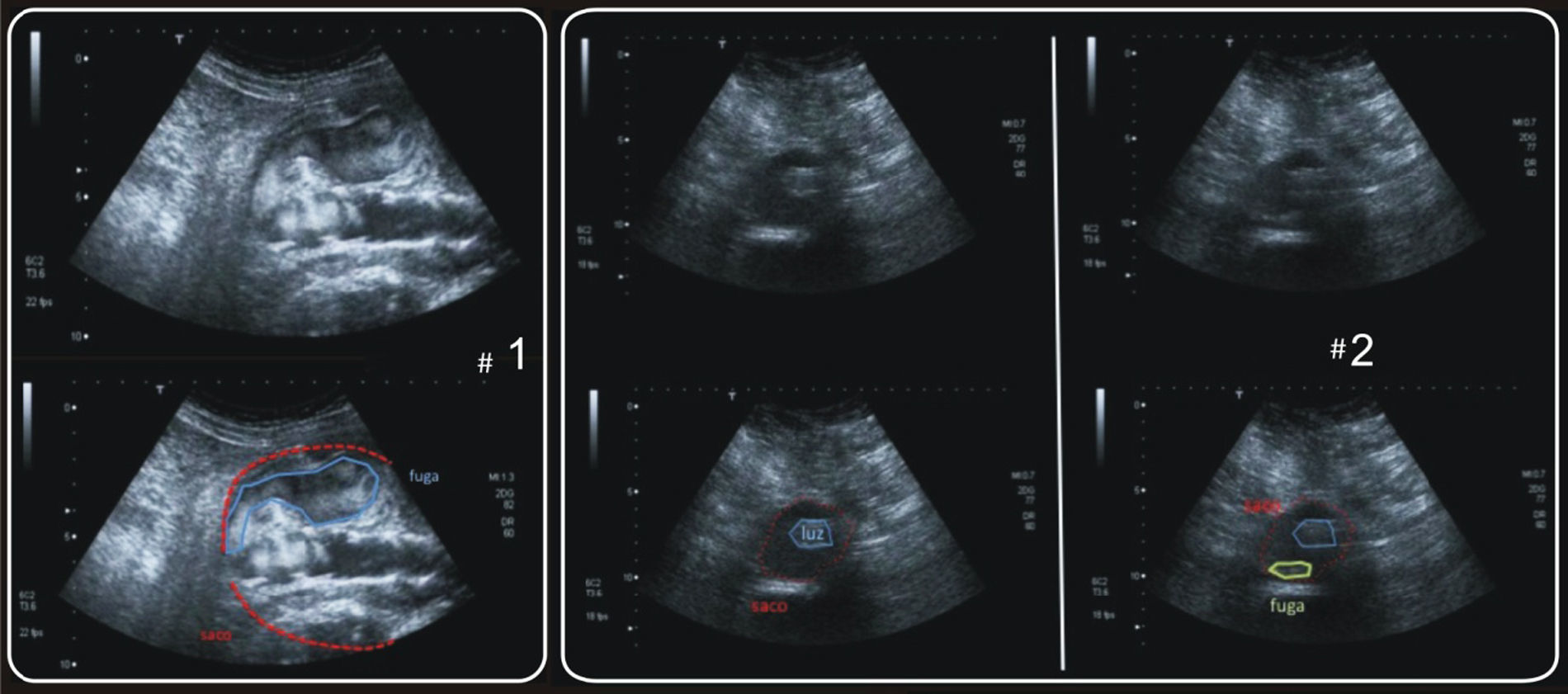
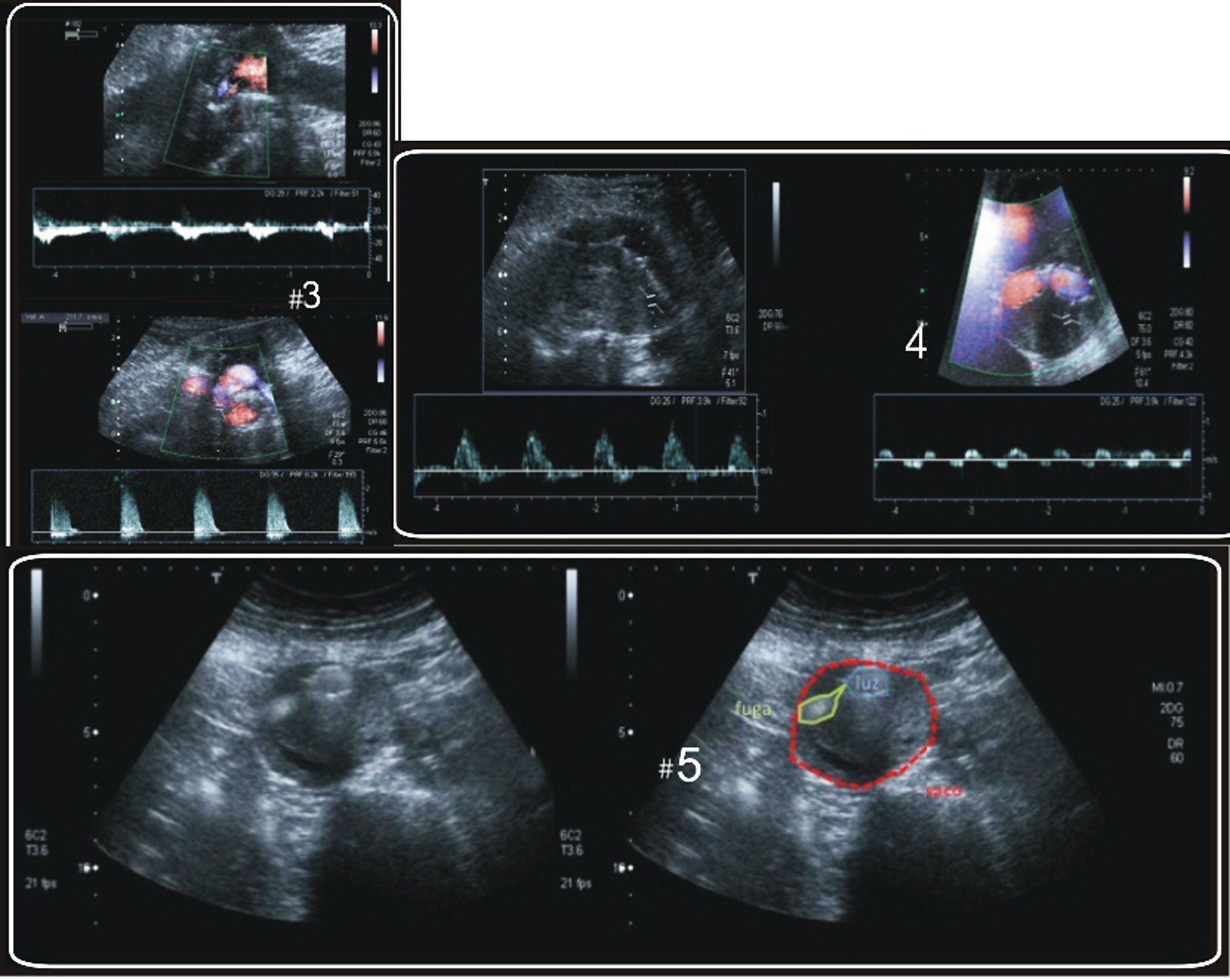
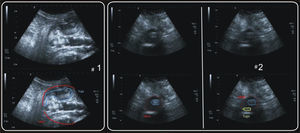
Fuga tipo IIEn las imágenes con ecocontraste, el realce hiperecogénico de su flujo se objetiva sobre todo en la periferia del saco, de manera siempre asincrónica (figura 1) con el realce aórtico, sin contacto con el endoinjerto o con contacto tardío con su pared, y generalmente localizado en la porción posterior o lateral del saco. La exploración ultrasonográfica permite además de la tipificación morfológica una valoración angiodinámica del comportamiento del ecocontraste en el saco, reconociendo la dirección del flujo (hacia la sonda o alejándose de la misma) y diferenciando fugas tipo II (desde la periferia hacia la prótesis) de tipo III (de la prótesis a la periferia) (figura 2).
La incertidumbre que normalmente rodea a la persistencia de este tipo de fugas y su relación con la presurización del saco aneurismático y su crecimiento y eventual ruptura, ha llevado al intento de relacionar parámetros angiodinámicos obtenidos tras la exploración ecográfica con tasas de crecimiento del saco.
- -
Dependiendo de los tiempos de llenado y lavado del ecocontraste, Bargellini19 et al han clasificado las fugas tipo II en hiperdinámicas, si el tiempo de llenado es menor de 100 segundos y el de aclarado menor de 520 segundos, e hipodinámicas en caso contrario. Este último parámetro se comportó en una serie de 18 pacientes como predictor independiente de crecimiento del saco aneurismático.
- -
Según la velocidad del flujo intrasaco, Arko et al25 han relacionado velocidades menores de 80cm/seg con fugas con tendencia a la autorresolución, y velocidades por encima de 100cm/seg con fugas alimentadas por grandes ramas o fugas múltiples. También se ha sugerido que las fugas con mayores velocidades pico eran más resistentes a la embolización transarterial. Estos datos, sin embargo, han sido puestos en duda en estudios recientes26.
Meier et al27 describieron que el análisis de la curva espectral de flujo de la fuga podría diferenciar aquellos que se sellan espontáneamente de los que persisten. Así, una morfología de curva tipo pseudoaneurisma, denominda «to-and-from», con un ascenso sistólico e inversión diastólica simétrica, podría preceder a la oclusión de la fuga, mientras que una morfología bifásica, semejante a curvas de flujo arterial normal, parecen ser predictoras de persistencia. Esta teoría se encuentra actualmente también en discusión.
Fuga tipo IIIEl flujo se visualiza estrictamente adyacente a la prótesis, con un contacto retardado con los márgenes del saco sólo en algunas ocasiones. Frecuentemente, además, se realzan sincrónicamente con la luz del endoinjerto. Como se ha descrito anteriormente, su direccionalidad opuesta permite distinguirlos de las fugas tipo II.
Fuga tipo IVSe deben a la porosidad de la propia prótesis y generalmente sólo se detectan en los primeros angiogramas intraoperatorios tras la colocación de la misma. La tipificación ecográfica de este tipo de fuga es tan infrecuente como compleja y debe considerarse como un diagnóstico de exclusión.
Limitaciones de la exploración con ecocontrastesA las limitaciones físicas de los ultrasonidos y la dependencia de la pericia del operador hay que añadir que las características físicas de las microburbujas de los ecocontrastes y los procesos físicos que dan lugar a la adquisición de las imágenes hacen que se describan artefactos típicamente relacionados con este tipo de materiales, sobre todo cuando se complementa la exploración con software de color y power doppler, apareciendo imágenes de rebosamiento («blooming»). Además, el análisis espectral de flujos que contienen microburbujas puede dar lugar a interpretaciones erróneas, con incrementos en la velocidad pico sistólica detectada de hasta el 50% en la fase de máxima ecogenicidad del ecocontraste25.
En general, los ecocontrastes actuales ofrecen un perfil de altísima seguridad hacia el paciente. Los efectos secundarios más frecuentes de su inyección (1-5% de casos) son alteraciones transitorias del gusto, dolor local en el punto de inyección, sensación de calor facial o eritema súbito generalizado28.
Ventajas de la angio-TC en el seguimiento del EVAR. ¿Superior al ecodoppler?Múltiples son las características que hacen de la angio-TC una buena herramienta para el seguimiento del AAA, entre ellas destacan: la enorme información que ha aportado desde la implantación de la reparación endovascular; los nuevos dispositivos helicoidales y multidetectores; la posibilidad de conseguir reconstrucciones en dos y tres dimensiones; la realización de cortes cada vez más finos; la reducción de las dosis de radiación y la adquisición de imágenes en distintas fases (sin contraste, arterial y retardada) y en modo dinámico.
Las ventajas que se obtienen son: a) gran conocimiento de la evolución global del implante, por lo que se ha convertido en el método más aceptado superando a la arteriografía29 y convirtiéndose en el patrón oro ya que es con quien se comparan el resto de pruebas; b) disponibilidad, se trata de una herramienta que está presente en prácticamente todos los hospitales; c) reproducibilidad, permite una rápida adquisición de imágenes; d) resolución espacial elevada en dos y tres dimensiones pudiendo realizar una valoración global del aneurisma, de sus dimensiones y de su relación con estructuras vecinas; e) método imprescindible para la planificación del tratamiento de las complicaciones (colocación de extensiones, cuff proximal, etc.). Sin embargo no es una prueba inocua, destacando entre sus inconvenientes su nefrotoxicidad y potencial carcinógeno y es costosa.
Para poder determinar qué prueba diagnóstica es superior a otra es preciso antes determinar cuáles son los parámetros que se pretenden analizar y cuál es su impacto real. Durante el seguimiento se hace especial hincapié en tres parámetros básicos: morfología y dimensión del saco aneurismático, integridad de la endoprótesis y la presencia de endofugas. Otras complicaciones como la presencia de trombo en la luz de la endoprótesis, la presencia de signos infecciosos o la relación con estructuras vecinas, se presentan con menor frecuencia.
Saco aneurismáticoTres son las variables que se evalúan: el tamaño, el volumen y el trombo aneurismático. El tamaño es el principal de ellos y el que determina si la reparación es efectiva. La presencia de disminución del diámetro máximo del aneurisma («shrinkage») indica una correcta exclusión y una despresurización del aneurisma. El ecodoppler y la angio-TC han mostrado prácticamente la misma fiabilidad y con una buena correlación en la medición del aneurisma tanto en la fase diagnóstica como en el seguimiento30, detectándose diferencias máximas en diferentes estudios de 2mm. Dados estos resultados y que la angio-TC presenta mayores efectos adversos que el ecodoppler, éste debería ser el método de elección para la evaluación del tamaño del saco aneurismático. Sin embargo, si se demuestra el crecimiento del aneurisma sería preciso realizar una TC para evaluar el mejor tratamiento.
El volumen y las características del trombo se han convertido en parámetros más precisos ya que permiten evaluar mejor cuál es la evolución de la exclusión de un aneurisma sobre todo en aquellos aneurismas en los que no se produce disminución del tamaño o que han presentado complicaciones incluyendo la rotura ya que permiten predecir la presencia de endofugas que no han sido detectadas con los procedimientos habituales. Sin embargo, a pesar de que el software está disponible en los nuevos aparatos, no es utilizado por la gran cantidad de tiempo que consumen para su determinación31–33. Para estos parámetros la TC es superior al ecodoppler.
Integridad de la endoprótesisDentro de este apartado se valoran entre otras las alteraciones de la estructura metálica, la migración de la endoprótesis, la presencia de estenosis o de trombo en el interior de la misma así como su impermeabilidad. Si el único parámetro que quisiéramos valorar fuera la estructura metálica de la endoprótesis ni la TC ni el ecodoppler podrían superar a una simple Rx de abdomen. Sin embargo, existe mayor interés en conocer las consecuencias de dicha alteración. Para ello tanto la angio-TC como el ecodoppler han demostrado su utilidad. El primero con las reconstrucciones en tres dimensiones nos permite valorar el estrés mecánico de la pared de la endoprótesis así como la presencia de fracturas y de migración de la endoprótesis, valorando la causa de la misma como pudiera ser un agrandamiento del cuello del aneurisma y siendo buenos predictores de riesgo de ruptura31. El segundo puede valorar la presencia de endofugas tipo I como consecuencia de una migración, tipo III por desadaptación de los módulos de la prótesis o hallar endofugas tipo IV secundarias a porosidad de la endoprótesis o por fractura de la misma34,35. Ambas pruebas nos permiten valorar la presencia de estenosis secundaria a alguna alteración de la endoprótesis o por la presencia de trombo intraprótesis.
EndofugasHay un gran número de estudios que comparan el ecodoppler con la angio-TC, pero tienen diferencias metodológicas entre ellos que hacen que sea difícil extraer conclusiones definitivas en la detección de endofugas. El principal problema es que realmente no hay un patrón oro para detectar las endofugas ya que se ha visto en algunos estudios que se detectan falsos negativos en todos los métodos diagnósticos evaluados, incluida la TC36. La primera revisión sistemática fue realizada por Aschoke et al37. La sensibilidad y la especificidad del ecodoppler respecto a la TC fueron del 69,1 y 90,6%, respectivamente, con mayor precisión diagnóstica en la detección de endofugas tipo I y tipo III. La principal conclusión a la que llegaron fue que el ecodoppler no presenta la suficiente precisión para detectar endofugas respecto a la TC. Un año más tarde se publicó una segunda revisión sistemática38 en la que se incluía el ecocontraste concluyendo que el ecodoppler no es superior a la TC pero que la adición permite una precisión diagnóstica similar a la TC. Estudios posteriores publicados en los últimos años demuestran que el ecodoppler no consigue igualar la TC, no obstante en otros estudios en los que se compara la TC con el ecocontraste se consiguen resultados similares a la TC como muestra la tabla 2. La principal conclusión es que el ecodoppler con ecocontraste representa la mejor opción en la detección de endofugas por su muy baja probabilidad de efectos adversos y su menor coste a pesar de la incorporación del ecocontraste.
Comparación ecodoppler con ecopotenciador en la detección de fugas
| Eco frente a TC | Sensibilidad | Especificidad | VPP | VPN | |
| Clevert et al39 | Sin contraste | 33% | 92,8% | 71% | 72% |
| Con contraste | 100% | 92,8% | 88% | 100% | |
| Iezzi et al23 | Sin contraste | 62,5% | 63,6% | 63,1% | 65,1% |
| Con contraste | 97,5% | 81,8% | 89,3% | 97,3% |
TC: tomografía computarizada; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se puede afirmar que aunque la TC actúa como patrón oro en la evaluación de la reparación endovascular del AAA, en la realidad no se puede tomar como tal por la presencia de falsos negativos. La principal ventaja de la TC es la gran experiencia que se tiene con ella ya que ha permitido la evaluación global de la reparación endovascular, sin embargo dado que presenta efectos adversos no desdeñables y que los parámetros actuales más interesantes en su evolución son el diámetro del aneurisma y la presencia de endofugas, se prefiere la utilización del ecodoppler con ecocontraste y reservar la TC para aquellos casos donde se detecte crecimiento del saco aneurismático con o sin endofuga detectada.
Protocolos para seguimiento del tratamiento EVARLos dos grandes puntos que debemos considerar a la hora de establecer un protocolo de seguimiento del tratamiento EVAR son la elección del método de diagnóstico por la imagen y el momento oportuno de su realización.
Elección de pruebas diagnósticasUna prueba diagnóstica «ideal» para el seguimiento debe cumplir con las premisas de que sea exacta, segura, barata y de cumplimentación sencilla para el paciente y el cirujano40. Entre el arsenal de pruebas de que disponemos en nuestro medio debemos analizar la Rx simple de abdomen, el ecodoppler y la angio-TC.
Radiografía simple de abdomenEn proyección anteroposterior y lateral es útil para la evaluación de alteraciones estructurales como roturas de stent, desacoplamientos y plicaturas. Resulta sencilla de realizar, es barata y asequible en todos los medios. Kranokpiraksa et al35 aconsejan una primera radiografía en el momento del implante y después a lo largo del seguimiento para valorar los cambios. La persona que interpreta la radiografía debe conocer ampliamente el diseño de la endoprótesis y sus marcas. Del mismo modo, la posición del paciente y la forma de realización deben ser regladas, de esta forma, una variación de 5mm en el posicionamiento del cuello proximal respecto a un cuerpo vertebral se puede considerar migración con alta probabilidad de endofuga tipo I35,40. La radiografía como prueba única no es útil para el seguimiento del saco y la identificación de endofugas.
Angio-TCHasta la fecha, como se ha comentado en la introducción, la angio-TC se ha considerado el «patrón oro» en el seguimiento de las endoprótesis. Es una prueba accesible en la mayoría de centros, reproducible, con excelente calidad de imagen, buena detección de endofugas, precisa medición de diámetros y buen análisis estructural de la endoprótesis. Pero sus inconvenientes llevan a una tendencia clara a la sustitución de esta prueba por otras no invasivas, en concreto el ecodoppler.
EcodopplerPrueba de fácil cumplimentación para el paciente, no invasiva, barata, portátil y sin radiación ionizante sobre el paciente pero con las limitaciones antes señaladas. Ha demostrado su precisión para la medición del diámetro de los aneurismas de aorta por lo que se considera aceptable realizar un seguimiento prequirúrgico de los aneurismas con esta técnica. Con las técnicas actuales de ecodoppler incluso existen series en las que se consiguen visualizar más endofugas con el ecodoppler que con la angio-TC41. Si se asocia el uso de ecocontrastes, la sensibilidad y valor predictivo positivo (VPP) suben a cifras muy elevadas. En un metaanálisis realizado por Mirza et al21 la sensibilidad y especificidad en el ecodoppler color fueron del 77 y 94%, respectivamente; al utilizar ecocontrastes éstas pasaron a ser del 98 y 88%, respectivamente.
Una tendencia muy observada y aceptada en la bibliografía es la de realizar un seguimiento ecográfico en aquellos aneurismas estables o con disminución de diámetro42.
Cuándo realizar los controlesLos protocolos actuales están basados en las recomendaciones empíricas de los primeros registros multicéntricos y fueron asumidos por la industria en los códigos de instrucciones de uso de los dispositivos43,44. Sternbergh III et al45 realizan una revisión retrospectiva de la base de pacientes incluidos en el registro de implantes de la prótesis Zenith en Estados Unidos. En este trabajo se analiza la morbilidad relacionada con el aneurisma (MRA) en relación con la aparición o no de endofugas y el momento de la aparición de éstas. En los pacientes en los que no se detectó endofuga tipo II en los primeros 30 días de seguimiento, la tasa de ausencia de MRA es del 92,3% a un año, y del 83,1% a 5 años, tasa que sufre una reducción estadísticamente significativa a 75,0 y 55,9% al año y 5 años en los pacientes en los que sí se observó endofuga en el primer mes. Esto permite diferenciar claramente dos grupos de pacientes que van a precisar de un protocolo de seguimiento diferente. Del mismo modo, en aquellos pacientes que al mes, 6 meses y al año del seguimiento permanecen libres de endofuga, la tasa de ausencia de MRA al año sigue siendo muy alta, marcando también la posibilidad de realizar un seguimiento más espaciado en estos pacientes. Los resultados de este trabajo confirman la benignidad de la historia natural de las endofugas tipo II y el buen comportamiento clínico de los pacientes que en el control inicial al mes del implante están libres de endofugas.
Propuesta de nuevo protocolo de seguimientoResulta comprensible diseñar un protocolo de seguimiento mucho menos exhaustivo tanto en el tipo de pruebas como en el número de las mismas. Evidentemente, como toda propuesta, se puede modificar y adaptar a la experiencia y disponibilidad de cada centro sin querer discriminar las opiniones y protocolos actuales de los diferentes centros en nuestro ámbito.
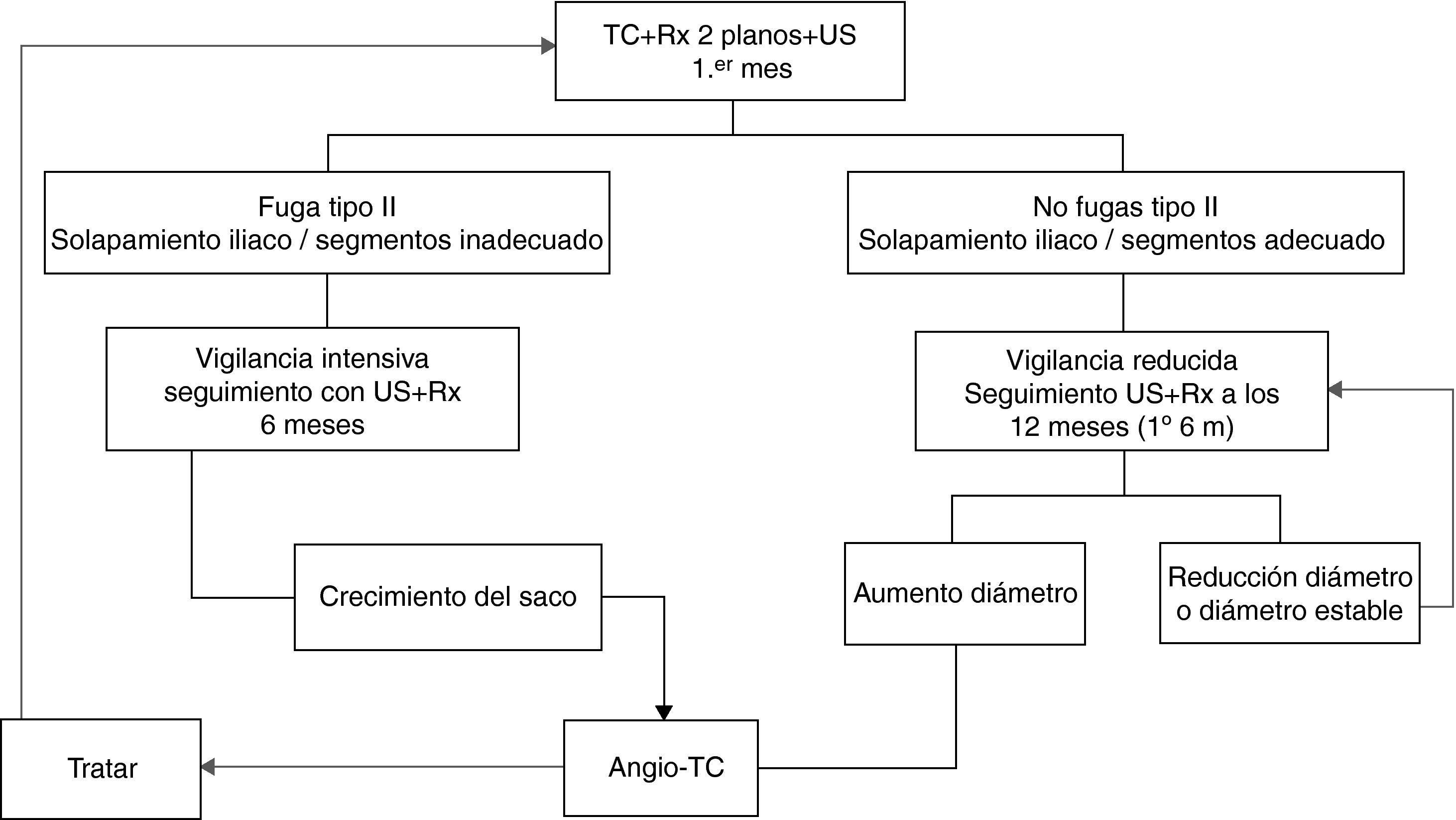
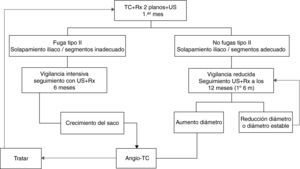
En la figura 3 se trazan las líneas principales de lo que debería ser un protocolo adaptado a la evidencia científica que disponemos. Se debe realizar el primer control al mes del implante mediante una angio-TC y una Rx simple de abdomen para descartar complicaciones precoces a la que se debe unir un ecodoppler basal. La presencia de fuga tipo I o tipo III obligaría a su reparación inmediata. Si en este primer control no se visualizan endofugas tipo II y el solapamiento de stents a nivel iliaco y entre segmentos es el adecuado, el paciente podría pasar a un protocolo de vigilancia reducida mediante ecodoppler a los 12 meses junto con Rx simple de abdomen. A partir de este momento, y siempre que permanezca sin endofugas o con un saco estable o disminuido, el paciente seguirá realizando controles únicamente anuales con ecodoppler y radiografía. En caso de que aparezca endofuga o solapamiento iliaco o de segmentos inadecuados, el paciente pasará a la otra rama del seguimiento, siendo éste de vigilancia intensiva. Si en el control inicial al mes o en cualquier momento del seguimiento se observa endofuga tipo II o solapamiento iliaco inadecuado, el paciente se someterá a una vigilancia intensiva. A este tipo de pacientes se les realizará ecodoppler y Rx cada 6 meses. Si en cualquier momento se produjese un crecimiento del saco se realizará una angio-TC para identificar la complicación y posterior tratamiento.
ConclusionesEstá en nuestras manos modificar los protocolos actuales de seguimiento de la reparación endovascular de la aorta abdominal infrarrenal. La evidencia actual nos permite abandonar con seguridad para el paciente el uso de la angio-TC como patrón oro para el seguimiento de las endoprótesis. Del mismo modo, el conocimiento del comportamiento de las prótesis y la historia natural de las complicaciones nos permite espaciar los controles periódicos e indicar correctamente las reintervenciones que pueda precisar un paciente. Es nuestra responsabilidad reducir el nivel de irradiación excesivo actual al que se somete a un paciente tanto en el diagnóstico como en el seguimiento en esta patología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Presentado en el Curso de actualización en el diagnóstico vascular no invasivo. Seguimiento de procedimientos endovasculares. Mesa redonda Sector aórtico I. Palma de Mallorca, 29-30 de octubre de 2009.