La patología obstructiva del sector aortoiliaco es una causa muy frecuente de isquemia crónica de los miembros inferiores (MMII). Se considera que el sector aortoiliaco se afecta hasta en el 35% de los casos de enfermedad arterial obstructiva de los MMII y es el segundo sector que con más frecuencia enferma después del sector femoropoplíteo y más concretamente de la arteria femoral superficial.
La causa más frecuente de lesiones oclusivas en este sector es la arteriosclerosis, aunque existen otras etiologías (arteritis de Takayasu, displasia fibromuscular, etc.) que constituyen un grupo de enfermedades menos habituales en la práctica clínica. Se suelen afectar fundamentalmente las arterias iliacas primitivas y las iliacas externas produciendo claudicación crurogemelar, aunque también es frecuente la afectación de la aorta abdominal infrarrenal produciendo el clásico síndrome de Leriche (claudicación glútea, impotencia coeundi y ausencia de pulsos femorales)1.
El diagnóstico suele ser clínico y se confirma mediante estudios no invasivos (fundamentalmente ecodoppler) visualizando directamente la aorta e iliacas o de forma indirecta mediante curvas femorales. En los casos en que se plantea realizar un tratamiento revascularizador, el estudio se debe completar con pruebas de imagen (angio-resonancia magnética nuclear [RMN], angio-tomografía computarizada [TC] o arteriografía) que permitirán plantear la estrategia terapéutica más oportuna para cada caso en particular1.
El tratamiento conservador se basa en el control de los factores de riesgo cardiovascular, realizar ejercicio físico controlado y seguir una medicación (básicamente antiagregación y estatinas) para intentar conseguir dos objetivos fundamentales: aumentar la distancia de claudicación y disminuir la mortalidad cardiovascular de estos pacientes. En fases más avanzadas de la enfermedad, cuando hay isquemia crítica, se debe hacer un tratamiento quirúrgico o endovascular que puede, en ocasiones, precisar revascularización del sector femoropoplíteo distal2.
El sector aortoiliaco ha sido el primer sector en el que el tratamiento endovascular ha sido utilizado y reconocido como una alternativa efectiva y en muchos casos ha desbancado a la cirugía como el tratamiento de elección. Desde la publicación del Consenso de la Inter-Sociedad Trans-Atlántica para el tratamiento de la Arteriopatía periférica (TASC)2, y más recientemente tras la publicación del TASC II3 y de la Guía para el Manejo de Pacientes con Arteriopatía Periférica del American College of Cardiology y de la American Heart Association4, se ha propuesto que las lesiones iliacas tipo A se benefician de un tratamiento endovascular y que en las lesiones tipo B el tratamiento más utilizado es endovascular, dejando para lesiones más extensas de todo el eje iliaco incluso con afectación de la arteria femoral común (lesiones C y D) el tratamiento quirúrgico como alternativa más utilizada y de elección respectivamente. Sin embargo, la mejora en los dispositivos actuales, el desarrollo de técnicas híbridas y el mayor conocimiento de su comportamiento a medio-largo plazo hacen que cada vez sea más frecuente el tratamiento endovascular de lesiones tipo C e incluso D con resultados no muy diferentes de los obtenidos con la cirugía abierta o, en todo caso, retrasándola5. La generalización del tratamiento endovascular en el sector aortoiliaco ha hecho que se hayan abandonando técnicas quirúrgicas más agresivas como la endarterectomía aortoiliaca o iliofemoral y ha ido ofreciendo un tratamiento revascularizador a priori menos agresivo y con menor tasa de complicaciones.
Los dispositivos endovasculares han evolucionado desde sus primeros diseños. Cada vez se utilizan dispositivos con menor perfil, mayor longitud y flexibilidad así como diseños de celda cerrada o stents recubiertos que permiten excluir lesiones potencialmente embolígenas como placas ulceradas en las arterias iliacas, aumentando el número de casos que se pueden tratar mediante terapéutica endovascular. El stent autoexpandible es más flexible y se adapta a la anatomía del vaso con una teórica menor exactitud en el implante. El stent balón expandible menos flexible pero más preciso es el de elección en técnicas tipo «kissing balloon». El uso de stent recubierto en recanalizaciones iliacas extensas e incluso de ambos ejes iliacos, con resultados más que aceptables, permite tratar lesiones inicialmente desfavorables y aumentar el número de pacientes que se pueden beneficiar de estas técnicas menos agresivas y reducir el número de intervenciones abiertas.
Sin embargo, no debemos perder la perspectiva de la posibilidad de tener complicaciones durante el tratamiento, derivadas fundamentalmente de la trombosis de los dispositivos, de la rotura de la propia arteria iliaca o de la embolización distal. En este sentido, la posibilidad de que se produzcan complicaciones graves es pequeña (alrededor del 1%) y pueden resolverse con la utilización de técnicas endovasculares para su resolución o pueden obligar a realizar intervenciones quirúrgicas alternativas (como revascularizaciones extraanatómicas) con resultados discretamente peores a medio plazo2.
Son muchas las series publicadas sobre todo en lesiones tipo B y C (que son las que más controversias generan) que muestran que el tratamiento quirúrgico convencional es el «patrón oro» para este tipo de lesiones (en cuanto a permeabilidad y durabilidad), aunque el tratamiento endovascular se presenta como una opción quizá menos duradera pero que se puede beneficiar de procedimientos asociados que mejoren la permeabilidad primaria y secundaria aumentando la durabilidad global del procedimiento con menores complicaciones5.
Dentro de la política sanitaria y de gestión actual, es importante valorar los costes que las técnicas revascularizadoras del sector aortoiliaco representan para el sistema sanitario. Los costes de una técnica se pueden realizar tomando como base el coste-efectividad o, mejor aún, a coste-utilidad (en forma de años de vida ajustados por calidad o AVAC). Los costes directos, derivados de la hospitalización, son menores al utilizar el tratamiento endovascular ya que las estancias hospitalarias son más cortas, la tasa de complicaciones es menor y no requieren habitualmente la estancia postoperatoria en unidades de vigilancia intensiva. Sin embargo, a medio plazo, debido a la menor durabilidad ya descrita de los tratamientos endovasculares y la necesidad de realizar procedimientos secundarios, los costes de ambas opciones terapéuticas se tienden a igualar6,7.
En el presente trabajo se pretende revisar la clínica producida por las lesiones obstructivas del sector aortoiliaco, su diagnóstico, las indicaciones actuales del tratamiento endovascular, describir el procedimiento y los dispositivos utilizados en la actualidad y con perspectivas de futuro inmediato, las complicaciones de este tratamiento, sus resultados iniciales y a medio plazo y los costes derivados de las técnicas endovasculares.
Exploraciones diagnósticasEl primer objetivo de este trabajo es aplicar las tecnologías actuales para valorar las estructuras arteriales (paredes-placas, estenosis, trombosis, disecciones, angulaciones, etc.) y la morfología que permita la introducción de catéteres, navegaciones de dispositivos, calcular longitudes y diámetros de los vasos que aporten una información sobre la indicación quirúrgica, la posible elección de los implantes intravasculares o estrategia de una cirugía abierta.
Podríamos dividir las técnicas en varias áreas dependiendo de las disponibilidades de cada centro hospitalario:
- 1.
Técnicas no invasivas: ecodoppler-dúplex, modo B, pulsado (color-energie) modo flow, tridimensional (con contraste intravenoso [iv] que realza la imagen).
- 2.
Técnicas por imagen endovascular: ecodoppler endovascular-ultrasonido intravascular (IVUS), angioscopia.
- 3.
Técnicas de reconstrucción por imagen: TAC, TAC helicoidal, angio-RM.
- 4.
Técnicas angiográficas: angiografía digital percutánea venosa (DIVA), arteriografía.
Es una técnica con gran disponibilidad y rapidez de ejecución, que permite un primer diagnóstico de estructuras arteriales, con visualización de la aorta infrarrenal, arterias renales, iliacas y femorales con sus ramas y tejidos circundantes. Se puede valorar el flujo intraarterial y determinar estenosis con trombosis parciales o totales asociadas8.
Los inconvenientes de esta técnica son la dificultad de una visualización global del sector explorado, la variabilidad de los diámetros de los vasos debido a la posición del cabezal en relación a la anatomía de los grandes vasos y a las angulaciones de las arterias. No es posible planificar estrategias endovasculares complejas y afinar en el diagnóstico de ramas arteriales de pequeño calibre. Se puede utilizar para realización de punción arterial y venosa, sobre todo en accesos complejos, así como control del paso de dispositivos endovasculares9.
El resto de los sistemas de ecodoppler son mejoras técnicas que progresivamente van aumentando la capacidad diagnóstica y en un futuro es muy posible que sea la exploración de elección.
Técnicas por imagen endovascularAngioscopiaEs necesario el bloqueo del flujo arterial. Visualiza la luz del vaso y con ello la existencia de placas, estenosis, trombosis, disecciones y suturas arteriales. En las técnicas endovasculares es posible ver las terminaciones de los implantes y navegar a través de los mismos hasta zona de exclusión de flujo.
Ecodoppler endovascular-ultrasonido intravascularSe trata de la misma técnica pero introduciendo un transductor de 12,5MHz y no precisa de bloqueo de flujo lo que permite además de la visualización del vaso la medida de la presión del intraluminal.
Las indicaciones de estas técnicas tienen utilidad en los casos de disparidad entre aspectos clínicos y angiográficos, sobre todo en las disecciones y para control de los resultados de las técnicas endovasculares cuando la arteriografía intraoperatoria no detecta lesiones que provoquen flujos inadecuados a nivel distal.
Los inconvenientes de estas técnicas son su disponibilidad y las maniobras de cierta complejidad para el control del flujo durante las exploraciones.
Técnicas de reconstrucción por imagenSe trata de una exploración que utilizando radiaciones físicas (rayos X, protones) permite una reconstrucción del mapa arterial con su patología y la posibilidad de valorar la estrategia quirúrgica.
Tomografía axial computarizada helicoidalEs la aplicación de la emisión de rayos X de forma circular y la plasmación en un plano de las variaciones de la interacción de las radiaciones ionizantes con las estructuras del cuerpo humano. En 1980 aparecen los primeros aparatos de tomodensitometría que revolucionaron los diagnósticos aortoiliacos pero con limitaciones de disponibilidad, lentitud de los estudios y sin posibilidades de imágenes angiográficas. A partir de 1995 aparece la TAC helicoidal, que proporciona estudios con secciones cada 2mm, a una imagen por segundo con la posibilidad de inyectar, por vía venosa, contraste iodado que opacifica las arterias, y mediante un programa informático obtendremos cortes con una excelente resolución espacial multiplanar y una reconstrucción tridimensional10,11.
La valoración de los cortes longitudinales posibilita ver:
- -
Cuello proximal y distal de las trombosis.
- -
Inicio de la lesión, extensión y finalización. Mediciones para estrategias endovasculares.
- -
Arterias renales, iliacas internas y viscerales.
- -
Morfología de las vísceras (riñón en herradura, patología intestinal).
- -
Tejidos circundantes periarteriales: hematomas, abscesos, gas, ascitis grasa, ganglios, vena cava.
Controles postoperatorios:
- -
Permeabilidad y «endolink» en las endoprótesis. Buena valoración de los dispositivos «metálicos».
- -
Reconstrucciones tridimensionales. Resolución en 3D.
- -
Alta definición, sin artefactos.
- -
Rapidez de ejecución.
Inconvenientes:
- -
Dosis elevada de radiación.
- -
No aporta una información hemodinámica.
- -
Dificultad de interpretación en lesiones muy calcificadas y angulaciones excesivas.
- -
Mala resolución de pequeños vasos y arterias viscerales a nivel distal.
- -
Mala tolerancia de los contrastes iodados en los pacientes portadores de una insuficiencia renal crónica (IRC) por su nefrotoxicidad y está contraindicado en embarazadas.
Es una técnica que se basa en la emisión de protones generando una perturbación molecular que se plasma, mediante la captación a través de un campo magnético, en imágenes permitiendo la reconstrucción en 2D y 3D12.
Para opacificar el sistema arterial es necesaria la inyección de contraste intravenoso (gadolinium) por una vía periférica. Se trata de un producto con muy buena tolerancia y se puede utilizar en pacientes que presentan alergia a los contrastes iodados, incluso en los que presentan IRC.
Permite la realización de imágenes arteriográficas con gran resolución ya que la alta concentración del gadolinium en la arteria desencadena una fuerte elevación de la señal y la posibilidad de visualizar una cartografía arterial que permitirá un diagnóstico preciso y una visión morfológica que pueda matizar las estrategias quirúrgicas y mediciones para técnicas endovasculares.
Ventajas de la angiografía por resonancia magnética (ARM):
- -
Es una técnica no irradiante, por lo tanto poco invasiva, y se puede repetir sin peligro de acumulación de radiaciones ionizantes.
- -
Aporta una buena información hemodinámica y la estructura de las paredes arteriales (composición de las placas).
- -
Rápida resolución de las imágenes en 2D y 3D.
- -
Mayores campos de aplicación y con orientaciones múltiples.
Inconvenientes:
- -
Baja disponibilidad: se trata de equipos de alta tecnología, con un programa informático muy complejo para permitir las resoluciones en 2D y 3D.
- -
Baja resolución visceral y de los tejidos circundantes al sector aortoiliaco y sus ramas.
- -
Artefactos en placas calcificadas.
- -
Está contraindicado en presencia de objetos metálicos (marcapasos, prótesis metálicas en áreas óseas, stent aortoiliacos, etc.) y embarazadas en el primer trimestre.
- -
Tiempo de ejecución (30min) mayor que la angio-TC, necesitando una inmovilidad total durante la exploración para evitar artefactos y duplicaciones. Sensación de claustrofobia.
Son técnicas conocidas por «opacificación vascular», son las más antiguas en la exploración arterial y siguen vigentes por la alta definición de las imágenes. Las mejoras de los equipos han permitido la realización de las exploraciones con menor radiación, menos contraste, menor agresión arterial con técnicas (Seldinger) por punción disminuyendo la iatrogenia, mejor resolución por la aplicación de la «sustracción de imágenes» y reconstrucciones en 3D (angiografía numerizada)13.
La DIVA se trata de la introducción del contraste intravenoso aprovechando los avances tecnológicos de los nuevos angiógrafos (sustracción de imágenes). Posibilita la reconstrucción arterial pero con una resolución de baja calidad que permite una valoración en casos muy seleccionados.
La arteriografía es una técnica de opacificación mediante la introducción de un contraste iodado intraarterial con una visualización del sector a explorar e imagen inmediata de todo el mapa arterial y las ramas, incluidas las de mediano y pequeño calibre.
Ventajas de la arteriografía14:
- -
Disponibilidad en todos los centros hospitalarios.
- -
Rapidez de ejecución y obtención de imágenes hemodinámicas.
- -
Gran resolución del sector arterial a explorar, con los troncos principales y las ramas, trombosis, estenosis, fugas de contraste en roturas, fístulas, hematomas periarteriales, disecciones (luz falsa y verdadera con punto de fuga y reentrada).
- -
Mediciones muy exactas de diámetros, cuellos, longitudes.
- -
Disposición anatómica de las arterias (tortuosidad y angulaciones) para la navegación con dispositivos, planificación de la cirugía endovascular y la realización de la misma.
Inconvenientes:
- -
Es una técnica invasiva debido a las radiaciones ionizantes y al abordaje arterial múltiple para la introducción del contraste (vía arterial directa, catéter-Seldinger).
- -
El uso de los contrastes iodados está contraindicado en embarazadas, pacientes alérgicos al Iodo (se puede suplantar por CO2 en casos necesarios) y en la IRC por la nefrotoxicidad.
- -
Poca información de las paredes arteriales y estructuras circundantes.
En el momento de planificar las exploraciones, es necesario valorar el estado general de los pacientes y la necesidad del diagnóstico. Los podemos agrupar en pacientes agudos y programados. La elección del tipo de exploración hay que basarla en criterios de menor agresividad con una máxima información para el diagnóstico, tratamiento quirúrgico y control postoperatorio.
En pacientes agudos se puede comenzar con un ecodoppler cuya alta disponibilidad nos permite un primer diagnóstico, que va a derivar a la realización de una arteriografía si la gravedad del cuadro (trombosis, embolias, estenosis, alteración hemodinámica, etc.) lo precisa, con la ventaja de obtener de inmediato el resultado de la prueba. Si el paciente se estabiliza parcialmente se puede programar una angio-TC, que nos dará una información del estado arterial y estructuras circundantes.
En pacientes estables, la exploración más efectiva y de mayor información es la angio-TC. En caso de ser portador de las incompatibilidades antes mencionadas para TAC hay que recurrir a la angio-RM. Obtendremos una información del estado morfológico del sector aortoiliaco con sus ramas, con posibilidad de mediciones para cirugía endovascular y planificación de cirugías abiertas.
Si el diagnóstico no es muy preciso, la arteriografía nos puede aportar un mapa arterial con mayor resolución hemodinámica y morfológica a pesar de los inconvenientes de la técnica, que en parte quedan subsanados realizando la técnica ya en quirófano.
Indicaciones del tratamiento endovascular en patología obliterante aortoiliacaDesde el año 1964 en que Dotter15 realizó la primera angioplastia, han sido numerosas las series publicadas por diversos autores con datos heterogéneos respecto al tipo de pacientes tratados, morfología de las lesiones y longitudes de las mismas y los sistemas de evaluación tanto de éxito inicial como a largo plazo de los procedimientos realizados.
Todo esto ha llevado a la necesidad de intentar definir las indicaciones del tratamiento endovascular de la enfermedad obliterante periférica.
En términos generales podemos establecer dos tipos de indicaciones, las clínicas y las morfológicas. A lo largo de esta guía intentaremos establecer dichas indicaciones a nivel aortoiliaco, muy especialmente a nivel iliaco, y cómo estas indicaciones han experimentado modificaciones con el paso del tiempo y con las sucesivas revisiones y trabajos basados en evidencia científica.
Indicaciones clínicasPodemos establecer la indicación de tratamiento endovascular en pacientes con isquemia crónica de MMII, incluyendo claudicación intermitente que limite la actividad cotidiana, el dolor isquémico de reposo, la gangrena, la ulceración isquémica o el ateroembolismo16–18 o, lo que es o mismo, grados IIB, III y IV de Fontaine.
Otro importante campo de actuación, más novedosa, surge en el tratamiento de las isquemias agudas y subagudas por trombosis arterial aguda.
La angioplastia no está indicada en lesiones asintomáticas y la llamada angioplastia «profiláctica» no se justifica, pues en sí supone una agresión contra la pared arterial19.
Indicaciones morfológicasHan existido varias clasificaciones según el sector afecto, la morfología de la lesión y la sociedad científica que las ha publicado.
Entre los primeros que intentaron establecer estas clasificaciones debemos destacar la SCVIR (Society of Cardiovascular Interventional Radiology of North America)20–25. Ellos catalogaron las lesiones en categorías que citaremos brevemente, pues ya no se aplica.
- -
Categoría 1: son lesiones en las que la angioplastia provoca un alivio completo de los síntomas, normalizándose los gradientes de presión, con un alto porcentaje de éxitos técnicos, por lo que los procedimientos endovasculares son los de elección.
- -
Categoría 2: su tratamiento puede dar lugar a un alivio completo de los síntomas o una mejoría sustancial, así como mejoría de los gradientes de presión y de los pulsos. También incluyen lesiones en las que el tratamiento endovascular precede al tratamiento quirúrgico de otras zonas (angioplastia transluminal percutánea [ATP]-stent iliofemoral+derivación femoropoplítea). Por ello son lesiones con buena indicación para tratamiento endovascular.
- -
Categoría 3: lesiones que aunque técnicamente pueden ser tratadas de forma endovascular, la localización, extensión o gravedad de la enfermedad, la probabilidad de éxito inicial y/o el beneficio a largo plazo son menores que si se trataran de forma quirúrgica convencional. Normalmente el tratamiento endovascular se reserva a casos de riesgo quirúrgico alto o no disponibilidad de material autólogo para el by-pass.
- -
Categoría 4: lesiones muy extensas, cuyo tratamiento percutáneo tiene una probabilidad muy baja de éxito técnico y permeabilidad a largo plazo. No indicación de tratamiento endovascular. Cirugía convencional de entrada.
Según el segmento afecto, diferenciaban:
- 1.
Aorta infrarrenal:
- -
Categoría 1: estenosis < 2cm de longitud con mínima aterosclerosis en el resto de la aorta.
- -
Categoría 2: estenosis de 2-4cm de longitud con moderada aterosclerosis del resto de la aorta.
- -
Categoría 3: estenosis > 4cm de longitud o de 2-4cm con aterosclerosis avanzada de la aorta o bien cualquier lesión estenosante que haya provocado ateroembolismo (síndrome de dedos azules).
- -
Categoría 4: estenosis u oclusión asociada a aneurisma de aorta abdominal.
- -
- 2.
Iliaca:
- -
Categoría 1: estenosis < 3cm de longitud, concéntrica y no calcificada.
- -
Categoría 2: estenosis entre 3-5cm de longitud o bien estenosis < 3cm excéntrica o calcificada.
- -
Categoría 3: estenosis entre 5-10cm, o bien oclusión < 5cm.
- -
Categoría 4: estenosis > 10cm de longitud u oclusión > 5cm o aterosclerosis extensa aortoiliaca bilateral o estenosis iliaca asociada a aneurisma de aorta abdominal.
- -
Sin embargo, actualmente utilizamos otra clasificación conocida universalmente, el TASC.
En el año 2000 se publica el TASC26 sobre el tratamiento de la enfermedad arterial periférica, fruto de la cooperación entre 14 sociedades científicas médicas y quirúrgicas vasculares, cardiovasculares, radiólogos vasculares y cardiólogos que realizan una categorización de las lesiones en tipos A, B, C y D según el tratamiento revascularizador indicado (quirúrgico o endovascular).
Así, en las lesiones tipo A, el tratamiento de elección es el endovascular, mientras en las lesiones tipo D se indicará tratamiento quirúrgico en principio. Las tipo B y C se pueden tratar indistintamente, aunque las B son más proclives al tratamiento endovascular y las C más quirúrgicas. Desde su publicación, las técnicas y dispositivos han evolucionado y mejorado los resultados del tratamiento endovascular, por lo que en el año 2004 se inicia la elaboración de un nuevo consenso que se ha publicado en enero de 2007, el TASC II27. Este nuevo trabajo se ha realizado bajo las directrices de 16 sociedades científicas y basado en niveles de evidencia científica. Es más resumido que su predecesor e incorpora las mejoras técnicas surgidas desde el año 2000, por lo que nos referiremos a esta última puesta al día. Quisiera recalcar la siguiente recomendación de este consenso: «Recomendación 35: Elección entre técnicas con resultados equivalentes a corto y largo plazo: En las situaciones donde la revascularización endovascular o quirúrgica de una lesión específica causante de síntomas de isquemia crónica sean equivalentes en la mejoría clínica a corto y largo plazo, debemos optar por el tratamiento endovascular en primer lugar».
Indicaciones por categorías (TASC II)Aunque la estratificación específica de las lesiones ha sido modificada respecto al TASC original, los principios básicos de tratamiento según tipos A, B, C y D son las mismas.
Recomendación 36: Tratamiento de las lesiones aortoiliacas.
Lesiones TASC tipo A y D: La terapia endovascular será el tratamiento de elección para lesiones tipo A y la cirugía el tratamiento de elección de las lesiones tipo D.
Lesiones TASC tipo B y C: El tratamiento endovascular será el preferido en lesiones tipo B y la cirugía el preferido para lesiones tipo C en pacientes con bajo riesgo quirúrgico. Los factores de riesgo asociados, las preferencias del paciente correctamente informado y los resultados a largo plazo del grupo deberán ser considerados a la hora de decidir el tipo de tratamiento aplicado en lesiones tipo B y C.
Indicaciones por segmentos (TASC II)La asignación de lesiones en categorías según las características morfológicas de las lesiones a tratar sí han sufrido cambios respecto al consenso previo.
- -
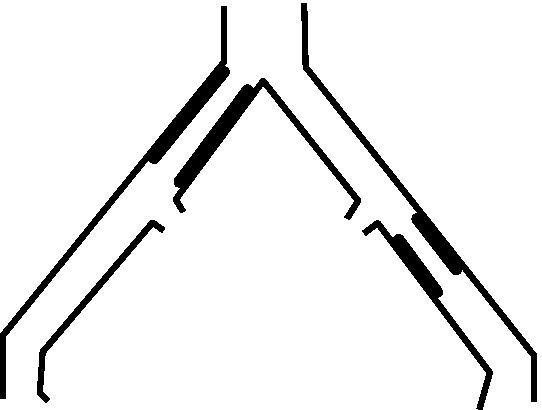
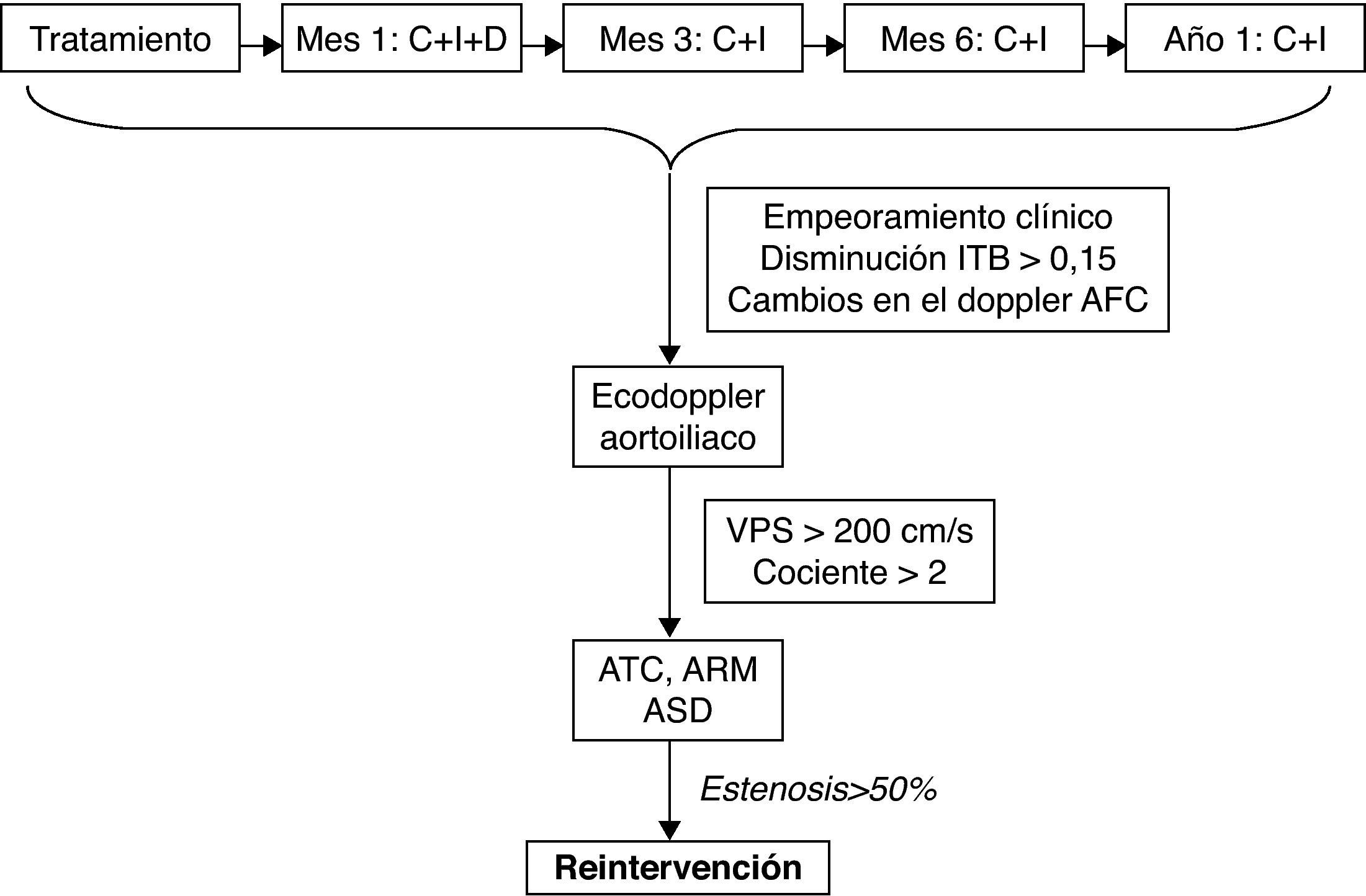
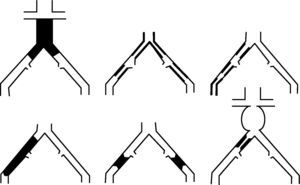
Lesiones tipo A: estenosis unilateral o bilateral de arteria iliaca común (AIC). Estenosis cortas (≤ 3cm) unilaterales o bilaterales de arteria iliaca externa (AIE) (fig. 1).
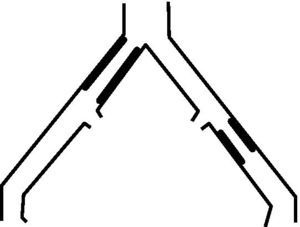
- -
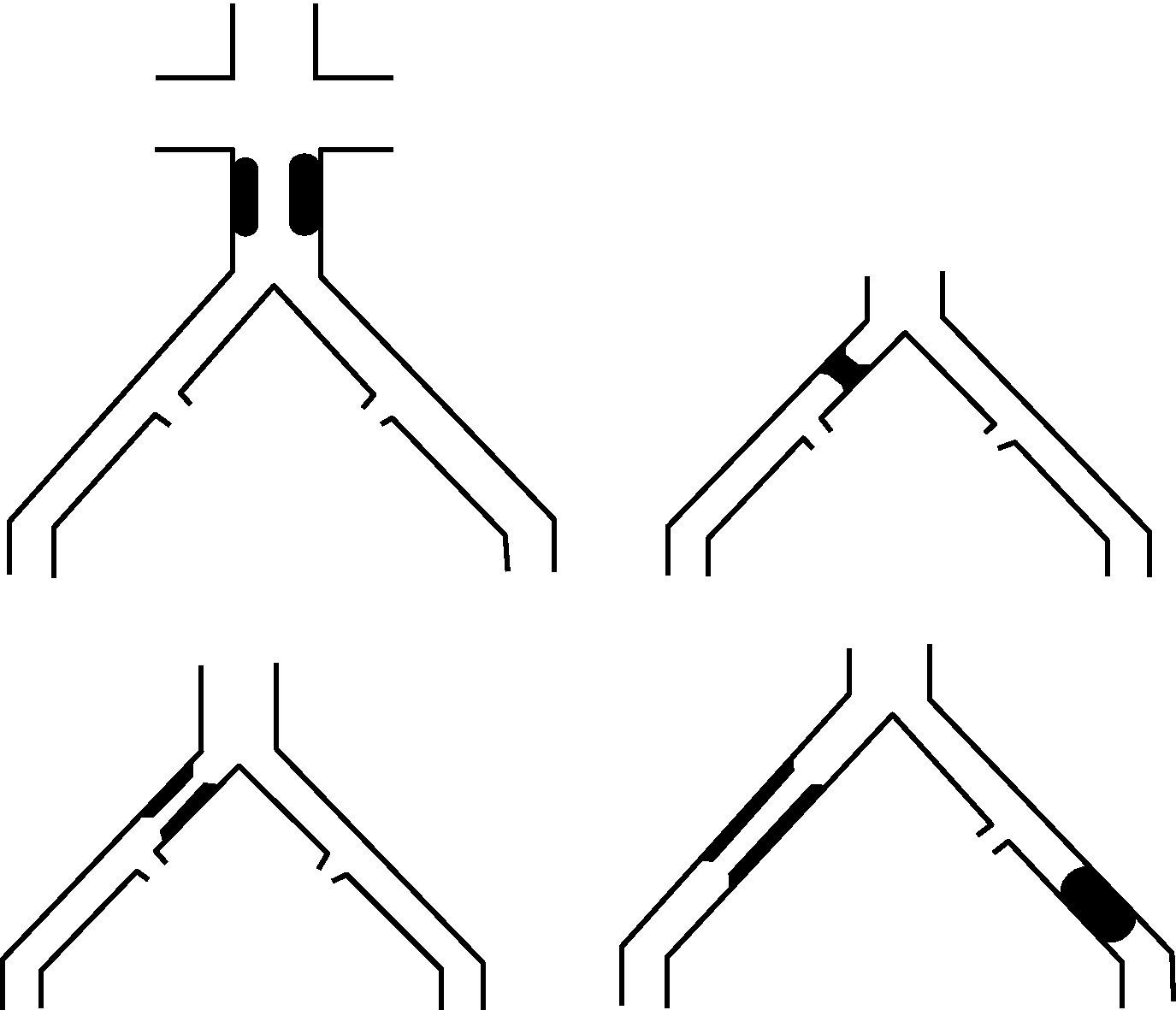
Lesiones tipo B: estenosis corta (≤ 3cm) de aorta infrarrenal. Oclusión unilateral de AIC. Estenosis única o múltiple de 3-10cm de AIE sin afectar arteria femoral común (AFC). Oclusión unilateral de AIE sin afectar el origen de la AII ni AFC (fig. 2).
- -
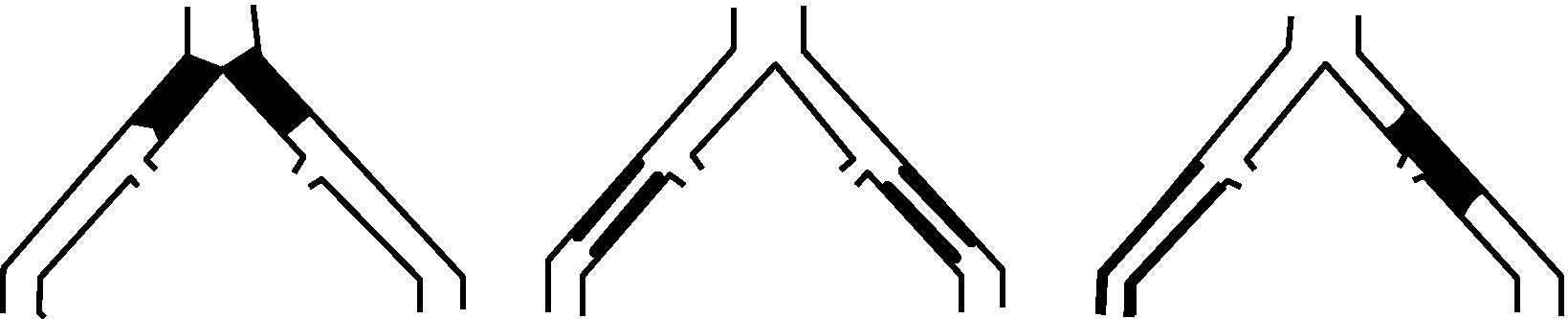
Lesiones tipo C: oclusión bilateral de AIC. Estenosis bilateral de AIE entre 3-10cm sin afectar la AFC. Estenosis unilateral AIE con afectación AFC. Oclusión unilateral AIE que afecta origen de la AII y/o AFC. Oclusión unilateral AIE fuertemente calcificada con o sin afectación del origen de la AII y/o AFC (fig. 3).
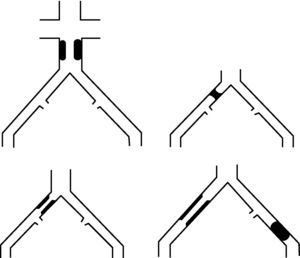
- -
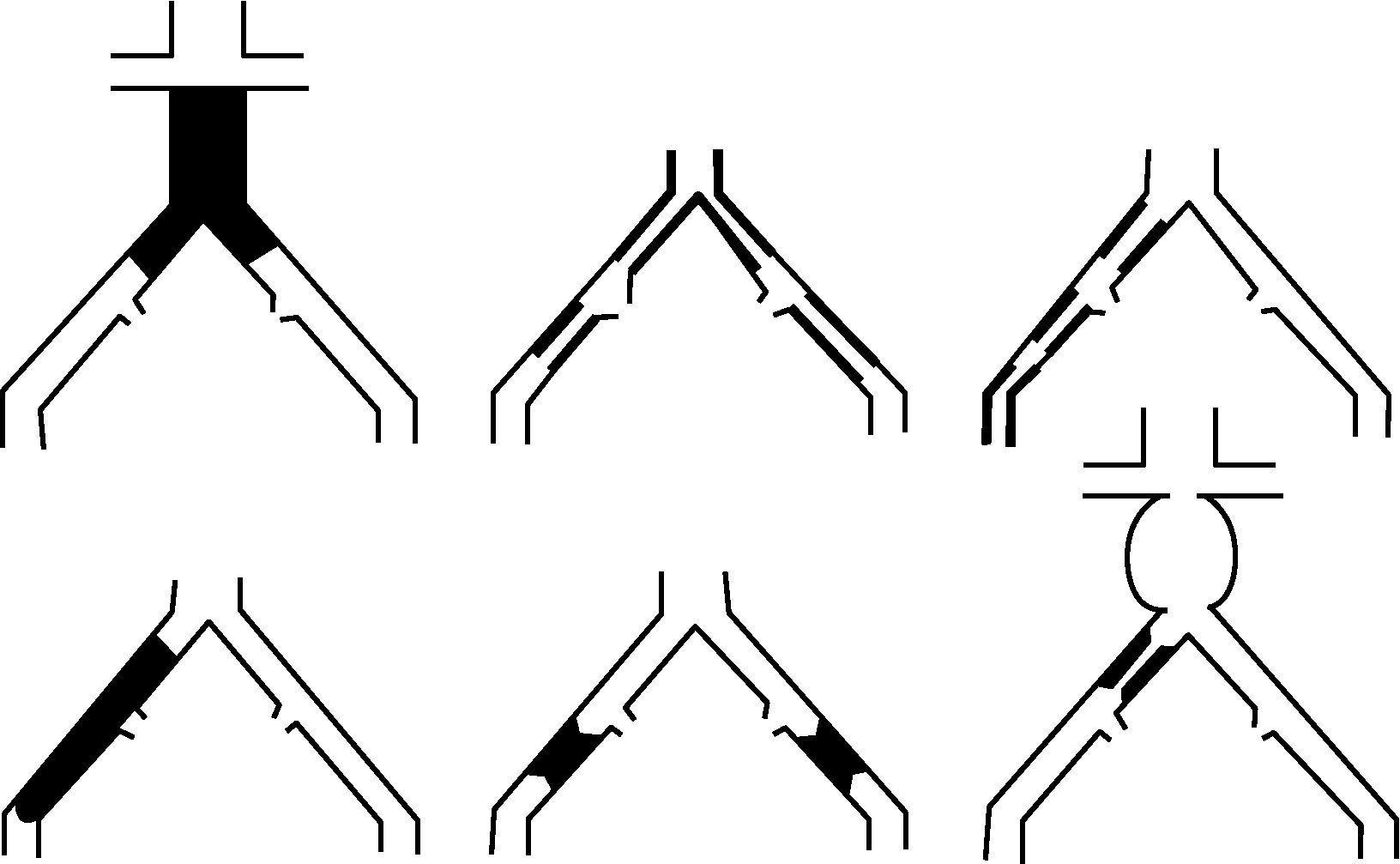
Lesiones tipo D: oclusión aorta infrarrenal. Enfermedad difusa que afecta aorta y ambas AIC. Estenosis difusas unilaterales que afectan AIC, AIE y AFC. Oclusión unilateral de AIC y AIE. Oclusión bilateral de ambas AIE. Estenosis iliaca junto a aneurisma de aorta abdominal (AAA) que precisa cirugía abierta (fig. 4).
El implante de prótesis intraluminales, como elementos que mantienen la permeabilidad de la arteria tras la dilatación (evitando el rebote elástico o re-coil, o bien la restenosis por hiperplasia intimal o progresión de la enfermedad arteriosclerosa), se inicia a finales de los sesenta, también por Charles Dotter, al colocar dichos dispositivos en las arterias femorales y poplíteas de perros28.
La utilización de stents se puede realizar de forma primaria o bien selectivamente tras ATP no satisfactoria.
Implante de stent selectivo tras angioplastia transluminal percutáneaEn aquellos casos en los que se produzca una disección, un flap intimal, permanezca una estenosis residual morfológicamente superior al 30% o bien un gradiente de presión superior a 10mmHg, y en los casos de recanalización de una oclusión en sector iliaco, la implantación de stent es mandatoria29.
Implantación primaria de stentEn términos generales, la ATP simple del sector iliaco de lesiones seleccionadas ofrece unos resultados excelentes, por lo que algunos autores se postulan en contra de la utilización primaria del stent30. Sin embargo, existen determinadas situaciones en las que la implantación primaria del stent mejora los resultados de la ATP, por lo que recomendamos su utilización en los siguientes casos:
- 1.
Tratamiento de lesiones complejas: lesiones difusas-largas de iliaca común y/o iliaca externa, lesiones calcificadas y/o excéntricas, lesiones ulceradas (para minimizar la posible embolización distal).
- 2.
Tratamiento de lesiones oclusivas: la recanalización iliaca precedida o no de tratamiento fibrinolítico.
Según el mecanismo de liberación, los stents pueden ser expandibles por balón o autoexpandibles. Según el material de composición pueden ser de acero, nitinol, etc. Cada tipo tiene unas características propias y así los balón-expandibles tienen más fuerza radial y su colocación es más precisa, por lo que recomendamos su uso a nivel aórtico, bifurcación aórtica y AIC. Los autoexpandibles presentan menores perfiles, son más flexibles, por lo tanto más navegables, y se adaptan mejor a anatomías tortuosas, a diferentes diámetros de arteria, por lo que recomendamos su uso en lesiones extensas (AIC-AIE), AIE y en casos de stenting contralateral.
Indicación de implantación de prótesis intraluminales recubiertasEl uso de prótesis intraluminales recubiertas (endoprótesis recubiertas) se inicia en 1986 con Volodos31, que utilizó la combinación de un injerto de Dacron asociado a un Z-stent para tratar una oclusión larga en el sector iliaco.
Posteriormente, el trabajo de Parodi32 sobre el tratamiento de AAA mediante endoprótesis revolucionó la cirugía endovascular.
Hay muy pocos trabajos publicados sobre el uso de stent recubierto o endoprótesis a nivel aortoiliaco y estos se basan sobre todo en la corrección de las complicaciones de la terapia endovascular, como roturas o disecciones, asi como en el tratamiento de fístulas arteriovenosas. En el campo de la patología obliterante parece interesante el planteamiento del grupo de Valladolid33, que postula su uso en pacientes jóvenes en los que la ATP-stent iliofemoral puede ser insuficiente a largo plazo por la hiperplasia.
Otra posible indicación surge en las recanalizaciones complejas con o sin fibrinólisis previa, ya que ayudaría a evitar posibles ateroembolismos.
El uso de stents liberadores de fármacos es otra novedosa evolución de la terapia endovascular, aunque en estos momentos su uso se limita al territorio coronario y estudios clínicos sobre todo a nivel femoropoplíteo.
Indicación de tratamiento fibrinolíticoPodemos establecer 4 situaciones en las que utilizar fibrinólisis previamente a la realización de una ATP, implante de stent o una endopróresis recubierta aortoiliaca:
- 1.
Trombosis arterial aguda.
- 2.
Trombosis de injerto, dentro de los primeros 15 dias.
- 3.
Tratamiento de las complicaciones de la terapia endovascular, como trombosis aguda post-ATP o embolizaciones distales.
- 4.
Oclusiones crónicas: su indicación es más discutida, aunque trabajos como el STILE18 o el TOPAS34 dieron pie a la creación de un grupo interdisciplinario que publicó un consenso en 199835.
En términos generales, recomendamos el tratamiento fibrinolítico como tratamiento inicial en las situaciones 1, 2 y 3. En caso de oclusiones crónicas si sospechamos trombosis en los últimos 15-30 días se puede iniciar fibrinólisis previa a la implantación de stent o prótesis recubierta. Si la oclusión es más antigua es mejor recanalización directa sin fibrinólisis previa.
Otras terapias endovasculares en el tratamiento de la isquemia aguda como la trombectomía percutánea por aspiración (PAT) o la trombectomía percutánea mecánica (PMT) se han utilizado conjuntamente con la fibrinólisis para acortar el tiempo y dosis de la terapia fibrinolítica36.
Procedimientos de recanalización del sector aortoiliacoLa angioplastia en el territorio iliaco se ha estandarizado como el tratamiento de elección. Sus resultados han mejorado con la introducción de los stents a la vez que se ha producido una disminución en la tasa de complicaciones.
El procedimiento suele llevarse a cabo bajo anestesia local, infiltrando sobre el sitio de punción; en algún caso extremo puede ser necesaria una sedación y, en los casos de cirugía combinada, puede ser necesaria la práctica de una anestesia locorregional.
Se recomienda la heparinización a dosis completas durante el procedimiento y posteriormente, especialmente si se va a realizar cirugía asociada, proceder a neutralización con sulfato de protamina. Igualmente, es aconsejable la utilización de sueros heparinizados presurizados conectados a las vías laterales de los introductores para evitar la formación de trombo in situ y pericatéter37,38.
Durante el procedimiento el paciente debe estar antiagregado y mantener esta situación de por vida. Las pautas más actuales aconsejan que ésta se lleve a cabo con ácido acetilsalicílico (AAS) y clopidogrel durante 3-6 meses y posteriormente continuar con uno de los dos.
Las lesiones muy cerradas, la presencia de fibrosis por cicatrices previas y la obesidad pueden dificultar la palpación del pulso y hacer necesaria la ayuda de un ecodoppler, agujas-doppler para guiar la punción o de un pequeño abordaje quirúrgico.
El paso previo en cualquier técnica percutánea, al igual que en la cirugía abierta, es obtener el consentimiento informado del paciente.
Es importante revisar todo el material necesario, guías, catéteres, balones, stents, etc., y estar seguro de que podemos hacer frente a las posibles complicaciones. El conocimiento de los materiales es decisivo para alcanzar el éxito del procedimiento. Una ligera variación de la flexibilidad de una guía o en el extremo distal de un catéter puede convertir un procedimiento complejo en sencillo o viceversa. El conocimiento correcto de los materiales y la selección de los mismos conlleva ahorro de material y del tiempo de utilización del quirófano, el abaratamiento de costes y menor tiempo de exposición a los rayos X.
El paciente debe estar monitorizado con control electrocardiográfico constante, tensión arterial, saturación de oxígeno y pulso.
El equipo de angiografía debe ser de la mayor calidad posible y manejado por un técnico lo suficientemente entrenado. Debe seleccionarse la mejor proyección radiológica39.
Arterias por tratar: aorta, AIC, AIE.
Material necesario40:
- -
Sistema de punción tipo Abocath™ del número 16 constituido por una vaina plástica tubular soportada en una aguja.
- -
Jeringuilla anillada con loek-luck.
- -
Introductor: cortos de 5F a 10 French de grosor dependiendo de los dispositivos que se van a utilizar (3,3mm); largos para realizar procedimientos en arterias contralaterales.
- -
Guías: de negociado: hidrofílica o similar con punta recta o «J» de 0,035” para paso de lesiones oclusivas y estenóticas respectivamente; de trabajo: rígida de 0,035” dará más soporte para paso de dispositivos.
- -
Catéteres diagnósticos para navegación, paso de la lesión a tratar e intercambio de guías. Preferentemente de 4F y luz de 0,38. Tipo multipropósito recto o con angulación distal RDC1 o UF (abordaje contralateral). Tipo pig-tail centimetrado para medición de las lesiones.
- -
Catéteres guía pueden utilizarse por preferencia del cirujano y sustituirán al introductor en la realización del procedimiento.
- -
Arco de angiografía.
- -
Contraste radiológico.
La AFC ipsilateral sería la puerta de entrada de elección en la mayoría de los casos entre los que se incluirían el abordaje endovascular del eje iliaco, sin lesiones significativas en AIE, y aorta abdominal41. En algún caso es posible o recomendable el tratamiento desde el lado contralateral para tratamiento de lesiones de AIE o AIC distal.
Detección de la arteria por puncionar- -
Por tacto de la pulsatilidad con los dedos de la mano izquierda en los zurdos y puncionando con la derecha.
- -
Punción ecoguiada utilizando un ecógrafo o ecodoppler para localizar la arteria.
- -
Se puede realizar el acceso arterial por referencias óseas en escopia.
- -
Local con bolos de suero heparinizado (heparina 50mg en 500ml de suero).
- -
Sistémica a dosis de 1mg/kg de peso corporal.
- -
Ambos procedimientos se pueden complementar entre sí.
- 1.
Se punciona la arteria femoral con sistema de punción tipo Abocath™ a nivel del pliegue inguinal o 1cm distal al mismo en el lugar de la pulsación, introduciendo todo el sistema de punción y retirándolo lentamente hasta que aparezca sangre pulsátil y roja, se retira al aguja metálica y se introduce la guía en «J» proporcionada en el kit del introductor. Se extrae Abocath™ y se introduce el introductor seleccionado.
- 2.
Se retira el sistema de punción (vaina de Abocath™) y sobre la guía en «J» se coloca el introductor, retirándose posteriormente el dilatador y heparinizando la luz del mismo y la arteria a la vez que se comprueba que retorna sangre. En este momento se realiza la heparinización general.
- 3.
Se introduce el cáteter seleccionado para paso de la lesión o abordaje contralateral si fuese preciso, se retira la guía del kit de punción y se introduce a través del catéter una guía hidrofílica de negociado para navegación hasta la lesión y recanalización de la misma bajo fluoroscopia; puede ser de ayuda el uso de «road map». Una vez pasada la guía se pasa el catéter y se comprueba su ubicación intraluminal (reflujo sangre en catéter e inyección de contraste comprobando un correcto posicionamiento).
- 4.
Una vez recanalizada la lesión se retira la guía de negociado y se pasa a una guía de trabajo de mayor soporte. Posteriormente se cambia a introductor de trabajo en función del stent que se pretende utilizar.
- 5.
Se introduce un catéter balón si se realiza una ATP previa al implante de stent (recomendable en uso de stent autoexpandible). Posteriormente se realiza implante de stent o stent recubierto autoexpandible o expandible con balón en función de la elección realizada. Si el stent es autoexpandible se recomienda ATP de remodelado.
- 6.
Se retira catéter portador del stent.
- 7.
Se realiza angiograma, generalmente desde introductor en sector iliaco o con catéter en aorta abdominal.
- 8.
Se retira el sistema de introductor y se realiza compresión por lo menos durante 10 minutos. También existe la posibilidad de realizar la hemostasia del vaso utilizando un sistema de cierre por dispositivo específico tipo Perclose o similar.
La variante de acceso quirúrgico al vaso es por punción arterial una vez disecada o de forma directa previa arteriotomía si está justificada por el tipo de patología que requiere cirugía convencional complementaria43,44.
Vías de abordaje- 1.
Abordaje femoral ipsilateral: es el de elección por ser el más directo y con el que más fácilmente se atraviesa la lesión. Es la vía más utilizada y por lo tanto la primera que debemos dominar a la hora de llevar a cabo una revascularización aortoiliaca. Se utilizará si la AIE ipsilateral no presenta lesiones significativas en su tercio medio-distal. Se realizará abordaje quirúrgico si se indica un procedimiento híbrido.
- 2.
Abordaje femoral contralateral: de elección en revascularización de sector iliaco con lesiones graves en AIE y de AIC distal. Precisa la utilización de un catéter curvo (RDC1, UF o similar) que situamos en el origen de la AIC contralateral y por el que pasamos la guía de negociado para paso de la lesión, sobre ésta el catéter y posteriormente se realiza intercambio a guía de trabajo. En ocasiones la guía puede llegar a femoral común y tomarla como referencia para una nueva punción del lado de la lesión. Está técnica de doble punción suele hacerse para la técnica de kissing balloon.
- 3.
Abordaje braquial: tiene la desventaja de estar alejado de la zona iliaca y tener que trabajar con material más largo y una teórica menor precisión. El menor tamaño de la arteria humeral aumenta el riesgo de complicaciones locales. Se indica en recanalización de lesiones que afectan a origen de AIC, lesiones complejas sobre todo oclusivas que no se consiguen recanalizar mediante abordaje femoral o cualquier tipo de lesión iliaca si es la preferencia del cirujano.
- 4.
Abordaje axilar: a pesar de ser un acceso muy directo y anterógrado, el principal inconveniente es la ausencia de plano óseo eficaz debajo de la arteria, por lo que la compresión posprocedimiento es dificultosa. Tanto el braquial como el axilar tienen indicaciones similares.
Se realiza inyectando bolos de contraste angiográfico por tres posibles sistemas45,46:
- 1.
Inyección mediante bomba de inyección previa colocación de un catéter tipo pig-tail o similar: se utilizarán unos 30ml de contraste a un flujo de 15ml/segundo.
- 2.
De forma retrógrada por la inyección del bolo de contraste de forma manual o por bomba a través del introductor femoral: se precisa un volumen de 10-20ml a 5-10ml/seg.
- 3.
De forma anterógrada por la inyección del bolo de contraste de forma manual o por bomba a través del introductor: se precisa un volumen de 10-20ml a 5-10ml/seg. Se realiza cuando se utiliza un introductor femoral contralateral o un introductor largo desde arteria humeral-axilar.
Se puede utilizar la técnica del road-mapping para facilitar la recanalización de la lesión y el tratamiento de la misma.
ModalidadesTécnica de la angioplastiaSe introduce un catéter-balón de diámetro y longitud seleccionado de acuerdo con el diámetro de la luz del vaso en un sector no patológico y de longitud ligeramente superior a la de la lesión a tratar. Se sitúa el balón en la zona estenótica/oclusiva teniendo como referencia las marcas radioopacas proximal y distal del mismo. Para su correcto posicionamiento se pueden utilizar marcas óseas, reglas centrimetradas o road-map. Posteriormente se hincha el balón, utilizando el manómetro, hasta el alcance de la presión nominal del dispositivo. El inflado será progresivo y lento, con una duración que dependerá del tipo de ATP realizada, si es terapéutica se realizará durante 1-3 minutos y podrá repetirse en función del resultado47, si es preimplante de stent la duración podrá ser menor.
Colocación de stentUna vez seleccionado el adecuado al tipo de lesión, se desplaza tomando como soporte la guía hasta el lugar de su implante.
Stent balón expandiblesSe realiza el hinchado del balón hasta presión nominal efectiva para suelta de stent y que deberá realizarse en escopia para objetivar su correcto despliegue; posteriormente se vacía el balón y se comprueba el correcto posicionamiento del stent. Si es preciso se pueden realizar hinchados complementarios a la misma presión. La retirada del catéter balón deberá realizarse bajo fluoroscopia para evitar movilización involuntaria del dispositivo.
Stents autoexpandiblesSe recomienda realizar una ATP previa a la suelta del stent, posteriormente se desplaza el dispositivo sobre la guía rígida hasta el lugar de la lesión y se realiza el implante del stent.
Todos los dispositivos de este tipo tienen su principio técnico de liberación en el desplazamiento de una vaina sobre un vástago que libera el stent autoexpandible. A veces antes de desplazar la vaina hay que retirar algún tipo de seguro. En ocasiones la liberación se realiza mediante un sistema de rueda que se gira de acuerdo a las especificaciones del dispositivo48.
Colocación de endoprótesisEn algunos casos ya sea por la morfología de la lesión o en el caso de alguna complicación tanto a nivel iliaco como de la aorta terminal, es preciso el implante de un stent cubierto. Existen stents recubiertos balón expandibles y autoexpandibles como la endoprótesis Wallgraft de Boston Scientific, las Hemobahn® y Viabahn® de Gore y todas las disponibles para el tratamiento de los aneurismas. El sistema de aplicación se basa generalmente en la liberación por el desplazamiento de una vaina que libera el sistema autoexpandible, salvo en el caso de las endoprótesis Hemobahn® y Viabahn®, en que se libera por la tracción de un hilo.
Tratamiento de lesiones contralateralesSe punciona la arteria femoral contralateral, se introduce una guía hidrofílica «J» negociando su paso al eje iliaco contralateral utilizando un catéter diagnóstico adecuado (RDC1, UF o J-Curve); una vez recanalizada la lesión se pasa sobre la guía el catéter utilizado para el paso de la bifurcación iliaca y si no es posible se realiza un intercambio a un catéter multipropósito convencional o hidrofílico; posteriormente se realiza intercambio a guía de trabajo de alto soporte. Se retira el catéter y se intercambia el introductor a uno largo (diseño contralateral o multipropósito) y se avanza hasta su ubicación lo más proximal a la lesión posible y a través del mismo se realiza el tratamiento con los dispositivos adecuados49.
El problema principal desde el punto de vista técnico se centra en la posibilidad de dificultad de paso del eje iliaco al contralateral si existe una angulación importante en la confluencia aortobiiliaca y que puede dificultar el paso de los dispositivos tipo stent con menor flexibilidad (expandibles con balón); para esto se tendrá que trabajar con una guía de alto soporte y utilizar el introductor adecuado con la punta distal del mismo lo más alejada de la bifurcación que sea posible.
Stenting primario (protegido)La ventaja del stenting primario es que limita el riesgo de una disección post-ATP y una posible embolia distal. La ventaja del stenting protegido es que se evita la posibilidad de que el stent roce o choque sobre una placa ateromatosa calcificada50.
- 1.
Colocación de un introductor largo con punta radioopaca. Inyección de contraste y realización de un road-mapping.
- 2.
Atravesar la lesión usando una guía de 0,035”.
- 3.
Predilatación usando un balón de perfil bajo (3-4mm) y de longitud adaptada a la lesión. El objetivo de la predilatación es hacer posible el avance del stent a la vez que limitar el riesgo de una embolismo distal.
- 4.
Avance del introductor (con dilatador) a través de la lesión (véase aquí la ventaja del uso de una punta opaca para seguir su progresión). Seguidamente se retira el dilatador.
- 5.
Avance del stent protegido por el introductor y situarlo en la zona de la lesión.
- 6.
Retirar el introductor.
- 7.
Despliegue del stent.
- 8.
Control final de imagen posprocedimiento.
- 1.
Punción arterial femoral ipsilateral/contralateral o en miembro superior. Colocación del introductor de longitud adecuada en función del acceso. Arteriografía pretratamiento.
- 2.
Guía y catéter se dirigen hacia la lesión y se procede a su recanalización. Sobre la guía se pasa el catéter y se realiza intercambio a guía de alto soporte de longitud adecuada (0,035”).
- 3.
Predilatación mediante el uso de un catéter balón de bajo perfil y longitud adecuada a la lesión.
- 4.
Inserción del stent autoexpandible que deberá tener una longitud mayor a la del balón utilizado con anterioridad. Se realizará visualizando los marcadores radioopacos del stent y ajustándolo a los límites de la lesión («roadmap», marcas óseas o regla centrimetrada). Es aconsejable abrir el primer centímetro del stent después de que éste haya cruzado la lesión para una vez abierto recolocarlo con exactitud sobre la lesión mediante una leve tracción del catéter portador y luego completar el despliegue del stent lentamente.
- 5.
Puede ser necesario (pero no obligatorio) una ATP de remodelado del stent mediante la utilización de un catéter balón de diámetro conveniente y una longitud menor o igual al stent para limitar el riesgo de disección. Esta técnica se utiliza particularmente para lesiones calcificadas.
- 6.
Verificación final mediante inyección de contraste.
A nivel de arteria iliaca primitiva se puede realizar también colocación de stent balón-expandible, pero no se debe de realizar en arteria iliaca externa al tener menor flexibilidad y adaptabilidad51.
Tratamiento de las lesiones de la bifurcación aortobiiliacaInserción de stents balón expandibles bilaterales (Kissing Stenting Technique)52.
- 1.
Punción femoral retrógrada bilateral, colocación de introductores y retirada de los dilatadores, posibilidad de conexión de sueros de lavado. Identificación y localización de las lesiones mediante arteriografía desde los introductores.
- 2.
Atravesar las lesiones mediante el uso de un catéter multipropósito o vertebral y guía hidrofílica «J» o recta dejando las guías en posición intraaórtica. Deberá realizarse intercambio a guías de alto soporte. Se puede realizar arteriografía pretratamiento con catéter diagnóstico en posición aórtica.
- 3.
Predilatación de lesiones iliacas mediante el uso de balones de perfil bajo.
- 4.
Implante de stent balón expandible al mismo tiempo. Si se quiere por la morfología de la lesión proteger los stents se deberán atravesar las lesiones usando introductores con dilatadores que posteriomente se retiran.
- 5.
Inserción en la zona de la lesión de dos stents balón expandibles protegidos por introductores.
- 6.
Retirada de introductores hasta visualización de la marca proximal del stent fuera del mismo para evitar el inflado del balón dentro de la vaina.
- 7.
Despliegue de ambos stents simultáneamente. Es esencial verificar en el preoperatorio que el diámetro de la aorta es igual o mayor que el total de diámetros de los dos dispositivos usados. Si se utilizan stents autoexpandibles deberá iniciarse su despliegue en posición intraaórtica unos 10-20mm proximales al ostium de las AIC realizando una pequeña tracción del stent dejando entre 5-10mm de este en posición intraaórtica.
- 8.
Si se precisa implante de stent aórtico deberá realizarse antes del kissing-stent utilizando stent autoexpandible en aorta distal y balón expandible en aorta infrarrenal media y proximal preferentemente.
- 9.
Verificación final. Retirada de dispositivos. Compresión de la zona de punción.
Las complicaciones o eventos adversos son indicadores de la seguridad y eficacia de los procedimientos endovasculares. Las complicaciones mayores53 serán revisadas y utilizadas para estimar su incidencia con el objetivo de una mejora en la calidad de los procedimientos realizados54.
Clasificaremos los eventos adversos en relación con55,56:
- -
Punto de punción: acceso femoral, braquial, axilar: a) hematoma; b) oclusión; c) pseudoaneurisma; d) fístula arteriovenosa.
- -
Procedimiento revascularizador: angioplastia e implante de endoprótesis (stent): a) producida por guía, introductor o catéter a través del punto de punción: embolismo distal, disección arterial/conducto subintimal, inyección subintimal de contraste; b) lesión arterial anterior al implante del stent: perforación/ruptura, disección post-ATP, oclusión post-ATP, embolización distal; c) relacionadas con el implante del stent: disección, migración/malposición, extravasación, trombosis, embolización distal.
- -
Complicaciones sistémicas: a) nefropatía inducida por contraste; b) ateroembolismo; c) trombocitopenia inducida por la heparina; d) reacciones alérgicas; e) cardiopatía isquémica.
- -
Relacionados con los cierres percutáneos.
- -
Lesión en relación con la exposición radiológica.
La AFC es el de elección en los procedimientos diagnósticos/terapéuticos en este sector y la punción deberá realizarse en el tercio medio/distal de la cabeza femoral permitiendo una compresión óptima por debajo del ligamento inguinal posprocedimiento.
HematomaEl sangrado podrá producirse desde el acceso en la AFC, sus ramas o zonas de la arteria próximas al punto de punción. Tiene como factores predisponentes la compresión inefectiva, punción alta (AIE), calcificación importante, antiagregación/anticoagulación periprocedimiento y el uso de dispositivos de perfil alto. Su forma de presentación más grave es el hematoma retroperitoneal56,57, que deberá sospecharse ante una hipotensión, náuseas, dolor lumbar/abdominal y a la palpación sobre el ligamento inguinal. La TAC abdominopélvica que incluya región inguinal confirmará el diagnóstico56. El tratamiento se realizará con suspensión de medicación anticoagulante, reposición sanguínea y de volumen. En casos graves, abordaje quirúrgico para cierre o corrección de la lesión arterial o implante de stent recubierto mediante abordaje femoral contralateral. El drenaje del hematoma puede evitar lesión de nervio femoral por compresión56,57.
OclusiónCon una incidencia del 0,14%58, tiene como factores predisponentes la existencia de patología previa en la arteria, pequeño tamaño, punción alta, bajo gasto cardíaco y alteración de la coagulación59. Los mecanismos de oclusión son el desprendimiento de trombo pericatéter y la disección subintimal de placa aterosclerótica con la trombosis secundaria60. El diagnóstico se basará en la clínica, exploración física, ecodoppler y confirmación angiográfica. El tratamiento quirúrgico precisará arteriotomía, trombectomía con balón de Fogarty, endarterectomía de la placa y plastia de la femoral en la mayor parte de los casos.
PseudoaneurismasLa incidencia oscila entre 0,07-0,38%61,62. La anticoagulación, antecedente de hematoma con relevancia clínica, punción dificultosa con mala compresión, punciones bajas (arteria femoral superficial/profunda) han sido descritos como factores predisponentes61,63. La mayoría de los pseudoaneurismas de pequeño tamaño cierran espontáneamente. La presencia de masa inguinal pulsátil y la confirmación con la información de la morfología, permeabilidad y diámetro de cuello mediante ecodoppler completan el diagnóstico. El tratamiento se realizará con compresión ecoguiada64 o inyección de trombina65 y si no es efectiva se realizará tratamiento quirúrgico mediante pseudoaneurismectomía y plastia arterial.
Fístula arteriovenosaComplicación menos frecuente (0,01%) en procedimientos endovasculares58. Un antecedente de hematoma, la palpación de thrill, la auscultación de un soplo continuo y el ecodoppler confirmarán el diagnóstico. El tratamiento quirúrgico de ligadura de la fístula arteriovenosa (FAV) se reservará para las que no cierren espontáneamente o no respondan a la compresión ecoguiada.
La prevención de las complicaciones relacionadas con el acceso femoral se basan en una correcta evaluación clínica de la función cardíaca, estado de la coagulación, existencia de patología iliofemoral asociada, una buena técnica de punción apoyada en ecodoppler y «referencias óseas» en escopia para casos complejos, utilización de materiales de bajo perfil, y sistemas de cierre percutáneo66,67.
Acceso braquial-axilarOpción en caso de ingle «hostil» por cirugía, prótesis femoral, infección inguinal previa, obesidad importante, o en recanalizaciones aortoiliacas complejas. Las complicaciones son menos frecuentes, autolimitadas y raramente precisan tratamiento quirúrgico. La oclusión68, disfunción neurológica transitoria o permanente69, isquemia cerebrovascular70 y los hematomas con más frecuencia en el acceso axilar son las que tendremos que tener más en cuenta.
Complicaciones relacionadas con el procedimientoDisecciónEs una complicación común y puede ocurrir en varias fases del procedimiento como:
- -
Punción arterial incorrecta con el extremo distal de la aguja alojada en la capa media y la guía crea un plano de disección.
- -
Paso de guía y/o catéter diagnóstico en segmentos de arteria enferma o sana.
- -
Paso de guía y catéter en lesiones de alto grado «por debajo» de la placa creando un plano de disección.
- -
Con mayor frecuencia durante la angioplastia y el implante del stent. La predilatación de lesiones de alto grado generalmente ocasiona una pequeña disección, en la mayor parte de los casos autolimitada y sin consecuencias. En ocasiones se extenderá «en espiral», anterógradamente en la mayor parte de los casos, por lo que es importante realizar «control angiográfico» después de la angioplastia y antes del implante del stent. Durante el stenting pueden producirse disecciones por una lesión creada por el extremo proximal o distal del stent en la arteria sobre todo en los stents expandibles con balón o en los autoexpandibles en el remodelado del mismo al sobrepasar el hombro del balón el borde del stent y lesionar así la pared arterial.
- -
La inyección de contraste a alta presión desde el introductor localizado distal a una lesión tratada con angioplastia o stent.
Para evitar las disecciones se deberá «trabajar con precaución». Otros puntos a tener en cuenta son:
- -
Observar siempre el movimiento de guía y catéter bajo fluoroscopia. Si la guía no progresa, no forzar y manejar el floppy de la guía hasta que el paso se produzca con suavidad.
- -
No avanzar un catéter sin el apoyo de una guía.
- -
Uso de guías hidrofílicas, apoyadas sobre catéter, de punta «J» y rectas (Terumo, Boston Scientific), que son útiles para atravesar lesiones complejas pero tienen facilidad para provocar disecciones, por lo es preciso utilizar dispositivos de torque. Una vez recanalizada la lesión y sobre catéter de realiza intercambio a guía de trabajo de alto soporte.
- -
Visualizar la punta distal del introductor y evitar inyección de contraste muy próxima a lesión tratada.
- -
Utilizar buena fluoroscopia y «road mapping» para recanalizar lesiones complejas.
- -
Uso de balones de predilatación de pequeño tamaño, generalmente de 4-5mm en lesiones complejas para facilitar el paso de dispositivos.
- -
Elección de diámetros y longitudes de balón/stent ajustados a la lesión de la arteria a tratar.
- -
Realizar una remodelación del stent, sobre todo en los autoexpandibles, evitando zonas de arteria no cubiertas por el stent y a baja presión.
- -
Los pacientes en hemodiálisis tienen mayor tendencia a la disección y alto grado de calcificación, por lo que la realización del procedimiento será meticulosa.
Cuando se origina una disección es importante determinar la localización y la extensión de la lesión pero nunca deberemos perder la guía que atraviesa la lesión, avanzaremos el introductor o el catéter diagnóstico para realizar un control arteriográfico por encima de la lesión y posteriormente en aorta, AIC y AIE se realiza implante de stent en función del tamaño del vaso. En lesiones de AFC se puede realizar una angioplastia durante1-2 minutos previa a la decisión de implante de stent si la punción es alta O abordaje quirúrgico para corrección de la lesión en la mayor parte de los casos.
Si se pierde la guía o la disección se produce con el manejo de la guía o catéter anterior a la angioplastia/stent deberemos recanalizar la luz verdadera desde el punto de punción o mediante acceso contralateral, siendo en estas situaciones de gran utilidad el «road mapping»; una vez asegurado el paso de la lesión se realizará un «stenting directo».
Si la disección se produce tras el implante del stent de procederá a implante de stent coaxial preferentemente autoexpandible.
Pequeñas disecciones originadas retrógradamente lejos de la lesión a tratar o en procedimientos diagnósticos si se comprueba buen flujo a canalizar la luz verdadera se sellan de manera espontánea y no precisan tratamiento.
ExtravasaciónSe origina la producirse la ruptura de las tres capas de la pared arterial y es potencialmente mortal, para evitarla deberemos tener en cuenta los puntos reflejados en el apartado de la disección.
En su tratamiento se utilizarán stents recubiertos de 7-14mm de diámetro disponibles en el mercado como Hemobahn/Viabahn (W.L. Gore), Wallgraft (Boston Scientific) o Fluency (C.R. Bard).
Una vez detectada la ruptura no deberemos perder la guía de trabajo y en caso de ser la extravasación importante y mientras se prepara el stent recubierto se puede proceder al inflado de un balón de angioplastia proximal a la lesión para control del sangrado, posteriomente se cubre la ruptura con un stent recubierto con margen suficiente proximal y distal. En caso de no ser posible técnicamente se realizará cirugía abierta.
Si la extravasación se produce en ramas de aorta, iliacas o femorales se puede proceder a embolización con coils o micro-coils fibrados, precisando previamente una buena imagen diagnóstica del sangrado del vaso, cateterización selectiva con catéter (4F) o microcatéter (2,2-3F) y embolización con coils ajustados al tamaño del vaso que tratar.
Migración del stentSu incidencia ha disminuido con la utilización de stents premontados sobre balón.
Puede producirse en las situaciones siguientes:
- -
Stents montados sobre balón por deslizamiento del stent sobre el catéter balón de angioplastia, en particular si el recubrimiento es hidrofílico.
- -
Suelta inadvertida de parte del stent dentro del introductor y tracción posterior del catéter portador.
- -
En el tratamiento de lesiones calcificadas no predilatadas efectivamente.
- -
Utilización de stent de diámetro menor al vaso tratar.
Para evitar esta complicación deberemos:
- -
Utilizar stents premontados o montados sobre balón con catéteres de bajo perfil.
- -
No aspirar el catéter balón en stent premontado antes de su avance por el introductor.
- -
«Bañar» balón y stent en medio de contraste.
- -
Uso de introductores largos de 25cm con el objetivo de pasar la lesión y una vez colocado stent en posición retirar el introductor y completar el despliegue del stent.
En el tratamiento utilizaremos diferentes estrategias en función de la localización del stent:
- -
Si el stent está parcialmente movilizado en el balón se puede desplegar el stent en la lesión y una vez apoyado en la arteria usar el mismo balón o mejor uno nuevo y posicionarlo el la zona de stent no abierta correctamente y dilatar este segmento.
- -
Si el stent está totalmente fuera del catéter balón, el problema es mayor, nunca se debe perder la guía de trabajo, y se deberá utilizar un balón de bajo perfil (3-4mm) con el fin de expandir el stent lo suficiente para el paso del balón propio del stent para expandirlo correctamente.
- -
Cuando el stent está fuera del catéter balón y la guía y está localizada en la iliaca se puede cambiar a un introductor mayor (9-11F), capturar con un lazo el stent, traccionar e introducirlo en el introductor. Otra opción es posicionar un nuevo stent de mayor longitud impactado el stent migrado en la pared de la arteria. Si el stent migra a AFC se realizará abordaje quirúrgico para su extracción.
- -
Si la migración se produce en un stent autoexpandible las opciones son más limitadas, teniendo que implantar stent coaxial generalmente proximal para fijarlo a la pared de la arteria.
Se pueden producir durante el implante del stent dos situaciones menos frecuentes:
- 1.
Ruptura del balón durante el implante de stent aórtico: se identifica al no aumentar la presión de inflado en el manómetro oal comprobar la existencia de sangre en la jeringuilla del balón al aspirar. Se debe cambiar con cuidado y bajo fluoroscopia el balón para expandir rápidamente el stent.
- 2.
Implante del stent en lugar incorrecto: puede ocurrir por deslizamiento inadvertido de un stent montado sobre balón, en lesiones calcificadas que no han sido previamente predilatadas o por fallo del operador al posicionar o desplegar el stent debiendo implantar nuevo stent coaxial que cubra la lesión a tratar.
Si se produce una oclusión inmediata las opciones de tratamiento son:
- -
Trombolisis mecánica con catéter: por punción percutánea o a través del introductor de trabajo, si es periprocedimiento se procede a la recanalización de la oclusión, paso de catéter en más de una ocasión si se precisa, se realiza control arteriográfico y posteriormente se decide tratamiento del defecto técnico con angioplastia o stent en la mayor parte de los casos, o con cirugía convencional sobre todo si la lesión es de salida a nivel femoral71,72.
- -
Trombolisis farmacológica preferentemente con urokinasa73. Se realizará un procedimiento percutáneo con recanalización de la oclusión, impregnación del trombo con 250.000-500.000 UI y perfusión transcatéter a ritmo de 4.000 UI/min entre 2-4h y posteriormente 2.000 UI/min, generalmente 24h, control arteriográfico y tratamiento de la lesión con angioplastia, stent o cirugía74.
- -
Trombectomía quirúrgica con catéter balón que se realizará preferentemente si la trombosis es periprocedimiento y el abordaje fue quirúrgico. Se puede utilizar contraste para llenado del balón y mejor control radiológico, una vez finalizada se realiza control arteriográfico para identificar la lesión, que se tratará con angioplastia o stent si la lesión es proximal o con cirugía si la lesión es distal.
Se define como el aumento del 25% de la creatinina basal o más de 0,5mg/dl en los tres días tras la administración de contraste intravenoso. Es una causa importante de fallo renal hospitalario y con significativa morbimortalidad en paciente con insuficiencia renal previa o neuropatía diabética75. El fallo renal agudo por contraste es generalmente no oligúrico y reversible.
Los factores predisponentes son: insuficiencia renal previa con creatinina > 1,5mg/dl, nefropatía diabética, insuficiencia cardiaca, deshidratación previa, altas dosis de contraste, uso de fármacos nefrotóxicos, múltiples inyecciones de contraste en < 72h, administración intraarterial, edad mayor de 60 años y existencia de mieloma múltiple76.
Medidas de protección y tratamiento son la hidratación con suero salino al 0,45% iv a 1-1,5ml/kg/h, iniciando 6-12h antes y continuando de 12-24h postratamiento77, uso de N-acetilcistina oral a dosis de 600mg c/24h78, utilización de contraste isoosmolar iodixanol (Visipaque®)79, el gadolinio80 y el dióxido de carbono (CO2)81, han demostrado ser menos nefrotóxicos en pacientes de alto riesgo.El uso de diuréticos no se recomienda en la prevención de nefropatía inducida por contraste.
AteroembolismoLa embolización de cristales de colesterol es una complicación poco reconocida pero con una importante morbimortalidad asociada. La arteriografía, los procedimientos endovasculares, la cirugía convencional, fármacos fibrinolíticos y anticoagulantes, la rigidez, diámetro y angulaciones en extremo distal de catéteres, la presión en la inyección de contraste son factores predisponentes82.
Cambios en la coloración de la piel como livedo reticularis, «síndrome de dedo azul», nódulos, ulceraciones y gangrena franca con pulsos distales en pie son sugestivos de ateroembolismo y se pueden producir inmediatamente o retrasarse semanas. Con la manipulación de la aorta yuxtasuprarrenal puede afectarse el riñón, que se manifiesta por hipertensión no controlada y rápidamente progresiva y fallo renal fatal.
El tratamiento tópico de las lesiones cutáneas, utilización de prostaglandinas, simpatectomía química y quirúrgica, exclusión quirúrgica o endovascular de la lesión arterial, y amputaciones son las alternativas terapéuticas.
Trombopenia inducida por la heparinaUn recuento menor de 150.000/UI o mayor del 50% del recuento plaquetario tras exposición a la heparina y ocurre en 5-10 día de tratamiento. La trombopenia inducida por la heparina (TIH) tipo II es la más grave con la formación de anticuerpos contra el complejo heparina-factor IV plaquetario. La incidencia del TIH tipo II es del 3-5% de pacientes expuestos a heparina, siendo más baja con el uso de heparinas de bajo peso molecular, sin embargo, en pacientes con historia de sospecha de TIH no deben ser utilizadas heparinas de bajo peso molecular83.
El tratamiento, además de la suspensión de la heparina, incluirá la administración como fármaco de elección de bivalirudin (Angiomax®), un inhibidor directo de la trombina en perfusión intravenosa en bolo 0,75mg/kg y 1,75mg/kg/h durante 4 horas después del procedimiento84.
Reacción alérgicaLos pacientes sometidos a procedimientos endovasculares pueden experimentar reacciones alérgicas a los anestésicos locales, contrastes, sulfato de protamina y al látex. Las reacciones alérgicas a anestésicos son menos frecuentes con el uso de nuevos fármacos como la lidocaína y bupivacaína85. Puede realizarse prueba cutánea en pacientes de riesgo antes del procedimiento.
La utilización de contrastes no iónicos ha disminuido la incidencia de reacciones al contraste y, de producirse, el tratamiento de elección es la utilización de bolus de 1ml de epinefrina diluida (1.10.000 ie, 0,1mg/ml) hasta mejoría del cuadro; en casos de antecedentes de reacciones alérgicas menores se puede premedicar con corticoides y antihistamínicos H1 y H2.La reacción alérgica a la protamina es poco frecuente pero el paciente diabético tratado con insulina NHP y con alergia al pescado tienen más riesgo de padecerlas86. La alergia al látex, que ha ido en aumento, se puede manifiestar con más frecuencia como una reacción de hipersensibidad retardada tipo IV o como un tipo I de reacción de hipersensibilidad inmediata causando anafilaxia y muerte87 y se tratará evitando el contacto en quirófanos específicos.
Cardiopatía isquémicaLa mayor parte de pacientes sometidos a procedimientos endovasculares en sector aortoiliaco tiene enfermedad coronaria asociada, siendo las complicaciones cardíacas las causas más importantes de morbimortalidad posprocedimiento.
Paciente con onda Q en electrocardiograma, diabetes mellitus, angina, historia de fallo cardíaco, edad mayor de 70 años y arritmia ventricular son predictores de infarto de miocardio88.
Complicaciones asociadas a sistemas de cierre percutáneoEl aumento del diámetro de los dispositivos de tratamiento percutáneo, protocolos más agresivos en el tratamiento antiagregante-anticoagulante, mayor número de procedimientos percutáneos y necesidad de acortar la estancia hospitalaria han desarrollado dispositivos de cierre percutáneo que tienen dos mecanismos fundamentalmente, por un lado el primer sistema desarrollado consiste en depósito de material reabsorbible sobre la arteria y en el trayecto del introductor (Angioseal, Vasoseal, Duett system), y por otro sistemas de cierre mecánico de la pared arterial utilizando suturas o clips (Perclose, X-press, Superstich).
Las complicaciones pueden ser las siguientes:
- -
Fallo de sistema de cierre: está relacionado con la no obtención de hemostasia en el punto de punción al no poder completar el proceso de cierre por dificultades técnicas siendo similares para ambos sistemas, 0-12%89,90, pero el dispositivo de cierre con sutura Perclose tiene como ventaja la posibilidad de comprobar la hemostasia antes de perder el acceso y si fuese necesario volver a reintroducir la guía y el introductor. El tratamiento de esta complicación es la conversión a la compresión manual y en casos que no fuese suficiente el cierre quirúrgico.
- -
Trombosis del vaso: complicación poco común con la compresión manual y más frecuente con los sistemas de cierre percutáneo, 1-1,4%91, siendo mayor con Angioseal. El tratamiento requerirá abordaje quirúrgico, trombectomía y plastia arterial.
- -
Infección: con una incidencia del 0-1,6%86,87, similar para todos los dispositivos. El tratamiento comprenderá antibioterapia intravenosa asociada a cirugía convencional de desbridamiento y retirada del dispositivo de cierre, plastia arterial preferentemente con vena safena, mioplastia con sartorio y, en casos excepcionales, utilización de homoinjerto o by-pass extraanatómico.
- -
Pseudoaneurisma: presenta una incidencia del 0-1,5% y similares para todos los dispositivos91,92. Su tratamiento se realizará con inyección de trombina ecoguiada, compresión guiada con ultrasonidos o cirugía si fuese necesaria, aunque en pseudoaneurismas de pequeño tamaño (< 20mm) se reportan trombosis en un porcentaje elevado de casos sin intervención93.
- -
Embolización del material hemostático: con una incidencia del 0,6-1,6% para los sistema de colágeno, sobre todo en el Angioseal, y del material de sutura, aunque menos frecuente, en Perclose. Se precisará abordaje quirúrgico femoral para extracción del material, utilización de catéter de trombectomía y si fuese necesario abordaje directo del material embolizado90,94.
Esta lesión puede ocurrir en procedimientos prolongados y complejos como revascularizaciones o embolizaciones95; después de la exposición a 200 rads (2Gy) pueden aparecer quemaduras en la piel, esta exposición puede ser alcanzada después de una hora de fluoroscopia en un mismo lugar y hay que tener en cuenta que la radiación expuesta en la series es añadida a la dosis de fluoroscopia.
Recientemente se ha propuesto que la dosis de exposición radiológica debe ser registrada para todos los pacientes incluyendo el tiempo de fluoroscopia y el número de series angiográficas realizadas, dosis de área, dosis acumulativa y dosis pico cutánea; estas mediciones requerirían un dosímetro que integrarían los nuevos equipos angiográficos96,97.
Consenso sobre el tratamiento endovascular de la patología isquémica del sector aortoiliaco. SeguimientoEl control y seguimiento de los pacientes sometidos a tratamiento endovascular, por patología isquémica, que afecta al sector aortoiliaco, puede detectar lesiones que, una vez corregidas, aumentan la permeabilidad primaria asistida de la técnica98 y ha sido incluida en las guías de la American Heart Association99 que hace una recomendación sobre la «necesidad de seguimiento a largo plazo de la permeabilidad de las zonas tratadas de forma endovascular, mediante índice tobillo/brazo (ITB) y pruebas de imagen a intervalos regulares».
La periodicidad y el tipo de pruebas a realizar en los controles de seguimiento varían entre lo publicado100–102 pero coinciden en un cierto patrón:
- 1.
Seguimiento a 1, 3, 6 y 12 meses y luego anualmente.
- 2.
En todos los controles se debe realizar una evaluación indirecta de la permeabilidad de la técnica, que consistiría en: exploración clínica, ITB con señal doppler y análisis de la morfología de la señal doppler a nivel de la AFC.
- 3.
Siempre que se halle una alteración en la evaluación indirecta, se debe realizar una evaluación directa mediante prueba de imagen del territorio tratado (en el documento de consenso elaborado por el Capítulo de Cirugía Endovascular [CCEV] de la Sociedad Española de Angiología y Cirugía Vascular [SEACV] se recomienda la exploración con ecodoppler en todos los controles de los pacientes sometidos a tratamiento endovascular con patología isquémica del sector infrainguinal102).
Hablamos de una alteración en la evaluación indirecta cuando se producen uno o más de los siguientes hallazgos:
- -
Empeoramiento del estatus clínico: disminución de la distancia de claudicación, aparición de dolor en reposo o lesión trófica; es decir, una variación en negativo en la categoría clínica de la isquemia de las extremidades (escalas de Fontaine y/o Rutherford).
- -
Disminución del ITB previo en > 0,15.
- -
Cambio en la morfología de la señal doppler de la AFC: pérdida del componente diastólico, disminución de la velocidad pico sistólica, ensanchamiento espectral.
La prueba de imagen más recomendada en la literatura para la evaluación directa ha sido el ecodoppler por no ser invasiva y con fiabilidad demostrada100,101, aunque no está bien establecido su papel para la evaluación de la permeablidad a largo plazo en la ATP/STENT99. Es aconsejable que la evaluación sea realizada por el mismo técnico que realizó el estudio preintervención o que disponga de la suficiente información (descripción de la técnica, arteriografías preprocedimiento y posprocedimiento) para optimizar la exploración.
Cuando las limitaciones de la técnica (mala visualización de sectores iliacos intermedios, artefactos, etc.) nos impidan una correcta evaluación de los sectores tratados, se debe recurrir a otras técnicas de imagen, siendo de elección las pruebas de imagen no invasivas (angio-TAC, ARM) pese a que su utilidad para el seguimiento en estos casos aún está por determinar99. La angiografía se debe reservar cuando todas las demás pruebas no hayan sido concluyentes. Recomendamos su realización en un ambiente que permita la corrección terapéutica o profiláctica de la lesión, en el mismo acto diagnóstico para minimizar la exposición a la radiación y a la administración de contraste yodado.
La evaluación directa nos indicará el pronóstico del territorio tratado y la necesidad de una nueva intervención:
- -
Estenosis < 50%: requieren un seguimiento de su evolución y de la permeabilidad de la técnica.
- -
Estenosis > 70%: implican un mal pronóstico y la necesidad de una nueva revascularización.
- -
Para estenosis entre el 50-70% no existen recomendaciones claras y la actitud a seguir está en función de las preferencias del médico99.
La correlación entre las velocidades medidas por ecodoppler y el grado de estenosis varía según los autores101,103–107. En las guías prácticas de exploración del Capítulo de Diagnóstico Vascular No Invasivo (CDVNI) de la SEACV, su sección «Guía Básica del seguimiento no invasivo de la cirugía arterial», en el apartado «Seguimiento de la angioplastia y stent iliofemoral» dice: El criterio diagnóstico más útil es el cociente de velocidad entre el punto de estenosis y la arteria proximal, considerando que un cociente superior a 2 es indicativo de estenosis superior al 50% y que uno entre 2,5 y 3 es sugestivo de estenosis superior al 70%. La periodicidad del seguimiento vendría condicionada por la clínica, siendo muy útil el examen al día siguiente del procedimiento, ya que nos sirve para conocer el punto de partida y diferenciar la estenosis residual de la reestenosis, lo cual tiene interés pronóstico y terapéutico, dado, que en algunos casos, la estenosis residual puede mejorar durante el seguimiento.
Por tanto, y a tenor de las distintas informaciones de la bibliografía, consideraremos que una estenosis postratamiento endovascular en el sector aortoiliaco es significativa si existe: a) aceleración focal con velocidad pico sistólica > 200cm/s y/o b) cociente de velocidad pre/intraestenosis > 2,0 (fig. 5).
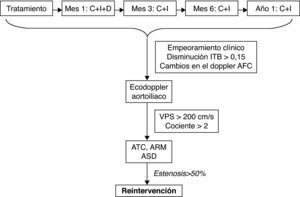
Algoritmo de decisión. AFC: arteria femoral común; ARM: angio-resonancia magnética nuclear; ASD: angiografía sustracción digital; ATC: angio-tomografía computarizada; C: control clínico; D: ecodoppler arterial; I: índice tobillo-brazo; ITB: índice tobillo-brazo; VPS: velocidad pico sistólica.
Quedan por considerar algunos puntos que podrían influir en el pronóstico de la técnica y que, por tanto, requerirían un control más específico:
- -
¿Se deben seguir igual pacientes con lesiones tipo A, B o C de la clasificaciónde la TASC?
- -
Los pacientes con afectación de territorios más distales (femoropoplíteo distal), ¿requieren un control más frecuente? Se ha demostrado en diferentes artículos108–110 que el factor pronóstico más importante en una revascularización aortoiliaca es el lecho distal infrainguinal).
Para dar contestación a estas preguntas se requieren estudios orientados a este fin; por ello no podemos realizar recomendaciones sobre estos puntos en el momento actual.
TratamientoLa terapéutica médica en los procedimientos endovasculares es complementaria y debe ser concomitante a los mismos: antiagregación preprocedimiento, intraprocedimiento y posprocedimiento, anticoagulación intraprocedimiento y tratamientos adyuvantes.
En este apartado consideraremos el tratamiento posprocedimiento.
En las guías de la American Heart Association99, publicadas en 2006, se hace una recomendación clase I con nivel de evidencia A sobre el tratamiento antiagregante posrevascularización:
- -
Salvo contraindicación, todos los pacientes sometidos a revascularización por isquemia crónica de las extremidades deben ser tratados con antiagregación y debe ser continuada de forma indefinida.
- -
La aspirina es un tratamiento antiagregante seguro y efectivo recomendándose a dosis diaria de 75 a 325mg. El clopidogrel (75mg al día) es una alternativa antiagregante efectiva a la aspirina.
El documento sobre la Séptima Conferencia de la American College of Chest Physicians sobre tratamiento antitrombótico y trombolítico111 publicado en la revista Chest en el 2004, adjunta un apartado específico al tratamiento endovascular de la patología isquémica de las extremidades en el que resume: La antiagregación con aspirina está indicada en todos los pacientes sometidos a angioplastia con balón (con o sin stent) de las extremidades inferiores. Existen insuficientes datos para recomendar cualquier tratamiento antiagregante o antitrombótico adicional. La adición de anticoagulación y antiagregación no parece ofrecer ninguna ventaja y sí aumentar el riesgo de complicaciones hemorrágicas.
Este documento hace dos consideraciones especiales: recomienda la doble antiagregación en arterias de pequeño calibre (troncos distales) y pone de manifiesto el problema del «objetivo móvil» que supone la evolución constante de la tecnología en este sector.
De la misma forma, el CCEV en su documento «Tratamiento endovascular de la patología arterial en los MMII. Documentos de base de terapéutica endovascular» presentado en el LII Congreso de la SEACV en junio de 2006102, recomienda, respecto al sector infrainguinal:
Todo paciente con enfermedad arterial oclusiva debe recibir tratamiento antiagregante plaquetario para reducir el riesgo de infarto agudo de miocardio, ictus y muerte vascular (nivel de evidencia: A), aspirina a dosis de 75mg a 325mg es segura y efectiva (nivel de evidencia: A). El clopidogrel (75mg/24h) es una alternativa eficaz y segura a la aspirina, en la reducción del riesgo de infarto agudo de miocardio, ictus y muerte vascular en pacientes con enfermedad arterial oclusiva (nivel de evidencia: B).
La anticoagulación oral no está indicada para disminuir el riesgo de complicaciones cardiovasculares en pacientes con enfermedad arterial oclusiva (nivel de evidencia: C).
A todo paciente que vaya a ser sometido a angioplastia ± stent de las arterias de las EEII, se le debe administrar aspirina 75-162mg. Se puede recomendar la doble asociación aspirina/clopidogrel (pre-stent 80-325mg/75-300mg; post-stent 80-325/75 al día durante un año) en pacientes sometidos a ATP ± stent en las arterias de EEII, continuando posteriormente con un solo fármaco.
Mucho se ha debatido en la literatura sobre la terapéutica adyuvante en los procedimientos (antiagregantes anti IIb-IIIa, trombolíticos), el uso de stents con agentes antirestenóticos o qué tratamiento es el más adecuado en la prevención secundaria, para incidir en los demás factores de riesgo (estatinas, inhibidores de la enzima convertidora de la angiotensina [IECA]).
En estudios como el Heart Protection Study (HPS)112, donde las estatinas han demostrado una mejoría de la distancia de claudicación de los pacientes, y el HOPE (Heart Outcomes Prevention Evaluation)113, donde los IECA (concretamente el ramipril) han reducido significativamente la tasa de muerte por causas cardiovasculares, infarto de miocardio y accidente vascular en pacientes con enfermedad arterial periférica, ambos tratamientos deberían ser añadidos de forma estándar después de un evento vascular que requiera terapéutica invasiva en la prevención secundaria, aunque no podemos recomendarlo de forma generalizada sino a criterio de cada profesional por falta de estudios específicos aleatorizados para el tratamiento posprocedimiento endovascular.
De esta forma recomendamos que el tratamiento después de un procedimiento endovascular (angioplastia ± stent) en el sector aortoiliaco debe ser la administración de la doble asociación aspirina/clopidogrel 80-325mg/75mg al día durante un año continuando posteriormente con un solo fármaco.
Costes de este tipo de terapéuticaSi bien las indicaciones del tratamiento endovascular admiten diferentes matices y modalidades terapéuticas, el tema de costes es todavía más variable si cabe. Podemos hablar de costes directos, de costes por año de vida ganado, de coste-eficacia, de coste ajustado por calidad de vida, etc. Por suerte o desgracia son muy escasos los estudios publicados sobre el costes de las técnicas endovasculares aplicables e la patología arterial obstructiva del sector aortoiliaco. Este hecho condiciona la redacción de unas guías clínicas basadas en los costes. Sin embargo deberemos hacer el esfuerzo para la orientación de los lectores. Para ello sistematizaremos este apartado atendiendo a las técnicas endovasculares más comúnmente aplicadas en el sector aortoiliaco por causa obstructiva. Informaremos de los costes directos a la vez que se referirán datos de los estudios de coste-eficacia que de modo testimonial aparecen en la literatura. Se asume que las indicaciones han seguido las recomendaciones basadas en la evidencia médica27,114.
Angioplastia percutáneaEl coste directo de una angioplastia con un balón (ATP) puede oscilar dependiendo del modelo de guía, catéter guía, medio de contraste, catéter-balón, manómetro y cierre percutáneo. También hay que añadirle los costes indirectos de honorarios médicos, derechos de quirófano, medicación y estancia. Sin embargo, solo calcularemos el coste directo. El precio del material utilizado en una angioplastia simple oscila entre: 400-800 €. Si añadimos un sistema de cierre percutáneo habrá que sumarle otros 100-250 €.
Angioplastia con stentA los costes de la ATP habrá que añadir los del stent aplicado. Este valor oscila entre 800 y 1.200 €. En las guías recientes se aconseja el uso del stent de modo selectivo, en los casos de resultado subóptimo de una ATP, es decir, gradiente de presión translesional, estenosis residual de más del 50%, disección con flujo limitado (nivel B). No obstante, existe la recomendación de su uso primario en estenosis u oclusiones de iliaca común (nivel B).
Fibrinólisis percutáneaLa fibrinólisis local o locorregional aplicada con catéter se recomienda en los casos de isquemia aguda con menos de 14 días de evolución (nivel A). El coste medio de una fibrinólisis de 12 horas de duración se sitúa en torno a 1.200 €.
Trombectomía mecánicaLos diferentes dispositivos de trombectomía mecánica pueden ser utilizados en isquemia aguda como terapia adyuvante (nivel B). El coste de una sesión tipo de trombectomía mecánica representa 1.200 a 2.200 €.
En la mayoría de los casos la fibrinólisis o la trombectomía mecánica precisa ser completada con ATP o ATP+stent.
Estudios comparativosLas técnicas endovasculares aplicadas a la patología obstructiva del sector aortoiliaco pueden ser comparadas con otras alternativas terapéuticas. Así, el tratamiento médico o la cirugía convencional a modo de derivación anatómica o extraanatómica son los tratamientos alternativos.
En un estudio observacional británico se comparan los costes y la permeabilidad del injerto femorofemoral cruzado y la angioplastia+stent primario en oclusiones totales de iliaca común en pacientes claudicantes. La estancia postoperatoria fue significativamente más larga para el grupo de la derivación imprimiendo un coste superior al de ATP+stent (3.072 frente a 1.912 £). Sin embargo, la permeabilidad fue superior para el grupo de la derivación, perdiéndose la ventaja de la ATP+stent en el coste al incrementarse el mismo como consecuencia de las reintervenciones. Por ello, este estudio concluye en recomendar la técnica endovascular para aquellos pacientes con esperanza de vida más corta y reservar la técnica de derivación para los pacientes más sanos y jóvenes115.
Otro estudio europeo, con modelos teóricos, compara el coste-eficacia de la revascularización, endovascular o convencional, frente a la terapia médica y ejercicio en pacientes con claudicación En él se concluye que tanto la cirugía como la ATP ofrecen mejores resultados clínicos inmediatos a los pacientes claudicantes. Sin embargo, el beneficio de la cirugía es pequeño cuando se compara con el coste. Los autores opinan que la relación coste-eficacia de la ATP se encuentra dentro del rango socialmente aceptable ($ 38.000 por QUALY)116.
Finalmente, un estudio estadounidense compara ATP+stent selectivo frente a ATP. Concluye que la ATP+stent selectivo es una estrategia coste-eficaz comparada con ATP sola en el tratamiento de pacientes claudicantes117.
ConclusionesSi bien la información sobre costes de las técnicas endovasculares en el sector aortoiliaco es muy escasa, podemos concluir que siguiendo las recomendaciones de indicación y técnica, la terapia endovascular del sector aortoiliaco no representa un coste directo excesivo. La reducción significativa de la estancia hospitalaria y el alto grado de tolerancia por el paciente hace razonable el coste de los elementos endovasculares. Son deseables estudios más dedicados al análisis coste-eficacia.