Debido al carácter menos invasivo y a los buenos resultados postoperatorios del tratamiento endovascular (EVAR) del aneurisma de aorta abdominal (AAA), han aumentado el número de AAA tratados mediante este procedimiento.
ObjetivoEvaluar el impacto del EVAR en la morbimortalidad del tratamiento por AAA.
Material y métodosEstudio observacional y retrospectivo de pacientes tratados mediante EVAR o cirugía abierta (CA) por AAA infrarrenal en nuestro centro, tanto programados como urgentes (de enero de 2007 a diciembre de 2014). Analizamos mortalidad, complicaciones durante el postoperatorio inmediato y seguimiento, reintervenciones por cualquier causa y por fuga en EVAR. Se realiza un análisis de supervivencia a largo plazo y se comparan ambos grupos de CA y EVAR usando los test biomédicos habituales.
ResultadosRealizamos 286 intervenciones por AAA infrarrenal: 80,1% programadas (28,3 CA vs. 71,7% EVAR) y 19,9% urgentes (77,2 CA vs. 22,8% EVAR).
En las programados, la edad media era significativamente mayor (68 vs. 76 años; p < 0,05) y la estancia media postoperatoria, menor (11 vs. 5 días; p<0,05) en EVAR. La mortalidad (4,6 CA vs. 0,6% EVAR; p<0,05) y las complicaciones (20 CA vs. 7,9% EVAR; p<0,05) a 30días fueron menores en EVAR, con mayor número de reintervenciones en el seguimiento (1,6 CA vs. 12,2% EVAR; p<0,05), pero sin diferencias en la mortalidad tardía (25,8 CA vs. 27,4% EVAR).
En urgentes, observamos más complicaciones cardiológicas y respiratorias en CA (25 y 31,8 CA vs. 0% EVAR), sin diferencias en mortalidad a 30días (31,8 CA vs. 23,1% EVAR) ni en el seguimiento (40 CA vs. 40% EVAR).
ConclusiónLos pacientes tratados mediante EVAR electivo presentan una morbimortalidad a 30 días significativamente menor que los tratados mediante CA, resultados que son comparables en cuanto a mortalidad en el seguimiento, con mayor número de reintervenciones en EVAR. Observamos más complicaciones cardiorrespiratorias en CA que en EVAR urgente, sin diferencias en la mortalidad a 30 días ni en el seguimiento.
Due to the less invasive nature and good post-operative outcomes of endovascular treatment (EVAR) of abdominal aortic aneurysm (AAA), the number of patients treated by this method has increased.
ObjectiveTo evaluate the impact of EVAR on morbidity and mortality in the treatment of AAA.
MethodsObservational and retrospective study of patients undergoing elective and emergency EVAR or open surgery (CA) for infrarenal AAA in our centre (January 2007-December 2014). An analysis was carried out on the mortality, early and long-term complications, re-operation for any cause, and due to endoleak in EVAR. An analysis of long-term survival was performed, and CA and EVAR groups were compared using routine biomedical tests.
ResultsA total of 286 patients who underwent infrarenal AAA repair were identified, of whom 80.1% (28.3 CA vs. 71.7% EVAR) were elective, and 19.1% emergency (77.2 CA vs. 22.8% EVAR).
In patients undergoing elective procedures, a significantly higher mean age (68 vs. 76 years, P<.05), and shorter mean post-operative hospital stay (11 vs. 5 days, P<.05) was observed with EVAR. Thirty-day mortality (4.6 CA vs. 0.6% EVAR, P<.05) and complications (20 CA vs. 7.9% EVAR, P<.05) were lower in EVAR, but the number of re-interventions was higher (1.6 CA vs. 12.2% EVAR, P<.05) during the follow up, with no difference in late mortality (25.8 CA vs. 27.4% EVAR).
In emergency procedures, cardiological and respiratory complications were more frequent in the CA group (28.3 CA, and 33.3 vs. 0% EVAR, respectively), with no difference in 30-day (31.8 CA vs. 23.1 EVAR) or late mortality (40 CA vs. 40% EVAR).
ConclusionPatients undergoing elective EVAR have a significantly lower 30-day morbidity and mortality than those undergoing CA. On the other hand, the long-term mortality was comparable, with a higher re-intervention rate in EVAR. More cardiorespiratory complications were found in CA than in emergency EVAR, with no difference in 30-day or late mortality.
El tratamiento quirúrgico clásico del aneurisma de aorta abdominal (AAA) con resección e interposición de injerto se remonta a mediados del siglo XX, cuando Dubost en 1951 realizó la primera resección con éxito, con reimplante de un homoinjerto de donante cadáver.
La otra opción terapéutica existente, la reparación endovascular del AAA (EVAR) fue descrita por Parodi en 1991. En un principio, esta técnica fue usada de una manera selectiva, en pacientes que no eran buenos candidatos para una cirugía abierta (CA) debido al elevado riesgo quirúrgico1.
Hoy en día, después de más de 25 años, con el avance de la tecnología y el aumento de la experiencia de los cirujanos, el EVAR se ha convertido en un procedimiento más generalizado: se han demostrado numerosas ventajas de este tratamiento sobre la CA, tales como una exposición quirúrgica menos invasiva, una disminución de las necesidades de transfusión, menos tiempo de estancia en unidades de reanimación y hospitalaria, así como disminución de la mortalidad perioperatoria2–4.
Dentro de los estudios aleatorizados multicéntricos con un mayor número de pacientes y que muestran menos mortalidad para EVAR en comparación con CA, se encuentran el EVAR1 con unas tasas del 1,8 frente a 4,3%, el DREAM con tasas de 1,2 frente al 4,6% y el OVER con tasas del 0,5 frente al 3%5–7.
El propósito de este trabajo de investigación es determinar el impacto del EVAR en la morbimortalidad por AAA en nuestra población.
Para esto se evalúan cuáles son los resultados en cuanto a mortalidad postoperatoria (30 días) y a largo plazo para la CA y el EVAR. Además, se busca analizar las diferencias en cuanto a complicaciones de ambos tratamientos, a corto plazo (30 días) y en el seguimiento, así como el número de reintervenciones en cada grupo.
Material y métodoSe realiza un estudio analítico, observacional y retrospectivo en el que se incluye a todos los pacientes tratados mediante CA o EVAR por AAA infrarrenal en nuestro centro desde el 1 de enero de 2007 hasta el 31 de diciembre de 2014. Se incluye a todos los pacientes intervenidos por AAA infrarrenal tanto programados como urgentes; se excluye a los pacientes con aneurismas yuxta- o pararrenales.
Se divide la muestra en 4 grupos: CA en intervenciones programadas, EVAR en intervenciones programadas, CA en intervenciones urgentes y EVAR en intervenciones urgentes. Se comparan por un lado los procedimientos electivos (CA vs. EVAR) y por otro los urgentes (CA vs. EVAR).
Se registran los datos preoperatorios: demográficos (edad y sexo), comorbilidades y riesgo anestésico y se describen algunas variables intraoperatorias tales como el tipo de injerto (aortoaórtico, aortobifemoral, aortobiilíaco, aortouniilíaco y bypass femorofemoral) o la vía de acceso (laparotomía media, incisión inguinal, acceso percutáneo).
Durante el postoperatorio inmediato (30 días) registramos las complicaciones cardiológicas, cerebrovasculares, respiratorias, renales, en extremidades inferiores (embolias periféricas, trombosis), colitis isquémica, trombosis de rama, fugas periprotésicas y mortalidad. En el seguimiento se recogen la aparición de trombosis de rama y fugas periprotésicas, la formación de pseudoaneurismas anastomóticos, infección protésica, fístulas aortoentéricas (FAE), la rotura o la necesidad de conversión a cirugía abierta en el caso de EVAR, mortalidad, el número de reintervenciones por cualquier causa y, finalmente, se analizan las reintervenciones por fuga en el grupo EVAR.
La tabla 1 contiene definidas, de manera detallada, las variables clínicas y de resultado analizadas.
Definición de las variables descriptivas y respuesta del estudio
| Variable descriptiva | Definición |
|---|---|
| Tabaquismo | Tabaquismo actual o historia previa de tabaquismo |
| Hipertensión arterial | Diagnóstico, por médico de familia o especialista, de hipertensión arterial o tratamiento específico para dicha dolencia |
| Diabetes mellitus | Diagnóstico, por médico de familia o especialista, de diabetes mellitus en tratamiento médico o dietético |
| Dislipidemia | Diagnóstico, por médico de familia o especialista, de dislipidemia o tratamiento específico para dicha dolencia |
| Obesidad | IMC>30kg/m2 |
| Enfermedad cerebrovascular | Antecedente de accidente cerebrovascular o accidente isquémico transitorio |
| Cardiopatía | Antecedente de angina, infarto agudo de miocardio o tratamiento revascularizador coronario previo |
| Enfermedad pulmonar obstructiva crónica | Antecedentes de bronquitis crónica o enfisema que haya presentado o no ingresos por descompensación con o sin tratamiento específico preoperatorio |
| Insuficiencia renal crónica | Diálisis o aclaramiento de creatinina estimado<60mL/min/1,73 m2 |
| Laparotomía previa | Antecedente de cirugía abdominal previa |
| ASA | Riesgo anestésico evaluado por servicio de Anestesiología |
| Variable resultado | Definición |
|---|---|
| Mortalidad a 30 días | Muerte en los primeros 30 días postoperatorios por cualquier causa |
| Complicaciones a 30 días | Complicaciones surgidas en los primeros 30 días postoperatorios (cualquiera de las complicaciones analizadas) |
| Complicaciones cardiológicas | Clínica compatible con infarto agudo de miocardio con cambios en el ECG, elevación de troponinas cardíacas, arritmias que requieren medicación o cardioversión o insuficiencia cardíaca congestiva aguda |
| Complicaciones respiratorias | Intubación>24h desde la intervención. Necesidad de asistencia respiratoria después de la extubación postoperatoria. Neumonía |
| Complicación cerebral | Episodio de accidente isquémico transitorio o infarto cerebrovascular en el postoperatorio |
| Complicación renal | Aumento de creatinina>0,5mg/dL, respecto a la basal, necesidad de diálisis de manera temporal o definitiva |
| Sangrado | Disminución de las cifras de hemoglobina que haga necesaria la politransfusión o la reintervención (clínica del paciente asociada a datos analíticos que indiquen hipoxemia) |
| Colitis isquémica | Isquemia intestinal (corroborada con datos analíticos o TAC) que origine sintomatología, independientemente de que se maneje de manera conservadora o quirúrgica |
| Otras complicaciones | De la herida (infección, hematoma o dehiscencia), a nivel de extremidades inferiores (embolias periféricas o trombosis), trombosis de rama, oclusión de arterias renales (que requieran tratamiento específico o prolonguen la estancia hospitalaria) |
| Fugas periprotésicas a 30 días | Fugas observadas en los primeros 30 días postoperatorios |
| Mortalidad en el seguimiento | Muerte tras los 30 días postoperatorios, por cualquier causa, tenga o no relación con el aneurisma |
| Complicaciones>30 días | Complicaciones durante el seguimiento tras los 30 primeros días con o sin relación con el aneurisma (pseudoaneurisma, infección protésica, fístula aortoentérica, rotura del AAA) |
| Fugas en el seguimiento | Fugas observadas tras los primeros 30 días postintervención |
| Reintervención | Reparación abierta o endovascular por complicaciones del AAA (trombosis del injerto, infección, pseudoaneurisma, fístula aortoentérica) o por fuga |
Se realiza un análisis descriptivo de la serie con medias y desviación estándar para las variables cuantitativas y con porcentajes para las variables cualitativas dentro de cada grupo.
Se comparan los grupos de pacientes intervenidos con CA y con EVAR utilizando el test de la Chi-cuadrado o exacto de Fisher para variables cualitativas y el test de Kruskal Wallis para variables cuantitativas. Se considera significación estadística un valor p<0,05.
Se realiza un análisis de supervivencia a largo plazo para ambos grupos mediante el test de Kaplan-Meier y el test de log rank. El programa estadístico utilizado es el SPSS versión 23.
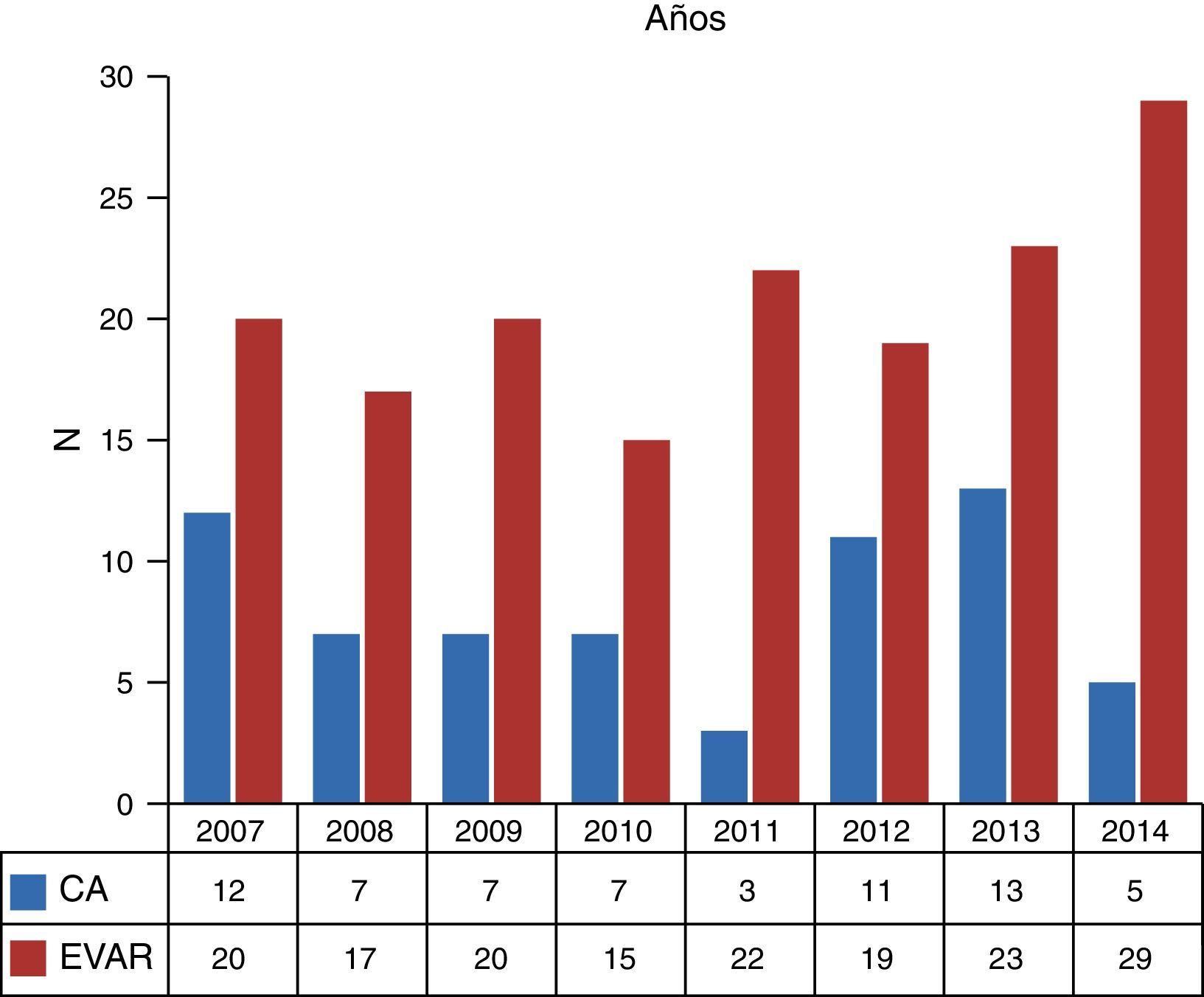
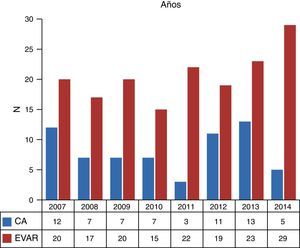
ResultadosEntre enero de 2007 y diciembre de 2014 se realizaron 286 intervenciones por AAA infrarrenal, en 272 varones y en 14 mujeres (95,1 vs. 4,9%). De ellas, 230 (80,1%) fueron realizadas de manera electiva frente a 57 (19,9%) de manera urgente. Dentro de las electivas, 65 fueron CA y 165 EVAR (28,3 vs. 71,7%). En cuanto a las intervenciones urgentes, 44 fueron mediante CA y 13 mediante EVAR (77,2 vs. 22,8%). La evolución en el tiempo muestra la distribución de casos electivos tratados según los años, con un mayor número de casos tratados con EVAR en todos los años (fig. 1).
El seguimiento medio de los pacientes fue de 37 meses.
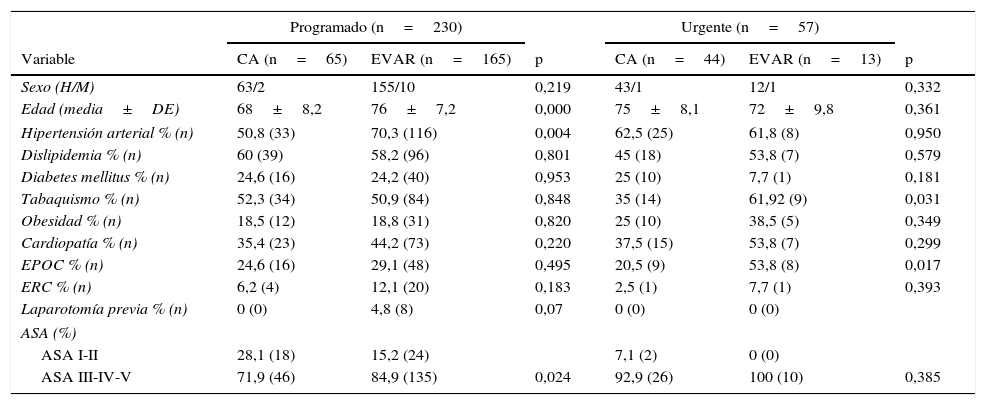
Procedimientos electivosEn cuanto a las variables demográficas, la media de edad en pacientes tratados mediante CA fue de 68 años frente a 76 en el grupo de EVAR (p<0,05) y no se encontraron diferencias en cuanto al sexo en los 2grupos; en cuanto a factores de riesgo cardiovascular, observamos diferencia estadísticamente significativa en la hipertensión arterial, con mayor número de hipertensos en el grupo EVAR (50,8 CA vs. 70,3% EVAR; p<0,05) (tabla 2).
Variables demográficas, clínicas y riesgo quirúrgico para ambos grupos
| Programado (n=230) | Urgente (n=57) | |||||
|---|---|---|---|---|---|---|
| Variable | CA (n=65) | EVAR (n=165) | p | CA (n=44) | EVAR (n=13) | p |
| Sexo (H/M) | 63/2 | 155/10 | 0,219 | 43/1 | 12/1 | 0,332 |
| Edad (media±DE) | 68±8,2 | 76±7,2 | 0,000 | 75±8,1 | 72±9,8 | 0,361 |
| Hipertensión arterial % (n) | 50,8 (33) | 70,3 (116) | 0,004 | 62,5 (25) | 61,8 (8) | 0,950 |
| Dislipidemia % (n) | 60 (39) | 58,2 (96) | 0,801 | 45 (18) | 53,8 (7) | 0,579 |
| Diabetes mellitus % (n) | 24,6 (16) | 24,2 (40) | 0,953 | 25 (10) | 7,7 (1) | 0,181 |
| Tabaquismo % (n) | 52,3 (34) | 50,9 (84) | 0,848 | 35 (14) | 61,92 (9) | 0,031 |
| Obesidad % (n) | 18,5 (12) | 18,8 (31) | 0,820 | 25 (10) | 38,5 (5) | 0,349 |
| Cardiopatía % (n) | 35,4 (23) | 44,2 (73) | 0,220 | 37,5 (15) | 53,8 (7) | 0,299 |
| EPOC % (n) | 24,6 (16) | 29,1 (48) | 0,495 | 20,5 (9) | 53,8 (8) | 0,017 |
| ERC % (n) | 6,2 (4) | 12,1 (20) | 0,183 | 2,5 (1) | 7,7 (1) | 0,393 |
| Laparotomía previa % (n) | 0 (0) | 4,8 (8) | 0,07 | 0 (0) | 0 (0) | |
| ASA (%) | ||||||
| ASA I-II | 28,1 (18) | 15,2 (24) | 7,1 (2) | 0 (0) | ||
| ASA III-IV-V | 71,9 (46) | 84,9 (135) | 0,024 | 92,9 (26) | 100 (10) | 0,385 |
EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica.
En cuanto al riesgo anestésico, se observa diferencia estadísticamente significativa entre los 2grupos, con un mayor riesgo anestésico para el grupo EVAR (ASA I-II: 28,1% CA vs. 15,1% EVAR; ASA III-IV-V: 71,9% CA vs. 84,9% EVAR; p<0,05) (tabla 2).
En CA se realizaron un 69,2% de injertos aortoaórticos (n=45), un 18,5% de aortoilíacos (n=12) y un 12,3% de aortofemorales (n=8); dentro del EVAR fueron aortobiilíacos el 86,7% (n=143), y aortouniilíacos y de bypass cruzado un 13,3% (n=22); se embolizaron las arterias hipogástricas en el 36,4% de los casos (n=60) y el implante fue percutáneo en un 10,3% de los casos (n=17).
La tabla 3 recoge en detalle las variables resultado.
Estancia media postoperatoria, complicaciones y mortalidad a 30 días y en el seguimiento, reintervenciones en ambos grupos
| Variable | Programado (n=230) | Urgente (n=57) | p | |||
|---|---|---|---|---|---|---|
| CA (n=65) | EVAR (n=165) | p | CA (n=44) | EVAR (n=13) | ||
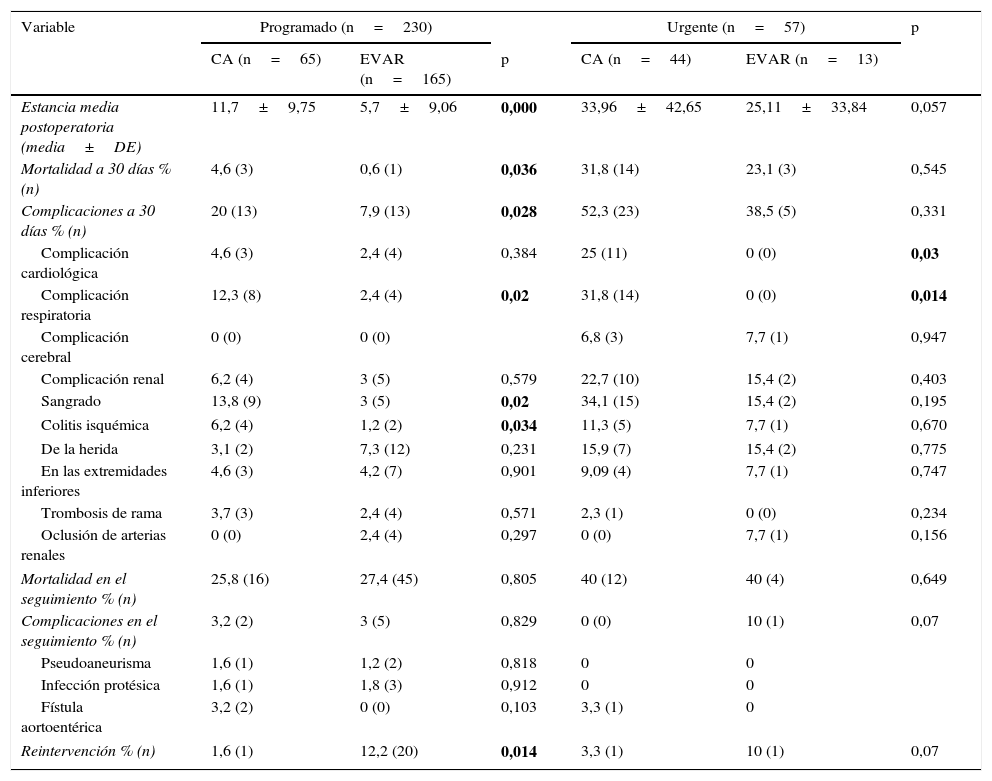
| Estancia media postoperatoria (media±DE) | 11,7±9,75 | 5,7±9,06 | 0,000 | 33,96±42,65 | 25,11±33,84 | 0,057 |
| Mortalidad a 30 días % (n) | 4,6 (3) | 0,6 (1) | 0,036 | 31,8 (14) | 23,1 (3) | 0,545 |
| Complicaciones a 30 días % (n) | 20 (13) | 7,9 (13) | 0,028 | 52,3 (23) | 38,5 (5) | 0,331 |
| Complicación cardiológica | 4,6 (3) | 2,4 (4) | 0,384 | 25 (11) | 0 (0) | 0,03 |
| Complicación respiratoria | 12,3 (8) | 2,4 (4) | 0,02 | 31,8 (14) | 0 (0) | 0,014 |
| Complicación cerebral | 0 (0) | 0 (0) | 6,8 (3) | 7,7 (1) | 0,947 | |
| Complicación renal | 6,2 (4) | 3 (5) | 0,579 | 22,7 (10) | 15,4 (2) | 0,403 |
| Sangrado | 13,8 (9) | 3 (5) | 0,02 | 34,1 (15) | 15,4 (2) | 0,195 |
| Colitis isquémica | 6,2 (4) | 1,2 (2) | 0,034 | 11,3 (5) | 7,7 (1) | 0,670 |
| De la herida | 3,1 (2) | 7,3 (12) | 0,231 | 15,9 (7) | 15,4 (2) | 0,775 |
| En las extremidades inferiores | 4,6 (3) | 4,2 (7) | 0,901 | 9,09 (4) | 7,7 (1) | 0,747 |
| Trombosis de rama | 3,7 (3) | 2,4 (4) | 0,571 | 2,3 (1) | 0 (0) | 0,234 |
| Oclusión de arterias renales | 0 (0) | 2,4 (4) | 0,297 | 0 (0) | 7,7 (1) | 0,156 |
| Mortalidad en el seguimiento % (n) | 25,8 (16) | 27,4 (45) | 0,805 | 40 (12) | 40 (4) | 0,649 |
| Complicaciones en el seguimiento % (n) | 3,2 (2) | 3 (5) | 0,829 | 0 (0) | 10 (1) | 0,07 |
| Pseudoaneurisma | 1,6 (1) | 1,2 (2) | 0,818 | 0 | 0 | |
| Infección protésica | 1,6 (1) | 1,8 (3) | 0,912 | 0 | 0 | |
| Fístula aortoentérica | 3,2 (2) | 0 (0) | 0,103 | 3,3 (1) | 0 | |
| Reintervención % (n) | 1,6 (1) | 12,2 (20) | 0,014 | 3,3 (1) | 10 (1) | 0,07 |
En negrita, resultado estadísticamente significativo, p< 0,05.
La estancia media postoperatoria fue de 11 días (DE±10; rango=58) para CA frente a 5 días (DE±9; rango=57) para EVAR (p<0,05); un 20% (n=13) de pacientes intervenidos mediante CA presentó complicaciones en los primeros 30 días frente a un 7,9% (n=13) en el grupo EVAR (p<0,05), con significativamente mayor incidencia de complicaciones respiratorias (12,3 CA vs. 2,4% EVAR), sangrado (13,8 CA vs. 3% EVAR) y colitis isquémica (6,2 CA vs. 1,2% EVAR). En EVAR observamos un 2,4% (n=4) de fugas de tipo 1 y un 1,2% (n=2) de fugas de tipo 3 tempranas, corregidas en el postoperatorio inmediato, y un 24%(n=40) de fugas de tipo 2. Finalmente, la mortalidad fue significativamente mayor en el grupo CA (4,6% [n = 3] CA vs. 0,6% [n=1] EVAR; p<0,05).
En el seguimiento observamos infección protésica en el 1,6% (n=1) de CA y en el 1,8% (n=3) de EVAR; FAE en el 3,2% (n=2) en CA y pseudoaneurismas en el 1,6% (n=1) en CA frente al 1,2% (n=2) en EVAR. Encontramos un 1,2% (n=2) de fugas de tipo 1 y 3 en EVAR, también corregidas y un 25,6% (n=42) de fugas de tipo 2.
En cuanto al número total de reintervenciones observamos un 1,6% (n=1) en CA frente a un 12,2% (n=20) en EVAR (p=0,007). Un 12,9% (n=21) de los pacientes intervenidos mediante EVAR precisó reintervención por fuga y, de ellas, un 7,9% (n=13) fueron por fugas de tipo 2.
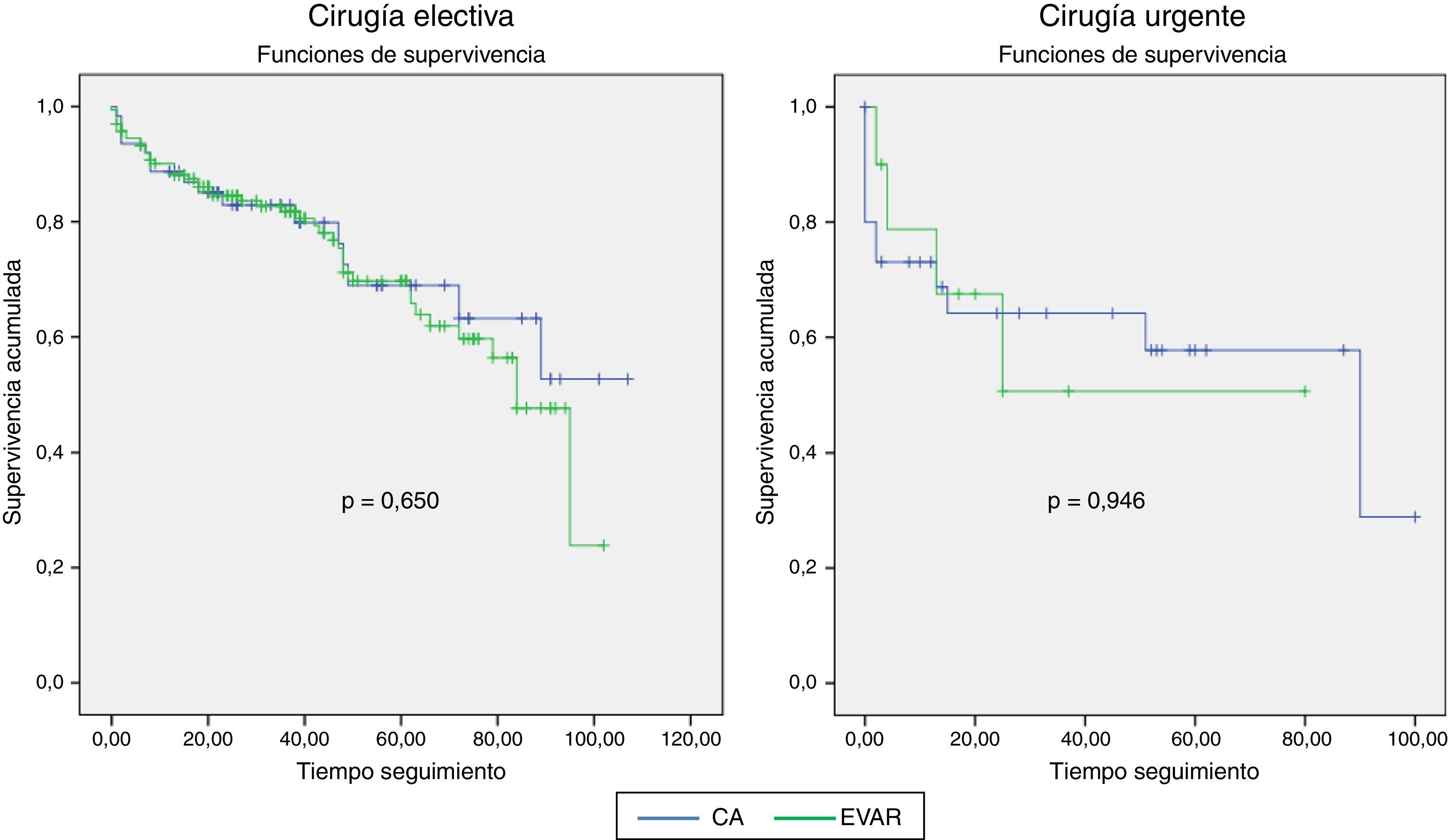
No se observaron roturas en el seguimiento ni fue necesario reconvertir ningún caso de EVAR a CA, y la mortalidad observada fue de un 25,8% (n= 16) para CA frente a un 27,4% (n=45) en EVAR (fig. 2).
Procedimientos urgentesNo encontramos diferencias en cuanto a las variables demográficas de edad y sexo, observando diferencia significativa dentro de los factores de riesgo, con una mayor prevalencia de hábito tabáquico (61,9 EVAR vs. 35% CA) y EPOC (53,8 EVAR vs. 20,5% CA) en el grupo EVAR (tabla 2).
Se realizaron un 50% de injertos aortoaórticos (n=22), un 25% de aortoilíacos (n=11) y un 25% aortofemorales (n=11) en el grupo de CA y en el grupo de EVAR el 53,8% (n=7) de los casos fueron aortobiilíacos y un 46,2% (n=6), aortouniilíacos con bypass femorofemoral cruzado.
En los primeros 30 días postoperatorios, observamos un mayor número de complicaciones cardiológicas (25 CA vs. 0% EVAR) y respiratorias (31,8 CA vs. 0% EVAR) en el grupo CA. En EVAR observamos un 7,7% (n=1) de fugas de tipo 1 y un 15,4% (n=2) de fugas de tipo 3 tempranas, corregidas, y un 30,8% (n=4) de fugas de tipo 2.
Analizando la mortalidad a 30días, encontramos un 31,8% (n=14) en el grupo CA frente a un 23,1% (n=3) en el grupo EVAR, sin diferencias significativas.
En el seguimiento no observamos pseudoaneurismas ni infección protésica en ningún grupo, y se diagnosticó FAE en un 3,3% (n=1) de los casos en el grupo de CA. Encontramos un 10% (n=1) de fugas de tipo 2 y ninguna de los tipos 1 y 3, dentro del grupo EVAR (tabla 3).
En cuanto a las reintervenciones en el seguimiento observamos un 3,3% (n=1) en CA frente a un 10% (n=1) en EVAR, sin diferencias estadísticamente significativas.
Finalmente, la mortalidad tardía fue similar en ambos grupos, con supervivencia del 60% al final del seguimiento en ambos grupos CA y EVAR (fig. 2).
DiscusiónEl propósito del EVAR como alternativa a la CA ha sido desde un principio el convertir el tratamiento del AAA en un procedimiento menos invasivo para los pacientes, disminuir las complicaciones asociadas y mejorar las tasas de mortalidad.
La experiencia en el tratamiento endovascular ha crecido notablemente y ha minimizado el impacto de la morbimortalidad asociada al tratamiento del AAA; a la vez, su uso se ha ampliado a anatomías complejas mediante endoprótesis estándar en unos casos, fenestradas o ramificadas, en otros8,9. Por esto, el EVAR, indicado en un principio para pacientes de alto riesgo quirúrgico, se ha convertido en un procedimiento menos selectivo y el número de procedimientos que se realizan en comparación con CA va en aumento.
Además se ha difundido su empleo en aneurismas rotos, aunque su uso sistemático cuenta con dificultades y existen distintos puntos de controversia10–12, como, por ejemplo, el tipo de anestesia o el manejo del síndrome compartimental abdominal.
Lo observado en nuestra serie es concordante con la literatura publicada previamente, con tasas de mortalidad y complicaciones perioperatorias menores para EVAR, tasas similares de mortalidad a largo plazo y mayor número de reintervenciones en el grupo EVAR para la cirugía electiva13.
En el caso de cirugía urgente, también observamos concordancia con las revisiones actuales, sobre todo en cuanto a la mortalidad, tanto a 30días como en el seguimiento, similares para EVAR y CA14.
El EVAR se ofrece, por lo tanto, como más atractivo en cuanto a morbilidad, mortalidad inmediata y menor agresividad, lo que justifica una gran aceptación de los pacientes. Es, además, la primera indicación en pacientes de alto riesgo quirúrgico. Por otro lado, el EVAR está limitado por las características anatómicas del AAA, si bien el desarrollo de nuevos dispositivos permite que estas limitaciones sean cada vez menores. Esto podría derivar en que los pacientes con una mayor complejidad anatómica sean los que reciban CA, lo que podría influir en la morbimortalidad postoperatoria15.
El número de reintervenciones que son necesarias a más largo plazo para evitar y corregir complicaciones es el mayor inconveniente del EVAR, lo que obliga a un seguimiento muy estricto de los pacientes, que claramente influye en los costes y, probablemente, en la calidad de vida de los pacientes. Esto nos hace pensar que el tratamiento endovascular en estos momentos no debe ser el único que se deba considerar16.
Los cambios en las características de las prótesis y la evolución de la tecnología deben, por lo tanto, centrarse tanto en mejorar la duración de los procedimientos como en adelantarse a sus posibles complicaciones.
Las principales limitaciones de nuestro estudio y sus resultados, aunque en la línea de lo publicado sobre el tratamiento actual del AAA, son su carácter retrospectivo y la no aleatorización de los pacientes; además, debemos considerar que el número de intervenciones programadas anualmente por esta enfermedad en nuestro centro es moderado y que el número de casos tratados en este periodo mediante EVAR es significativamente mayor que con CA, cosa que podría influir en los resultados.
Nuestros resultados en cuanto a morbimortalidad postoperatoria nos obligan a seguir trabajando en la misma línea, pero tratando de minimizar el número de reintervenciones en el tratamiento endovascular, intentando prever y corregir a priori las posibles fugas periprotésicas más habituales.
ConclusiónLos pacientes intervenidos mediante EVAR electivo presentan una morbimortalidad a 30 días significativamente menor que los de CA, con una mortalidad comparable en el seguimiento y con un número de reintervenciones mayor en EVAR. La mortalidad, tanto precoz como tardía, es similar para las intervenciones urgentes realizadas mediante CA o EVAR, con mayor incidencia de complicaciones cardiorrespiratorias postoperatorias para el primer grupo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflictos de interésLos autores declaran que no existe conflicto de intereses.
Los autores desean agradecer a la Sociedad Española de Angiología y Cirugía Vascular (SEACV) y a los organizadores y tutores del curso «Cómo escribir un artículo científico» (Madrid, abril de 2016), en especial a Estrella Blanco y a Melina Vega, la ayuda recibida para la redacción de este artículo.
Además, desean agradecer al resto de los compañeros involucrados de nuestro servicio, Eva Pérez Carballo, Luis Franco Núñez y Francisco Rielo Arias, sin olvidarnos de los doctores José Luis Altamirano, Laura Velásquez y Cristóbal Torres, por la colaboración en la recogida de datos.
Parte de la información de este manuscrito fue presentada en la XV Reunión Galaico-Duriense de Anxioloxía e Cirurxía Vascular, celebrada en Oporto el 20 de febrero de 2016.