Comparar la evolución clínica de las reestenosis >70% asintomáticas de los stents de arteria femoral superficial (AFS) con tratamiento endovascular vs. tratamiento conservador.
PacientesEstudio descriptivo de cohortes históricas de pacientes con stent femoral con reestenosis del 70-99% asintomática, desde enero del 2010 a diciembre del 2015. Se formaron 2 grupos de pacientes: manejo conservador vs. tratamiento endovascular.
Material y métodosComparamos: curvas de superviencia libre de amputación mayor (SLA) y supervivencia libre de isquemia crítica o claudicación limitante (<250m) (SLIC) desde la colocación del primer stent hasta la aparición de isquemia crítica o realización de amputación mayor (log-rank, Kapplan-Meier). Analizamos la permeabilidad primaria y la permeabilidad primaria asistida.
Resultados y conclusionesSe diagnosticaron un total de 23 reestenosis >70% en 20 pacientes de 78 años de edad media (DE 9,6). Seguimiento medio: 30,1 meses. En 12 pacientes (52,2%) se realizó tratamiento médico (AAS y estatinas) + endovascular, y en 11 (47,8%) únicamente tratamiento médico.
No hubo diferencias en la SLA (p=0,967). Observamos que la SLIC fue mayor en el grupo de manejo conservador que en el de tratamiento endovascular (p=0,031).
La permeabilidad primaria fue de 14,2 meses (IC 8,2-20,2), y la permeabilidad primaria asistida de 65,5 meses (IC 57,4-77,5).
En nuestra experiencia tratar las lesiones graves asintomáticas de los stents de AFS no disminuye el riesgo de amputación, isquemia crítica o claudicación limitante respecto a la evolución natural de las mismas. En pacientes asintomáticos la conducta expectante puede ser una buena opción, sin que ello suponga un aumento del riesgo de amputación o isquemia crítica a medio plazo.
To compare the clinical outcomes of asymptomatic >70% in-stent restenosis in the superficial femoral artery (SFA) treated using an endovascular procedure or conservative treatment.
PatientsA historical cohort study was performed on patients with femoral artery stent with an asymptomatic in-stent restenosis of 70-99% from January 2010 to December 2015. The patients were divided into two groups: conservative management vs. endovascular treatment.
Material and methodsThe variables compared were, limb salvage and critical ischaemia or limiting claudication free survival rates (<250m) from initial stent treatment until the appearance of critical ischaemia or major amputation (log-rank, Kaplan Meier). Primary patency and assisted primary patency were analysed.
Results and conclusionsA total of 23 >70% in-stent restenosis were diagnosed in 20 patients who had a mean age of 78 years old (SD 9.6). The mean follow-up was 30.1 months. Medical (aspirin and statins) and endovascular treatment was received by 12 patients (52.2%), and 11 patients (47.8%) received medical treatment only.
No differences were seen in limb salvage.
Critical ischaemia or limited claudication free survival rates were higher in the conservative treatment group than in the endovascular group (P=.031).
Primary patency was 14.2 months (95% CI: 8.2-20.2), and assisted primary patency was 65.5 months (95% CI: 57.4-77.5).
In our experience, treatment of severe asymptomatic lesions of in-stent stenosis in the SFA does not reduce the risk of amputation, critical ischaemia or limiting claudication. Conservative treatment could be a good option in asymptomatic patients, without increasing the risk in amputation and critical ischaemia.
La prevalencia de arteriopatía periférica oscila entre el 3-10%, y aumenta hasta el 15-20% en mayores de 70 años1,2. Tras el fracaso del tratamiento médico, la cirugía endovascular (CEV) actualmente es el tratamiento de primera línea, hasta el punto de que tanto lesiones tipo C y D (TASC II) tienen como indicación inicial de tratamiento la CEV1,2.
La tasa de reestenosis tras CEV en miembros inferiores (MMII) puede llegar al 40%, siendo el primer año el que más reestenosis va a tener3.
Muchos cirujanos vasculares apoyan la idea de que el control ultrasonográfico de la CEV en el sector femoropoplíteo (SFP) es necesario para vigilar la evolución de los procedimientos y para realizar una intervención precoz en caso de que aparezca una reestenosis que pueda poner en peligro la permeabilidad del vaso, ya sea sintomática o no4,5.
No obstante, la evidencia científica en cuanto al beneficio del tratamiento precoz ante una reestenosis del stent es actualmente escasa o nula6.
De hecho, en la guía del Capítulo de Diagnóstico Vascular de la Sociedad Española de Cirugía Vascular7 podemos encontrar, en lo que a CEV en SFP se refiere, que la evaluación clínica asociada al ITB más prueba de esfuerzo es suficiente para predecir el fracaso de un procedimiento endovascular. Esta recomendación destaca la importancia de la clínica con respecto a la imagen en este tipo de procedimientos en este sector. Esta idea, junto con el hecho de que el tratamiento precoz de las reestenosis de stents femorales no ha demostrado una disminución en cuanto al número de amputaciones mayores a largo plazo, nos hace plantearnos la cuestión sobre si deben ser tratadas las reestenosis asintomáticas de los stents de arteria femoral superficial (AFS).
El objetivo de este trabajo es comparar la evolución clínica de las reestenosis asintomáticas de los stents de AFS tratadas de forma endovascular con las manejadas de forma conservadora.
Material y métodosEstudio descriptivo de cohortes históricas de pacientes tratados con stent de AFS entre los años 2010-2015 por isquemia crónica de MMII.
Criterios de inclusión: pacientes diagnosticados por eco de reestenosis del 70-99%, reestenosis asintomática, que hubiera sido tratada mediante CEV y tratamiento médico (AAS y estatinas) o solamente mediante tratamiento médico.
Criterios de exclusión: pacientes con reestenosis sintomáticas o tratadas mediante cirugía abierta y pacientes en los que se hubiera realizado cirugía abierta o CEV en MMII previa a la colocación del primer stent.
Formamos 2 grupos: reestenosis tratadas mediante tratamiento médico (AAS y estatinas), y reestenosis tratadas mediante tratamiento médico y CEV.
De forma habitual, tras los procedimientos endovasculares pautamos doble antiagregación con AAS 100mg cada 24h y clopidogrel 75mg cada 24h durante un mes, luego se continúa de forma indefinida solo con AAS 100mg.
El análisis de las variables fue retrospectivo: como comparación principal analizamos curvas de superviencia libre de amputación mayor (SLA) y curvas de supervivencia libre de isquemia crítica o claudicación limitante (<250m) (SLIC) en cada grupo y las comparamos entre sí (log-rank, Kapplan-Meier).
Realizamos entrevistas telefónicas a los pacientes preguntándoles la clínica que presentaban en el momento del diagnóstico de la reestenosis. La información obtenida la correlacionamos con las notas de los cirujanos.
Estudiamos tanto la permeabilidad primaria de todos los stents como la permeabilidad primaria asistida en el grupo de tratamiento endovascular (Kaplan-Meier, log-rank).
Comparamos las permeabilidades primarias entre ambos grupos (Kaplan-Meier, log-rank).
Realizamos curvas de Kaplan-Meier, calculando los tiempos medios de permeabilidad y utilizando el log-rank como estadístico de contraste para comparar.
Para valorar la homogeneidad en ambos grupos, realizamos comparaciones de las variables que pudieran influir en la evolución clínica de los pacientes.
Comparamos: edades (t de Student), factores de riesgo cardiovascular (FRCV) (test exacto de Fisher), clínica que presentaban los pacientes antes de la primera revascularización y clínica que presentaban en el momento del diagnóstico de la reestenosis (es la misma con la que se quedaron tras la primera CEV) (ji-cuadrado de tendencia lineal), ambas clasificadas mediante la escala de Fontaine.
Comparamos la severidad de la arteriopatía en el SFP comparando la clasificación TASC II de los pacientes de cada grupo antes de la primera CEV y la severidad de las lesiones arteriales en el sector distal (SD), también antes de la primera CEV (ji-cuadrado de tendencia lineal). Para valorar la afectación del SD clasificamos cada extremidad con 0, 1, 2, o 3 en función del número de vasos distales que lleguen al pie (ji-cuadrado de tendencia lineal).
Comparamos el tipo de lesión arterial que tenían en el SFP inicialmente en el momento de realizar la primera CEV (estenosis corta [<3cm], estenosis larga [>3cm o más de una corta], obliteración corta [<3cm], y obliteración larga [>3cm o varias cortas]) (ji-cuadrado de tendencia lineal).
El análisis estadístico se realizó mediante el software SPSS Statistics 17.0, considerando estadísticamente significativo un valor de p<0,05.
Definimos SLA o SLIC como meses transcurridos desde la primera CEV hasta la aparición de isquemia crítica, realización de amputación mayor o fecha del último control.
Para cuantificar las estenosis calculamos el cociente entre la velocidad sistólica máxima en la estenosis y la velocidad máxima en un segmento situado entre 2-4cm proximal a la misma. Ratios sistólicos >4 se corresponden con estenosis severas (>70%), que suelen corresponderse con velocidades pico sistólicas ≥300cm/s3.
Consideramos reestenosis asintomática aquella que se produce en un paciente sin provocar ninguna afectación clínica, sin que el paciente haya notado empeoramiento clínico desde la primera intervención o desde el último control con eco en el que el stent estuviera correcto hasta el diagnóstico de la misma.
Es importante destacar que no hablamos de paciente asintomático sino de reestenosis asintomática.
Todas la reestenosis fueron diagnosticadas por eco doppler. Todas las exploraciones fueron realizadas por el mismo explorador. Realizamos los controles en todos los pacientes a los 6 meses y después anualmente.
ResultadosEntre enero de 2010 y diciembre de 2015 se diagnosticaron 23 reestenosis >70% en 20 pacientes de 78 años de edad media (DE 9,6) —5 mujeres y 15 hombres—, con isquemia crónica de MMII. El tiempo medio de seguimiento fue de 30,1 meses (9,7-88,2). En 12 (52,2%) se realizó tratamiento médico (AAS y estatinas) + endovascular, y en 11 (47,8%) únicamente tratamiento médico.
La edad media por grupos ha sido de 79,3±9,3 años en el grupo de tratamiento endovascular y de 77,2±9,6 en el grupo de tratamiento médico.
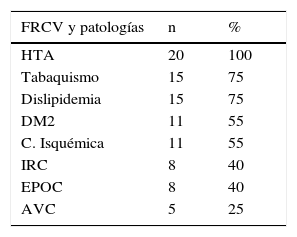
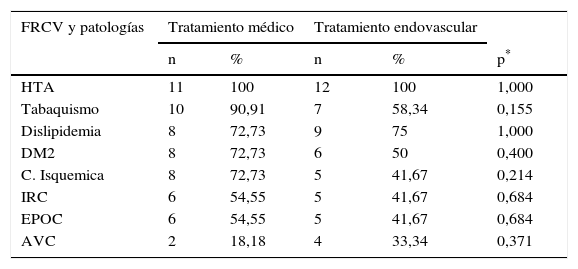
La distribución de los FRCV a nivel global y por grupos se describen en las tablas 1 y 2.
FRCV y patologías a nivel global
| FRCV y patologías | n | % |
|---|---|---|
| HTA | 20 | 100 |
| Tabaquismo | 15 | 75 |
| Dislipidemia | 15 | 75 |
| DM2 | 11 | 55 |
| C. Isquémica | 11 | 55 |
| IRC | 8 | 40 |
| EPOC | 8 | 40 |
| AVC | 5 | 25 |
AVC: accidente vascular cerebral; C. Isquémica: cardiopatía isquémica; DM2: diabetes mellitus tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; IRC: insuficiencia renal crónica.
FRCV y patologías por grupos. Significación estadística entre comparaciones
| FRCV y patologías | Tratamiento médico | Tratamiento endovascular | |||
|---|---|---|---|---|---|
| n | % | n | % | p* | |
| HTA | 11 | 100 | 12 | 100 | 1,000 |
| Tabaquismo | 10 | 90,91 | 7 | 58,34 | 0,155 |
| Dislipidemia | 8 | 72,73 | 9 | 75 | 1,000 |
| DM2 | 8 | 72,73 | 6 | 50 | 0,400 |
| C. Isquemica | 8 | 72,73 | 5 | 41,67 | 0,214 |
| IRC | 6 | 54,55 | 5 | 41,67 | 0,684 |
| EPOC | 6 | 54,55 | 5 | 41,67 | 0,684 |
| AVC | 2 | 18,18 | 4 | 33,34 | 0,371 |
AVC: accidente vascular cerebral; C. Isquémica: cardiopatía isquémica; DM2: diabetes mellitus tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; IRC: insuficiencia renal crónica.
La primera CEV realizada en el 100% de los casos fue angioplastia transluminal percutánea simple (ATP simple) asociada a la colocación de stent autoexpandible de nitinol o cubierto en AFS.
No realizamos ningún tipo de CEV en SD en ningún caso. No se extendió el stent femoral hasta la segunda porción de la arteria poplítea en ningún caso.
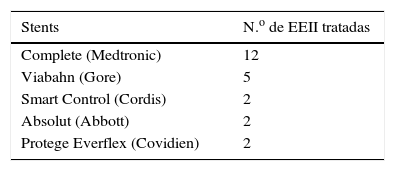
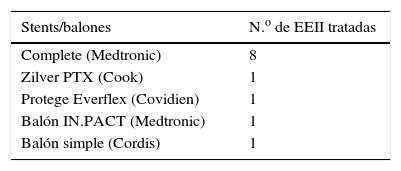
Todos los stents colocados en la primera intervención fueron autoexpandibles, 5 de los cuales fueron cubiertos. En la tabla 3 se muestran los tipos de stents.
En todos los casos, tras el procedimiento se pautó el tratamiento médico antiagregante habitual ya explicado.
En ningún caso se obliteró ningún stent; el 100% fueron reestenosis intrastent o en los extremos en los stents cubiertos.
En el grupo de las reestenosis tratadas mediante CEV, se realizó ATP simple en un caso, ATP con balón farmacoactivo en otro caso y ATP simple asociada a colocación de stent intrastent en los otros 10; uno de los stents fue liberador de fármaco. El material utilizado se indica en la tabla 4.
También pautamos doble antiagregación tras la segunda CEV. Pasado el primer mes, tanto el tratamiento médico, como el control de los FRCV, como los controles en consultas externas se realizaron igual en ambos grupos.
En el grupo de tratamiento médico no se realizó CEV por diversos motivos: 8 se negaron a la reintervención por estar asintomáticos, 2 se programaron para reparación endovascular pero finalmente no se realizó por presentar uno de ellos una descompensación de su patología cardiológica y el otro una neumonía, y en otro caso se decidió posponer el tratamiento por haberse realizado recientemente un cateterismo cardiaco con colocación de stents coronarios.
No observamos diferencias ni entre los FRCV ni entre las edades de ambos grupos (test exacto de Fisher p=0,94 y t de Student p=0,564, respectivamente) (tabla 2).
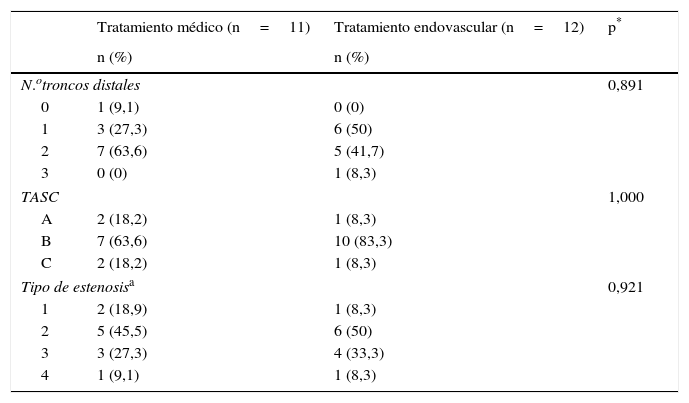
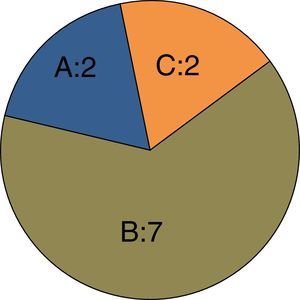
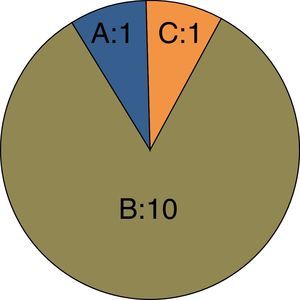
No observamos diferencias en la severidad de las lesiones arteriales que presentaban los pacientes antes del primer procedimiento, ni en la comparación del TASC en el SFP ni en la comparación en cuanto al tipo de lesión (estenosis corta/larga, obliteración corta/larga) (ji-cuadrado de tendencia lineal, p=1,000 y p=0,92 respectivamente) (tabla 5, figs. 1 y 2). Tampoco en las lesiones en el SD antes del primer procedimiento (ji-cuadrado de tendencia lineal, p=0,891) (tabla 5).
Comparación entre grupos de la severidad de la afectación arterial antes del primer procedimiento
| Tratamiento médico (n=11) | Tratamiento endovascular (n=12) | p* | |
|---|---|---|---|
| n (%) | n (%) | ||
| N.otroncos distales | 0,891 | ||
| 0 | 1 (9,1) | 0 (0) | |
| 1 | 3 (27,3) | 6 (50) | |
| 2 | 7 (63,6) | 5 (41,7) | |
| 3 | 0 (0) | 1 (8,3) | |
| TASC | 1,000 | ||
| A | 2 (18,2) | 1 (8,3) | |
| B | 7 (63,6) | 10 (83,3) | |
| C | 2 (18,2) | 1 (8,3) | |
| Tipo de estenosisa | 0,921 | ||
| 1 | 2 (18,9) | 1 (8,3) | |
| 2 | 5 (45,5) | 6 (50) | |
| 3 | 3 (27,3) | 4 (33,3) | |
| 4 | 1 (9,1) | 1 (8,3) | |
Fila superior: sector distal. Fila intermedia: clasificación TASC sector femoropoplíteo. Fila inferior: tipo de lesión arterial de cada paciente.
Tampoco encontramos diferencias en el estadio de Fontaine que presentaban los pacientes en el momento de la primera revascularización (ji-cuadrado de tendencia lineal, p=0,688) (tabla 6).
Clasificación de Fontaine. N.o de extremidades en cada estadio en el momento de la primera intervención, comparación por grupos
| Tratamiento médico (n=11) n (%) | Tratamiento endovascular (n=12) n (%) | p* | |
|---|---|---|---|
| Fontaine | 0,688 | ||
| IIa | 1 (9,1) | 0 (0) | |
| IIb | 3 (27,3) | 4 (33,3) | |
| III | 2 (18,2) | 2 (16,7) | |
| IV | 5 (45,4) | 6 (50) |
En la tabla 7 se muestra la clínica que presentaban los pacientes en el momento de diagnosticar la reestenosis: era la misma clínica con la que quedaron tras el primer procedimiento endovascular; tampoco encontramos diferencias entre los grupos (ji-cuadrado de tendencia lineal, p=0,722).
Clasificación de Fontaine. N.o de extremidades en cada estadio tras el diagnóstico de la reestenosis, comparación por grupos
| Tratamiento médico (n=11) n (%) | Tratamiento endovascular (n=12) n (%) | p* | |
|---|---|---|---|
| Fontaine | 0,722 | ||
| I | 2 (18,2) | 1 (8,3) | |
| IIa | 2 (18,2) | 3 (25) | |
| IIb | 6 (54,5) | 7 (58,3) | |
| III | 0 | 0 | |
| IV | 1 (9,1) | 1 (8,3) |
No observamos diferencias en el número de amputaciones mayores al final del seguimiento (una amputación en cada grupo, p=0,967).
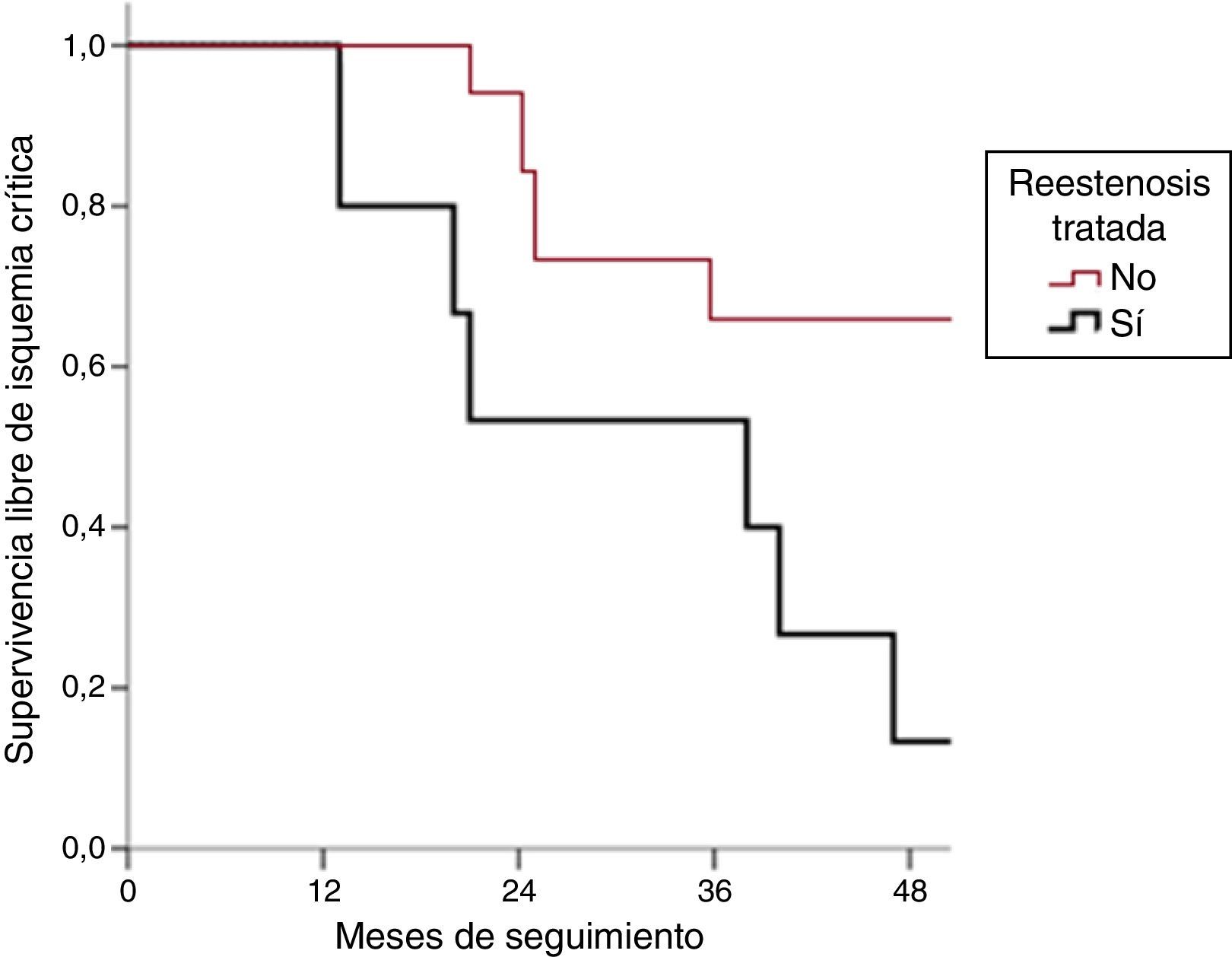
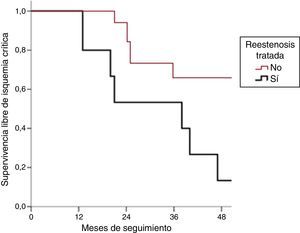
Sin embargo, observamos que la SLIC es mayor en el grupo de reestenosis manejadas de forma conservadora que en el grupo de reestenosis tratadas mediante CEV, obteniendo una p=0,031 (Kaplan-Meier, log-rank) (fig. 3).
El tiempo medio libre de isquemia crítica en el grupo de tratamiento endovascular fue de 36,1 meses (IC 95%: 19,7-52,4), y de 58,2 meses (IC 95%: 59,1-77,3) en el grupo de tratamiento médico. Todos los pacientes menos uno del grupo de tratamiento médico cayeron en isquemia crítica al final del seguimiento.
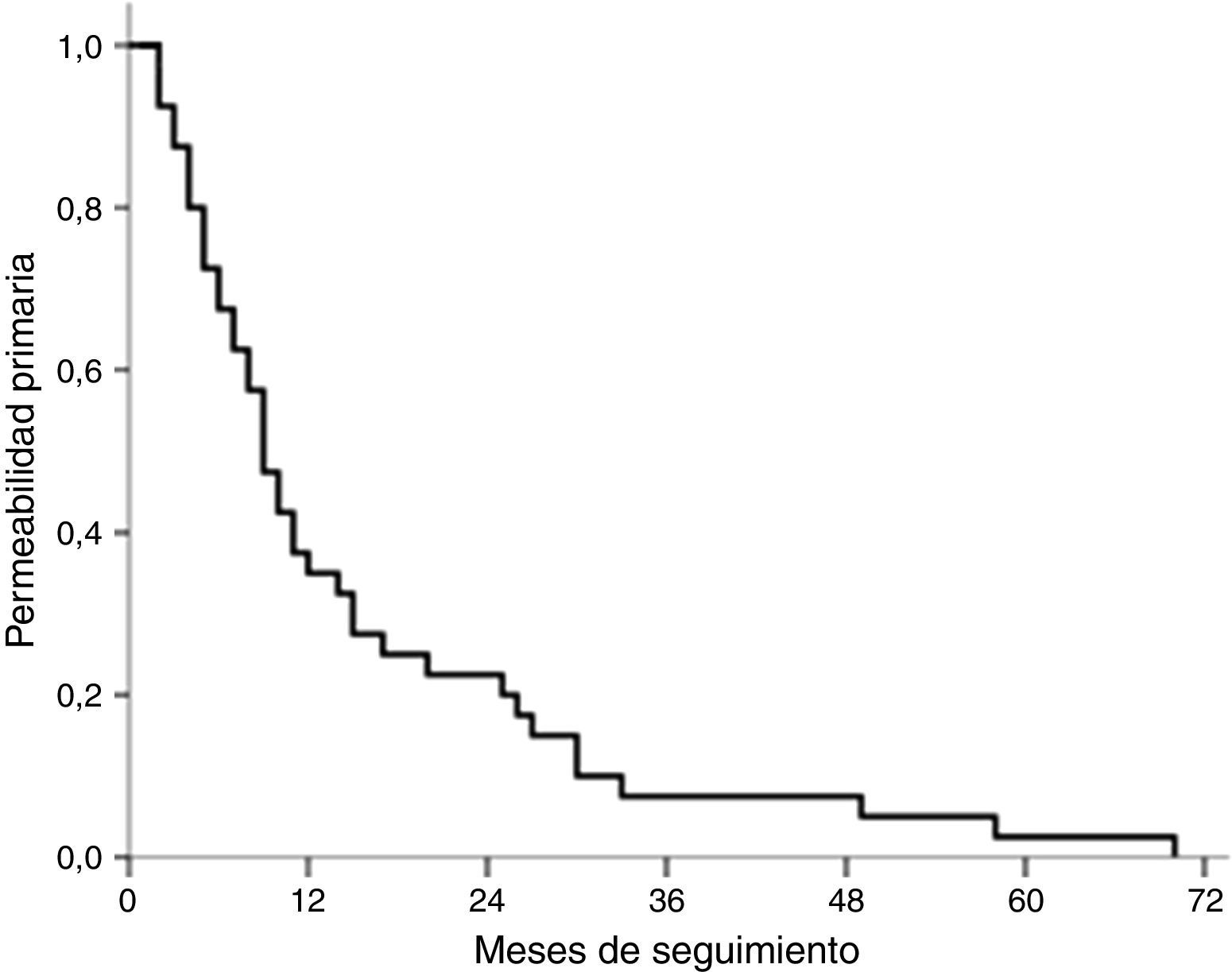
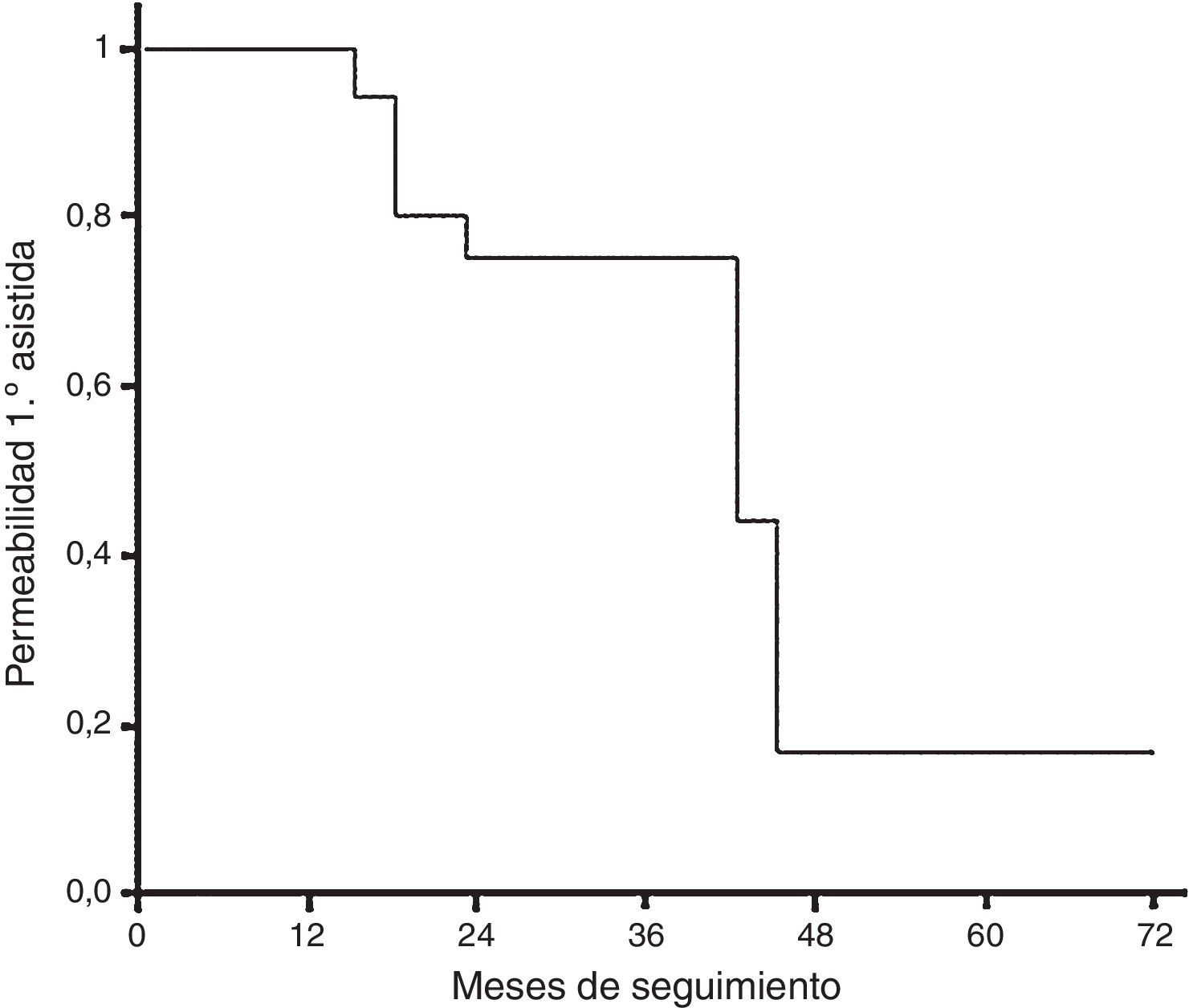
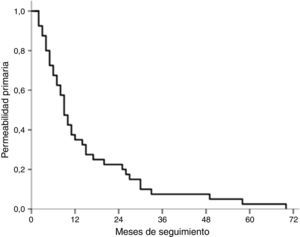
El tiempo medio de permeabilidad primaria global ha sido de 14,2 meses (IC 95%: 8,2-20,2); en el grupo de tratamiento médico el tiempo medio de permeabilidad primaria ha sido de 15,0 meses (IC 95%: 7,4-22,6) y en el grupo de tratamiento endovascular, de 13,0 meses (IC 95%: 4,5-15,5). No ha habido diferencias entre ambos grupos (log-rank test, p=0,233) (fig. 4).
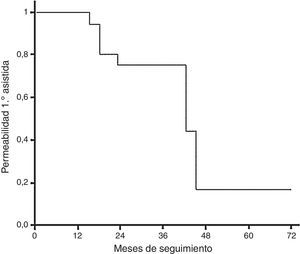
La permeabilidad primaria asistida (en el grupo de tratamiento endovascular) ha sido de 65,5 meses (IC 95%: 57,4-77,5) (fig. 5).
DiscusiónLos resultados de nuestro trabajo muestran que la evolución clínica de los pacientes con reestenosis >70% asintomática de stents de AFS es la misma tanto si se tratan mediante CEV como si se manejan de forma conservadora. Es decir, el tratamiento endovascular de la reestenosis no ha aportado beneficio a los pacientes de nuestra muestra.
En la literatura encontramos numerosos trabajos que proponen como primera opción de tratamiento de la reestenosis de los stents de AFS realizar ATP con balón farmacoactivo8-10. Otros grupos hablan sobre la posibilidad de realizar el tratamiento con stent farmacoactivo11,12, y explican resultados similares a los del balón con droga, incluso mejores en algunas series. Pero no hay trabajos aleatorizados que comparen el manejo conservador de las reestenosis de los stents asintomáticas con otra modalidad de tratamiento (probablemente sería una cuestión éticamente controvertida).
Numerosos estudios comparan los resultados del tratamiento de las reestenosis de los stents de AFS con balón simple frente al balón impregnado en droga; en concreto, el ensayo clínico FAIR comparó el tratamiento mediante ATP simple o bien mediante ATP con balón impregnado en paclitaxel, observando que el tratamiento con este último se asoció con una menor tasa de reestenosis y un mejor resultado clínico, sin diferencias en cuanto a seguridad8.
Otra opción de tratamiento propuesta para tratar la reestenosis de los stents es la colocación de un stent intrastent. En concreto, el ensayo multicéntrico Gore RELINE MAX comparó el tratamiento mediante stent cubierto Viabahn con ATP simple, observando mejores resultados en cuanto a permeabilidad y evolución clínica a favor de los stents13.
En el ensayo Treatment of femoropopliteal in-stent restenosis with paclitaxel-eluting stents obtenido a partir del estudio ZILVER-PTX trataron 119 extremidades mediante la colocación de stent de nitinol liberador de paclitaxel, obteniendo elevadas tasas de permeabilidad y seguridad11.
Recientemente se ha comenzado a hablar sobre técnicas más novedosas y con un uso no tan extendido para el tratamiento de la reestenosis; por ejemplo, el ensayo EXCITE ISR trial comparó el tratamiento mediante ATP simple asociada a aterectomía láser excimer frente a ATP simple, observando superioridad de ATP asociada a láser en cuanto a permeabilidad a un año y seguridad14,15.
Sobre lo que no hay tanta literatura publicada es de estudios en los que se compare cualquiera de estas formas de tratamiento propuestas frente al «no tratamiento quirúrgico» o conducta expectante.
En nuestro análisis hemos observado una SLIC mayor en el grupo tratado de forma médica. A pesar de no tener evidencias científicas de otros trabajos, creemos que los resultados obtenidos en nuestra muestra son plausibles con la realidad; parece lógico pensar que si un paciente ha desarrollado una hiperplasia intimal tras la colocación del primer stent, la desarrollará de nuevo al colocar el segundo, siendo la intensidad de esta probablemente mayor al ser la segunda vez y ser una arteria ya manipulada, por lo que consideramos que si el paciente se encuentra asintomático el manejo conservador podría ser una opción válida y justificada.
En cuanto a las limitaciones de nuestro trabajo: no se ha realizado un análisis por intención de tratar; se trata de un estudio retrospectivo, por lo que habrá factores de confusión y sesgos propios de este tipo de estudios que son difícilmente controlables. Disponemos de una muestra pequeña y además no se trata de grupos aleatorizados, por lo que no se puede garantizar completamente la homogeneidad de la muestra. Hemos tratado de minimizar al máximo este posible sesgo realizando comparaciones entre ambos grupos en cuanto a factores que pudieran influir en la evolución o no a isquemia crítica.
No analizamos el ITB por presentar DM muchos de los pacientes de nuestra muestra, y en varios la arteria resultó incompresible.
Tampoco hemos podido comparar el tipo de reestenosis (corta/larga) que presentaron los pacientes, ya que en el grupo de tratamiento médico no tenemos arteriografía y en el informe del eco doppler no se detalla la morfología en algunos casos, pero sí que sabemos que no había ninguna obliteración.
Tenemos que decir que el tratamiento que recibió el grupo de tratamiento endovascular no fue completamente homogéneo; la mayoría fueron stents descubiertos de nitinol, no obstante hubo uno tratado mediante ATP simple, uno mediante ATP con balón farmacoactivo y otro mediante stent liberador de fármaco. No sabemos si el resultado de nuestro trabajo hubiera sido el mismo si se hubieran tratado todos con balón farmacoactivo o todos con stent liberador de fármaco.
En resumen, creemos que los datos dejan entrever una posibilidad sobre el manejo de esta patología que no está ampliamente estudiada y de la cual se podrían beneficiar muchos pacientes; futuros trabajos aleatorizados, con un número de muestra mayor y prospectivos podrían terminar de definir la opción terapéutica del manejo conservador en el tratamiento de estas reestenosis.
ConclusionesEn nuestra serie el tratamiento de las reestenosis asintomáticas de los stents de AFS mediante stent autoexpandible intrastent no mejoró la evolución de los pacientes. No observamos una disminución del número de amputaciones mayores ni tampoco que aumente la SLIC.
Consideramos que en pacientes asintomáticos la conducta expectante puede ser una buena opción sin que ello suponga un aumento del riesgo de amputación o isquemia crítica a corto y medio plazos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido presentado como comunicación oral en el 62.o Congreso Nacional de la Sociedad Española de Angiología y Cirugía Vascular (SEACV) celebrado en junio de 2016 en Sitges.