Los paragangliomas del cuerpo carotídeo son tumores poco frecuentes, ricamente vascularizados, de crecimiento lento, habitualmente benignos e infrecuentemente secretores de catecolaminas. Actualmente estos tumores son cada vez mejor diagnosticados y catalogados, pero su óptimo tratamiento es controvertido.
Teniendo como base una experiencia, durante los últimos 25 años, de 42 pacientes portadores de 47 paragangliomas carotídeos realizamos una propuesta sobre las indicaciones quirúrgicas y seguimiento de estos tumores. Concluimos que en la actualidad existe un cambio del paradigma terapéutico de los paragangliomas del cuerpo carotídeo.
Carotid body tumours are rare, richly vascularised, slow-growing, usually benign, and infrequently catecholamine-secreting tumours. The diagnosis and classification of these tumours is improving, but optimal treatment is still controversial.
On the basis of experience over the past 25 years, with 42 patients with 47 carotid body tumours we present a proposal on surgical indications and follow-up of these tumours. It is conclude that there is now a change in the therapeutic paradigm of these tumours.
Los paragangliomas carotídeos (PGC) son tumores poco frecuentes, muy vascularizados, de crecimiento lento, habitualmente benignos y raramente secretores. Cada vez son mejor diagnosticados y catalogados, pero su óptimo tratamiento continúa siendo controvertido.
Una visión histórica del problema la aporta la Mayo Clinic (Rochester, Minnesota, EE.UU), cuya publicación inicial de Shamblin et al.1 fue continuada por otras de Irons et al.2, Hallett et al.3 y Erickson et al.4. Ellos nos presentan la mayor experiencia publicada sobre paragangliomas (PG) en general y PGC en particular. Entre 1935 y 1998, en la Clínica Mayo han sucedido cosas muy relevantes respecto a esta patología, tales como: 1) una mayor resección completa de los PGC, que pasó del 80 al 98%; 2) reducción del ictus perioperatorio, del 23 al 2,7%; 3) reducción de la mortalidad perioperatoria (del 6 al 0%), y 4) no reducción significativa en la disfunción de pares craneales (del 46 al 40%), porcentaje que han permanecido prácticamente similar durante estos 60 años. Por todo ello, no cabe duda que una mayor resección completa del tumor, asociada a un mínimo riesgo de ictus o de muerte, anima a ser agresivos e indicar cirugía ente el diagnóstico de un PGC. No obstante, queda pendiente de tratar el tema de la disfunción de pares craneales por lesión intraoperatoria, aspecto al que volveremos posteriormente.
Los favorables hechos evolutivos anteriormente referidos se explican por las novedades diagnósticas y terapéuticas que con el paso del tiempo han posibilitado un mayor y más precoz diagnóstico de los PG, así como por las mejoras en las técnicas operatorias y los cuidados perioperatorios. En este sentido, Shamblin et al.1 referían en 1971: a) solo existen 500 PGC reportados en la literatura mundial; 2) la mortalidad operatoria se sitúa en el 5,7%, relacionada con el daño o ligadura de la carótida, y 3) un elevado número de casos en estadioiii (27%), donde existen más posibilidades de resección incompleta y complicaciones intraoperatorias. Por el contrario, en la actualidad existen muchas series internacionales, como la nuestra (tablas 1 y 2), que superan las decenas de casos (curiosamente hasta no hace mucho tiempo se decía: «probablemente muchos cirujanos vasculares no vean ningún caso durante toda su vida profesional») y donde el número de casos avanzados (ShamblinIII) ya no es tan elevado, según 2 revisiones de series contemporáneas5-6.
Paragangliomas en el Hospital Clínico de Salamanca (1991-2016)
| Localización | Número de tumores | Servicio/s implicados |
|---|---|---|
| Yugulotimpánicos | 63 (2) | ORL |
| Vagales | 8 (8) | ORL y cirugía vascular |
| Carotídeos (PGC) | 47 (42) | ORL y/o cirugía vascular |
| Aórtico-pulmonar | 1 | Cirugía cardiaca |
| Órgano de Zuckerkandl | 1 (1) | Cirugía general y vascular |
| Prostático | 1 | Urología |
| Total | 121a (53) | — |
Entre paréntesis: participación personal.
Paragangliomas carotídeos (1991-2016): 47 tumores en 42 pacientes
| A) Localizaciones | |
| Carotídeos únicos o aislados | 35 pacientes (83,3%)=35 PGC |
| Carotídeos multicéntricos | 7 pacientes (16,7%)=12 PGC |
| Doble carotídeo | 3 pacientes=6 PGC |
| Doble carotídeo+yugular | 1 paciente=2 PGC |
| Doble carotídeo+doble yugular+vagal | 1 paciente=2 PGC |
| Carotídeo+vagal | 1 paciente=1 PGC |
| Carotídeo+yugulotimpánico | 1 paciente=1 PGC |
| B) Época (mes-años) | |
| 1.ª época (ene. 1991-dic. 2000) | 14 pacientes (17 PGC)=1,4 × año |
| 2.ª época (ene. 2001-dic. 2010) | 14 pacientes (15 PGC)=1,4 × año |
| 3.ª época (ene. 2011-abr. 2016) | 14 pacientes (15 PGC)=2,3 × año |
| C) Tratamiento | |
| Cirugía | 35 pacientes (83,3%) |
| Un tiempo (nunca un PGC bilateral) | 31 pacientes |
| Dos tiempos (PGC bilaterales) | 4 pacientes |
| Radioterapia | 2 pacientes (4,8%) |
| Seguimiento (wait & scan) | 5 pacientes (11,9%) |
| D) Técnica quirúrgicaay grado Shamblin | |
| Resección periadventicial (RP) | 32 (91,4%) SI (11), SII (17), SIII (4) |
| RP+resección arteria carótida externa | 1 (2,9%) SII (1) |
| RP+resección arteria carótida interna: | 2 (5,7%) SIII (2) |
| Anastomosis terminoterminal=1 | |
| Interposición vena safena interna=1 | |
| E) Complicaciones postoperatorias, grado de Shamblin y multiplicidad | |
| Neurológicas=6 pacientes (17,1%) | |
| Paresia nervio laríngeo recurrente | 4 (1 SI y 3 SII) PGC único |
| Lesión VII, X y XII | 1 (SII) 2 PGC+PGY+PGV |
| Lesión VII, IX | 1 (SII) 2 PGC+PGY |
| Vasculares=1 paciente (2,8%) | |
| ACV (ictus menor) | 1 (SII) PGC único |
| F) Complicaciones postoperatorias por épocas (B) | |
| 1.ª época (1991-2000) | Neurológicas=2. Vasculares=0 |
| 2.ª época (2001-2010) | Neurológicas=2. Vasculares=1 |
| 3.ª época (2011-2016) | Neurológicas=2. Vasculares=0 |
| G) Seguimiento | |
| Mortalidad a 30 días | 0 pacientes |
| Malignos (metástasis) | 3 pacientes (3/42=7,1%) |
| Vivos sin recidiva | 30 pacientes |
| Vivo con metástasis local | 1 paciente |
| Fallecidos | 7 pacientes (incluye 2 malignos) |
| Perdido seguimiento | 4 pacientes |
Siguiendo a los autores de mayor experiencia en el tratamiento quirúrgico de los PGC1-5, en 2009 decíamos7: es característico de los PGC su inicio asintomático y lento crecimiento. En su evolución pueden comprimir diversas estructuras y ocasionar manifestaciones clínicas, neurológicas, etc., aunque desde el punto de vista local es infrecuente su comportamiento maligno. También decíamos que precisamente su crecimiento, aunque lento pero progresivo, y el riesgo de malignización de los PGC obligaban a plantear su tratamiento. Que al no existir un tratamiento conservador (medicación) la cirugía era el único procedimiento curativo, estando indicada en todos los pacientes con aceptable riesgo. Conjuntamente consideramos la radioterapia como un tratamiento alternativo o complementario a la cirugía en situaciones de irresecabilidad, recurrencia o malignización; como tratamiento inicial, la radioterapia tenía escasos argumentos frente a la cirugía: solo el estado general del paciente, los riesgos de disfunción de pares craneales en ciertos casos quirúrgicos y el rechazo al tratamiento quirúrgico. También exponíamos que la actitud pasiva wait and scan era compartida por muy pocos.
Finalmente referíamos que la cirugía es tanto más sencilla y exenta de complicaciones cuanto más temprano sea el diagnóstico y su tratamiento (supuestamente un solo tumor y de pequeño tamaño). Esto no contradice que en casos de pacientes muy mayores, con tumores pequeños y asintomáticos, con corta expectativa de vida o en casos de tumores múltiples sea más apropiada la actitud wait and see. En estos y en situaciones de contraindicación quirúrgica formal es aconsejable la conducta expectante.
Pero las cosas han cambiado. Así, aunque la cirugía sea el tratamiento universalmente aceptado para los PGC, el impacto de la cirugía sobre los nervios craneales y la arteria carótida a menudo se ha subestimado. Por ello, y por otras consideraciones, cada vez se contemplan más otras posibilidades tales como la radioterapia o el seguimiento sin tratamiento.
En apoyo de la radioterapiaUna reciente revisión sistemática de Suárez et al.8 valoró la eficacia y la seguridad de la cirugía y la radioterapia en el tratamiento de los PGC. Se identificaron 67 artículos que incluían 2.175 pacientes tratados quirúrgicamente y 17 artículos con 127 pacientes tratados con radioterapia. El seguimiento a largo plazo se obtuvo en el 93,8% de los pacientes quirúrgicos y en el 94,5% del grupo radioterapia. La cirugía presentó un 22,2% de déficits permanentes de algún nervio craneal, mientras que en el grupo radioterapia no se registraron nuevos déficits (a los existentes antes del tratamiento). La arteria carótida común/interna se resecó en el 12,5% de los pacientes debido a lesión o atrapamiento tumoral, con reconstrucción inmediata en el 78,2%. El 3% de los pacientes desarrolló un ACV permanente y el 1,3% murió debido a complicaciones postoperatorias. Los principales tipos de complicaciones y la mortalidad global después del tratamiento también fueron significativamente superiores en las series quirúrgicas, fundamentalmente en casos de tumores grandes (ShamblinIII). Por lo tanto, el presente análisis pone en evidencia que la radioterapia ofrece una oportunidad similar de control del PGC con menor riesgo de morbilidad en comparación con la cirugía. Se cuestiona así la noción tradicional de que la cirugía debe ser la base del tratamiento; hecho que se magnifica en los casos quirúrgicos complejos y donde el equipo quirúrgico tenga escasa experiencia en el tratamiento de estos tumores.
En apoyo de la observación-seguimiento (wait and scan)Las políticas pasivas están basadas en el conocimiento de la historia natural de los PGC, que consideran a estos tumores de crecimiento muy lento. No obstante, es preciso resaltar que existen muy pocos estudios que evalúan la tasa de crecimiento de los PGC no operados.
En 2000, Jansen et al.9 son de los primeros en recomendar de forma científica la observación y seguimiento en casos seleccionados. En 20 pacientes con PGC (volumen de 2,3cm3) seguidos una media de 4,5 años, observaron un crecimiento superior al 20% en el 60% de los casos, con un crecimiento medio de 0,83mm/año, llegando a doblar su tamaño cada 7,13años; conjuntamente señalaron un crecimiento bifásico (menor en los tumores pequeños y grandes respecto de los medianos).
En 2010, Langerman et al.10 identificaron 43 pacientes con 47 tumores (28 PGC y 19 vagales) para política de observación. Las razones fueron la preferencia del paciente (35%), la edad avanzada (28%) y la existencia de déficits contralaterales de los nervios craneales (26%). El tamaño medio del tumor fue de 2,6cm (rango de 1,0 a 7,2cm). Durante una media de seguimiento de 5años (rango, 1-17años) el 42% de los casos se mantuvieron estables en tamaño, el 38% crecieron y el 20% disminuyeron. De los 17 tumores que crecieron, el promedio fue de 2mm/año.
Por lo tanto, ambos estudios apoyan que la observación y el seguimiento regular con pruebas de imagen parece una estrategia válida en el manejo de pacientes seleccionados tales como aquellos con tumores pequeños (<2cm), mayores, con comorbilidad, máxime si son asintomáticos o donde la cirugía se prevea compleja.
En este sentido es preciso recordar cuándo se considera inaceptable o elevado el riesgo quirúrgico: a) pacientes con lesión de pares craneales o del tronco simpático contralateral; b) pacientes con PGC bilaterales, si después de la primera resección se presenta hipertensión refractaria (patología del barorreceptor); c) en los pacientes del grupoiii de Shamblin (mayor probabilidad de lesión nerviosa y vascular) debe valorarse cuidadosamente el riesgo/beneficio, y d) en los PGC residuales y/o PG multifocales, que modifican el riesgo/beneficio.
La cirugía como método terapéutico de elecciónA pesar de todo lo referido, la única opción curativa y que garantiza la resección completa de un PGC sigue siendo la cirugía. En los PGC, a diferencia de otros PG cervicocefálicos (vagal o yugulotimpánico), existe un amplio consenso en que el tratamiento de elección es la resección quirúrgica, dado que el riesgo operatorio es aceptable.
Según Knight et al.11, las razones para resecar un PGC son: a) algunos tumores son malignos en el momento de la cirugía, aunque no lo sepamos hasta años después; b) no disponemos de un óptimo método de seguimiento (progresión del tumor); c) no existe evidencia en la literatura científica de regresión espontánea; d) en manos expertas, el riesgo de resección de un PGC pequeño (ShamblinI) es mínimo, y e) todo tumor puede hacerse sintomático.
Con la información actual, el objetivo del tratamiento de los PGC ha cambiado y busca: 1)prolongar la supervivencia; 2)mejorar la calidad de vida; 3)evitar el crecimiento del tumor (causa de sintomatología); 4)evitar la malignización, y 5)eliminar la fuente de catecolaminas (u otros productos vasoactivos) en los raros casos de tumores secretores.
Investigando estos objetivos, De Flines et al.12 estudian la evolución de 86 pacientes con PG (49 con PGC) e informan que la presencia de un PG no reduce la expectativa de vida y que, por tanto, el objetivo fundamental en estos pacientes es preservar o mejorar su calidad de vida más que curar la enfermedad. Conjuntamente recordar que aunque actualmente la mortalidad perioperatoria es baja (1%)5-6, tampoco es una cifra despreciable.
Por otro lado, la morbilidad poscirugía, fundamentalmente las lesiones de pares craneales, ronda el 20% según las series europeas más amplias5-6. En este sentido, los únicos estudios realizados sobre calidad de vida en pacientes con PGC refieren que la presencia de un PG reduce la calidad de vida y que esta no mejora después de la cirugía si surgen complicaciones postoperatorias, e incluso empeoran si aparecen síntomas específicos, tales como disfonía13-14.
Actualmente también sabemos que la presencia de la mutación SDHB (complejo succinato deshidrogenasa) se asocia a peor supervivencia después de la resección de un PGC15, lo que sugiere que ante su presencia se debe ser agresivo quirúrgicamente. En nuestra experiencia, la presencia de esta mutación se asoció en 2 de los 3 casos de posterior evolución maligna16. Otras mutaciones del SDH más frecuentes, como la SDHD, tienen bajo riesgo de malignización, pero están más relacionadas con PG múltiples (sincrónicos o metacrónicos), y por eso precisan seguimientos periódicos17.
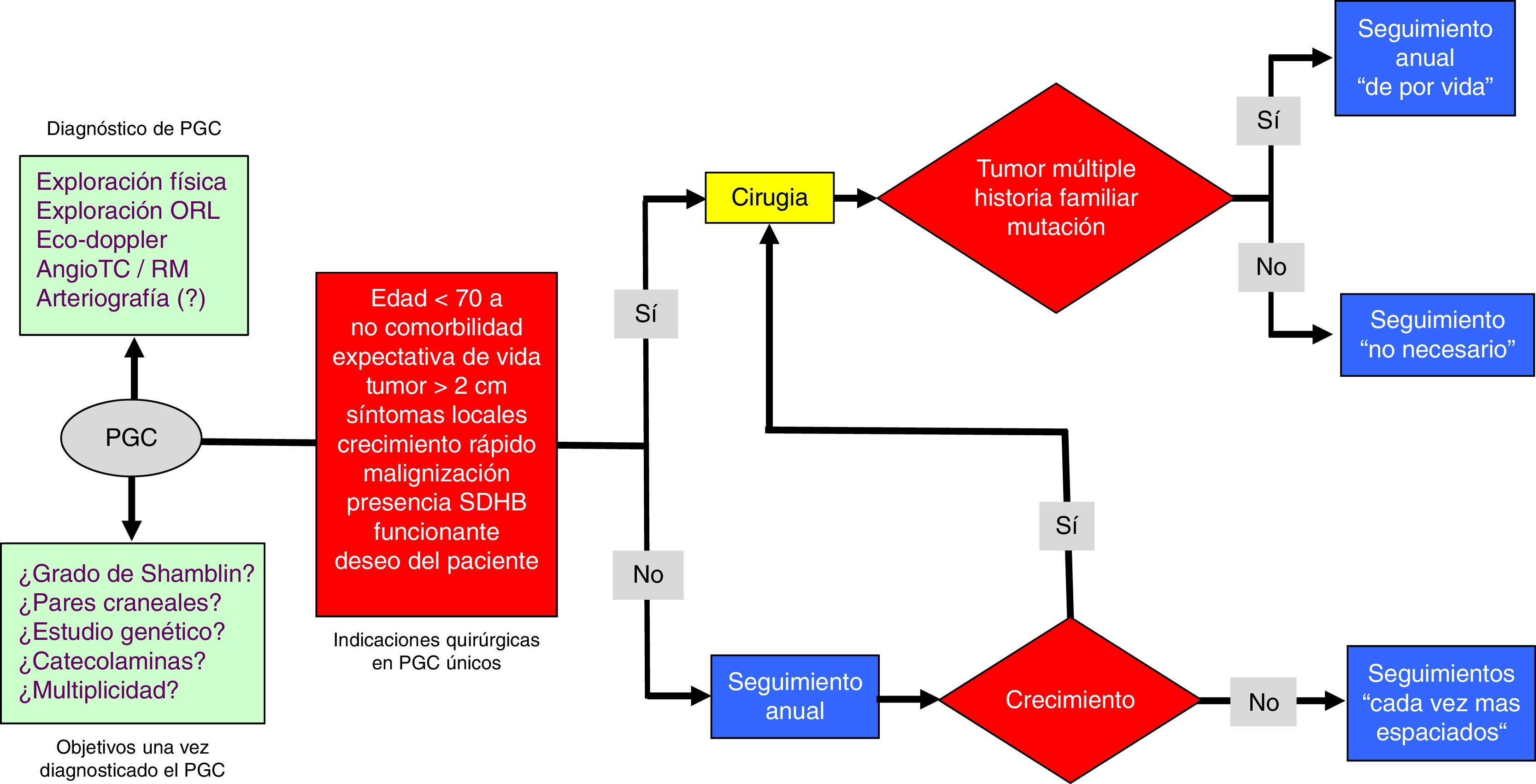
Por ello, y aunque se mantiene en general la indicaciones dadas hace 10 años por Knight et al.11, estas han variado y deben tener en cuenta los siguientes 10 aspectos: 1) edad del paciente; 2) su comorbilidad; 3) su expectativa de vida; 4) el tamaño del tumor; 5) la sintomatología (afectación de pares craneales); 6) el crecimiento del tumor; 7) la existencia de criterios de malignización; 8) el perfil genético (importancia del SDHB) del paciente; 9) la posible secreción de productos vasoactivos por parte del PG (p.ej., catecolaminas), y 10) el deseo del paciente a ser tratado. Conjuntamente existen 2 aspectos adicionales que cobran especial importancia: a) bilateralidad del PGC, y b) multiplicidad de PG (sincrónicos y metacrónicos).
- 1)
Edad. Para algunos la edad cronológica es un factor importante a la hora de indicar cirugía en los PGC; González-Orús et al.18 la contraindican por encima de 65 años y en ausencia de parálisis de pares craneales, síntomas secretores o malignización, aconsejando la observación y el seguimiento de estos pacientes.
- 2)
Comorbilidad. Como en cualquier cirugía, un alto riesgo operatorio por elevada comorbilidad (p.ej., ASA IV) puede contraindicar la cirugía más sencilla.
- 3)
Expectativa de vida. Basado en los 2 aspectos previos (edad y comorbilidad). Se entiende fácilmente la abstención quirúrgica en pacientes con una corta expectativa de vida.
- 4)
Tamaño del tumor. Desde los trabajos iniciales de Shamblin sabemos que existe una fuerte correlación entre el tamaño del tumor y la frecuencia de complicaciones relacionadas con la cirugía (a mayor tamaño, mayor número de complicaciones intraoperatorias).
- 5)
Síntomas preoperatorios y/o afectación de pares craneales. Derivados del crecimiento del tumor y de la compresión del mismo a estructuras próximas; es un criterio de indicación quirúrgica.
- 6)
Crecimiento del tumor. La progresión del tumor, en el momento del diagnóstico o después de un periodo de observación, es una clara indicación quirúrgica para la gran mayoría de autores.
- 7)
Malignización. Es infrecuente en los PGC; solo un 4,2% en la amplia serie europea de Sajid et al.5. Cuando el diagnóstico de malignidad está basado en el estudio anatomopatológico de ganglios metastásicos la cirugía es el tratamiento más recomendable, con la finalidad de prevenir futuras diseminaciones. El conocimiento preoperatorio de existencia de una mutación SDHB, como ya hemos referido, es de enorme utilidad: la asociación con PGC malignos es elevada.
- 8)
Perfil genético. Los PG familiares son el 30-40% del total. Los pacientes con mutaciones del SDH requieren un seguimiento de por vida, con estudios de imagen para detectar precozmente la aparición de otros tumores. La mayoría de PGC (únicos, pequeños en tamaño, asintomáticos, no funcionantes, etc.), no familiares y sin mutaciones pueden beneficiarse de las actitudes conservadoras referidas (wait and scan), y estos, una vez resecados (al crecer o aparecer sintomatología), no precisan seguimiento evolutivo.
- 9)
Secretores. Solo el 3-5% de los PG de cabeza y cuello son secretores de catecolaminas. La cirugía es el tratamiento preferible en esta situación. La resección elimina la fuente de secreción de catecolaminas y la sintomatología derivada de la misma.
- 10)
Finalmente, y como bien señalan Paridaans et al.6, el deseo del paciente es otro criterio de indicación quirúrgica.
Con todos estos criterios, planteamos una propuesta de algoritmo para la indicación quirúrgica de los PGC únicos o aislados (fig. 1).
BilateralidadUn 5-10% de pacientes con PGC son bilaterales. En estos casos se deben aplicar consideraciones especiales. Inicialmente es importante saber que existe una predisposición genética subyacente, lo que sitúa a estos pacientes en un mayor riesgo de desarrollar lesiones adicionales o multicéntricas.
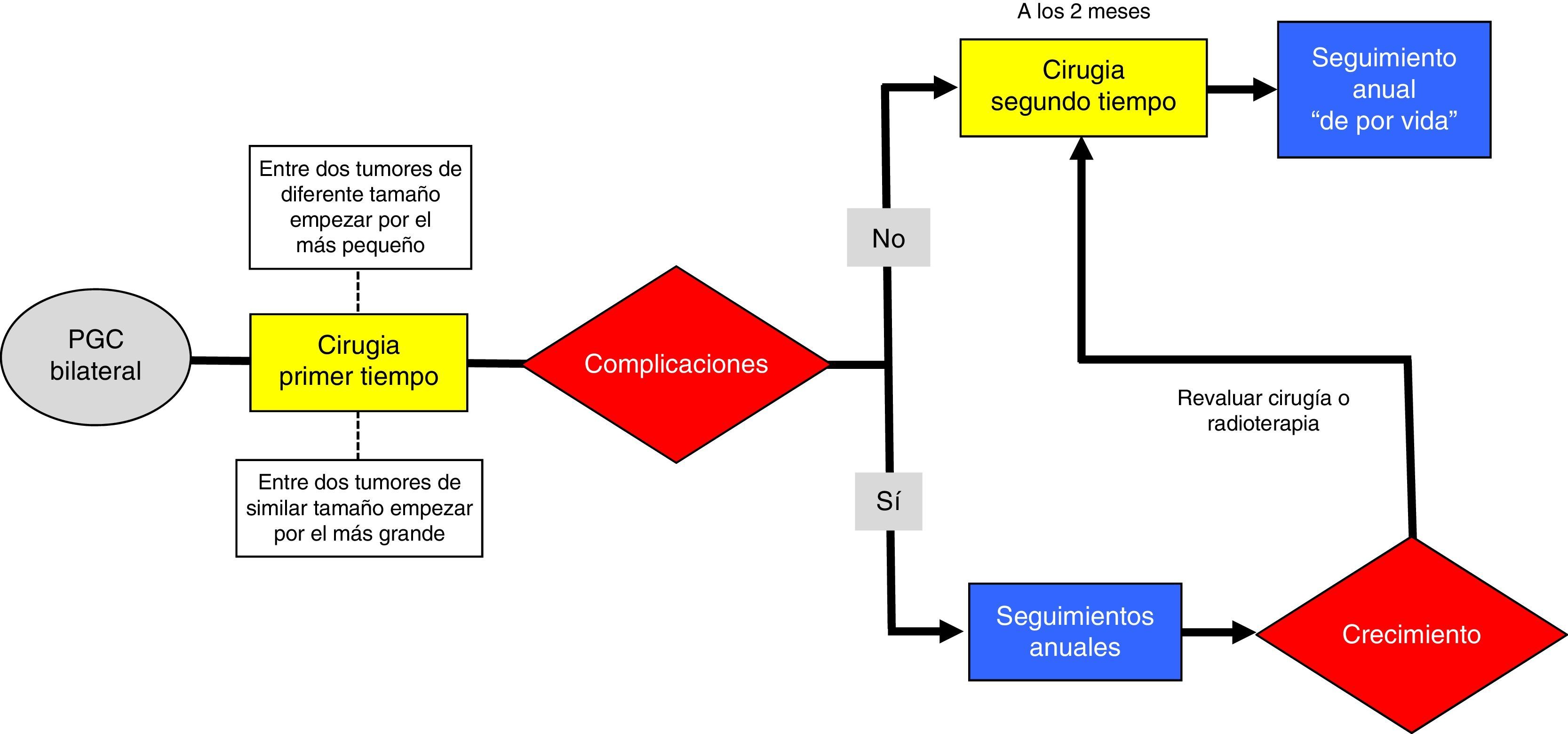
Una clásica revisión de la literatura encontró 107 pacientes, 67 de los cuales fueron resecados bilateralmente, algunos sorprendentemente en el mismo acto operatorio19. Actualmente sabemos que las formas bilaterales no deben tratarse en el mismo acto quirúrgico, fundamentalmente por el riesgo bilateral de lesión nerviosa. Antes de la segunda intervención debe evaluarse cuidadosamente la funcionalidad de las cuerdas vocales y la deglución del paciente. Ante una lesión de los nervios vago o hipogloso debe ser valorada la segunda cirugía, pues en caso de lesión bilateral la evolución es dramática. En esta situación debemos actuar de forma conservadora —seguimiento del segundo tumor—, y en caso de crecimiento o hacerse sintomático, contemplar la radioterapia como alternativa terapéutica.
Según Moore et al.20, son factores adicionales a tener en cuenta en los PGC bilaterales la cirugía o la radioterapia previa del cuello, la situación neurológica, la esperanza de vida del paciente, su función pulmonar y la reserva para la deglución. En los pacientes ancianos o en aquellos con disfagia preexistente o patología pulmonar, la observación o la radioterapia pueden ser conductas apropiadas.
Cuando se considera la cirugía, es necesario hacerlo de forma gradual para minimizar el riesgo bilateral de neuropatías craneales y/o el impacto en la circulación cerebral. La elección de qué lado operar en primer lugar es una cuestión de debate, y no hay literatura concluyente. Cuando existe un tumor grande y otro pequeño, primero se interviene el pequeño para minimizar complicaciones. Si surgen complicaciones postoperatorias, las opciones de observación o radioterapia para el tumor restante deben ser consideradas. Cuando ambos tumores son similares en tamaño, el más grande debe ser tratado inicialmente; el tumor más pequeño se puede observar o radiar después si se producen complicaciones neurológicas en el momento de la primera operación.
Otra complicación que hay que considerar si resecamos, aunque sea secuencialmente, dos PGC es el riesgo de hipertensión inestable por denervación de los barorreceptores del seno carotídeo (síndrome de fallo del barorreceptor). Debido a esta rara eventualidad, aunque cada vez más reconocida, la observación o la radioterapia se consideran a menudo para el segundo lado, con la finalidad de evitar este problema20.
Si no surgen complicaciones y no existen contraindicaciones, la segunda cirugía puede realizarse aproximadamente 2 meses después. El planteamiento de la radioterapia primaria en ambas carótidas no descarta el síndrome de fallo del seno.
Presentamos una propuesta de algoritmo para la indicación quirúrgica de los PGC bilaterales (fig. 2).
MultiplicidadEste aspecto, que incluye la bilateralidad de un PGC, es todavía más complejo que aquel. La asociación más común de PG múltiples son los PGC bilaterales ya referidos. No obstante, un 2% de pacientes con PGC pueden presentar simultáneamente un PG en otra localización cervicocefálica (vagal o yugulotimpánico). En casos de asociación entre PGC y vagal contralateral, la primera cirugía debe corresponder al PGC.
La presencia de 3 PG es realmente infrecuente pero posible. En estas situaciones la ubicación del PG es importante en la toma de decisiones; por ejemplo, en el caso más que excepcional de PGC único o bilateral y vagal bilateral estará siempre contraindicada la resección bilateral del PG vagal21.
Existen muchas posibles combinaciones (casi todas con algún caso publicado en la literatura), pero la asociación PGC bilateral y PG vagal unilateral es de las más referidas. La cirugía debe planificarse en 2 tiempos, al igual que en los PGC bilaterales únicos. Si después de la primera cirugía del PGC el hipogloso y el vago no han sufrido lesión, se puede realizar el segundo tiempo para resecar el segundo PGC y el PG vagal. En caso de lesión en la primera cirugía, la segunda (donde asienta el PG vagal) está contraindicada, ya que la resección de un PG vagal generalmente comporta la lesión del vago. En este caso, la radioterapia (u observación) es la primera elección terapéutica.
En los PG múltiples la radioterapia y la observación-seguimiento cobran especial importancia22. El seguimiento en casos familiares (y mutaciones SDH) es particularmente importante en busca de PG metacrónicos, que pueden aparecer en amplios intervalos de tiempo (2-46 años; media de 12,1 años) después de tratado el primer tumor22-23.
Finalmente se han descrito PGC asociados a otras situaciones, tales como neoplasia endocrina múltiple (MEN-IIA y IIB), síndrome de Hippel-Lindau, neurofibromatosis tipo 1, tríada de Carney (PG, leiomioma gástrico y condroma pulmonar), adenoma paratiroideo, astrocitoma, carcinoma de tiroides y tumor de la pituitaria. En todas estas situaciones, lógicamente, es muy importante la estrategia diagnóstica (búsqueda) y terapéutica.
Debido a la variabilidad de los PG multicéntricos, no es posible proponer un algoritmo terapéutico, siendo necesario individualizar cada paciente. La finalidad será determinar los beneficios y potenciales riesgos de las opciones terapéuticas, incluida las prioridades (tiempos) en caso de tumores sincrónicos.
En resumen, la indicación quirúrgica de los PGC, basada solamente en la presencia de síntomas y el tamaño del tumor, ha cambiado. En la actualidad existe un cambio del paradigma terapéutico de estos PG.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEn este manuscrito no existen conflictos de intereses.
Parte de este artículo fue presentado durante la XV Convención bianual de Cirujanos Vasculares de Habla Hispana (CVHH). Quito (Ecuador), 9-12 de octubre de 2015.