La isquemia mesentérica aguda es un estado de hipoperfusión brusca del intestino que ocasiona un problema clínico muy grave con elevada morbimortalidad. La sintomatología es inespecífica y el diagnóstico, a menudo, se consigue mediante una laparotomía exploradora, a veces tardía, cuando el cuadro de peritonitis ya se ha establecido. Para mejorar el pronóstico de esta entidad es fundamental el diagnóstico precoz. Los datos analíticos (leucocitosis, elevación de lactato y dímero-D) y la realización de una angiotomografía computarizada permiten con bastante fiabilidad establecer el diagnóstico y su posible causa (embolia, trombosis arterial, trombosis venosa o síndrome isquémico no oclusivo). El principio quirúrgico básico es la resección de los segmentos necróticos intestinales y la reinstauración de la circulación esplácnica. La cirugía abierta ha sido el tratamiento quirúrgico de elección en las últimas décadas, pero las técnicas endovasculares (guías, catéteres, stent, etc.) son hoy día una parte integral del arsenal terapéutico de los cirujanos vasculares. En este artículo de revisión se comentan las principales características diagnósticas y los opciones de tratamiento de esta grave enfermedad.
Acute mesenteric ischemia is a state of sudden hypoperfusion of the bowel that causes a serious clinical problem with high morbidity and mortality. The symptoms are non-specific and the diagnosis is often achieved by an exploratory laparotomy, sometime later, when the peritonitis has been already established. Early diagnosis is essential to improve the prognosis of this pathology. Analytical data (leukocytosis, elevated lactate and D-dimer), and performing a computed tomography angiography helps establish the diagnosis and possible cause (embolism, arterial thrombosis, venous thrombosis, or non-occlusive ischemic syndrome). The main treatment is surgical resection of necrotic bowel segments and the restoration of the splanchnic circulation. Open surgery has been the treatment of choice in recent decades, but the endovascular techniques (guides, catheters, stent, etc.) are nowadays an integral part of the armamentarium of vascular surgeons. This review article discusses the main diagnostic features and treatment options for this serious disease.
La isquemia intestinal aguda (IIA) se puede definir como aquella situación de hipoxia del intestino debida al descenso brusco de la perfusión sanguínea causada por una embolia o por una trombosis arterial o venosa. Sigue siendo, por desgracia, una enfermedad grave y muchos pacientes fallecen a pesar de instaurar un tratamiento correcto.
La sintomatología es inespecífica y el diagnóstico, a menudo, se consigue mediante una laparotomía exploradora, a veces tardía, cuando el cuadro de peritonitis ya se ha establecido. Para mejorar el pronóstico de esta entidad es fundamental el diagnóstico precoz. Para ello, se necesita un elevado nivel de sospecha clínica y la instauración rápida de medidas exploratorias complementarias encaminadas a su confirmación y a un tratamiento efectivo.
Esta enfermedad es relativamente infrecuente. Entre todos los pacientes que llegan a un servicio de urgencias con dolor abdominal, solo un 0,5%1 tienen IIA. En estudios observacionales, la mortalidad a los 30 días es del 60-85%1 para los pacientes que no son tratados quirúrgicamente tras un diagnóstico establecido. Otro factor contribuyente a este mal pronóstico son las características de comorbilidad asociada, ya que suelen ser pacientes mayores con enfermedad pulmonar obstructiva crónica, cardiopatía isquémica o aterosclerosis generalizada. En la mayoría de los estudios, la edad media de los pacientes es de 70 años. Dos tercios de estos pacientes son mujeres. La isquemia intestinal secundaria a trombosis venosa mesentérica suele tener mejor pronóstico y representa el 5-15% de todos los casos. La mortalidad a los 30 días es del 30%1.
Etiología y fisiopatologíaEl territorio esplácnico se irriga a través de 3 vasos: el tronco celíaco, la arteria mesentérica superior (AMS) y la arteria mesentérica inferior (AMI), que nacen en la cara anterior de la aorta a la altura de T12, L1 y L3, respectivamente. Existen conexiones anatómicas normales entre los 3 troncos, que cumplen un papel fundamental como compensación de flujo colateral, ante la eventual oclusión de uno de ellos. Pero de todas las arterias, la AMS es la principal, ya que irriga el intestino delgado y la primera mitad del colon. La AMI y ramas de la arteria hipogástrica perfunden la parte distal del colon y recto, razón por la que la oclusión de la AMI raramente causa isquemia.
Dado que casi todo el intestino se irriga por una única arteria, la oclusión brusca de la AMS tiene efectos devastadores. La respuesta inicial es una contracción y vasoespasmo importante. Debido a la elevada actividad metabólica de la mucosa intestinal, que consume el 80% de la sangre arterial, las células de las vellosidades se necrosan primero, pudiendo observarse microscópicamente los cambios isquémicos a los 30 min de la oclusión. Estos pacientes presentan dolor abdominal de instauración brusca que se acompaña, de forma muy precoz, con vómitos y diarrea y, en ocasiones, sangre en heces. En el transcurso de la enfermedad y como consecuencia de la liberación de mediadores bioquímicos intestinales, se produce cierta hipotensión reactiva que contribuye a incrementar el daño isquémico de la pared intestinal. Esto es seguido por una necrosis difusa en la mucosa, que se extiende a toda la pared intestinal. El resultado es un infarto transmural y una peritonitis local. El intestino puede perforarse y entonces el paciente desarrolla una peritonitis. La acidosis metabólica, deshidratación, anuria y fallo multiorgánico pueden ser los eventos posteriores que desencadenen el resultado final.
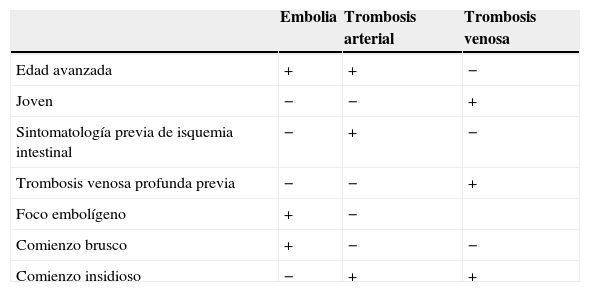
La principal etiología de la IIA es la embolia o trombosis de la AMS (tabla 1). Una causa menos frecuente es la trombosis venosa mesentérica (tabla 2), que cuando ocurre suele afectar a pacientes más jóvenes y, habitualmente, es secundaria a un traumatismo, inflamación o a estados de hipercoagulabilidad. Finalmente, como consecuencia de disfunciones cardiológicas pueden producirse situaciones de isquemia intestinal no oclusiva por bajo gasto1,2.
Etiología de la isquemia mesentérica aguda por oclusión arterial
| Embolia mesentérica |
| Cardiopatía embolígena |
| Arritmias (fibrilación auricular) |
| Valvulopatías |
| Trombos murales |
| Infarto de miocardio |
| Insuficiencia cardiaca |
| Aneurisma ventricular |
| Miocardiopatía dilatada |
| Endocarditis |
| Cardioversión |
| Embolia paradójica |
| Ateroembolismo |
| Embolismo iatrogénico |
| Trombosis mesentérica |
| Arterioesclerosis |
| Aneurismas |
| Disección aórtica o mesentérica |
| Embolización terapéutica |
| Vasculitis |
| Enfermedad de Buerger |
| Displasia fibromuscular |
| Traumatismos (iatrogénicos o accidentales) |
| Trastornos hematológicos |
| Síndromes mieloproliferativos |
| Disproteinemias |
| Síndromes de hipercoagulabilidad |
Fuente: Rodríguez de la Calle et al.17.
Etiología de la isquemia mesentérica aguda por trombosis venosa
| Primaria |
| Deficiencia de antitrombina III |
| Deficiencia de proteína C |
| Deficiencia de proteína S |
| Policitemia vera |
| Trombocitosis |
| Anticonceptivos orales |
| Neoplasias |
| Embarazo |
| Esplectomía |
| Anemia de células falciformes |
| Síndrome mieloproliferativo |
| Secundaria |
| Procesos sépticos intraabdominales: apendicitis, diverticulitis, colangitis, perforación gastrointestinal, abscesos |
| Pancreatitis aguda y crónica |
| Enfermedad inflamatoria intestinal |
| Hipertensión portal |
| Gastroenteritis aguda |
| Neoplasia |
| Traumatismo abdominal |
Fuente: Brandt et al.18.
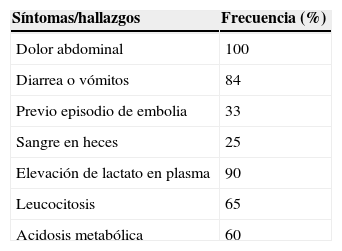
En muchos pacientes la presentación clínica inicial de la oclusión de la AMS es bastante inespecífica, haciendo que la sospecha diagnóstica sea difícil. La tríada de síntomas que puede hacer sospechar una IIA es (tabla 3): intenso dolor periumbilical, vómitos o diarrea, antecedente previo de embolismo o situaciones clínicas embolígenas.
Porcentaje de pacientes con síntomas y hallazgos analíticos en el momento del ingreso hospitalario por IAI1
| Síntomas/hallazgos | Frecuencia (%) |
|---|---|
| Dolor abdominal | 100 |
| Diarrea o vómitos | 84 |
| Previo episodio de embolia | 33 |
| Sangre en heces | 25 |
| Elevación de lactato en plasma | 90 |
| Leucocitosis | 65 |
| Acidosis metabólica | 60 |
Cuando la tríada diagnóstica está presente, es relativamente fácil sospechar el diagnóstico, aunque deberemos realizar diagnóstico diferencial con otras causas de dolor abdominal. El dolor, el cual a menudo precede a los vómitos y a la diarrea, es el síntoma clave. Suele tener un comienzo brusco y una localización periumbilical. Tiene características cólicas. Es un dolor desproporcionado para la exploración física. El dolor desaparece cuando aparece necrosis intestinal, entonces hay un periodo libre de dolor que suele malinterpretarse como que el paciente ha mejorado. El dolor reaparece cuando el intestino se perfora. El 95% de estos pacientes tiene antecedentes de cardiopatía y el 30% han presentado episodios de embolias previos en otras localizaciones del árbol arterial. Las embolias son frecuentes después de un infarto agudo de miocardio, en el inicio de una fibrilación auricular y como complicación de una arteriografía o un tratamiento endovascular.
TrombosisOcurre en pacientes con aterosclerosis generalizada y antecedentes de cardiopatía o arteriopatía periférica. El comienzo de la sintomatología en estas ocasiones es más insidioso que en las embolias. El dolor es, habitualmente, constante y progresivo aunque a veces tiene las mismas características que en situaciones embólicas.
En la trombosis de la vena mesentérica, la duración de los síntomas suele ser de varios días y es todavía más imprecisa que en la trombosis arterial. Suelen presentar fiebre y el 85% de los pacientes presentan alteraciones de hipercoagulabilidad que predisponen a esta enfermedad, como por ejemplo: gestación, anticonceptivos orales, neoplasias, enfermedades inflamatorias, hipertensión portal o traumatismos1,2.
Exploración físicaLos hallazgos en la exploración física de la IIA son imprecisos y difíciles de interpretar. Por ello, es muy importante examinar cuidadosamente al paciente. En la exploración física podemos apreciar la existencia de signos de aterosclerosis como soplos carotídeos o soplos cardiológicos, al igual que la existencia de posibles focos embolígenos.
Los hallazgos en la exploración abdominal son la base para el tratamiento urgente. Podemos encontrar signos de peritonitis, más relacionados con las trombosis arteriales que con las venosas2.
DiagnósticoEn la mayoría de los pacientes, la tríada diagnóstica no es completa y en muchas ocasiones hay que realizar una laparotomía exploradora. Los datos analíticos pueden reforzar el diagnóstico. Las exploraciones complementarias indicadas son una radiografía abdominal que descarte la presencia de neumoperitoneo o una angiotomografía computarizada (angio-TC). La arteriografía diagnóstica, aunque presenta signos inequívocos de la oclusión arterial y su posible causa, no está disponible en la mayoría de los centros por su carácter invasivo y puede en ocasiones retrasar el tratamiento. Por otra parte, el estudio con ecodoppler es difícil de realizar debido a la existencia de gas intestinal. En manos muy experimentadas puede localizar la oclusión de la AMS. Una posible ventaja de la ecografía es descartar la existencia de otras causas de abdominalgia, tales como problemas renales o vesiculares (tabla 4).
Suele presentarse una leucocitosis ya en fases precoces de la enfermedad. La presentación de la tríada clínica clásica junto con cifras de leucocitos superiores a 15.000 l/mm3 es patognómica de la enfermedad. Niveles plasmáticos elevados de lactato y dímero-D también son sugestivos de la necesidad de un tratamiento quirúrgico. Cuando la concentración de lactato excede los 2,6 mmol/l es considerado altamente sensible de isquemia mesentérica aguda (90-100%), su especifidad, sin embargo, es baja (40%). En estas circunstancias también cabe descartar shock, diabetes, fallo renal, pancreatitis. A medida que evoluciona la enfermedad y se pierde líquido en un tercer espacio intestinal, se incrementa la leucocitosis, junto con la elevación de la hemoglobina y el hematocrito por hemodilución. Posteriormente, cuando ya existe necrosis intestinal, se produce una pérdida sanguínea a la luz intestinal con la subsiguiente caída del hematocrito y de la hemoglobina. El equilibrio ácido-base se ha de vigilar ya que evoluciona hacia un estado de acidosis1.
Angiotomografía computarizadaEsta prueba de imagen ha reemplazado de manera progresiva en los últimos años a la arteriografía. Su carácter no invasivo y la amplia disponibilidad en los centros permite con bastante fiabilidad establecer el diagnóstico de IIA. En las formas arteriales, la angio-TC multicorte permite demostrar la oclusión de los vasos en sus porciones proximales con una sensibilidad similar a la proporcionada por la angiografía. Otros signos que puede mostrar son el engrosamiento y dilatación de las asas, la presencia de ascitis, gas en la porta o el infarto esplénico.
Su mayor rendimiento sigue siendo el diagnóstico de la trombosis venosa mesentérica (90-100%). De hecho, existe la recomendación expresa de solicitar una angio-TC abdominal en todo paciente con dolor abdominal sin signos de peritonitis y una historia de trombosis venosa profunda o de hipercoagulabilidad. En estos casos se podrá ver la oclusión de la vena mesentérica superior o la presencia de gas dentro de estas venas1.
TratamientoPreparación prequirúrgicaLa mayoría de los pacientes que acuden al servicio de urgencias con la historia clínica y la exploración física descrita previamente deberían ser estudiados con una angio-TC y, en su caso, una laparotomía exploradora.
Tan pronto como la necesidad quirúrgica se haya establecido, se deben adoptar las siguientes medidas:
- •
Coger una vía venosa central.
- •
Comenzar la fluidoterapia: expansores del plasma son la primera opción, sobre todo si se sospecha una trombosis venosa.
- •
Realizar un electrocardiograma.
- •
Realizar un estudio analítico con sistemático de sangre, bioquímica, incluyendo el lactato, y estudio de hemostasia con la determinación de dímero-D.
- •
Gasometría arterial para estudiar el pH y el equilibrio ácido-base.
- •
Obtener el consentimiento informado.
- •
Administración de analgésicos (opiodes intravenosos).
Se debe corregir la acidosis metabólica, reducir los fármacos vasoconstrictores o que reducen el flujo sanguíneo intestinal (digital, calcio-antagonistas, diuréticos, antiinflamatorios no esteroideos…), e iniciar la antibioterapia sistémica frente a bacterias intestinales1.
Intervención quirúrgica abiertaEl mejor acceso se logra mediante una laparotomía media. De esta forma podemos examinar todo el intestino y establecer su viabilidad. El principio básico es que solamente aquellos segmentos con necrosis transmural deben ser resecados y se debe realizar un second-look al cabo de 24 h. Los segmentos viables presentan un color rosado y suelen tener pulsaciones en las partes distales del mesenterio y el peristaltismo conservado. Una sonda doppler, cuando esté disponible, puede ayudar a delimitar las áreas necróticas con la presencia o ausencia de señales.
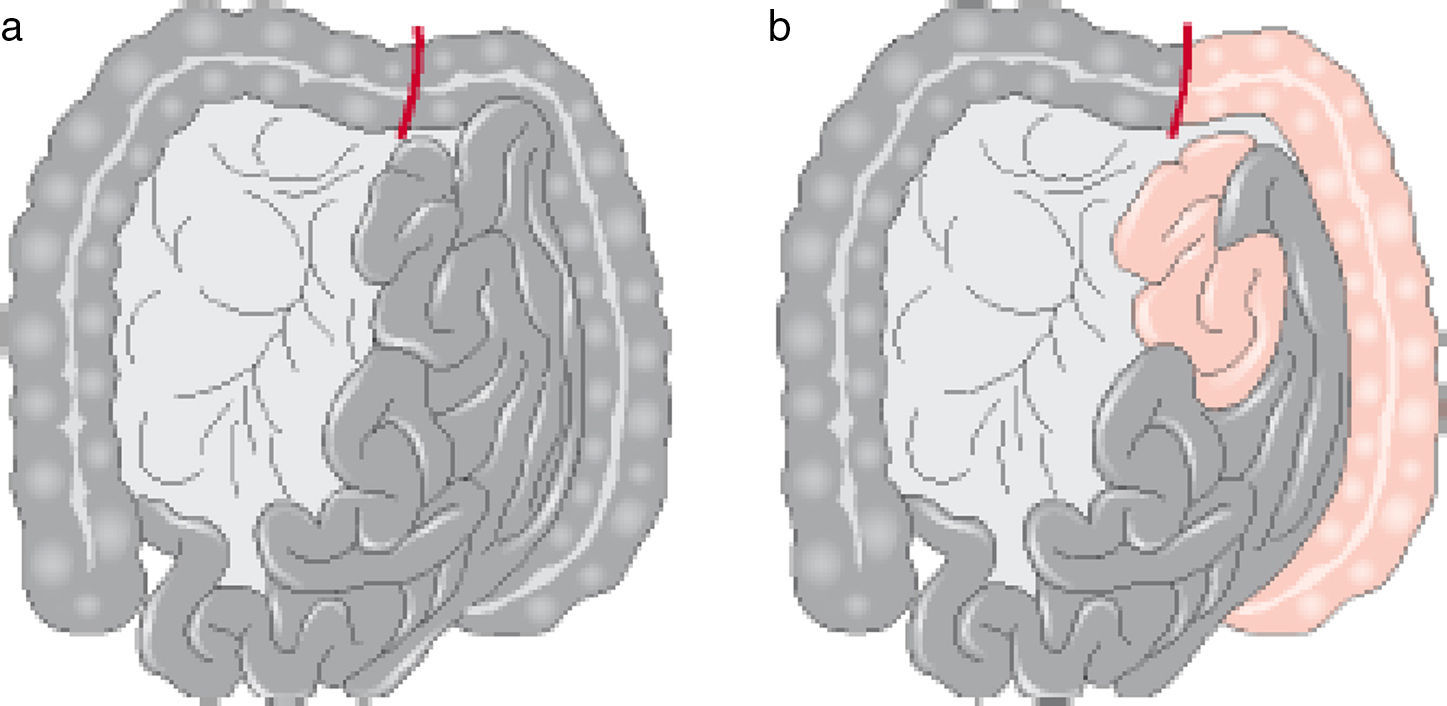
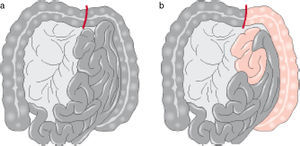
Oclusión embólicaSi la primera parte del yeyuno parece normal y hay pulso en la primera arcada arterial después del origen de la AMS, la embolia es el diagnóstico más probable (fig. 1). Bajo estas circunstancias, se debe realizar una embolectomía antes de la resección intestinal.
Isquemia aguda con necrosis intestinal. a) Intestino totalmente afectado, indica trombosis arterial. b) Isquemia intestinal con yeyuno y colon izquierdo viable, indica embolia de la arteria mesentérica superior1.
La realización de una embolectomía de la AMS consiste en movilizar el colon transverso cranealmente e identificar la AMS utilizando los dedos. Realizaremos una palpación del área ventral del páncreas detrás de la vena mesentérica superior. Posteriormente, se expone la arteria mediante una incisión longitudinal en el dorso del peritoneo, justo donde perdemos el pulso. A veces se requiere una división parcial del ligamento de Treitz para una movilización correcta de la 4.ª porción del duodeno. Disecaremos la arteria y la controlaremos con vessel-loops. Necesitamos exponer al menos 4-5cm. Administraremos 5.000 unidades de heparina sódica intravenosa al 5% y haremos un pinamiento de la arteria. Haremos una arteriotomía transversal. Comprobaremos el flujo sanguíneo proximal mediante la relajación del loop y realizaremos la embolectomía con catéter Fogarty n.° 4 o n.° 3 cortos. Si el diagnóstico ha sido correcto, podremos extraer el material trombótico y recuperar el flujo distal. Si el flujo no es adecuado se puede realizar una fibrinólisis intraarterial con urocinasa o rtPA. El cierre de la arteriotomía se realiza con una sutura de prolene 6-0 a puntos sueltos. Colocaremos el intestino en posición correcta y terminaremos con la palpación del pulso distal y la inspección del intestino. Si la viabilidad del intestino es incierta, esperaremos 20-30 min antes de decidir qué segmento del intestino resecar. Posteriormente cerraremos la laparotomía.
Trombosis arterialSi el intestino delgado y el colon están isquémicos, la causa más probable es una trombosis arterial. La embolectomía no está indicada en estos casos e incluso puede ser perjudicial. Si todo el intestino, incluyendo el colon ascendente, está necrótico, se deberá abandonar la cirugía y cerrar la laparotomía. Al menos se requiere un metro de intestino delgado para sobrevivir. En el caso de que exista una trombosis arterial, la cirugía de elección es un bypass aortomesentérico. Para ello es necesario un adecuado lecho distal, lo cual en ocasiones se consigue mediante trombectomía o trombólisis intraoperatoria y, posteriormente, verificación arteriográfica.
Trombosis venosa o isquemia no oclusivaEl intestino también se puede afectar cuando existe una trombosis de la vena mesentérica o una isquemia intestinal no oclusiva. En estos casos, la laparotomía se debe evitar pero, en aquellas circunstancias en que se realiza, el intestino se encuentra hiperémico y edematoso con sangrado petequial en la serosa. Antes estos hallazgos, se debe cerrar la laparotomía y plantear un second-look. La anticoagulación sistémica es el mejor tratamiento. Si en el second-look se aprecian segmentos de intestino isquémicos, estos se deben resecar dejando márgenes de seguridad.
La trombectomía venosa y la trombólisis se han descrito de forma esporádica y no existe mucha evidencia del beneficio para el paciente. Los pacientes con isquemia intestinal no oclusiva conservan el flujo monofásico en arterias bastantes distales al origen de la AMS. Estos pacientes precisan de optimación de la función cardiaca1,2.
Tratamiento endovascularLa cirugía abierta ha sido el tratamiento quirúrgico de elección en las últimas décadas. Dos circunstancias paralelas han contribuido al desarrollo del tratamiento endovascular en la isquemia mesentérica aguda. La primera es el desarrollo de las pruebas de imagen no invasivas (angio-TC o angio-RMN). La calidad y la disponibilidad de estos métodos ha permitido diagnosticar a muchos pacientes precozmente antes del tratamiento quirúrgico. El segundo elemento es el importante desarrollo de medios técnicos endovasculares (catéteres, guías, stent, etc.), que son hoy día una parte integral del arsenal terapéutico de los cirujanos vasculares3.
El quirófanoCuando nos planteamos realizar un tratamiento endovascular, debemos escoger un lugar que nos ofrezca las óptimas condiciones angiográficas y quirúrgicas. Lo ideal es la realización de estos procedimientos en un quirófano híbrido y, si esto no es posible, en un quirófano con un arco de fluoroscopia de alta calidad. Es importante poder trabajar con una proyección lateral para poder visualizar la AMS y el tronco celíaco. Se recomienda el empleo de la inyectora de contraste con objeto de minimizar la exposición a los rayos X, de por sí incrementada al emplear este tipo de proyecciones. También es recomendable realizar estos procedimientos bajo anestesia general, ya que a veces los procedimientos pueden ser largos y molestos para el paciente y la inmovilidad del paciente es fundamental. Además, no es infrecuente tener que realizar una laparotomía para la resección, en su caso, del intestino necrótico3,4.
AccesoLa elección del acceso debe ser individualizada, para minimizar los riesgos y las complicaciones. Generalmente, se emplea en primer lugar el acceso femoral y se reserva el acceso braquial izquierdo cuando el ángulo del vaso es muy agudo o si el abordaje femoral es dificultoso o si existe una lesión en el ostium. Cuando los abordajes anterógrados fallan, se puede realizar un abordaje retrógrado, mediante la exposición intraoperatoria de la AMS3–5.
ImagenPara la obtención de una imagen de calidad debemos emplear un catéter pigtail 5 Fr localizado en T12. Algunos autores han recomendado la administración de una ampolla de glucagón para disminuir los movimientos peristálticos del intestino, pero en nuestra experiencia esto no es necesario. El contraste es inyectado con un caudal de 20ml/s con un total de 20-25ml. Se colocará el arco en proyección anteroposterior y lateral.
Cuando se inicie la manipulación con guías, debe administrarse un bolo de heparina sódica (100 U/kg), y la colocación de un introductor largo de 7Fr (Destination; Terumo Corp, Tokyo, Japón; catéter guía de Cordis Europe, Waterloo, Bélgica o Cook Medical Inc, Bloomington, Indiana, EE. UU.) que facilite la navegación de los diferentes dispositivos. Una vez identificado el origen de los troncos viscerales, estos pueden ser selectivamente cateterizados. Aun así, debemos tener especial cuidado ya que el coágulo en el origen de la arteria puede ser desplazado. Tanto la AMS como la TC pueden ser cateterizados con un catéter tipo Bentson (www.cookmedical.com). Se debe dirigir el catéter a una posición anterior y levemente hacia la izquierda mientras descendemos por la aorta abdominal, hasta conseguir entrar en la arteria. Posteriormente, debemos confirmar nuestra ubicación con una pequeña cantidad de contraste manual (es suficiente 15ml), manteniendo la secuencia tanto tiempo como sea necesario para permitir rellenar los vasos viscerales, tanto arterias como venas3,4.
Embolectomía por aspiraciónPasaremos primero una guía hidrofílica de 0,035 in y sobre esta aproximaremos el introductor al émbolo. La guía rígida Amplatz (Boston Scientific®, Miami, FL, EE. UU.) debe evitarse, ya que existe riesgo de disección o rotura arterial. Por dentro del catéter guía, podemos introducir un catéter de 4-6 Fr que ubicaremos en el coágulo y se realizará la aspiración con una jeringa de 20ml. Habitualmente se necesita repetir el procedimiento varias veces para poder aspirar completamente el coágulo. Posteriormente, realizaremos una angiografía de control. Estos catéteres de aspiración tienen una doble luz, una luz para pasar la guía y otra para realizar la aspiración. Actualmente se encuentran disponibles catéteres aspiración sobre guía (Export XT aspiration catheter, Medtronic, Minneapolis, Minnesota, EE. UU.; Fetch, www.possis.com). La ventaja de estos catéteres es que permiten aspirar trombos más pequeños distales y mantener una posición estable en el vaso proximal mientras se realiza la aspiración6,7.
Trombolisis de AMSLa trombolisis como único tratamiento en la isquemia mesentérica aguda es infrecuente, pero aun así se han descrito buenos resultados, aunque la literatura es limitada. Una revisión por Schoots et al.8, publicada en 2005, incluyó un total de 48 casos tratados con trombolisis, 30 de los cuales no precisaron intervención quirúrgica y 43 pacientes sobrevivieron. Para otros autores es una técnica coadyuvante de la trombectomía.
La trombolisis está indicada en los casos con una aspiración incompleta del trombo o con embolización distal4,9. Esta decisión ha de ser cuidadosamente tomada y ser reservada para pacientes en los que se sospeche una escasa afectación intestinal, ya que puede provocar hemorragia gastrointestinal por una mucosa ya afectada por la isquemia.
Para su realización se necesita la cateterización selectiva de la AMS con un catéter de 4 Fr y se emplea rTPA a dosis de 0,5 a 1 mg/h. Se debe realizar un control angiográfico cada 12 h con independencia del estado clínico del paciente8.
Stenting en las arterias viscerales en la isquemia mesentérica agudaTanto en la oclusión aguda de tipo embólico como de origen trombótico se ha descrito con éxito el empleo de stent sin necesidad de trombo apiración o trombolisis. En estos casos se aconseja emplear stent montado sobre balón. No se recomienda en casos de embolia la realización de angioplastia previa que pueda fragmentar el coágulo y desplazarlo a zonas distales, ni stents autoexpandibles carentes de la suficiente fuerza radial para vencer las lesiones del ostium. Ante una lesión estenótica, la angioplastia sola ha mostrado bajas tasas de permeabilidad.
Los stents se deben elegir con una adecuada longitud y diámetro. Para el tronco celíaco y la AMS, un diámetro de 7-9mm puede ser suficiente. No existen datos que demuestren la superioridad de un stent balón-expandible sobre otro. Estos stents están disponibles para guías de 0,014, 0,018 y 0,035 in. Los stents autoexpandibles en arterias viscerales quedan reservados para situaciones particulares de angulación o tortuosidad que permitan una mejor acomodación por su flexibilidad. No se suelen emplear filtros: aunque puede existir riesgo de embolización, el empleo de estos filtros complica aún más el procedimiento10,11.
Abordaje híbridoEn ocasiones, la situación clínica del enfermo junto con la combinación de los hallazgos exploratorios hace mandataria la laparotomía para descartar una isquemia irreversible. Una opción quirúrgica endovascular de recanalización del origen de la AMS es el abordaje retrógrado durante la laparotomía11–15.
Medidas después de la cirugíaMientras esperamos al second-look de la intervención, el paciente debe estar monitorizado en una unidad de cuidados intensivos. La situación clínica para el paciente es complicada pues existe una pérdida de fluidos continua, liberación de metabolitos tóxicos y enzimas proteolíticas a la circulación sistémica, lo cual es negativo para la función renal y cardiaca. También existe riesgo de septicemia debido a la traslocación bacteriana. Se debe rehidratar al paciente, administrar plasma y sangre, y antibioterapia.
La anticoagulación con heparina se debe continuar para prevenir futuros episodios embolígenos y como profilaxis trombótica. Debido a que un intestino lesionado es propenso a sangrar, la anticoagulación debe ser monitorizada cuidadosamente. La reperfusión después de una embolectomía contribuye a la morbimortalidad1.
ResultadosLa mortalidad asociada a esta enfermedad es muy alta. Si la resección intestinal es el único tratamiento, la tasa de muerte a los 30 días es del 85-100%. Si se combina con la embolectomía o con la reconstrucción arterial, la mortalidad se reduce en un 55%. Los mejores resultados se alcanzan si el paciente llega al quirófano en las primeras 12 h. La fibrinólisis ha reportado excelentes resultados y es probable que, como primera opción terapéutica, pudiera incrementar la supervivencia16.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.