Los pacientes portadores de aneurisma de aorta abdominal (AAA) tienen un mayor riesgo cardiovascular. La cirugía abierta ha sido el tratamiento tradicional; sin embargo, el abordaje endovascular ha crecido exponencialmente en los últimos años debido al menor riesgo perioperatorio. La rigidez arterial parece elevarse tras el implante de endoprótesis aórtica.
Material y métodosPresentamos un subestudio del estudio registrado en la web del National Institutes of Health (ClinicalTrials.gov) como NCT02642952. Describimos 3 grupos que han recibido diferentes endoprótesis aórticas como tratamiento de un AAA. El grupoA fue tratado mediante el implante de una endoprótesis aórtica bifurcada estándar, el grupoB mediante una endoprótesis ramificada (4 ramas) y el grupoC con una endoprótesis de sellado del saco. Cada grupo incluye 2 pacientes. Hemos analizado los cambios individuales en la rigidez arterial mediante el análisis de la onda de pulso carótido-radial (AOP) y el índice de aumento (IA).
ResultadosTodos los pacientes estudiados fueron varones, mayores de 70años, con AAA en rango quirúrgico y alto riesgo quirúrgico (ASAIII). Hemos observado cambios variables del AOP carótido-radial y del IA@75 en el postoperatorio en los pacientes incluidos.
ConclusionesNuestro estudio muestra que los dispositivos endovasculares en el tratamiento de los AAA están implicados en el cambio de los diferentes parámetros de rigidez arterial. Nuevos estudios aleatorizados y con mayor tamaño muestral son necesarios para comparar los diferentes tipos de endoprótesis aórticas. El impacto cardiovascular a largo plazo de estos dispositivos requiere más estudios.
Patients with diagnosis of abdominal aortic aneurysm (AAA) are known to have an increased cardiovascular risk. Open surgery has been the traditional approach however, endovascular repair has widely expanded due to the lower peri-operative risk. Arterial stiffness has been suggested to change and elevate after aortic stent-graft implantation.
Material and methodsAs part of a study registered in National Institutes of Health website (ClinicalTrials.gov) with NCT02642952, a description is presented of 3 groups with endovascular treatment of AAA with different endografts and mechanisms. GroupA with standard bifurcated endograft, groupB with a branched (4 branches) device, and groupC with a sac sealing device. Each group included 2 patients. A report is presented on the individual changes of arterial stiffness measured by carotid-radial pulse wave velocity (PWV) and Augmentation Index (AIx).
ResultsAll the patients included were men, older than 70 years, with AAA greater than 55mm, and high-risk (ASAIII) patients. We observed a variable change in carotid-radial PWV and IA@75 in the postoperative period in all patients studied.
ConclusionsIt seems that endovascular devices in the treatment of AAAs are implicated in the change of arterial stiffness measurements. More randomised studies, with larger samples comparing the different types of endografts are required. The long-term impact on cardiovascular outcomes needs further investigation.
La aterosclerosis es la principal causa de morbimortalidad en los países occidentales, incluyendo enfermedad cerebro-vascular, enfermedad coronaria, enfermedad arterial periférica y enfermedad aneurismática1. Se ha demostrado que el control y tratamiento precoz de los diferentes factores de riesgo cardiovascular, como la hipertensión, ayudan a controlar la morbimortalidad en estos pacientes.
Los pacientes diagnosticados de aneurisma de aorta abdominal (AAA) tienen un elevado riesgo de morbilidad cardiovascular, debido a los factores de riesgo y comorbilidades asociadas a la enfermedad aneurismática1,2. La prevalencia de enfermedad aneurismática es del 4-9% de los pacientes mayores de 60años, y el momento de tratamiento depende de su riesgo de rotura3.
La rigidez arterial es una característica tanto de la enfermedad oclusiva como de la enfermedad aneurismática y está relacionada directamente con la edad. Su aparición es debida a cambios estructurales secundarios a la edad a nivel de las capas íntima y media de la pared arterial, y que condiciona una pérdida de elasticidad en la misma3,4. La rigidez arterial es un factor importante en el cálculo del riesgo de rotura aneurismático.
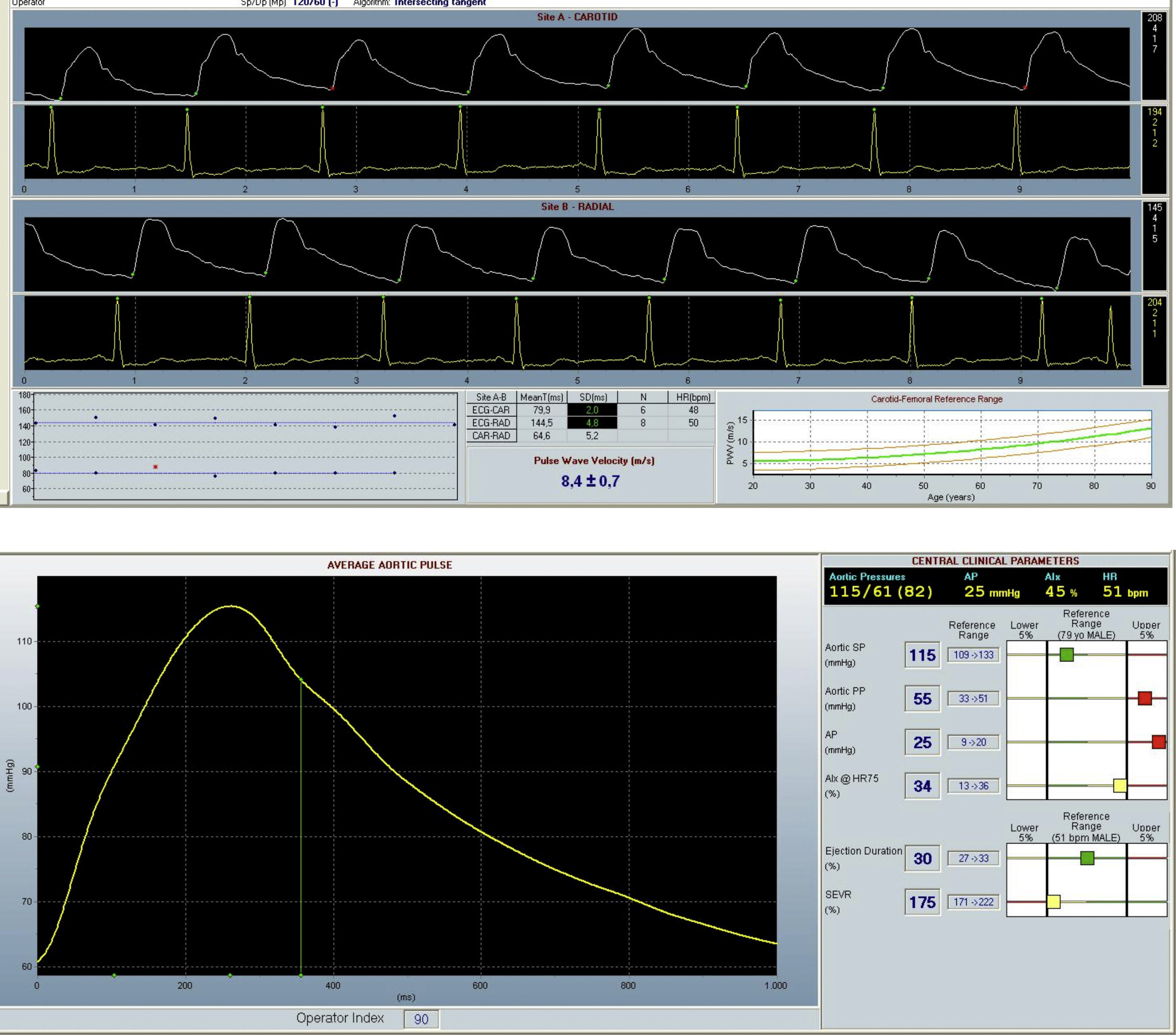
El dispositivo SphygmoCor® permite realizar estudios hemodinámicos no invasivos y nos proporciona una valoración fidedigna de la rigidez arterial a través de parámetros como la velocidad de onda de pulso (VOP), el análisis de onda de pulso (AOP), el índice de aumento (IA), la presión sistólica central (PSC) y la presión diastólica central (PDC)5. Estos parámetros se obtienen mediante un sensor colocado en arterias periféricas como la arteria radial, carótida o femoral.
La reparación endovascular de los aneurismas de aorta abdominal (EVAR) ha demostrado ser una alternativa segura, efectiva y menos invasiva que la cirugía abierta, al estar asociada a una menor morbimortalidad6. Sin embargo, los resultados a largo plazo que comparan EVAR y cirugía aórtica abierta muestran una esperanza de vida similar en ambos tratamientos, ya que la mayoría de fallecimientos a lo largo del seguimiento están en relación con las amplias comorbilidades de este tipo de pacientes.
Aunque las técnicas endovasculares aórticas están implantadas en nuestra práctica diaria desde hace más de una década, sus consecuencias sobre la rigidez arterial han sido escasamente reportadas en la bibliografía. Recientemente, se han publicado artículos sobre la evolución de la rigidez arterial tras EVAR, que sugieren efectos perjudiciales en los parámetros biomecánicos inducidos tras el implante de stent aórticos5-9.
A continuación, presentamos una serie de casos de pacientes con AAA tratados mediante 3 tipos de dispositivos endovasculares diferentes, sobre los cuales hemos analizado los cambios en la rigidez arterial.
Material y métodosPresentamos un subestudio, realizado a partir de pacientes que han sido registrados en el estudio prospectivo registrado en la web del National Institutes of Health (ClinicalTrials.gov) como NCT02642952. Disponemos de la aprobación del Comité de Ética del centro y a todos los pacientes se les proporcionó un consentimiento informado, que firmaron. El presente estudio se ha realizado de acuerdo con la Declaración de Helsinki. Todos los pacientes programados para tratamiento endovascular por un AAA en nuestro centro fueron incluidos en el estudio.
Describimos 3 grupos que han recibido diferentes endoprótesis aórticas como tratamiento de un AAA; cada uno de ellos incluye 2 pacientes. El grupoA fue tratado mediante el implante de una endoprótesis aórtica bifurcada infrarrenal estándar (Endurant, Medtronic, Santa Rosa, CA), el grupoB mediante una endoprótesis ramificada con 4 ramas para aneurismas pararrenales (Extra-design, Jotec GmbH, Hechingen, Alemania) y el grupo C con una endoprótesis de sellado del saco (Nellix, Endologix, Irvine, CA).
Detalles técnicosTodos los pacientes incluidos en el estudio se realizaron un angioTC toraco-abdominopélvico previo al procedimiento, cuyas imágenes fueron analizadas para obtener las medidas necesarias del AAA. La decisión de llevar a cabo el procedimiento endovascular se basó en las comorbilidades del pacientes y las características anatómicas del aneurisma, zonas de sellado y ejes iliacos. Todos los pacientes incluidos fueron tratados dentro de las instrucciones de uso (IFU) de cada uno de los dispositivos endovasculares utilizados.
Criterios de exclusión- -
Aneurismas que afectan la aorta visceral.
- -
Enfermedades del tejido conectivo.
- -
Pacientes intervenidos previamente mediante otro tratamiento a nivel aórtico.
- -
Pacientes en estadio terminal de insuficiencia renal.
- -
Presión arterial y frecuencia cardíaca: se registraron en decúbito supino y tras 15min de reposo.
- -
Todas las medidas fueron realizadas por 2 cirujanos vasculares entrenados en técnicas hemodinámicas.
- -
Todas la medidas se realizaron con el dispositivo y el software específico de SphygmoCor® (AtCor Medical Pty. Ltd., Sydney, Australia).
- -
Las medidas se realizaron el día previo a la cirugía y 3±1meses postoperatorios.
- -
La rigidez arterial se evaluó mediante el AOP carótido-radial y el IA.
- -
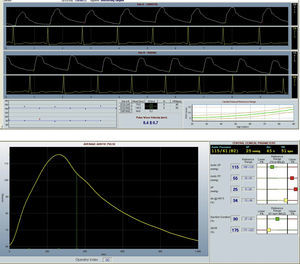
Medida de IA: la onda de presión arterial radial se registró a nivel de la muñeca, usando un transductor de tensión de alta fidelidad (Millar Instruments, Houston, TX). Al conseguir una secuencia de 20 ondas de características similares se valida la serie y a través de un modelo matemático se obtiene la onda de presión aórtica central. El IA se obtiene tras el análisis de dicha onda. El IA depende de la frecuencia cardíaca; por lo cual se realiza una corrección automática a 75 latidos por minuto (lpm), denominado «IA@75».
- -
Medida de AOP: medición consecutiva de las ondas de pulso arteriales en la carótida y radial en combinación con 3 derivaciones electrocardiográficas. Esto permite calcular el tiempo que transcurre entre la aparición de la primera y la segunda onda en cada una de las localizaciones. La distancia entre cada localización se midió sobre la superficie corporal para calcular el AOP (m/s).
La figura 1 muestra imágenes representativas del análisis del IAx y AOP.
Variables a estudio- -
Presión arterial (mmHg).
- -
Presión aórtica (mmHg).
- -
IA (%).
- -
Frecuencia cardíaca (lpm).
- -
IA@75 (%).
- -
AOP (m/s).
Se ha realizado exclusivamente un estudio descriptivo de los datos obtenidos por el escaso número de pacientes estudiado en este artículo.
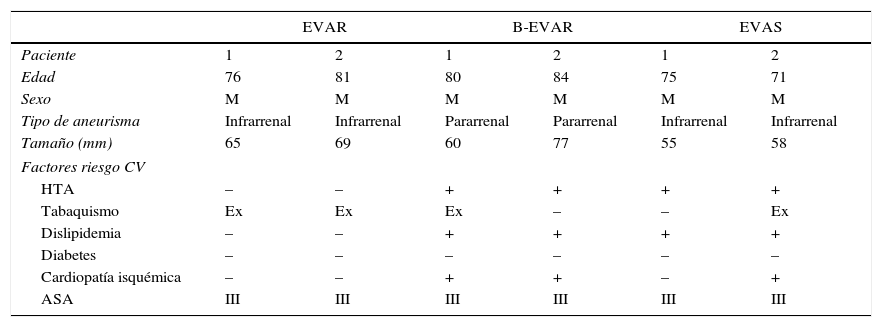
ResultadosLas características basales de los pacientes incluidos en este estudio preliminar aparecen en la tabla 1. Todos los pacientes son varones, septa y octagenarios, con aneurisma infrarrenal o pararrenal en rango quirúrgico, con alto riesgo quirúrgico (ASA III) y los factores de riesgo cardiovasculares habituales en este tipo de pacientes, ya que más de la mitad de ellos son exfumadores, hipertensos, dislipémicos y con historia previa de cardiopatía isquémica.
Descripción individual de las características basales de los pacientes
| EVAR | B-EVAR | EVAS | ||||
|---|---|---|---|---|---|---|
| Paciente | 1 | 2 | 1 | 2 | 1 | 2 |
| Edad | 76 | 81 | 80 | 84 | 75 | 71 |
| Sexo | M | M | M | M | M | M |
| Tipo de aneurisma | Infrarrenal | Infrarrenal | Pararrenal | Pararrenal | Infrarrenal | Infrarrenal |
| Tamaño (mm) | 65 | 69 | 60 | 77 | 55 | 58 |
| Factores riesgo CV | ||||||
| HTA | – | – | + | + | + | + |
| Tabaquismo | Ex | Ex | Ex | – | – | Ex |
| Dislipidemia | – | – | + | + | + | + |
| Diabetes | – | – | – | – | – | – |
| Cardiopatía isquémica | – | – | + | + | – | + |
| ASA | III | III | III | III | III | III |
ASA: American Society of Anaesthesiology; B-EVAR: reparación endovascular aórtica con ramas; CV: cardiovascular; EVAR: reparación endovascular aórtica; EVAS: sistema de sellado endovascular aórtico; Ex: exfumador; HTA: hipertensión; M: masculino.
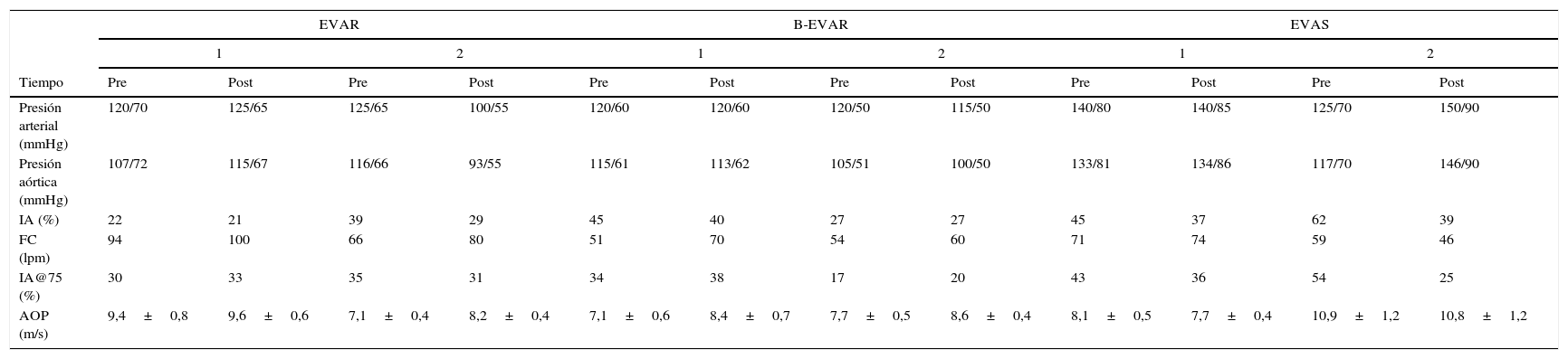
Se han analizado las diferentes variables a estudio sobre la rigidez arterial en el pre y postoperatorio en cada uno de los 3 grupos, cuyos resultados se pueden apreciar en el tabla 2. Se puede apreciar resultados dispares del AOP carótido-radial y del IA@75 en el postoperatorio. En relación con IA@75, se observó un paciente con incremento y otro con disminución en el grupo EVAR, ambos pacientes del grupo BEVAR con incremento y ambos del grupo EVAS con disminución de este parámetro. En relación al AOP carótido-radial todos (EVAR y BEVAR) presentaron un ligero incremento, exceptuando al grupo EVAS con valores muy similares o tendencia a la disminución.
Resultados individuales sobre las medidas de rigidez arterial de cada uno de los pacientes
| EVAR | B-EVAR | EVAS | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | |||||||
| Tiempo | Pre | Post | Pre | Post | Pre | Post | Pre | Post | Pre | Post | Pre | Post |
| Presión arterial (mmHg) | 120/70 | 125/65 | 125/65 | 100/55 | 120/60 | 120/60 | 120/50 | 115/50 | 140/80 | 140/85 | 125/70 | 150/90 |
| Presión aórtica (mmHg) | 107/72 | 115/67 | 116/66 | 93/55 | 115/61 | 113/62 | 105/51 | 100/50 | 133/81 | 134/86 | 117/70 | 146/90 |
| IA (%) | 22 | 21 | 39 | 29 | 45 | 40 | 27 | 27 | 45 | 37 | 62 | 39 |
| FC (lpm) | 94 | 100 | 66 | 80 | 51 | 70 | 54 | 60 | 71 | 74 | 59 | 46 |
| IA@75 (%) | 30 | 33 | 35 | 31 | 34 | 38 | 17 | 20 | 43 | 36 | 54 | 25 |
| AOP (m/s) | 9,4±0,8 | 9,6±0,6 | 7,1±0,4 | 8,2±0,4 | 7,1±0,6 | 8,4±0,7 | 7,7±0,5 | 8,6±0,4 | 8,1±0,5 | 7,7±0,4 | 10,9±1,2 | 10,8±1,2 |
EVAR, reparación endovascular aórtica; B-EVAR, reparación endovascular aórtica con ramas; EVAS, sistema de sellado endovascular aórtico; mmHg, milímetros de mercurio; IA, índice de aumento; FC, frecuencia cardíaca; lpm, latido por minuto; IA@75, índice de aumento corregido a 75 latidos por minuto; AOP, análisis de onda de pulso; m/s, metro por segundo.
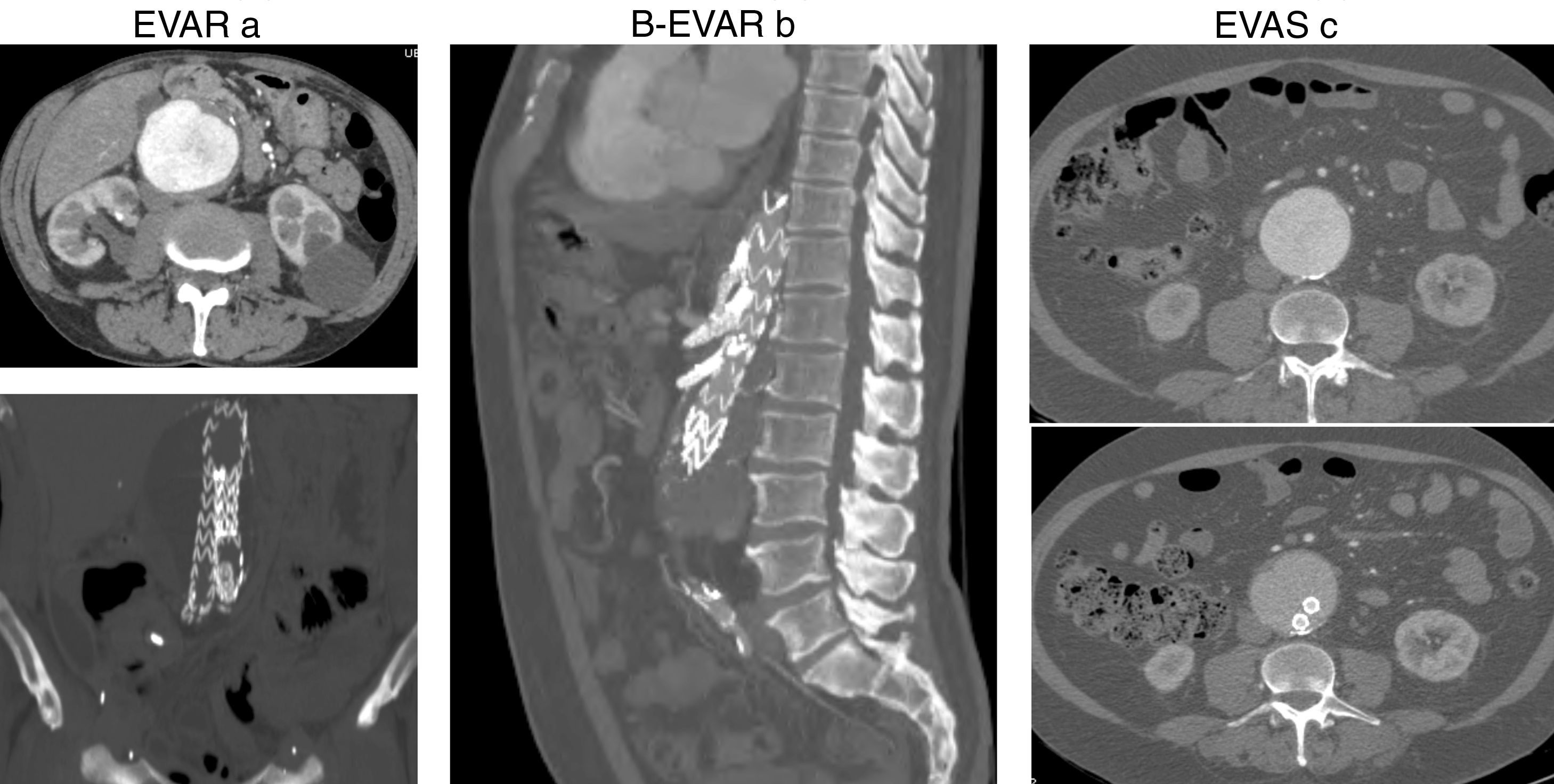
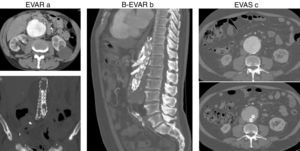
La figura 2 muestra imágenes obtenidas durante el estudio de rigidez arterial pre y postoperatorio en cada uno de los pacientes incluidos en el estudio.
(a) AngioTC pre y postoperatorio de AAA tratado mediante EVAR. (b) AngioTC postoperatorio de AAA tratado mediante B-EVAR (tratamiento endovascular aórtico con ramas a arterias viscerales). (c) AngioTC pre y postoperatorio de AAA tratado mediante EVAS (endobolsas que rellenan el saco aneurismático).
Tras una búsqueda bibliográfica extensa, creemos que este artículo es el primer estudio que describe cambios de la rigidez arterial con el uso de 3 dispositivos endovasculares diferentes para el tratamiento del AAA.
La evidencia científica sobre el estudio de la rigidez arterial en pacientes con AAA es escasa en la actualidad. Lee et al.10 demostraron un menor AOP y mayor IA en pacientes portadores de AAA comparado con controles sanos, concluyendo que estos parámetros mecánicos no eran fiables en pacientes con AAA. Sin embargo, otros estudios han demostrado un aumento de la rigidez arterial mediante la medición del AOP, en pacientes tratados con dispositivos aórticos infrarrenales. Este efecto depende del tipo de endoprótesis utilizado y aparece en el postoperatorio precoz. Recientes estudios recomiendan el uso de otros parámetros hemodinámicos, como el índice de aumento, la presión de aumento, además del AOP, para optimizar los cambios en el análisis de la rigidez arterial tras el implante de endoprótesis. Además, sugieren que el implante de la endoprótesis aórtica tiene un efecto hemodinámico inmediato no solo debido a la rigidez del dispositivo implantado, sino también por la modificación de la onda de pulso y el flujo aórtico, lo que puede modificar los resultados del AOP9. Nuestro estudio no permite un análisis extenso ni obtener resultados concluyentes, aunque demuestra cambios en la rigidez arterial que aparentan ser distintos según el tipo de dispositivo endovascular utilizado.
Kadoglou et al.11 realizaron un estudio prospectivo sobre los efectos en la rigidez arterial de los diferentes stents aórticos. Compararon un grupo de pacientes tratados con endoprótesis aórticas con poliéster y el otro con politetrafluoroetileno (ePTFE). Este estudio encontró un aumento del AOP de ambos grupos, aunque mayor en el grupo del poliéster. Todos los pacientes mostraron un aumento del PWV después del implante de la endoprótesis y todos menos uno tuvieron un aumento del IA. Concluyeron que el aumento del AOP está en relación con las endoprótesis de polyester, debido a una mayor respuesta inflamatoria.
Georgakarakos et al. publicaron un estudio preliminar con 3 pacientes tratados con un dispositivo infrarrenal de fijación del cuello anillada (Ovation stent-graft system - TriVascular, Santa Rosa, CA) encontrando un aumento de la rigidez arterial tras el tratamiento endovascular, aunque sugieren que este cambio no es debido al tipo de endoprótesis12.
Así, después de la revisión bibliográfica realizada, aún no se puede aclarar si el AOP o el IA se deben considerar como parámetros principales de rigidez arterial en la enfermedad aneurismática o si tienen un papel complementario.
LimitacionesEl presente estudio tiene limitaciones. La más importante es el pequeño tamaño muestral global y de cada uno de los grupos, razón por la cual no es posible hacer un análisis estadístico de los resultados, sino una mera descripción de los datos.
Nuevos estudios con mayor tamaño muestral y aleatorizados son necesarios para comparar los diferentes tipos de endoprótesis aórtica y sus consecuencias a nivel de los diferentes parámetros biomecánicos. El impacto cardiovascular a largo plazo de estos dispositivos requiere más estudios.
ConclusiónNuestro subestudio sugiere que los dispositivos endovasculares para el tratamiento de los AAA están implicados en el cambio de los diferentes parámetros de rigidez arterial como el AOP y AI.
Esperamos publicar nuestros resultados del estudio completo sobre rigidez arterial próximamente.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.