Revisión de evidencia y opciones terapéuticas del factor de crecimiento epidérmico recombinante humano bioidéntico (rhEGF) en úlceras vasculares. El rhEGF ha evidenciado eficacia, tolerabilidad y seguridad, considerándose tratamiento adyuvante o emergente en guías de práctica clínica basadas en la evidencia. Se dispone de rhEGF mediante formulación magistral, asegurando estabilidad, efectividad y seguridad, permitiendo la individualización (adición de principios activos, cambios de galénica). Los compuestos con rhEGF mediante formulación magistral pueden considerarse indicados en el tratamiento de úlceras vasculares.
Review of scientific evidence and therapeutic options of recombinant human bioidentical epidermal growth factor (rhEGF) for vascular ulcers. Efficacy, with excellent tolerability and safety has been demonstrated with rhEGF, and it has been considered as an adjuvant or emerging treatment in evidence based clinical practice guidelines. rhEGF is available by magistral prescription, ensuring stability, effectiveness and safety, allowing individualisation (addition of active principles or dose personalisation). Compounds with rhEGF can be considered for managing vascular ulcers.
Las úlceras vasculares en extremidades inferiores presentan difícil tratamiento, requieren curas durante largo tiempo, suelen causar dolor y producen importantes complicaciones y repercusiones en los pacientes (físicas, psicológicas, sociales y económicas: estigmatización social y largos períodos de baja laboral). Con una incidencia del 1-2%, que aumenta con la edad1-3, cuestan unos 9.569 euros/año/paciente (Alemania), 300-600 millones de libras/año (Reino Unido) o más de 2.000 millones de dólares/año (EE.UU.)1,3.
Existen guías de práctica clínica basadas en la evidencia para manejarlas atendiendo a su fisiopatología, sintomatología y estadificación4-6, y el factor de crecimiento epidérmico (EGF) se incluye como tratamiento coadyuvante en las más recientes7.
Se presenta este resumen sobre revisiones, guías clínicas y evidencias de la aplicación del EGF como coadyuvante en el tratamiento de las úlceras vasculares. El primer artículo de uso de EGF biosintético en úlceras data de 1986, mostrando en animales de experimentación un aumento de la velocidad de curación en las heridas tratadas con EGF humano obtenido por ingeniería genética8. Posteriormente, Gonzalez et al.9 publicaron en 1995 los resultados de un ensayo aleatorizado con 60 pacientes, analizando el uso de EGF asociado a sulfadiazina argéntica en úlceras venosas respecto al grupo que había recibido tratamiento únicamente con sulfadiazina, aunque los resultados no eran significativos por la escasa cantidad de pacientes incluidos.
El factor de crecimiento epidérmico recombinante humano bioidénticoLa recombinación genética y la investigación translacional permiten disponer de EGF recombinante humano bioidéntico (EGF heterólogo, recombinant human epidermal growth factor [rhEGF]) en concentraciones precisas y estables, útil como principio activo. Por su composición y concentración precisas, el rhEGF bioidéntico puede complementar la obtención de EGF a partir de sangre del propio paciente (platelet rich plasma [PRP], que contiene además platelet-derived growth factor [PDGF], transforming growth factor [TGF], platelet factor interleukin [IL], platelet-derived angiogenesis factor [PDAF], vascular endothelial growth factor [VEGF], insulin-like growth factor [IGF] y fibronectina); asimismo, el rhEGF es un principio activo de más fácil disposición, mayor pureza y menor coste que factores provenientes del PRP (EGF autógeno)10,11. No se dispone de estudios comparativos de coste-eficacia entre el PRP i el uso de EGF para la curación de las úlceras vasculares.
El EGF promueve el crecimiento, la proliferación, la diferenciación y la supervivencia celulares12 mediante la unión con su receptor específico de membrana (epidermal growth factor receptor [EGFR])13; se encuentra fisiológicamente en plaquetas14, macrófagos y fluidos (orina, saliva, leche y plasma)15, así como en el exudado de las úlceras14; consiste en un polipéptido de 53 aminoácidos y 6 residuos de cisteína, que presenta 3 puentes disulfuro intramoleculares («dominio EGF»)16 fundamentales para la afinidad con el receptor. Como otros factores de estructura parecida al EGF («dominio EGF»)17, es sintetizado asociado a la membrana celular en forma promotora y es activado mediante escisión proteolítica al liberarse a la matriz intercelular.
El complejo activado EGF-EGFR promueve la proliferación queratinocítica aumentando su adhesividad y motilidad, modulando su propia actividad por retroalimentación; en queratinocitos y otras células cutáneas suprime la expresión de genes responsables de la diferenciación celular epidérmica18 promoviendo el mantenimiento, la integridad y la regeneración cutánea. El rhEGF de manera natural produce proliferación, migración celular y síntesis de fibras de colágeno de tipoi en fibroblastos cutáneos acelerando la curación de las heridas, aumentando la velocidad de reepitelización y regulando el infiltrado inflamatorio14,19, la función de barrera y defensa ante la infección. Incide sobre la expresión y la activación del sistema del complemento en la epidermis y queratinocitos20, cuya activación como respuesta a una lesión aguda constituye un proceso beneficioso pero que parece no activarse en las heridas crónicas (impidiendo la curación). El EGF parece estimular la migración y la proliferación fibroblástica, sugiriendo una estrategia terapéutica útil para la curación de heridas21-23 y para la medicina regenerativa cutánea y de los folículos pilosos24. El EGF se relaciona asimismo con el epitelio digestivo alto25 y otros epitelios y mucosas (desarrollo embrionario del árbol bronquial, epitelio corneal y conjuntiva ocular)26.
El efecto mitogénico requiere la presencia continuada del factor durante 3-4 días (inicio del efecto terapéutico), y su ausencia disminuye la actividad del receptor en unas 4h27. De manera natural y en la cicatrización por segunda intención, el EGF interviene en el efecto de epitelización y remodelación en el período tardío, a partir de los 12días14.
La actividad anómala de los receptores parece producir patogenicidad26; actividades anormalmente altas de EGFR en algunos tumores cutáneos se relacionan con mutaciones del receptor más que con aumentos en la actividad o concentración del EGF28: la disregulación del receptor se considera independiente de los niveles de EGF o de la unión EGF-EGFR29, por lo que el uso clínico de rhEGF no induciría el funcionamiento alterado en receptores normales. Conocer los mecanismos bioquímicos de estos tumores ha permitido desarrollar quimioterápicos y anticuerpos monoclonales inhibidores del EGFR, cuya toxicidad cutánea (erupción, sequedad, alopecia)30 mostrarían las funciones homeostáticas dependientes del EGFR31,32.
La comprensión de los mecanismos moleculares relacionados con el EGF, la disponibilidad de rhEGF y el desarrollo de formulaciones estables han permitido determinar efectos, posibilidades, indicaciones y seguridad del rhEGF como terapia y posibilitar su uso clínico.
rhEGF: evidencias de uso en úlceras vascularesLas úlceras son lesiones elementales dermatológicas que en ocasiones presentan tendencia a cronificar, dependiendo de su causa. Las vasculares son lesiones con pérdida de sustancia por alteraciones en la circulación sanguínea en las extremidades inferiores, de difícil tratamiento; pueden afectar a las capas superficiales de la piel o planos más profundos, tejidos musculares y óseos. Se suelen clasificar en arteriales, venosas o mixtas (arteriovenosas), linfáticas o neuropáticas (tabla 1); un tipo especial es el pie diabético, que suele presentar asociadas afectación arterial macrovascular y neuropatía por afectación microvascular. Otros tipos menos frecuentes son angiodisplasias, iatrogénicas o producidas por agentes físicos o químicos (congelación, perniosis).
Principales tipos de úlceras vasculares
| Venosas | • Úlcera varicosa: secundaria a insuficiencia venosa (frecuentemente sobre vena superficial o perforante) • Úlcera postflebítica: en zonas con secuelas crónicas de trombosis venosa profunda |
| Arteriales (vasculopáticas, isquémicas) | • Úlcera arteriosclerótica: por isquemia crónica periférica • Úlcera hipertensiva (de Martorell, angiodermitis necrótica): en HTA diastólica mal controlada • Tromboangitis obliterante (enfermedad de Buerger): vasculitis de arterias de pequeño y mediano calibre que ocasiona trombosis |
| Mixtas (arteriovenosas) | Compuestas entre los tipos anteriores |
| Neuropáticas | Con neuropatía periférica (generalmente diabética, indolora, sobre puntos de presión) |
| Otras | • Manifestaciones cutáneas de linfedema: lesiones tróficas en paciente con linfedema primario, o secundario (úlcera, exudación, hiperpigmentación, etc.)82 |
| • Angiodisplasias | |
| • Iatrogénicas | |
| • Agentes físicos/químicos (perniosis, congelación) |
La curación de cualquier herida comprende 3 fases sucesivas (inflamación, proliferación y remodelado), implicando la participación de diversos tipos celulares. En este proceso intervienen factores de crecimiento como el EGF33,34; cambios en estos factores pueden alterar el proceso35.
Las heridas agudas generan factores de crecimiento que contribuyen a su curación, mientras que las heridas crónicas (úlceras vasculares, diabéticas, por presión, etc.) pierden el equilibrio en sus factores de crecimiento enlenteciendo o imposibilitando su curación (úlceras como las de origen diabético son deficitarias en factores de crecimiento)35-37. La aplicación exógena de factores implicados (EGF o combinaciones de factores), otras moléculas exógenas (algunos fármacos y oligoelementos) o injertos celulares obtenidos por bioingeniería pueden acelerar la curación2,33,38; contrariamente, infección39, corticosteroides, denervación o hemorragia en el lecho de la herida la enlentecen33. En úlceras de origen venoso (las más frecuentes) el objetivo del tratamiento será una curación superior al 40% en 4 semanas («modelo de las 4 semanas»); más allá de ese período, los pacientes podrían ser tributarios de intervenciones avanzadas, como cirugía o injertos de piel humana u obtenidos por bioingeniería (no persisten en el tiempo, sino que aportan una cascada de factores de crecimiento y citoquinas que estimulan la curación de la úlcera)2,40.
Aunque el tratamiento tópico es fundamental en las úlceras vasculares, cabe destacar que siempre se considera adicional al control de la enfermedad de base. Adicionalmente, en diseño de ensayo clínico controlado hay experiencias del uso del abordaje quirúrgico, comparado con el tratamiento con vendaje compresivo, en que la corrección quirúrgica del reflujo venoso puede reducir la recurrencia de las úlceras a los 12meses41.
El uso terapéutico del rhEGF sobre úlceras crónicas ofrece evidencias alentadoras, por lo que algunas revisiones y guías de práctica clínica basadas en la evidencia han incluido algunos factores de crecimiento como «tratamientos emergentes»7 o como «agentes adyuvantes» que podrían ser útiles para el tratamiento de las úlceras42; a este propósito, las Guías australianas y neozelandesas mencionan los factores de crecimiento queratinocitario en el tratamiento de las úlceras venosas, concretamente del preparado Repifermin®, forma truncada del factor de crecimiento fibroblástico-10 (conocido como factor de crecimiento keratinocítico-2 [KGF-2])43. En una dirección semejante, guías como la de Robson et al.44 o de la Wound Healing Society45 incluyen las conclusiones de resultados de ensayos analizando factores como el factor de crecimiento fibroblástico, estimulante de colonias, de citoquinas, y otros. Las guías NICE, actualmente en revisión, incluyen la recomendación de uso de EGF y otros factores de crecimiento como tratamiento coadyuvante en problemas del pie diabético46. En el borrador de elaboración de esta guía47 se incluyó el tema de los factores de crecimiento como una de las «review questions» (punto 4.5.3), incluyendo la revisión sistemática de 4 estudios sobre el uso de EGF en pie diabético (Afshari et al., 2005; Fernández-Montequin et al., 200948; Tsang et al., 200349; Viswanathan et al., 2006), siendo en el de Fernández-Montequin et al. (n=149) en el que se observaron diferencias significativas a favor del grupo al que se administró rhEGF.
El estudio de Hardwicke et al.50 analiza el efecto de EGF en heridas crónicas, relacionándolo con la degradación del EGF por las proteasas de la herida crónica, sugiriendo que la forma de liberarse el EGF es fundamental para su efecto. Existen evidencias con distintos diseños experimentales tanto en animales de experimentación como sobre humanos: se ha utilizado el EGF con resultados satisfactorios en forma de gel tópico (para úlceras vasculares de todos los tipos, especialmente en pie diabético)49,51,52, como ungüento tópico53, spray (en úlceras diabéticas)54,55, apósitos (asociado a diversos principios activos)56, inyectable (tratamiento de úlceras del pie diabético y de la úlcera hipertensiva de Martorell)48,40,57,58. Se ha demostrado el valor predictivo positivo de la respuesta al rhEGF de la úlcera diabética en la aparición de tejido de granulación y el cambio de tamaño en el área de la úlcera59. Gainza et al.60 utilizan rhEGF en nanopartículas lipídicas como vehículo para la aplicación del factor en la terapéutica de úlceras cutáneas, mientras que otros autores proponen el uso de otros materiales de última generación con fines similares61.
El rhEGF sobre heridas «limpias» producidas por objetos cortantes (heridas quirúrgicas, con bordes precisos y próximos, sin detritus ni infección) evidencia un aumento en la velocidad de curación, cicatrices de menor grosor y mayor flexibilidad62; análogamente, se ha usado como terapia para aftas orales o lesiones de la mucosa digestiva (por administración vía endoscópica), para lesiones corneales, etc.4.
Formas de prescripción del rhEGF: formulación magistralEn galénica adecuada y dosis precisa, el EGF es estable y efectivo sin efectos secundarios ni colaterales importantes en patologías de piel y mucosas, en prevención primaria o como tratamiento, con indicaciones en diversas especialidades (dermatología, cirugía, oftalmología, digestología, otorrinolaringología, medicina estética, regenerativa, etc.)4,63. Como efectos indeseables de la inyección intralesional de rhEGF durante más de 4semanas se ha reportado algún caso de escalofríos; el dolor local o la sensación de quemazón postinyección fue de poca importancia, sin diferencias significativas respecto al grupo control48. En el trabajo de Doerler et al.64 (n=31) se especifica la efectividad del apósito utilizado, así como su seguridad, aunque algunos pacientes abandonaron el estudio por infección (2 pacientes) o dolor (2 pacientes).
La formulación magistral es idónea para la disponibilidad del rhEGF: permite almacenar durante largo tiempo rhEGF estable en las condiciones previas a su constitución en la farmacia formuladora u hospitalaria, y constituir «a demanda» los compuestos finales justo antes de su uso en condiciones óptimas, garantizando la estabilidad de la molécula en la fórmula constituida durante meses.
La versatilidad de la formulación magistral permite personalizar tratamientos, individualizar dosis y combinar principios activos según las necesidades. La aplicación del rhEGF se ha referenciado en diferentes concentraciones de gel49,51,52 o de crema tópica65,66, ungüento (10μg/g, 2 al día, 14días)53, apósitos (capas esponjosas hidratadas: superior con ácido hialurónico de alto peso molecular e inferior idéntica más arginina, vitamina C±EGF)56,67, spray conteniendo 0,005% de EGF (Easyef®) más hidrocoloide55, spray asociado a eritropoyetina54, inyectable (Heberprot-P®, previa recomposición de liofilizado)48,57,68, micropartículas (6,44±2,45μm) de ácido poli-lacto-co-glicólico y seroalbúmina como transportadoras,69 péptido carabina (chaperon) TD1 para facilitar el paso transdérmico por vía tópica, además del rLMWP-EGF70 o un péptido combinado TD1-EGF de idéntica actividad biológica que el EGF y mayor penetración transdérmica.
Se comercializan presentaciones aptas y estables de rhEGF para la formulación magistral en ampollas individuales de 1 y 5ml con concentraciones de 1μg/ml, apropiadas para constituir crema, emulsión (concentración final de EGF: 0,33μg/10g, o 1μg/30g) u otras galénicas (loción, apósito, spray, etc.).
Se ha demostrado estabilidad superior a un mes del rhEGF en preparaciones de cremagel, en emulsión y en gel a base de silicona. Según la última actualización en las recomendaciones internacionales para el estímulo de la cicatrización71, el uso de productos basados en siliconas se concibe como un tratamiento bien establecido en la prevención y el tratamiento de las cicatrices hipertróficas y de amplia utilización en la práctica clínica, aunque la calidad de la evidencia científica sea mejorable según las revisiones Cochrane72; el uso de las siliconas en gel mejora las limitaciones inherentes a las láminas de silicona, haciendo estos geles adecuados para su uso incluso en zonas como la cara y el cuello.
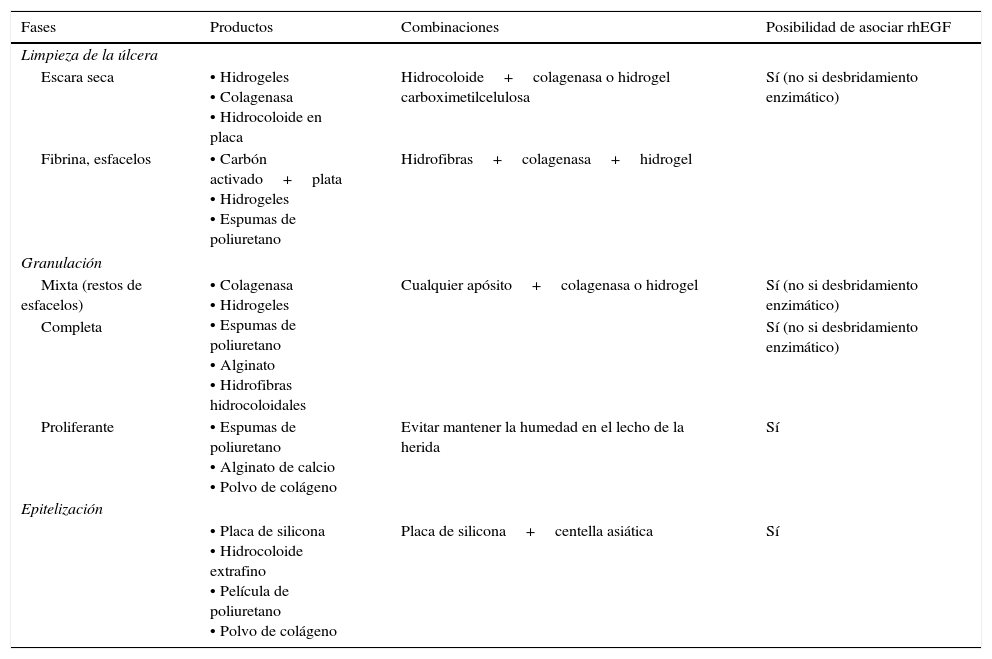
En la tabla 2 se detallan posibles indicaciones de uso del rhEGF en úlceras vasculares, y en la tabla 3 se enumeran algunas fórmulas magistrales de rhEGF con sus posibles indicaciones y posologías; la versatilidad de la formulación magistral permite la elaboración de fórmulas con diferentes concentraciones o la adición de principios activos, personalizando la fórmula con rhEGF según las necesidades individuales de cada paciente.
Resumen de tratamientos recomendados según la fase de curación de las úlceras vasculares (ver bibliografía en el texto)
| Fases | Productos | Combinaciones | Posibilidad de asociar rhEGF |
|---|---|---|---|
| Limpieza de la úlcera | |||
| Escara seca | • Hidrogeles • Colagenasa • Hidrocoloide en placa | Hidrocoloide+colagenasa o hidrogel carboximetilcelulosa | Sí (no si desbridamiento enzimático) |
| Fibrina, esfacelos | • Carbón activado+plata • Hidrogeles • Espumas de poliuretano | Hidrofibras+colagenasa+hidrogel | |
| Granulación | |||
| Mixta (restos de esfacelos) | • Colagenasa • Hidrogeles • Espumas de poliuretano • Alginato • Hidrofibras hidrocoloidales | Cualquier apósito+colagenasa o hidrogel | Sí (no si desbridamiento enzimático) |
| Completa | Sí (no si desbridamiento enzimático) | ||
| Proliferante | • Espumas de poliuretano • Alginato de calcio • Polvo de colágeno | Evitar mantener la humedad en el lecho de la herida | Sí |
| Epitelización | |||
| • Placa de silicona • Hidrocoloide extrafino • Película de poliuretano • Polvo de colágeno | Placa de silicona+centella asiática | Sí | |
Posibles formulaciones magistrales de compuestos conteniendo EGF, a partir de los datos expuestos en el texto (ver bibliografías contenidas en el texto)
| Factor de crecimiento epidérmico (epidermal growth factor, EGF) Formulación magistral | ||
|---|---|---|
| Fórmula base | Factor de crecimiento epidérmico 1 amp. (EGF) Cremagel csp 30g. | • Estimulante de la granulación • Base (crema/cremagel/silicona) |
| Combinación de otros compuestos, según necesidad | |
| Infección por Pseudomonas spp. | Gentamicina sulfato 1% |
| Necesidad de apósito de plata, infección por anaerobios | Sulfadiacina argéntica 1% |
| Según antibiograma | Neomicina 0,35% Clorhexidina 0,5% Ácido fusídico 600mg Otro antibiótico |
| Infección fúngica (según antibiograma) | Ketoconazol 2% |
| Mantenimiento de la humedad | Ácido hialurónico 1% Carboximetilcelulosa 1% |
| Estímulo adicional de epitelización | Centella asiática 0,01g. Aceite de rosa mosqueta |
El abordaje terapéutico de las úlceras vasculares incluye, además del control metabólico y de enfermedades de base, la limpieza de la herida y el cuidado del tejido lesional, el control de la infección, el desbridamiento (en casos en que sea necesario), el vendaje (en los casos indicados) y la utilización de apósitos sobre la lesión.
Los apósitos deben enfocarse a la curación, controlar el exudado, aumentar el bienestar, asegurar la compresión y prevenir la adhesión del vendaje sobre la úlcera en los casos en que esté indicado2.
Las curas en ambiente húmedo evidencian ligeramente una mayor rapidez que la cura mediante gasa seca: la humedad mantiene la velocidad de epitelización y reduce la pérdida de tejido (grado de recomendación C); deben utilizarse apósitos no adhesivos73, protectores de agresiones externas (físicas, químicas o bacterianas), que mantengan la humedad de la úlcera mientras evitan el exceso de humedad en el tejido perilesional; deben facilitar la eliminación del tejido necrótico y absorber el exudado, adaptarse a la forma de la lesión, ser fáciles de aplicar y retirar dejando pocos residuos.
El uso de siliconas como excipiente, en forma de gel o como láminas de silicona, parece tener un efecto beneficioso en el proceso de curación de las heridas y prevención de las cicatrices hipertróficas desde hace más de 20años74; su efectividad es atribuida al aumento de la hidratación de la piel de la zona por la oclusión producida por la silicona, característica inherente al producto. Se consideran los productos con silicona (en gel o lámina) el tratamiento gold standard para la prevención de la aparición de cicatrices anómalas (incluyendo heridas quirúrgicas)75 y para el tratamiento de las cicatrices en general76.
Se observan leves aumentos de eficacia con apósitos de ácido hialurónico, hidrogeles o productos impregnados con plata, aunque su relación coste-efectividad es discutida2,73. Existen apósitos con distintas composiciones (hidrocoloides, alginatos, hidrogeles, poliuretanos, apósitos de plata o carbón, etc.), con asociaciones fijas o que permiten la individualización por asociación con otros principios activos1. No se recomiendan compuestos a base de miel73, soluciones sobresaturadas de azúcar, ni el uso rutinario de apósitos que contengan plata, antisépticos locales o antibióticos a largo plazo77.
Según la etiología de la úlcera, el abordaje terapéutico general será distinto (tabla 4). Los servicios especializados en úlceras son los que óptimamente pueden dar tratamiento a las úlceras vasculares73,78.
Abordajes terapéuticos específicos de las úlceras vasculares y grados de recomendación (ver referencias bibliográficas en el texto)
| Abordaje terapéutico específico | Grado de recomendación |
|---|---|
| Úlceras venosas/linfáticas (índice tobillo/brazo: 0,9-1,2) Vendaje compresivo multicapa, apósitos no adherentes Elevación de la extremidad, ejercicio físico Mantenimiento de la humedad, desbridamiento | A C |
| Úlceras arteriales (isquemia severa: índice tobillo/brazo < 0,5) Vendaje compresivo contraindicado Valoración por cirugía vascular, revascularización Control del dolor, tratamiento de la isquemia Si lesión irreversible, cura seca con povidona yodada para evitar necrosis húmeda por sobreinfección; desbridamiento no agresivo | C C |
| Úlceras mixtas (índice tobillo/brazo: 0,5-0,9) Vendaje de contención si índice tobillo/brazo ≥ 0,7 (valores menores, vendaje contraindicado) | |
| Úlceras neuropáticas Control de la isquemia, evitar puntos de presión, mantenimiento de la humedad, desbridamiento |
Según la fase evolutiva de la úlcera, las guías de práctica clínica prevén las indicaciones de uso de diversos tipos de apósitos sobre el lecho de la úlcera (tabla 2), ya sean considerados apósitos primarios (en contacto con la superficie de la lesión) o secundarios (que establecen una barrera impermeable o semipermeable con el exterior)79. Como coadyuvante puede ser útil aplicar compuestos que contienen rhEGF para aumentar la velocidad de curación80; la base de rhEGF se puede formular como una crema o cremagel conteniendo 0,033% de rhEGF (tabla 3), pudiéndose añadir otros principios activos según criterio facultativo y según las necesidades particulares del paciente. El rhEGF puede aplicarse en diversos formatos (hidrocoloide, hidrogel, geles de silicona, etc.) o administrarse directamente sobre el lecho de la úlcera previamente a la administración del apósito, crema o gel elegido (mientras el vehículo no contenga enzimas proteolíticas o urea, que inactivarían el rhEGF; al ser una proteína, la mayoría de enzimas proteolíticas inespecíficas podrían inactivar el factor).
Limpieza de la úlcera. En presencia de escaras (especialmente en úlceras por presión en estadioiv)81, cuando existan escaras secas estarán indicados productos que mantengan la humedad y eliminen tejidos desvitalizados: hidrogeles o hidrocoloides en placa, pudiéndose combinar con carboximetilcelulosa o colagenasas; en presencia de fibrina y esfacelos serán útiles productos con carbón activado y plata, hidrogeles y espumas de poliuretano, en combinaciones de hidrofibras con colagenasa. Según su mecanismo de acción, el rhEGF podría ser útil asociado a geles para estimular la aparición de tejido de granulación mientras el tejido necrótico desaparece, aunque la parte que no se pusiera en contacto con el tejido de granulación no podría ejercer su función. No está indicado el rhEGF asociado a un desbridamiento enzimático, ya que algunas enzimas inactivarían el rhEGF. Se recomienda la fórmula base (tabla 3) compuesta de rhEGF y ácido hialurónico más una base de cremagel. Únicamente en infección local estaría indicada la adición de antibióticos específicos, según antibiograma.
Con la aparición de tejido de granulación, las guías muestran la utilidad de todo tipo de apósitos húmedos con colagenasas o hidrogeles para eliminar por completo los restos de esfacelos, en su caso; en tejido de granulación proliferante sin restos necróticos se recomienda evitar el exceso de humedad en el lecho de la úlcera (el exceso de exudado reduce la presencia de factores de crecimiento, dificultando la curación)5 mediante espumas de poliuretano, alginato de calcio o productos con polvo de colágeno. Independientemente de la presencia de esfacelos, estará indicado el mantenimiento de la humedad; el mecanismo de acción del EGF sugiere la aplicación al apósito elegido de la fórmula base con rhEGF (con o sin ácido hialurónico), manteniendo la humedad adecuada y añadiendo carboximetilcelulosa para absorber el posible exceso de humedad.
En la fase de epitelización, las guías proponen estimular la epitelización mediante placas de silicona, hidrocoloides extrafinos, películas de poliuretano o polvo de colágeno; algunas recomiendan también el uso de productos de centella asiática como estimulantes de la epitelización1. Según el mecanismo de acción, podría aplicarse también en esta fase la fórmula base de rhEGF, añadiendo si se considera preceptivo un extracto de centella asiática.
ConclusionesEl factor de crecimiento epidérmico recombinante humano bioidéntico (rhEGF) ha sido probado en úlceras vasculares (venosas, arteriales, diabéticas, etc.) en humanos y en animales de experimentación, evidenciando eficacia y siendo incluido como tratamiento adyuvante o emergente en guías de práctica clínica actualizadas para el abordaje terapéutico de úlceras vasculares en humanos.
No se observan efectos secundarios o colaterales de importancia con productos que contengan rhEGF (solo leves escalofríos, dolor o sensación de quemazón en administración inyectada intralesional), evidenciando óptima tolerabilidad y seguridad en uso continuado de más de un mes, definiendo galénicas y compuestos de administración tópica que parecen haber demostrado efectividad.
Se dispone de rhEGF en concentraciones y pureza para uso terapéutico; existen galénicas estables en el tiempo a través de la formulación magistral, otorgando ventajas adicionales de flexibilidad, efectividad y seguridad, permitiendo individualizar cada tratamiento con la adición de diversos principios activos. Se pueden considerar los compuestos con rhEGF a través de la formulación magistral para el tratamiento de las úlceras vasculares.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónPara la redacción de la presente revisión no se ha recibido financiación por parte de organismos oficiales.
Conflicto de interesesEl autor principal es asesor médico de Fagron Ibérica S.A.U., Coordinador de Investigación en el Servei Universitari de Recerca en Fisioteràpia en las Escuelas Universitarias Gimbernat (adscritas a la Universitat Autònoma de Barcelona) y médico asistencial en el Centro Médico Teknon de Barcelona.
El segundo autor es asesor ocasional de Fagron Ibérica S.A.U., Coordinadora de la Unidad de Medicina Preventiva y médico especialista en Medicina Familiar y Comunitaria de Àptima (Terrassa, Barcelona) y en el Centro Médico Teknon de Barcelona.
AgradecimientosAgradecemos a Fagron Ibérica S.A.U. su colaboración científica para la obtención de información pertinente a esta revisión.