El pie diabético es una entidad clínica causante de una importante morbimortalidad en nuestro medio. En 2014, la Society of Vascular Surgery propuso una nueva clasificación que estima el riesgo de amputación para miembros inferiores e incluye a pacientes diabéticos.
ObjetivoEvaluar el valor pronóstico que tendría la aplicación de la clasificación Wound, Ischaemia, and foot Infection classification system (WIfI) en la salvación de extremidad del pie diabético.
Material y métodosEstudio de cohortes retrospectivo unicéntrico (2008-2013) de pacientes con pie diabético. Se calculó el riesgo de amputación y la recomendación de revascularización según la clasificación WIfI y se comparó con la actitud terapéutica real que se había realizado. El grupo A se compuso con pacientes en los que la recomendación obtenida aplicando la clasificación WIfI coincidía con la terapia realizada. En el grupo B se incluyó a pacientes en los que estos parámetros no eran coincidentes. Se calcularon las tasas a 12 meses de salvamento de extremidad, supervivencia global y supervivencia libre de amputación para ambos grupos.
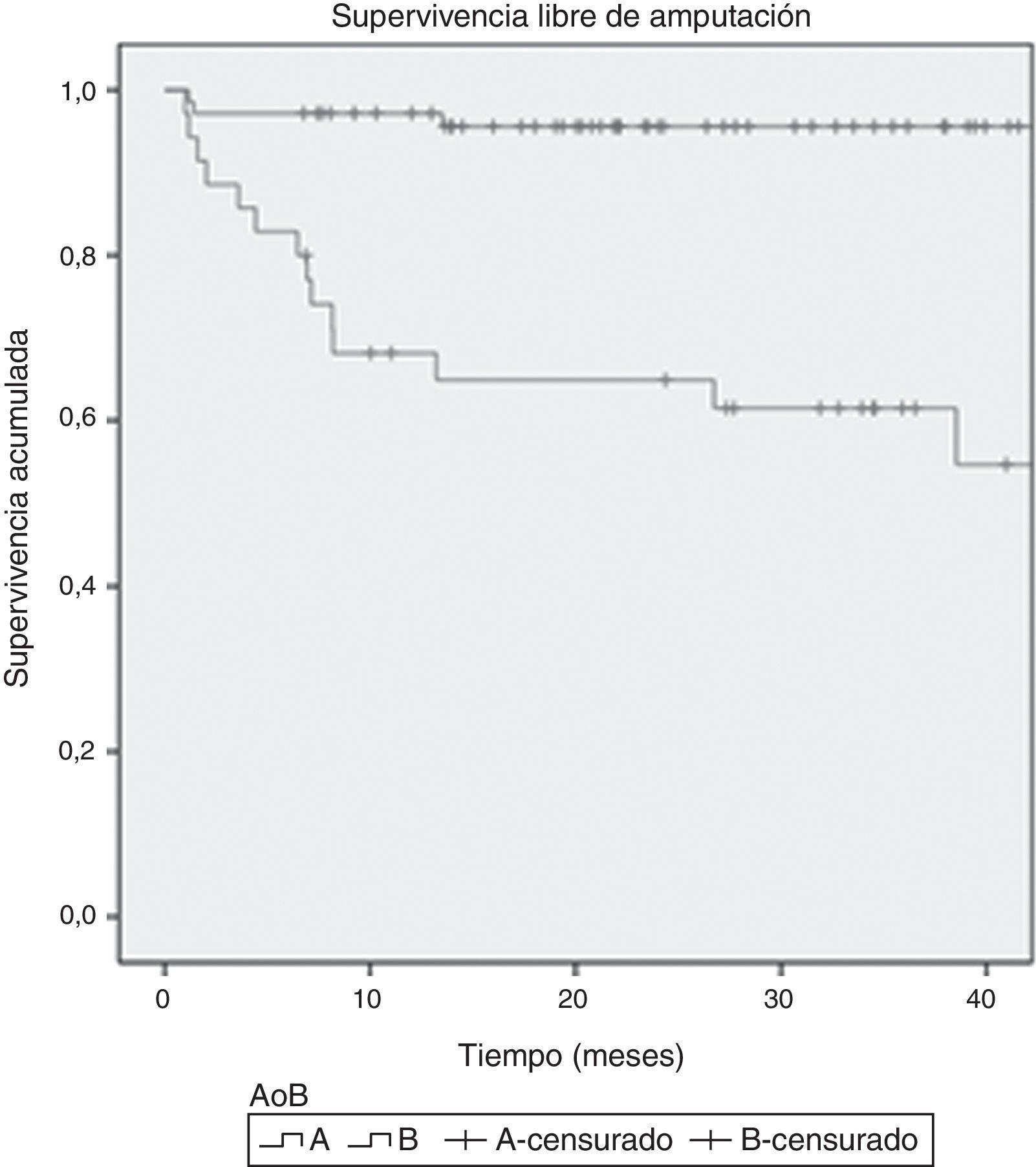
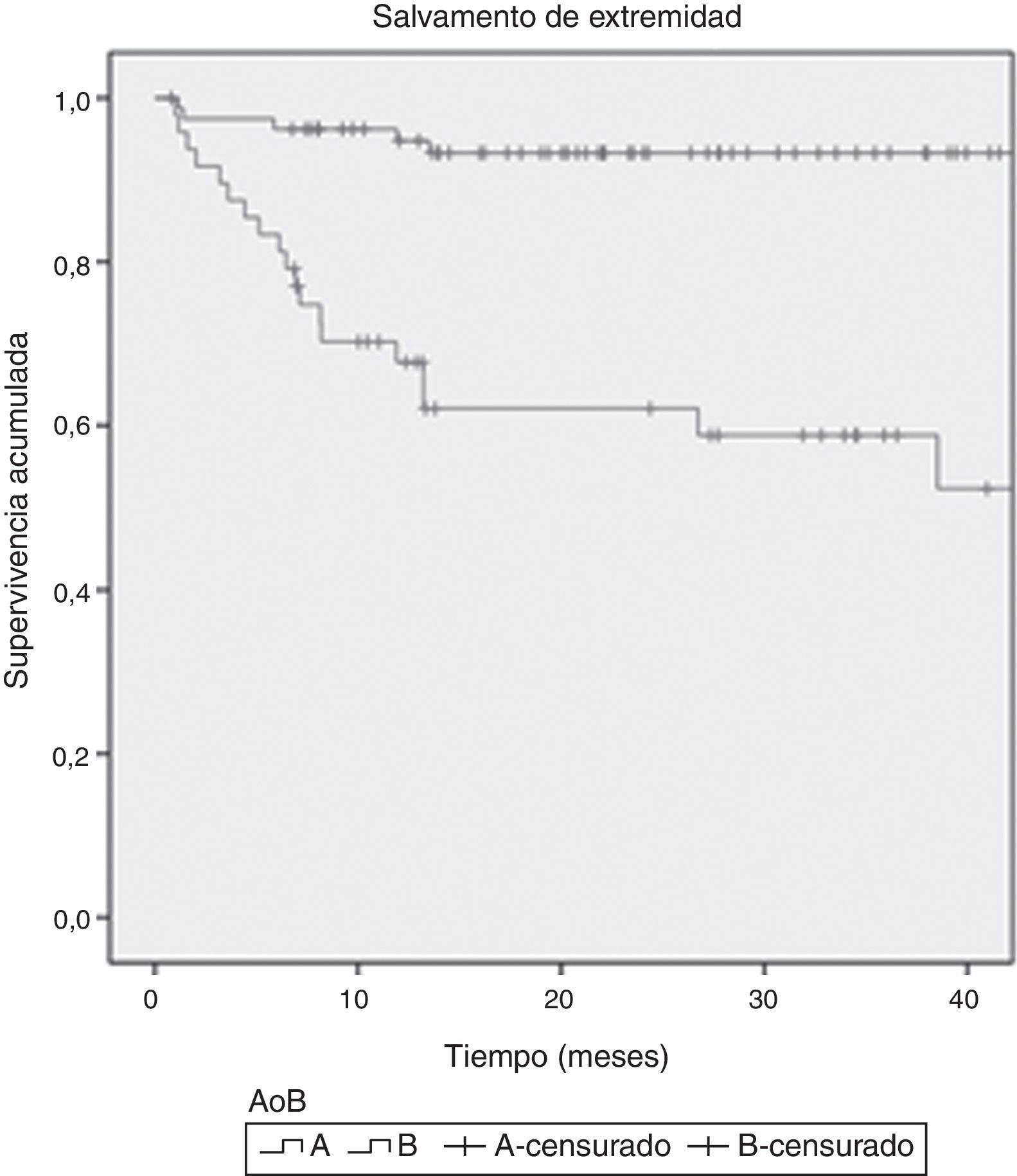
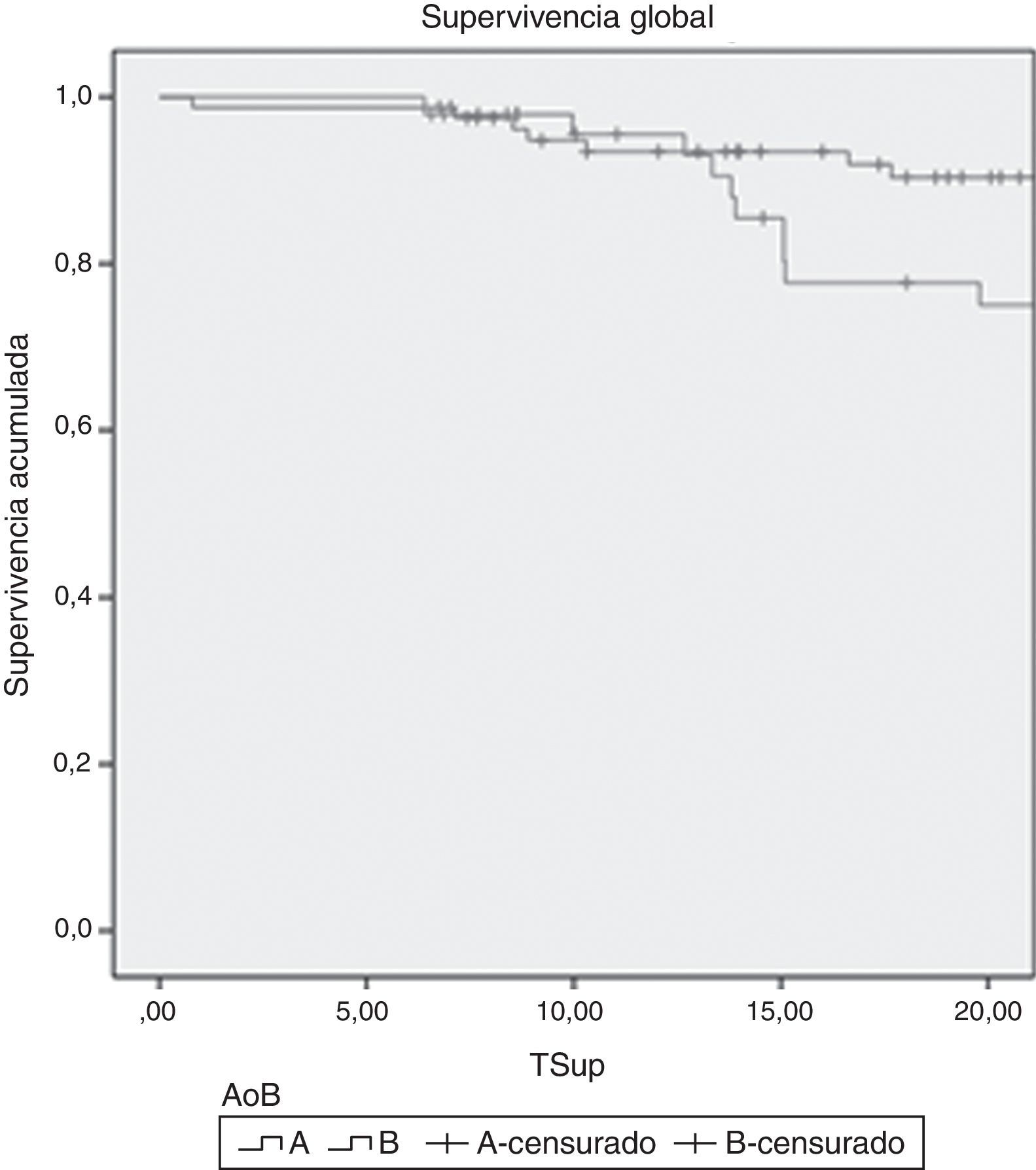
ResultadosSe estudiaron 128 extremidades (93 en el grupo A y 35 en el grupo B). Ambos grupos eran comparables. La supervivencia libre de amputación para el grupo A fue del 90%, vs. el 78% del grupo B (p<0,0001). La tasa a 12 meses de salvamento de extremidad fue del 97,2 vs. 68,1% (p<0,0001) para el grupo A y B, respectivamente. No se encontraron diferencias en cuanto a la supervivencia global entre los grupos.
ConclusiónLa aplicación de la clasificación WIfI en pacientes con pie diabético mejora el pronóstico a corto plazo, lo que aumenta la tasa de salvamento de extremidad.
Diabetic foot is an important cause of morbidity and mortality. In 2014, the Society of Vascular Surgery proposed a new classification system (Wound, Ischaemia, and foot Infection classification system [WIfI]) which estimates lower limb amputation risk, including diabetic patients.
ObjectiveTo evaluate the WIfI classification prognostic value in salvage threatened limbs of patients with diabetic foot.
Material and methodsA retrospective single-centre cohort study (2008-2013) of patients with diabetic foot. The risk of amputation and revascularisation recommendation was calculated according to the WIfI classification and compared with the real therapeutic approach that was used. Group A included patients in whom the recommendation obtained by applying WIfI classification coincided with the therapy performed. Group B included patients in whom recommendation obtained and therapy performed was mis-matched. Limb salvage rate after 12-months, overall survival, and amputation-free survival for both groups, were calculated.
ResultsA total of 128 limbs (93 in group A and 35 in group B) were included. Both groups were comparable. Limb salvage rate was 90% for group A and 78% for group B (P<.0001). Amputation-free survival was 97.2 versus 68.1% (P<.0001) for group A and B, respectively. No differences were observed in overall survival.
ConclusionThe application of WIfI classification system in patients with diabetic foot improves short term prognosis, increasing the rate of limb salvage after 12 months.
El pie diabético (PD) es una entidad clínica definida como la infección, ulceración o pérdida de tejido del pie en un paciente diabético con neuropatía, esté asociada o no a una enfermedad arterial periférica (EAP) de las extremidades inferiores (EEII)1.
En este grupo de pacientes el grado real de isquemia ha sido históricamente difícil de evaluar. Muchos de estos pacientes no encajan con la definición de isquemia crítica y presentan valores falsamente normales en los estudios hemodinámicos. La mayor agresividad de la EAP que padecen y las alteraciones inmunológicas, neurológicas y hemorreológicas asociadas a la diabetes hacen que el riesgo de amputación mayor sea en este grupo de 5 a 10 veces superior al observado en pacientes no diabéticos2, todo ello con la consecuente merma en su calidad de vida, vida social y los consecuentes efectos económicos, sociales y personales3.
En enero de 2014, la Society of Vascular Surgery (SVS) publicó la Wound, Ischaemia, and foot Infection classification system (WIfI)4 que tiene como objetivo principal proporcionar una herramienta que permita clasificar de forma homogénea a los pacientes con lesiones tróficas en los pies, lo que permitiría establecer grupos comparables. Para ello se basa en 3parámetros para estratificar el riesgo de amputación: la herida (wound), la isquemia (ischemia) y la infección (foot infection). Además, los autores proponen que su aplicación sería válida tanto en pacientes no diabéticos como en pacientes diabéticos4. Este hecho diferencial podría convertirla en una herramienta útil en la toma de decisiones para la indicación de revascularización y para disminuir la tasa de amputaciones mayores en pacientes con PD.
El objetivo del presente estudio es evaluar el valor pronóstico que presumiblemente tendría la aplicación de esta clasificación como soporte para la indicación de revascularización en cuanto a la salvación de extremidad de pacientes con diagnóstico de PD.
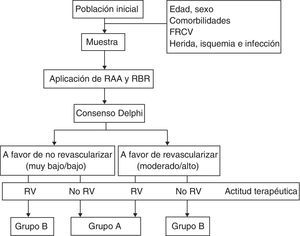
Material y métodosSe diseñó un estudio de cohortes retrospectivo unicéntrico de una base de datos informatizada. Se incluyó a los pacientes con PD atendidos en nuestro centro desde el 1 de febrero de 2008 hasta el 28 de febrero de 2013. Se excluyó a los pacientes en los que los datos demográficos, comorbilidades, factores de riesgo cardiovascular (FRCV) o variables de la clasificación WIfI eran dudosos, no valorables o estaban incompletos. Tampoco se incluyó a aquellos pacientes en los que fracasó un intento de revascularización. Se recogió la edad, el sexo, las comorbilidades y los FRCV de toda la muestra y se estudiaron los EEII de forma individualizada.
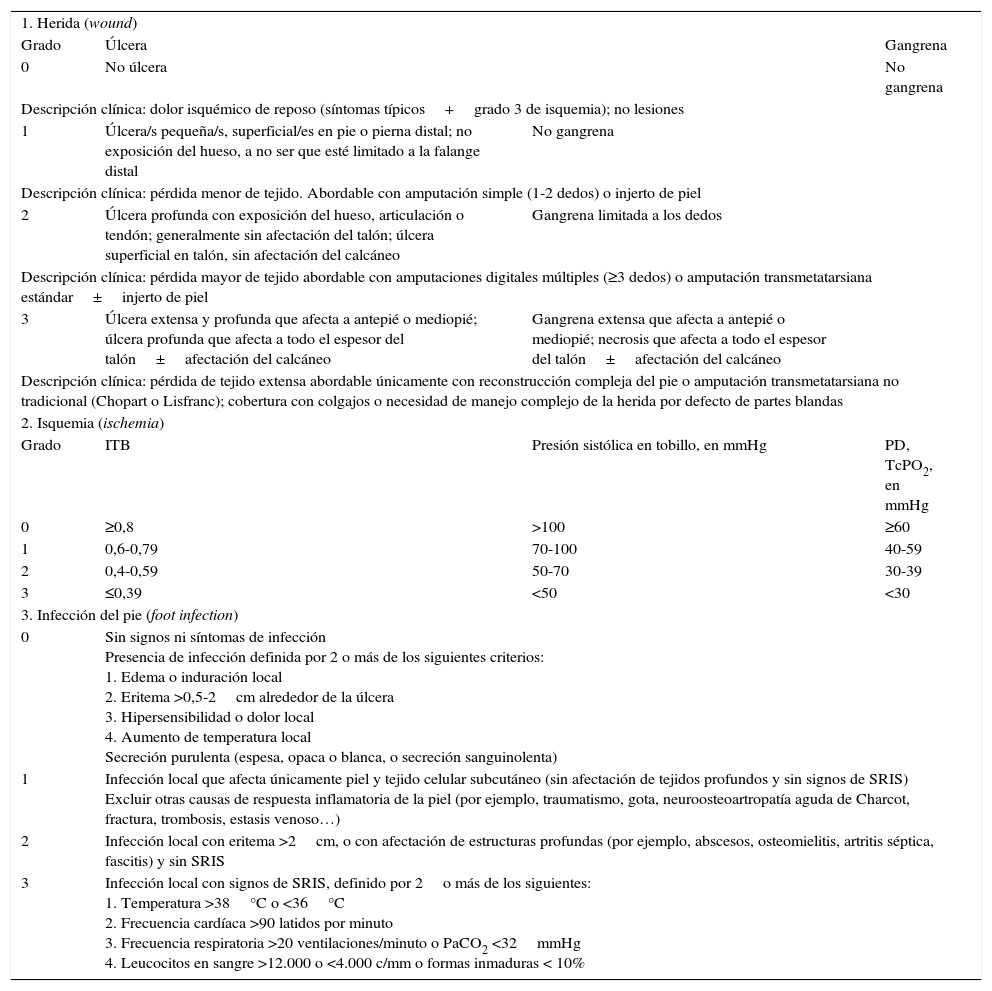
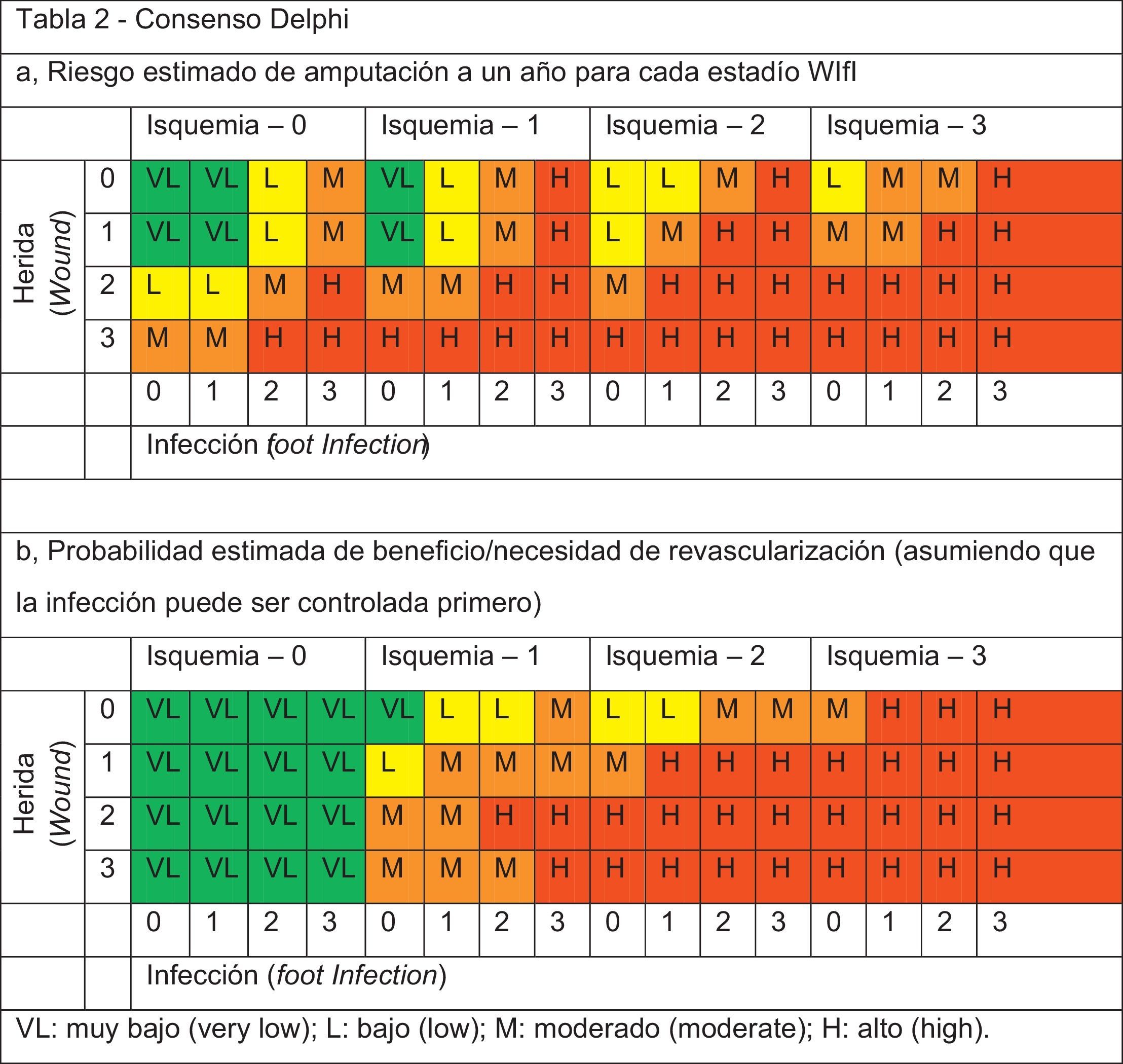
La clasificación WIfI se construyó a partir de 3factores que han demostrado ser predictores del riesgo de amputación: la extensión de la lesión (wound), el grado de isquemia (ischemia) y la gravedad de la infección (foot infection). Los autores ordenan cada una de las 3variables según su gravedad en 4categorías: muy leve, leve, moderado y grave (tabla 1). Con la combinación se generaron las tablas de riesgo de amputación al año (RAA) y la tabla de riesgo/beneficio de revascularización (RBR) (tabla 2). Los estadios clínicos WIfI resultan de la combinación de estas 3variables de un modo similar a como se calcula el riesgo de muerte por causas cardiovasculares en los modelos de riesgo derivados del estudio de Framingham. El RAA y RBR se estratifican en muy bajo, bajo, moderado y alto y su estratificación la estableció un panel de expertos en el consenso Delphi. Dado que se ha visto que la odds ratio (OR) para la lesión, la isquemia y la infección son diferentes, la importancia que da el consenso Delphi difiere para cada uno de estos factores: es mayor para el grado de isquemia, seguido por la extensión de la lesión y finalmente por la infección del pie4.
Variables que componen la clasificación WIfI, descritas según su gravedad
| 1. Herida (wound) | |||
| Grado | Úlcera | Gangrena | |
| 0 | No úlcera | No gangrena | |
| Descripción clínica: dolor isquémico de reposo (síntomas típicos+grado 3 de isquemia); no lesiones | |||
| 1 | Úlcera/s pequeña/s, superficial/es en pie o pierna distal; no exposición del hueso, a no ser que esté limitado a la falange distal | No gangrena | |
| Descripción clínica: pérdida menor de tejido. Abordable con amputación simple (1-2 dedos) o injerto de piel | |||
| 2 | Úlcera profunda con exposición del hueso, articulación o tendón; generalmente sin afectación del talón; úlcera superficial en talón, sin afectación del calcáneo | Gangrena limitada a los dedos | |
| Descripción clínica: pérdida mayor de tejido abordable con amputaciones digitales múltiples (≥3 dedos) o amputación transmetatarsiana estándar±injerto de piel | |||
| 3 | Úlcera extensa y profunda que afecta a antepié o mediopié; úlcera profunda que afecta a todo el espesor del talón±afectación del calcáneo | Gangrena extensa que afecta a antepié o mediopié; necrosis que afecta a todo el espesor del talón±afectación del calcáneo | |
| Descripción clínica: pérdida de tejido extensa abordable únicamente con reconstrucción compleja del pie o amputación transmetatarsiana no tradicional (Chopart o Lisfranc); cobertura con colgajos o necesidad de manejo complejo de la herida por defecto de partes blandas | |||
| 2. Isquemia (ischemia) | |||
| Grado | ITB | Presión sistólica en tobillo, en mmHg | PD, TcPO2, en mmHg |
| 0 | ≥0,8 | >100 | ≥60 |
| 1 | 0,6-0,79 | 70-100 | 40-59 |
| 2 | 0,4-0,59 | 50-70 | 30-39 |
| 3 | ≤0,39 | <50 | <30 |
| 3. Infección del pie (foot infection) | |||
| 0 | Sin signos ni síntomas de infección Presencia de infección definida por 2 o más de los siguientes criterios: 1. Edema o induración local 2. Eritema >0,5-2cm alrededor de la úlcera 3. Hipersensibilidad o dolor local 4. Aumento de temperatura local Secreción purulenta (espesa, opaca o blanca, o secreción sanguinolenta) | ||
| 1 | Infección local que afecta únicamente piel y tejido celular subcutáneo (sin afectación de tejidos profundos y sin signos de SRIS) Excluir otras causas de respuesta inflamatoria de la piel (por ejemplo, traumatismo, gota, neuroosteoartropatía aguda de Charcot, fractura, trombosis, estasis venoso…) | ||
| 2 | Infección local con eritema >2cm, o con afectación de estructuras profundas (por ejemplo, abscesos, osteomielitis, artritis séptica, fascitis) y sin SRIS | ||
| 3 | Infección local con signos de SRIS, definido por 2o más de los siguientes: 1. Temperatura >38°C o <36°C 2. Frecuencia cardíaca >90 latidos por minuto 3. Frecuencia respiratoria >20 ventilaciones/minuto o PaCO2 <32mmHg 4. Leucocitos en sangre >12.000 o <4.000 c/mm o formas inmaduras < 10% | ||
ITB: índice tobillo/brazo; PaCO2: presión parcial arterial de dióxido de carbono; PD: presión en el dedo; SRIS: síndrome de respuesta inflamatoria sistémica; TcPO2: presión transcutánea de oxígeno.
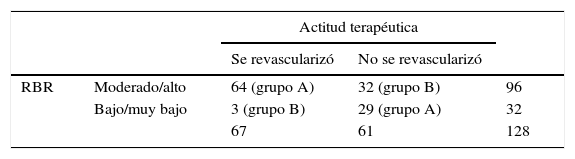
Se consideró indicada la revascularización a partir de un RBR moderado o alto y no indicada para RBR muy bajo o bajo. Se formaron 2grupos de estudio combinando el RBR junto con la actitud terapéutica realizada.
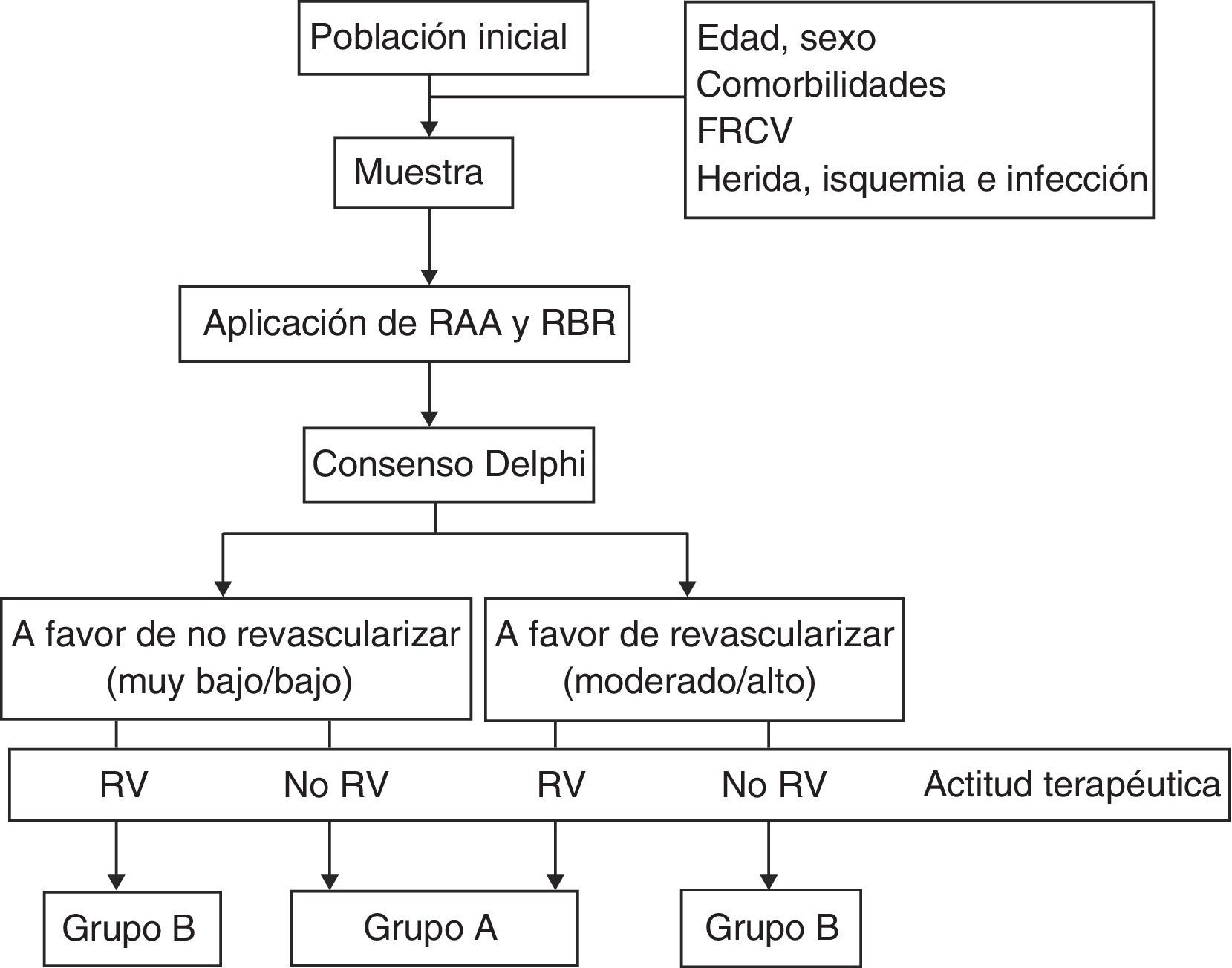
Todos los EEII de la muestra se clasificaron de acuerdo con los grados que establece la clasificación WIfI para las 3variables (muy leve, leve, moderado y grave), obtenidos a partir de clasificaciones previas para cada variable como la clasificación de Texas, Meggit-Wagner, PEDIS, etc., revisadas y consensuadas por el panel de expertos del consenso Delphi. Se calculó el RAA aun año y el RBR para cada EEII utilizando la estratificación propuesta por el consenso Delphi. Posteriormente, se realizó una revisión retrospectiva de la actitud terapéutica que se llevó a cabo para cada EEII y se comparó con la actitud que se obtenía de la aplicación de la clasificación WIfI.
En el primer grupo (grupo A) se incluyeron EEII con un RBR bajo o muy bajo que no se revascularizaron y aquellos con un RBR moderado o alto que fueron intervenidos. El segundo grupo (grupo B) se formó con EEII con un RBR muy bajo/bajo que fueron revascularizados y con aquellos en los que era moderado/alto y no se realizó intervención (fig. 1).
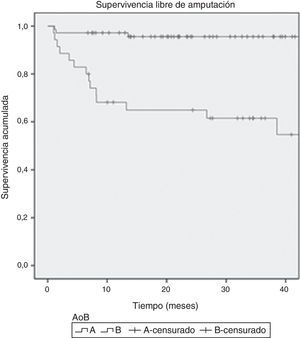
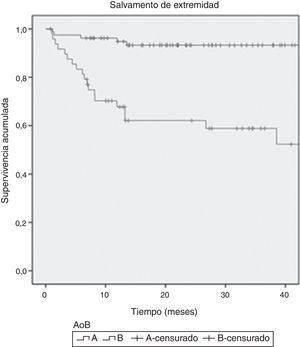
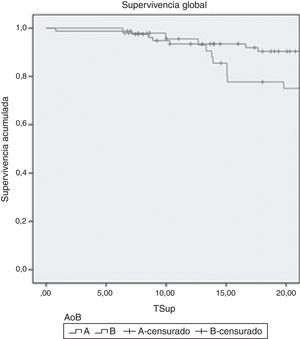
Obtenidos ambos grupos, se analizó el valor pronóstico de la clasificación WIfI comparando la supervivencia libre de amputación (SLA), tasa de supervivencia global (TSG) y tasa de salvamento de extremidad (TSE) a los 12 meses en ambos grupos. La SLA se calculó en función del número de EEII en pacientes vivos que no habían sido amputadas, en tanto por cien. La TSG es la relación entre los pacientes fallecidos durante el seguimiento y la muestra inicial. La TSE se define como la relación entre el número de EEII no amputadas y el número de EEII con PD de la muestra inicial.
Para el análisis estadístico se realizó un test de Kolmogorov-Smirnov de normalidad. Se utilizó el test de Mann-Withney para datos independientes en las variables cuantitativas, el test exacto de Fisher para las cualitativas dicotómicas y las curvas de Kaplan-Meier (test de Mantel-Cox) para las curvas de supervivencia.
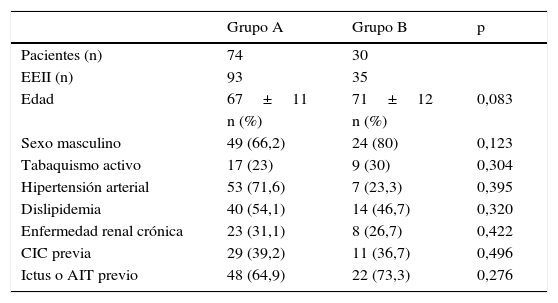
ResultadosSe partió de una población inicial de 136 pacientes. El test de Kolmogorov-Smirnov determinó que se trataba de una muestra con un comportamiento no normal. Hubo un total de 32 pacientes (23,5%) que fueron excluidos. En 26 (81,3%) pacientes el índice tobillo/brazo no era valorable por calcificación. La falta de descripción de la lesión (14 pacientes) o el grado de infección (12 pacientes) fueron otras causas de exclusión. Se obtuvo una muestra final de 104 pacientes y se estudiaron 128 EEII. El tiempo medio de seguimiento fue de 29±18 (6–70) meses. No se encontraron diferencias estadísticamente significativas en factores demográficos, comorbilidades ni FRCV entre los grupos (tabla 3).
Factores demográficos, comorbilidades y FRCV según grupo de estudio
| Grupo A | Grupo B | p | |
|---|---|---|---|
| Pacientes (n) | 74 | 30 | |
| EEII (n) | 93 | 35 | |
| Edad | 67±11 | 71±12 | 0,083 |
| n (%) | n (%) | ||
| Sexo masculino | 49 (66,2) | 24 (80) | 0,123 |
| Tabaquismo activo | 17 (23) | 9 (30) | 0,304 |
| Hipertensión arterial | 53 (71,6) | 7 (23,3) | 0,395 |
| Dislipidemia | 40 (54,1) | 14 (46,7) | 0,320 |
| Enfermedad renal crónica | 23 (31,1) | 8 (26,7) | 0,422 |
| CIC previa | 29 (39,2) | 11 (36,7) | 0,496 |
| Ictus o AIT previo | 48 (64,9) | 22 (73,3) | 0,276 |
AIT: accidente isquémico transitorio; CIC: cardiopatía isquémica crónica; EEII: extremidades inferiores.
La distribución de las EEII según los grupos de estudio se muestra en la tabla 4.
A los 12 meses de seguimiento, la SLA estimada en el grupo A fue del 94%, mientras que en el grupo B fue del 66%, diferencia estadísticamente significativa (p<0,0001). Se encontró una TSE estimada al año del 95,2% en el grupo A, mientras que en el grupo B fue del 64,9% (p<0001). No se encontraron diferencias en cuanto a la TSG entre ambos grupos. Las curvas de Kaplan-Meier se muestran en las figuras 2–4.
DiscusiónEn los pacientes diabéticos es común la ausencia de clínica de claudicación, el dolor de reposo o el asociado a la lesión, lo que suele retrasar el diagnóstico2,5. Estas peculiaridades clínicas condicionan que, en ocasiones, se infraestime la magnitud de la lesión isquémica, lo que conlleva un retraso en la indicación de revascularización o seguir inicialmente una actitud expectante, lo que puede ser fatal para la evolución del paciente.
Es en este punto donde la clasificación WIfI puede aportar un nuevo enfoque terapéutico. Llama especialmente la atención la recomendación moderada/alta de revascularización en pacientes con lesiones extensas y complicadas con infección moderada-grave con un índice tobillo/brazo entre 0,79 y 0,4 que realiza el consenso Delphi4. Es en esta ventana donde los pacientes diabéticos podrían beneficiarse de una actitud más agresiva a la hora de indicar un tratamiento invasivo, lo que podría ser una cuestión que revisar en nuevos trabajos.
En la revisión de la literatura no se han encontrado ensayos clínicos controlados y aleatorizados en PD que comparen el tratamiento revascularizador con el tratamiento médico. La evidencia existente sobre la idoneidad de revascularizar o no procede de estudios de baja calidad científica y, además, en su mayor parte son estudios que no se diseñaron específicamente para pacientes con PD. Algunos estudios comparan la revascularización con la abstención quirúrgica en isquemia crítica y muestran una TSE de entre el 54 y el 77% al año. Así, Lepäntalo reportó una TSE en pacientes con isquemia crítica del 54% al año y una SLA del 28%, sin encontrar diferencias en los resultados de pacientes diabéticos y no diabéticos6. En una muestra donde el 70,4% de pacientes eran diabéticos, Marston encontró una TSE al año del 77%7. Elgzyri mostró, en un estudio centrado en pacientes con PD que no habían sido revascularizados, una TSE y TSG al año del 73 y del 77%, respectivamente5.
Por otro lado, respecto a pacientes diabéticos que fueron revascularizados, Faglia reporta una TSE del 94,8% en pacientes con PD isquémica revascularizada mediante angioplastia simple (ATP)8. En un estudio que incluye a pacientes con PD e isquemia crítica tratados mediante ATP se describe una TSE del 90% al año9. AhChong reportó una TSE del 78% para pacientes diabéticos tratados mediante bypass infrainguinal10. En un estudio que combina revascularización con injerto de tejido realizado en pacientes con isquemia crítica, Meyer obtuvo una TSE y SLA del 87% y una TSG del 100% el primer año11. Recientemente, Chou proporciona una TSE del 92,8% en pacientes diabéticos en un estudio similar12. En otros estudios realizados en pacientes diabéticos se observaron TSE al año de entre el 87 y el 98,3%13–16. Sin embargo, la mayoría de estos trabajos se realizaron en pacientes con PD e isquemia crítica y no tenían en cuenta a pacientes con grados leves o moderados de isquemia. Recientemente, ha sido publicada una revisión sistemática realizada por Hinchliffe en la que se muestra una TSE anual del 78% (IC 95%: 70-89%) y una tasa de mortalidad del 20% (13-36%) en pacientes con PD que han sido revascularizados17.
Parece que existe una mejoría en las TSE en los pacientes con PD que asocian EAP, especialmente en aquellos con isquemia crítica, cuando son revascularizados. Los resultados de nuestro estudio son similares a los presentados en la literatura entre revascularización o no revascularización en isquemia crítica, lo que iría a favor de la utilidad de la clasificación WIfI para la estratificación del RAA en estos casos. No obstante, la cuestión de si los pacientes diabéticos con isquemia moderada se benefician de una actitud más agresiva en cuanto a la revascularización queda sin aclarar.
Los pacientes diabéticos con lesiones extensas e infecciones graves pueden tener como sustrato alteraciones inmunológicas, de cicatrización y de perfusión distal de mayor entidad. En estos casos, la cicatrización de la lesión podría verse dificultada en casos con isquemia leve o moderada, por lo parece lógico pensar que, siguiendo una actitud más agresiva en cuanto a la indicación de revascularización, se podría mejorar la tasa de cicatrización y complicaciones, lo que redunda en una mayor TSE y, por tanto, en una menor morbilidad para el paciente diabético. Este trabajo puede abrir el camino para una mayor profundización en esta cuestión.
El presente estudio se fundamenta en el consenso Delphi, una propuesta de un panel de expertos que no ha sido validada en la actualidad para su aplicación en pacientes diabéticos, lo que supone una clara limitación a este estudio. Sin embargo, empiezan a aparecer estudios que apuntan a que esta estratificación parece ofrecer una estimación válida de riesgo de amputación al año18 y ha sido validada por Beropoulis para un subgrupo de pacientes no diabéticos con isquemia crítica tratados mediante técnicas endovasculares19. Causey ha observado una correlación entre el riesgo de amputación y su estadio clínico dado por la clasificación WIfI en la isquemia crítica, sobre todo en grados avanzados. El autor concluye que esta clasificación es una herramienta complementaria más para el manejo de la isquemia crítica20.
Otra de las limitaciones del trabajo es el reducido tamaño de la muestra obtenida debido a las sustanciosas pérdidas durante la selección de los pacientes.
ConclusiónLa aplicación de la clasificación WIfI aumenta la TSE y la supervivencia libre de amputación en pacientes con PD, sin influir en las tasas de mortalidad global.
La utilización de la clasificación WIfI para la estratificación del riesgo de amputación puede ser útil a la hora de abordar la decisión de si debemos o no revascularizar a un paciente con PD, y aumentar la TSE al año.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A la 3.ª edición del Curso de cómo escribir y publicar un artículo científico patrocinado por la Sociedad Española de Angiología y Cirugía Vascular.
Al Dr. J. de Haro por su ayuda y apoyo para la consecución del presente trabajo.
Resultados preliminares presentados en el 60.° Congreso Nacional de la SEACV celebrado en Madrid en junio del 2014.